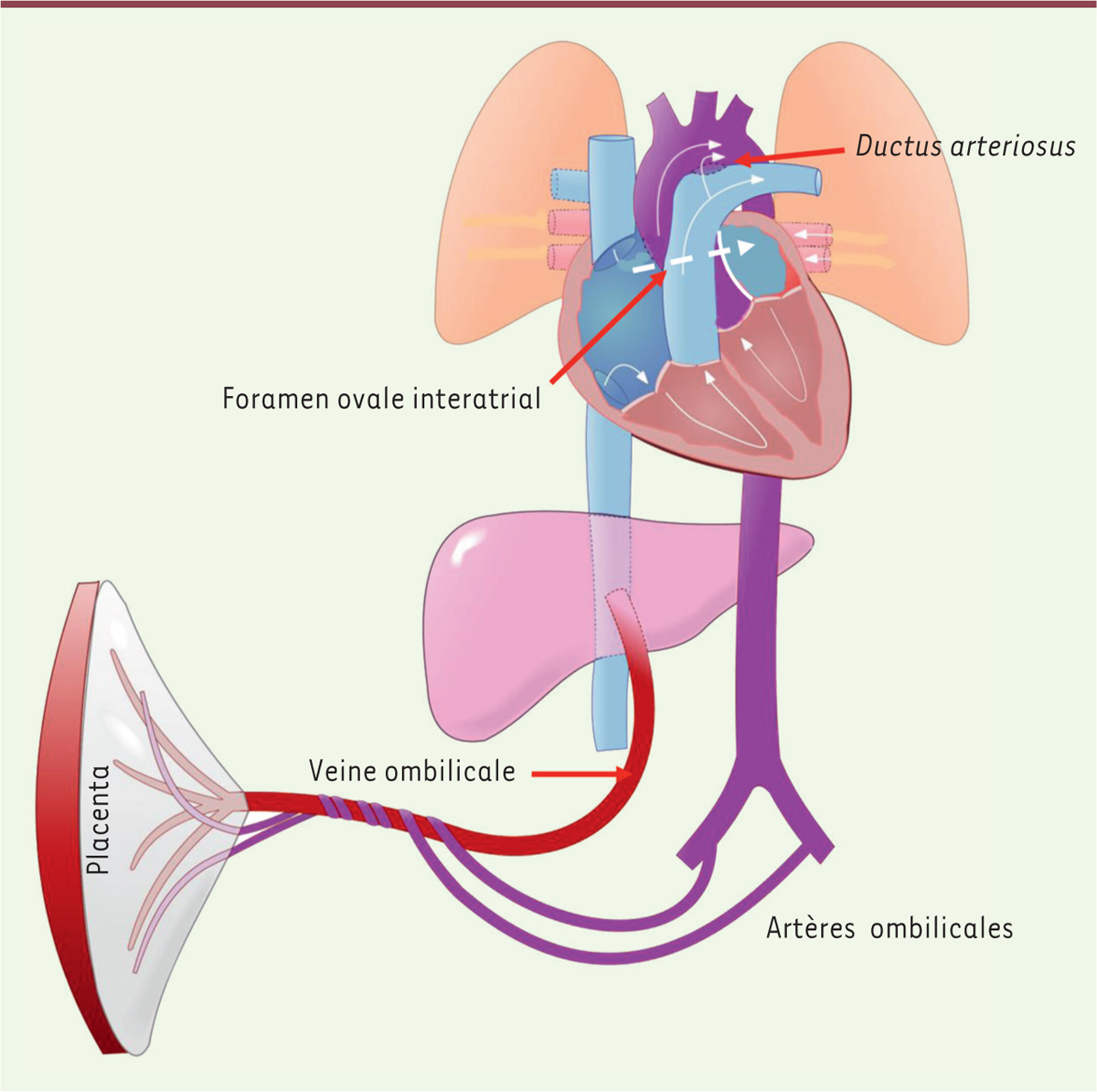
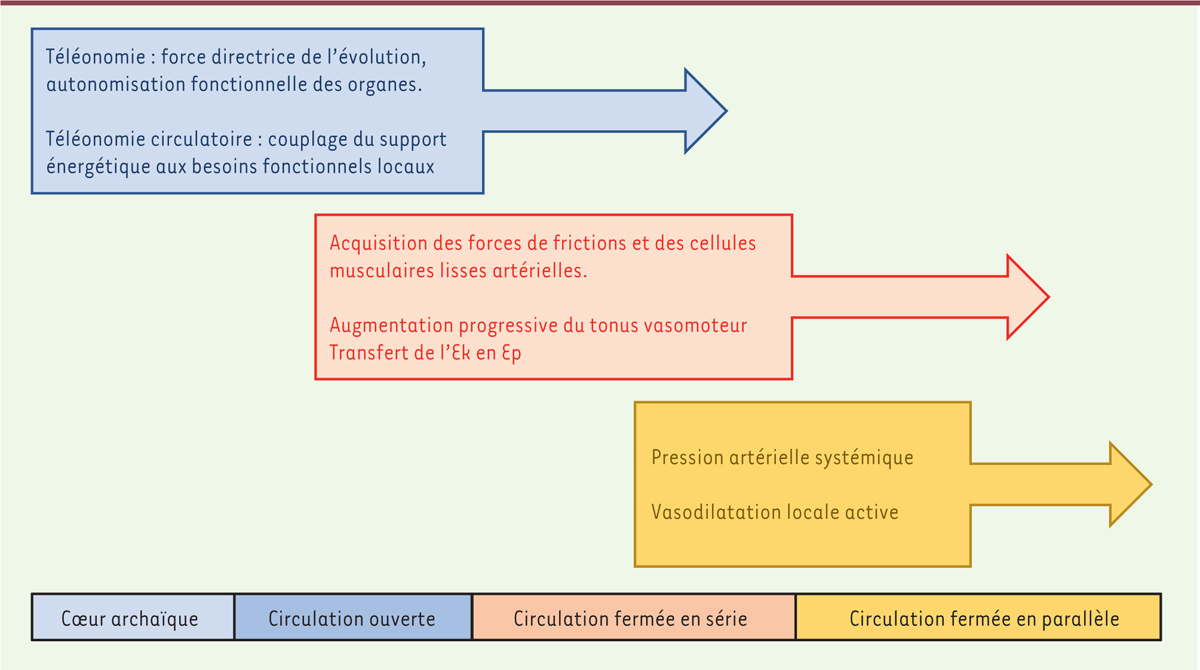
La caractéristique principale de la circulation chez les mammifères est le développement en parallèle d’un secteur capacitif à basse pression, regroupant la circulation capillaire, le retour veineux, la circulation pulmonaire, la pompe cardiaque droite complètement sectorisée (septation), et d’un secteur résistif à haute pression (ventricule gauche, artères et artérioles). Comme chez le poisson, l’énergie cinétique prédomine dans la circulation pulmonaire chez le mammifère et le faible gradient de pression dépend directement des variations de vitesse du sang. À l’effort, ce gradient de pression s’accroît de 15 à 30 mmHg, voire plus.
L’architecture fonctionnelle du ventricule gauche a été décryptée par le cardiologue espagnol Francisco Torrent-Guasp en 1972
7
. Une bande musculaire unique relie la valve aortique à la valve pulmonaire, bouclant sur elle-même deux fois, ce qui explique la dynamique topologique des cavités. Elle est responsable des équilibres hémodynamiques en systole et en diastole, à droite comme à gauche [
7
].
À la différence du secteur capacitif, le secteur résistif à haute pression des artères de conductance (aorte, artères carotides, artères iliaques), riches en matrice extracellulaire (MEC), est exposé à des forces tensionnelles élevées, qui sont proportionnelles à la pression et au rayon du vaisseau (selon la loi de Laplace
8
), et à des forces de cisaillement faibles. Dans le secteur résistif distal, constitué de petites artères et d’artérioles riches en CML, les forces de friction transfèrent l’énergie cinétique du flux en énergie potentielle. Elles dissipent les deux énergies mécaniques protégeant ainsi des grandes vitesses et des pressions, le réseau capillaire dans lequel s’effectuent les échanges par diffusion entre sang et organes. La mise en place « en parallèle » d’un système artériel génère de nombreuses bifurcations qui sont nécessaires aux apports métaboliques spécifiques des territoires irrigués.
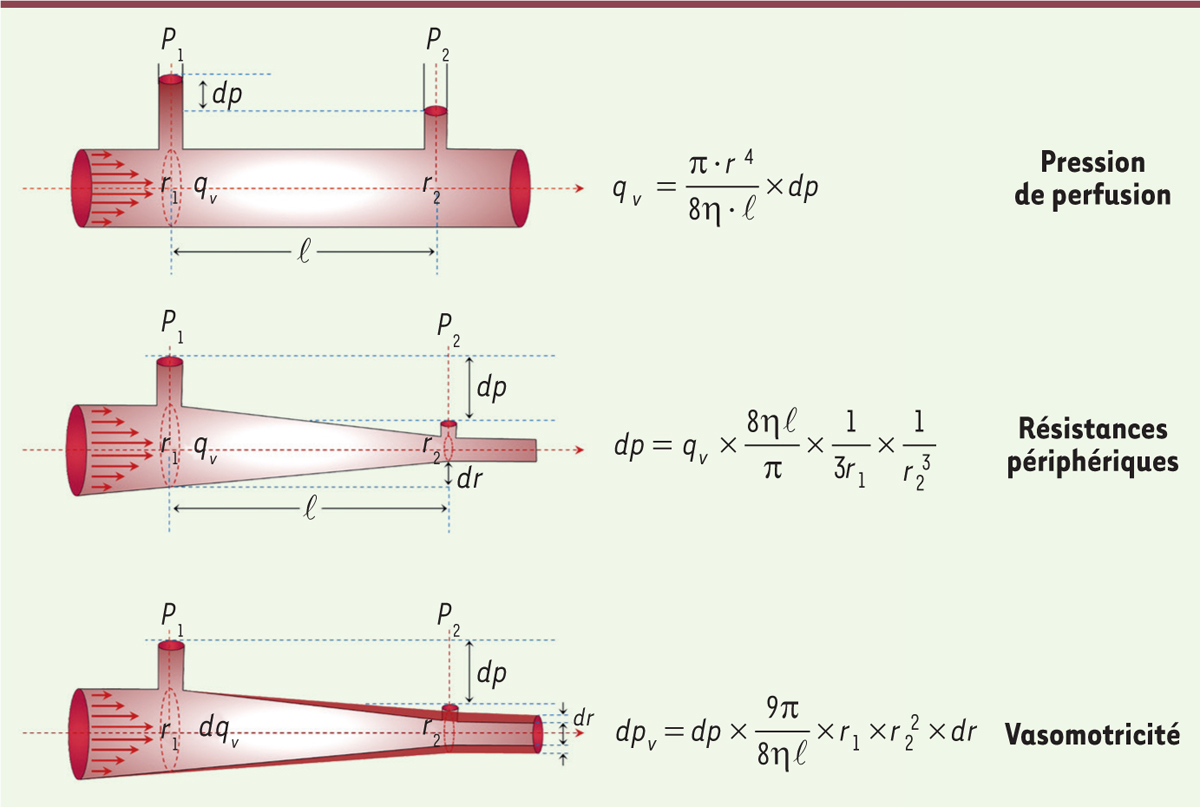
La vasomotricité détermine la pression artérielle à travers les forces de friction
La circulation est un système mécaniquement clos et homéotherme
9,
. La loi de conservation de l’énergie est donc approximativement applicable (Ek + Ep = constante). Les résistances périphériques à l’écoulement, acquises progressivement au cours de la phylogénèse, déterminent le transfert de l’énergie cinétique (Ek) en énergie potentielle (Ep) chez les mammifères. Elles sont générées par les forces de friction exercées par le sang visqueux sur les parois artérielles. Selon la loi de Poiseuille
10
(
Figure 2
)
, elles sont proportionnelles à la viscosité sanguine (qui est constante), à la vitesse d’écoulement et inversement proportionnelles au rayon du vaisseau à la puissance 4. La diminution progressive du rayon des artères régule donc la pression artérielle systémique par transfert d’énergie. Ce transfert prédomine dans les artères distales, dites artères de résistance. Cette diminution du rayon du vaisseau est due à une contraction partielle des CML, par glissement des fibres de myosine sur l’actine. Le maintien de ce tonus contractile, contrôlé par des kinases spécifiques et consommateur d’énergie, repose principalement sur le système nerveux sympathique adventiciel, formé de synapses neuromusculaires qui cheminent tout au long des artères. La pression artérielle d’amont et la réduction des vitesses et de la pression en aval, résultent du rétrécissement actif des artères de résistance. Pour maintenir un haut niveau de pression dans les artères de conductance (de gros calibre), la structure de la paroi de celles-ci sont très particulières. Elle est organisée en lames élastiques associant CML et protéines de la MEC, afin de lui apporter la solidité nécessaire pour résister à la tension et lui donner l’élasticité suffisante pour emmagasiner l’énergie potentielle (Ep), transmise sous forme de l’onde de pouls en systole, avec restitution (transfert) sous forme d’énergie cinétique (Ek) au cours de la diastole. Plus on s’éloigne du cœur, plus la paroi artérielle s’appauvrit en MEC élastique, et plus elle se densifie en CML qui s’interconnectent, favorisant la diffusion dans ces cellules de signaux biochimiques de contraction et de relaxation. Cette interconnectivité est assurée par des connexines, des protéines transmembranaires formant les jonctions communicantes entre cellules. Les ondes de dépolarisation diffusent également d’une CML à l’autre
via
des jonctions serrées. Ce fonctionnement intercellulaire est sensible aux contraintes mécaniques pariétales. En effet, les forces frictionnelles de cisaillement sont essentielles pour, en particulier, l’artériogenèse, durant la vie fœtale, la vasodilatation active, le transfert entre les énergies mécaniques et leur dissipation, protégeant ainsi la structure et les fonctions des capillaires
 | Figure 2.
La loi de Poiseuille : les formules régissant le flux.
|
L’influx sympathique détermine le tonus vasomoteur
L’innervation des artères est réalisée par des fibres sympathiques post-ganglionnaires qui projettent dans l’adventice. La densité d’innervation (synapses neuromusculaires lisses) augmente proportionnellement à la diminution du calibre de l’artère. C’est ce qui génère le tonus contractile. Celui-ci repose sur la sécrétion par les synapses de catécholamines qui agissent sur le récepteur a-1 adrénergique exprimé par les CML. Ce récepteur initie une signalisation impliquant la mobilisation de calcium, l’activation de la phospholipase C et l’inactivation des phosphatases. Tout repose sur le transfert de groupes phosphoryles, fournis par l’ATP ou le GTP produits par la respiration mitochondriale, aux protéines contractiles. L’activation du système nerveux sympathique lié au baroréflexe (un réflexe d’adaptation à la gravité développé chez
Homo erectus
) participe au maintien relativement constant de la pression et de la circulation du sang dans le cerveau (comme pour la girafe [
8
]). Les petits vaisseaux résistent ainsi à l’augmentation de pression par une réponse contractile (tonus myogénique) afin de protéger le réseau capillaire.
Couplage entre activités tissulaires et vasodilatation active
Les couplages entre activités fonctionnelles spécifiques à chaque organe, tissu, territoire, cellule, et apport métabolique, modulable et adapté, sont une nécessité qui s’est maintenue au cours de l’évolution, jusqu’à l’homme. Elle définit la finalité de la phylogenèse et de l’ontogenèse de la circulation, à savoir la régulation locale du tonus vasomoteur. Les médiateurs qui y participent sont divers, dépendant essentiellement du type d’activité directement reliée (contraction musculaire), ou non (activité cérébrale), à la consommation d’énergie au niveau des tissus. Le couplage neuro-vasculaire (entre l’activité neuronale et l’augmentation du flux sanguin dans le cerveau) est, par exemple, à l’origine des signaux détectés en IRM (imagerie par résonance magnétique) fonctionnelle et reposant sur l’effet BOLD (
blood oxygen level dependent
)
11
[
9
]. La dépolarisation de la membrane neuronale s’étend aux cellules endothéliales qui rétro-conduisent ensuite, de l’aval vers l’amont, la dépolarisation,
via
les jonctions serrées, et les seconds messagers,
via
les connexines. Cette conductance endothéliale rétrograde active la NO (monoxyde d’azote) synthase et provoque une vasodilatation active (induite par le NO ainsi produit), par inhibition locale du tonus musculaire lisse.
Rôle vasodilatateur du flux dans les artères de conductance
Le flux phasique dans les artères de conductance entretient en permanence un cisaillement endothélial
12
et, de ce fait, une production basale de NO, qui inhibe le tonus musculaire lisse sous-jacent maintenu au niveau adventiciel par l’activité sympathique. La vasodilatation distale augmente la vitesse du sang proximal. L’intensité de la relaxation des CML qui est proportionnelle à l’intensité des forces de cisaillement qui s’exercent sur les cellules endothéliales, implique, dans la cellule endothéliale, l’activation du complexe calcium-calmoduline, et dans la CML, la production de GMP cyclique et l’activation de la G-kinase-1.
Stress pariétal tensionnel et mécanotransduction dans la cellule musculaire lisse
La contrainte tensionnelle pariétale est proportionnelle à la pression exercée dans le vaisseau et à son rayon. Elle se répartit sur l’épaisseur de sa paroi, particulièrement sur la MEC qui est synthétisée par les CML. Cette tension pariétale apparaît dès la naissance. Elle s’exerce de façon pulsatile. La fatigue biomécanique ainsi générée, est proportionnelle au produit du pic d’intensité de la contrainte par la fréquence des pulsations. Elle est repartie dans le temps et correspond à 3 x 10
9
étirements pariétaux, pour une durée de vie de 80 ans chez l’homme. Cette fatigue est essentiellement supportée par les protéines insolubles de la MEC dont la maturation se réalise dans le milieu extracellulaire. Les fibres élastiques contribuent à la résistance de la paroi à la dilatation. Les différents types de collagène permettent, eux, de résister à la rupture. Certaines séquences peptidiques, communes aux composants de la MEC, permettent l’ancrage des CML, par l’intermédiaire d’intégrines, et la transmission des signaux mécaniques (mécanotransduction) [
10
] (
→
) de la MEC aux CML. Ces points relais sont également les points d’activation de kinases qui phosphorylent les tyrosines de nombreuses cibles protéiques intracellulaires engagées dans l’adhérence, la survie, la migration, la prolifération, la différenciation, et la plasticité des CML. RhoA, une petite protéine G associée aux points focaux d’adhérence, est impliquée dans la régulation de la structure du cytosquelette et dans la formation du complexe d’actomyosine. Le temps de réponse de la CML à un signal mécanique est particulièrement réduit : il est cent fois plus court que celui que prend une réponse de type ligand/récepteur. Les récepteurs à sept domaines transmembranaires couplés aux protéines G (RCPG) sont également mécano-sensibles et l’extension de la membrane que subit la cellule facilite leur activation ; sa compaction l’inhibe.
(→) Voir la Synthèse de R.M. Mège et B. Ladoux,
m/s
n° 11, novembre 2018, page 963
Deux principaux modèles d’intégration de la mécanotransduction dans la biologie cellulaire ont été proposés : le modèle de tenségrité, qui intègre des éléments de tension et de compression, et un modèle dynamique fluctuant (métastable) entre un cytosquelette rigide et un comportement plus fluide selon l’énergie disponible. Le maintien et les variations de la mécanotransduction sont très consommatrices d’énergie. Ils reposent sur la bioénergétique mitochondriale (mitofusion et mitofission) et sur la NADPH oxydase cytosolique, qui module l’état d’oxydo-réduction de la cellule, dont la dynamique de l’actine.
Mécanotransduction nucléaire
Les forces mécaniques ressenties par la cellule ont des effets sur la structure et le fonctionnement de son noyau. L’enveloppe nucléaire est fenêtrée et encapsule des lamines
13
, dont la lamine A. La chromatine peut être sous forme d’hétérochromatine, peu active, localisée sous l’enveloppe nucléaire, ou d’euchromatine située dans le nucléole. Cette dernière est moins compactée et est plus active transcriptionnellement. Les échanges bidirectionnels entre hetéro- (F-actine) et euchromatine (G-actine) sont mécanosensibles (sensibles à la compaction et à l’élongation). Ils contrôlent les processus d’épigénétique (par méthylation ou acétylation de l’ADN et des histones) régulant ainsi l’expression génique de la cellule. La lamine est reliée au cytosquelette par un complexe de molécules de liaison. La F-actine s’organise en un anneau périnucléaire et/ou en un câble apical (actomyosine, contrainte extensive) relié aux points focaux d’adhérence. Elle protège ainsi le noyau de la cellule contre des déformations trop importantes de sa membrane. Le système YAP/TAZ qui forme dans le noyau des cofacteurs de transcription, fonctionne comme une navette universelle entre cytosol (peu de contrainte) et noyau (forte contrainte) [
11
].