| |
| Med Sci (Paris). 37(1): 35–40. doi: 10.1051/medsci/2020258.Homéostasie de la réponse IgA et microbiote Virginie Pascal,1 Margaux Hiblot,1 Batoul Wehbi,1 Jean-Claude Aldigier,1 and Michel Cogné1,2* 1CNRS UMR 7276, Inserm U1262, Contrôle de la réponse immune B et lymphoproliférations, Université de Limoges
,
Rue du Docteur Marcland
,
87000Limoges
,
France 2EFS Bretagne, Inserm U1236, Université de Rennes 1
,
Rue Pierre-Jean-Gineste
,
35000Rennes
,
France |
Vignette (Photo © Inserm/U1111/Kaiserlian, Dominique).
La surveillance immunitaire des revêtements cutanéo-muqueux constitue la première ligne de défense de l’organisme contre les microorganismes pathogènes de l’environnement. Son enjeu réside dans la capacité d’engendrer une réponse immunitaire adaptée contre une éventuelle menace infectieuse tout en maintenant une tolérance physiologique vis-à-vis de la flore commensale qui est bénéfique. Dans le cas des muqueuses gastro-intestinales, le système immunitaire doit ainsi « savoir » distinguer d’occasionnels antigènes produits par des microbes pathogènes au sein d’un mélange complexe et dynamique constitué d’antigènes étrangers qui sont pour la plupart inoffensifs (car provenant du régime alimentaire ou du microbiote commensal). Chez l’homme, comme chez tous les mammifères, les muqueuses intestinales sont tapissées d’un enchevêtrement de mucus, de peptides antimicrobiens et d’une importante quantité d’immunoglobulines (Ig), notamment de classe A (IgA) [
1
]. Les spécificités de ces IgA, leur éventuelle polyréactivité et leurs propriétés
in vivo
restent encore en partie énigmatiques, mais elles semblent être d’une part, des actrices majeures de la balance fonctionnelle opposant tolérance et inflammation dans le cadre de l’immunité muqueuse et, d’autre part, des organisatrices importantes de la composition du microbiote chez le sujet sain afin de la rendre optimale [
2
].
|
Structure et propriétés des IgA intestinales
Toutes les immunoglobulines (Ig) ont une architecture commune, modulaire, constituée de divers domaines en feuillets b. Les domaines variables (V) portent la spécificité pour l’antigène, tandis que les domaines constants (C) confèrent ses propriétés effectrices à la molécule. À l’instar des autres Ig, l’unité monomérique d’IgA comprend deux chaînes lourdes (en anglais
heavy
, H) identiques (chacune constituée de quatre domaines : VH [V pour variable], CH1, CH2 et CH3 [C pour constant]), associées à deux chaînes légères (en anglais
light
, L) également identiques (comportant deux domaines, VL et CL). Le site de fixation de l’antigène (ou paratope) est conjointement formé par l’organisation tri-dimensionnelle des domaines VH et VL, ou, plus précisément, par l’association spatiale de leurs boucles « hypervariables » (ou CDR pour
complementarity determining regions
). Les domaines CH les plus distaux forment ensemble la région Fc de l’IgA (Fca). Celle-ci peut se lier aux différents récepteurs cellulaires de ces immunoglobulines, qui permettent de neutraliser et d’éliminer les antigènes, ou qui participent à leur transport (pour revue voir [
3
]).
Dans les tissus lymphoïdes associés à l’intestin, tels que les plaques de Peyer
1
, les ganglions lymphatiques mésentériques, les follicules lymphoïdes isolés et l’appendice cæcal, les lymphocytes B se différencient en plasmocytes producteurs d’IgA (ou plasmocytes IgA
+
) dans un environnement le plus souvent exempt d’inflammation, mais au contact permanent d’antigènes étrangers [
4
]. Ces plasmocytes se répartissent ensuite préférentiellement dans la
lamina propria
(la couche de soutien) de la muqueuse de l’intestin grêle, où ils produisent l’IgA, principalement sous la forme de dimère (ou IgAd), l’association des deux monomères étant stabilisée grâce à leur liaison à une protéine appelée chaîne J. Cette liaison est à l’origine de degrés supplémentaires d’association avec d’autres monomères d’IgA pour former des tétramères ou des pentamères, que l’on désigne sous le terme générique d’IgA polymériques (ou IgAp). La détermination, toute récente, de la structure tridimensionnelle de ces IgAd a permis de montrer que deux monomères d’IgA s’associaient en formant un angle de 110°, pris en sandwich par des régions en feuillets b de la chaîne J, tel un trombone [
5
]. La chaîne J s’associe de façon asymétrique, à la partie inférieure de l’une des régions Fca et à la partie supérieure de l’autre.
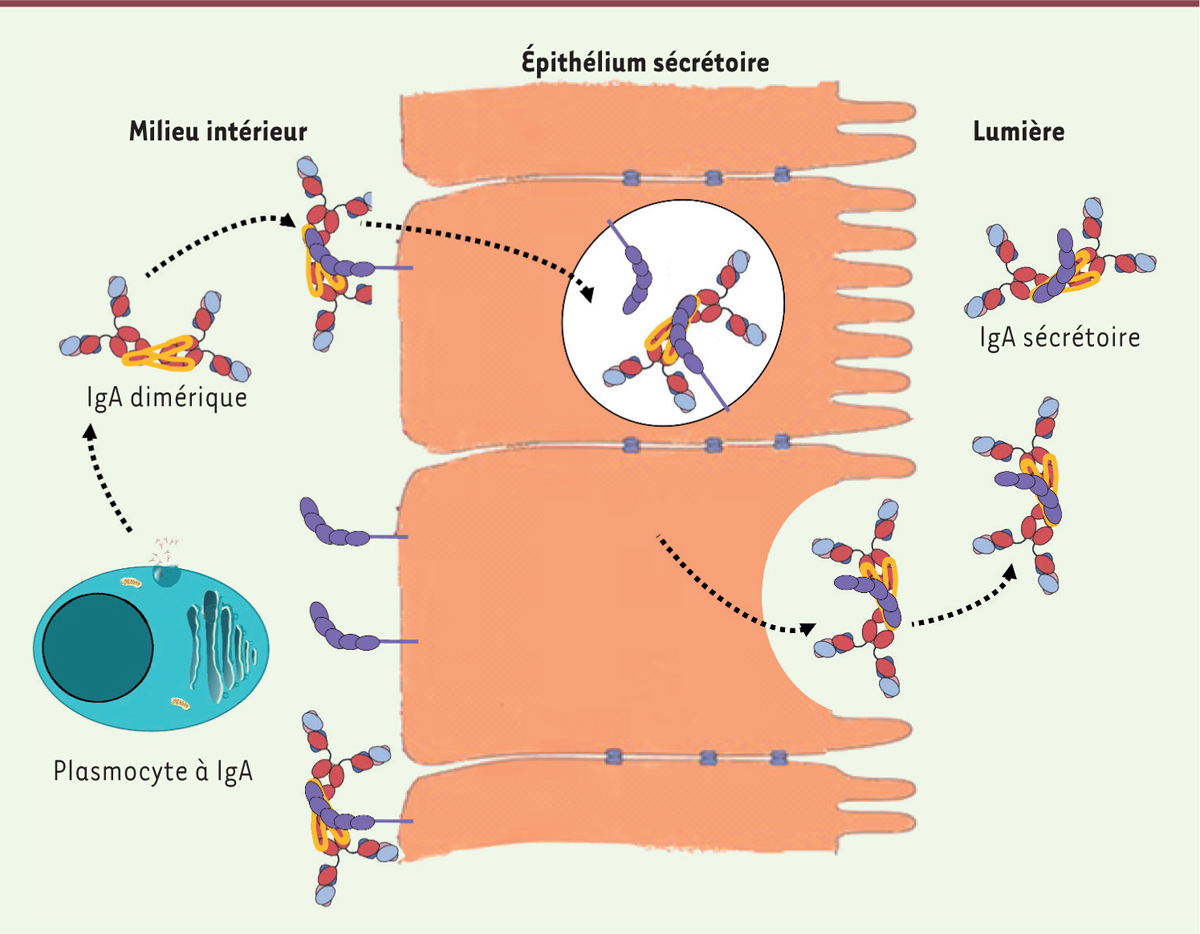
Les IgAd (dimères) ou IgAp (polymériques) auxquelles participe la chaîne J, peuvent ainsi se fixer au récepteur des Ig polymériques (ou pIgR) qui est exprimé à la surface du pôle basal des cellules épithéliales intestinales. Cette liaison induit un changement de conformation du récepteur [
5
], ce qui permet l’internalisation de l’immunoglobuline et du récepteur dans les cellules épithéliales et leur transcytose du pôle basal vers la surface apicale, où le pIgR sera clivé au niveau de sa portion juxta-membranaire qui est sensible à la protéolyse. Sa partie extracellulaire, glycosylée, restera liée à l’IgAp (en tant que « pièce sécrétoire », un complexe de 80 kDa) et constituera avec elle, dans la lumière intestinale, la forme sécrétoire de l’IgA (ou IgAs)
(
Figure 1
)
[
6
]. D’importantes quantités d’IgAs sont ainsi sécrétées quotidiennement par les plasmocytes intestinaux afin d’enrober et de contenir le microbiote commensal en modulant sa prolifération et ses capacités d’invasion. Rappelons que les IgA intra-luminales peuvent subir une transcytose inverse, après qu’elles aient été reconnues par le récepteur Dectine-1 exprimé par les cellules M intestinales (
microfold cells
)
2
[
7
]. Cette capture et ce convoyage spécifique des complexes IgA-antigènes vers des tissus lymphoïdes sous-muqueux, participent ainsi à la fonction immuno-régulatrice des IgA.
 | Figure 1.
Transport de l’IgA par le pIgR vers la lumière des muqueuses.
Le récepteur des Ig polymériques (pIgR) s’associe à l’IgAd au pôle basal des cellules épithéliales muqueuses, et la transporte
via
le compartiment endosomal au pôle apical des cellules, où sa translocation puis son clivage libèrent l’IgA sécrétoire (IgAs) dans la lumière des muqueuses.
|
|
Spécificité des IgA intestinales
La connaissance des mécanismes en cause dans l’immunité muqueuse s’approfondissant, un certain nombre de dogmes historiques se sont récemment fissurés. Cette immunité « locale » a en effet longtemps été considérée comme un compartiment particulier, quasi-disjoint de l’immunité générale et de la formation des anticorps présents dans le sang. De nombreux germes commensaux intestinaux n’induisent en effet la production d’IgA qu’au niveau muqueux, et cela indépendamment des lymphocytes T, et sans qu’il n’en résulte d’anticorps circulants [
8
]. L’immunisation générale est, parallèlement, souvent réputée n’induire que la production d’anticorps circulants, sans qu’il n’y ait de contrepartie muqueuse. Cette vision par trop simpliste mérite aujourd’hui d’être réévaluée. Certaines bactéries intestinales commensales (comme
Burkholderia, Helicobacter
et d’autre membres du phylum des Protéobactéries) induisent en effet la production d’IgA sériques selon une voie qui dépend des lymphocytes T. Celle-ci permet ainsi de générer des IgA qui auront un rôle fonctionnel protecteur pour le contrôle des bactériémies et la prévention du sepsis [
9
]. Le rôle protecteur des IgA et sa contribution à l’élimination des virus sont aussi connus dans les infections respiratoires virales, et spécialement mis en valeur par la pandémie du COVID-19 [
10
]. En ce qui concerne le microbiote présent au niveau des muqueuses, l’exploration de l’interaction entre les bactéries et les IgA a permis de distinguer une flore totalement commensale et non pathogène, qui est généralement faiblement revêtue par les IgA (ou vierge de toute liaison avec les IgA, comme c’est le cas des phylums
Firmicutes
et
Bacteroïdètes
), d’une flore plus agressive, éventuellement génératrice de colite, qui est au contraire fortement revêtue d’IgA dont la production dépend des lymphocytes T [
11
]. Alors qu’il est connu que les IgA sécrétoires « accrochent » préférentiellement des sous-ensembles taxonomiquement distincts parmi les microbes commensaux [
12
], des avancées techniques récentes, utilisant la cytométrie en flux bactérienne combinée au séquençage à haut débit des ARN ribosomiques bactériens, ont permis d’identifier des espèces bactériennes fortement ciblées par les IgA qui les tapissent (et donc positives en cytométrie pour les IgA). Ces progrès ont ainsi révélé les mécanismes immunologiques qui expliquent l’affinité spécifique de certaines IgA vis-à-vis du microbiote intestinal [
13
,
14
].
Ces études ont démontré l’intrication, dans la muqueuse gastro-intestinale, d’au moins deux aspects distincts de l’immunité humorale.
Les mécanismes de l’homéostasie humorale, face aux bactéries commensales, semblent impliquer des IgA dites « naturelles ». Leur répertoire est quasi « germinal » : il présente peu de maturation d’affinité des régions variables. Ces IgA partagent une réactivité inter-espèces, car souvent poly-réactives (reconnaissant flagellines, ADN et polysaccharides bactériens) et en partie produites par des lymphocytes B sans nécessité de co-stimulation des lymphocytes T [
13
]. Une très récente étude réalisée chez le fœtus humain, a révélé une importante fréquence de lymphocytes B naïfs produisant des Ig polyréactives avant toute stimulation [
15
]. Ces IgA polyréactives peuvent lier non seulement des cellules endogènes apoptotiques, mais aussi des bactéries commensales du microbiote, telles que celles du genre
Dorea
(des bactéries généralement liées à des IgA chez l’adulte, mais dont l’abondance est réduite en cas de déficit en IgA) [
15
].
Lors des réponses immunitaires locales induites par des agents pathogènes, ou par des vaccins visant à développer une réponse immunitaire muqueuse, des IgA protectrices de haute affinité sont produites dans les centres germinatifs des tissus lymphoïdes qui sont associés aux muqueuses. Cette réponse dépendant des lymphocytes T s’apparente à celle des réponses générales, établissant une immunité spécifique aussi efficace et neutralisante qu’après une infection généralisée ou une vaccination [
16
]. Les mécanismes à l’origine de la production d’IgA de haute affinité présentent cependant quelques particularités : l’hypermutation des domaines variables semble en effet moins focalisée, voire aléatoire. Chez la souris, la production des IgA liant les germes de type SFB (
segmented filamentous bacteria
) est ainsi dépendante des lymphocytes T mais indépendante de l’activité de l’AID (
activation-induced deaminase
), responsable de la maturation des anticorps [
16
]. Ces SFB jouent un rôle majeur dans la maturation d’une immunité locale « homéostatique » chez ces animaux. Celle-ci protège leurs muqueuses contre l’invasion par divers pathogènes, en stimulant localement tant des réponses lymphocytaires T, tout particulièrement celles impliquant les lymphocytes Th 17, que le développement de centres germinatifs et la production d’IgA [
17
,
18
]. D’autres symbiontes (ou commensaux) jouent vraisemblablement un rôle analogue aux SFB chez l’homme.
À côté de ces réponses relativement classiques à des antigènes bactériens, d’autres modes de stimulation de l’immunité humorale semblent possibles, notamment en réponse à des super-antigènes [
13
,
19
].
|
Super-antigènes du microbiote intestinal
Alors que la plupart des antigènes microbiens ne sont reconnus de manière spécifique que par une infime fraction de lymphocytes B ou de lymphocytes T, certains microorganismes pathogènes expriment des antigènes capables de stimuler un important éventail de lymphocytes, en se liant directement à leurs récepteurs de l’antigène respectifs (BCR [
B cell receptor
] pour les lymphocytes B ou TCR [
T cell receptor
] pour les lymphocytes T), hors du site classique de liaison entre l’épitope et le paratope. Plusieurs de ces super-antigènes ont été identifiés pour les lymphocytes T. En revanche, en ce qui concerne les lymphocytes B, peu ont été déterminés. Parmi eux, citons la protéine A staphylococcique et la protéine L peptostreptococcique, qui présentent, toutes deux, de puissantes propriétés immunostimulatrices et une redoutable pathogénicité.
Dans une étude récente, l’équipe de Jeffrey J. Bunker a identifié et caractérisé une nouvelle classe de super-antigènes, semblant induire une puissante activation des lymphocytes B intestinaux et une immunité « intriquée » [
19
]. C’est l’exploration des interactions entre IgA murines et divers microbiotes intestinaux de nourrissons humains qui a révélé qu’une partie du répertoire polyclonal des IgA intestinales murines reconnaissait spontanément et intensément un sous-ensemble bactérien bien distinct au sein des microbiotes humains qui ont été étudiés. Cette étonnante réactivité spontanément portée par l’ensemble des domaines variables d’Ig des sous-groupes VH5/6/7 murins et VH3 humain, cible les protéines membranaires IbpA et IbpB (
immunoglobulin-binding protein A/B
) à la surface de bactéries commensales de la famille des
Lachnospiraceae (
Figure 2
)
. En cas de présence au sein du microbiote de bactéries exprimant ces protéines, cette liaison de type « super-antigène » et l’activation lymphocytaire B qui en résulte, induiraient la différenciation polyclonale de plasmocytes produisant des IgA présentant les domaines VH impliqués. Ceci déclencherait une augmentation des taux intestinaux d’IgA, tant ceux d’IgAs libres que ceux des IgA liées aux bactéries exposant les protéines IbpA/B, ou ceux des IgA liées à d’autres commensaux.
 | Figure 2.
Différents types de liaison entre IgA et microbiote intestinal. A.
« Liaison antigène-anticorps classique » d’IgA protectrices de haute affinité ;
B.
Liaison d’IgA « naturelles », peu affines, avec réactivité croisée inter-espèces ;
C.
Bactéries commensales de la famille des Lachnospiraceae (dont les super-antigènes IbpA/IbpB sont liés par toutes les IgA à domaines variables VH5/6/7 murins ou au domaine VH3 humain) stimulant la production d’IgAs libres ou liées (tant aux bactéries IbpA/B+ qu’à d’autres commensaux).
|
Présents dans plus de 40 % des microbiotes intestinaux chez l’homme, ces super-antigènes sont certainement impliqués dans un mode alternatif, commun et fondamental, d’induction de la production d’IgAs dans la muqueuse intestinale. Ces résultats bousculent ainsi le dogme qui ne présentait, jusqu’ici, les IgAs polyréactives que comme de simples anticorps « naturels », d’apparition spontanée ! De telles IgA « naturelles » seraient donc spécifiquement induites en réponse aux variations antigéniques d’une flore intestinale précise, selon une réponse représentant une forme primitive d’immunité adaptative. Une autre étude récente a concerné les lymphocytes B1-b, des lymphocytes B dits naturels et impliqués dans les réponses indépendantes des lymphocytes T, eux aussi souvent présentés comme sources majeures d’anticorps naturels. En fait, le BCR de certains de ces lymphocytes B1 (notamment, chez la souris, les domaines variables VH 6-3 et VH 7-3 du récepteur
3
) présente une affinité pour une copule glucidique (de type N-acétylgalactosamine) exprimée par les streptocoques du groupe A. La présence de ces streptocoques au sein du microbiote des jeunes souriceaux est ainsi capable de fortement stimuler et renforcer la présence ultérieure de lymphocytes B1 qui les reconnaissent, conduisant à la production non seulement d’IgM « naturelles », mais aussi de plasmocytes producteurs d’IgA ayant la même spécificité et se localisant au niveau des muqueuses
(
Figure 3
)
[
20
].
 | Figure 3.
IgAs naturelles polyréactives et leurs multiples origines possibles.
|
|
Effets bénéfiques et délétères des IgA intestinales
Les réponses immunitaires à la présence des microorganismes commensaux variés que nous avons évoquées, constituent ainsi un répertoire immun homéostatique qui fait écho à la variété du microbiote que les muqueuses hébergent. Ce répertoire ne se borne pas à contrôler le microbiote commensal, il est également, et surtout, la source d’une immunité protectrice vis-à-vis des pathogènes. Des anomalies du microbiote, fonction de l’environnement, alliées à des altérations de ce répertoire, favoriseront le développement de processus immunopathologiques. Les conséquences fonctionnelles de la liaison entre IgA et microbiote sont en effet couramment invoquées pour leur contribution à la pathogénie des dysbioses (les modifications de microbiote). Ces liens restent cependant incomplètement élucidés chez l’homme et il est difficile de les décrypter en raison de l’extrême hétérogénéité du microbiote intestinal humain, mais aussi de la complexité des répertoires des immunoglobulines IgA qui participent à l’immunité muqueuse. Des aspects qui semblent des constantes peuvent cependant être définis dans la caractérisation du microbiote intestinal humain, et des microbes qui le composent qui se lient ou non aux IgA, avec, en particulier, des évolutions qui reposent en premier lieu sur sa maturation, selon l’âge et l’alimentation [
20
]. L’étude de patients présentant un déficit de production d’IgA, l’une des immunodéficiences humaines les plus fréquentes, permet de comprendre certains rôles spécifiques de cette réponse. En effet, malgré une forte réponse de type IgM, qui n’est, en fait, qu’en partie compensatoire, le déficit en IgA peut exposer à des infections respiratoires ou à des colites, et à une translocation facilitée de certaines bactéries (telles
Salmonella typhimurium
) vers les ganglions mésentériques, de même qu’à une incidence accrue de maladies dysimmunitaires, comme la maladie cœliaque [
22
,
23
]. Le déficit en IgA ne bouleversera que modérément le microbiote des patients. Néanmoins, ce déficit pourra conduire à une hyporeprésentation de certains genres bactériens (en particulier les
lachnospiracées
et des
Firmicute
s, connus pour leur effet anti-inflammatoire, tels
Faecalibacterium
). D’autres seront au contraire sur-représentés en l’absence d’IgA : ils correspondent à des bactéries pro-inflammatoires, telles que
Streptococcus sanguinis, Veillonella parvula
et
Haemophilus parainfluenzae
[
23
]. Certaines liaisons entre IgA et microbiote apparaissent être les témoins d’une pathogénicité ou d’un processus inflammatoire : c’est le cas dans certaines maladies inflammatoires chroniques de l’intestin, ou chez certains enfants malnutris, ou encore dans la glomérulonéphrite à dépôts mésangiaux d’IgA [
16
]. Ainsi, pour cette néphropathie dysimmunitaire, caractérisée par des dépôts glomérulaires d’IgA polyclonales, un traitement antibiotique ciblant le microbiote intestinal diminue, chez la souris, la production globale d’IgA, la protéinurie et les dépôts glomérulaires d’IgA [
24
]. À noter que les stimulations antigéniques environnementales et la diversification des domaines variables des IgA permettent de moduler la capacité de ces immunoglobulines à former des dépôts [
25
,
26
].
Ainsi, par son action directe sur la synthèse d’IgAs, comme par son modelage des réponses lymphocytaires T, la flore microbienne est intimement impliquée dans la régulation de l’immunité muqueuse. Néanmoins, de nombreuses questions demeurent quant aux mécanismes par lesquels la liaison des IgA modifie la physiologie, la trophicité et/ou la composition du microbiote. En effet, on peut s’étonner de constater que malgré leur plasticité génomique, certains micro-organismes commensaux ne contre-sélectionnent pas les super-antigènes ciblés par les IgAs. Certains de ces super-antigènes, conservés au cours de l’évolution, ne semblent ainsi pas subir de pression de sélection négative exercée par la réponse immunitaire qu’ils suscitent, mais au contraire, une pression bénéfique. Cette pression pourrait les immobiliser dans le mucus, en des sites propices à la croissance des bactéries qui les expriment, d’une façon tolérogène ou symbiotique. Les futures études qui exploreront ces questions pourraient fournir des pistes thérapeutiques intéressantes. En particulier, des stratégies de manipulation du microbiote, pourraient prévenir, traiter ou guérir des maladies de l’intestin par le rétablissement d’une flore intestinale équilibrée chez les patients dysbiotiques.
L’IgA reste encore aujourd’hui une classe d’anticorps délaissée, en termes d’applications thérapeutiques. Pourtant, ses propriétés effectrices pourraient être intéressantes pour, par exemple, un ciblage anti-tumoral [
27
]. Une meilleure connaissance du système immunitaire muqueux, de son dialogue avec le microbiote et de son rôle dans la tolérance comme dans l’immunité, fournira sans doute des clés en vue de l’utilisation clinique future d’une classe d’anticorps dont les fonctions, à doubles facettes, restent assez énigmatiques.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Les auteurs ont bénéficié du soutien d’un contrat de l’Agence nationale de la recherche (ANR-16-CE15-0019-01) et de l’Institut national contre le cancer (INCA-12642).
|
Footnotes |
1.
Woof
JM
,
Mestecky
J
.
Mucosal immunoglobulins.
.
Immunol Rev.
2005;
;
206
:
:64.
–
82
.
2.
Sterlin
D
,
Fadlallah
J
,
Adams
O
,
et al.
Human IgA binds a diverse array of commensal bacteria.
.
J Exp Med.
2020;
;
217
:
:e20181635.
.
3.
Bruhns
P
,
Jönsson
F
.
Mouse and human FcR effector functions.
.
Immunol Rev.
2015;
;
268
:
:25.
–
51
.
4.
Biram
A
,
Strömberg
A
,
Winter
E
,
et al.
BCR affinity differentially regulates colonization of the subepithelial dome and infiltration into germinal centers within Peyer’s patches.
.
Nat Immunol.
2019;
;
20
:
:482.
–
492
.
5.
Kumar
N
,
Arthur
CP
,
Ciferri
C
,
Matsumoto
ML
.
Structure of the secretory immunoglobulin A core.
.
Science.
2020;
;
367
:
:1008.
–
14
.
6.
Mostov
KE
,
Friedlander
M
,
Blobel
G
.
The receptor for transepithelial transport of IgA and IgM contains multiple immunoglobulin-like domains.
.
Nature.
1984;
;
308
:
:37.
–
43
.
7.
Rochereau
N
,
Drocourt
D
,
Perouzel
E
,
et al.
Dectin-1 is essential for reverse transcytosis of glycosylated SIgA-antigen complexes by intestinal M cells.
.
PLoS Biol.
2013;
;
11
:
:e1001658.
.
8.
Macpherson
AJ
,
Gatto
D
,
Sainsbury
E
,
et al.
A primitive T cell-independent mechanism of intestinal mucosal IgA responses to commensal bacteria.
.
Science.
2000;
;
288
:
:2222.
–
2226
.
9.
Wilmore
JR
,
Gaudette
BT
,
Gomez Atria
D
,
et al.
Commensal microbes induce serum IgA responses that protect against polymicrobial sepsis.
.
Cell Host Microbe.
2018;
;
23
(
(302–11)
):
:e3.
.
10.
Secchi
M
,
Bazzigaluppi
E
,
Brigatti
C
,
et al.
COVID-19 survival associates with the immunoglobulin response to the SARS-CoV-2 spike receptor binding domain.
.
J Clin Invest.
2020
Nov 9;
:142804.
. doi:
10.1172/JCI142804
.
11.
Palm
NW
,
de Zoete
MR
,
Cullen
TW
,
et al.
Immunoglobulin A coating identifies colitogenic bacteria in inflammatory bowel disease.
.
Cell.
2014;
;
158
:
:1000.
–
1010
.
12.
van der Waaij
LA
,
Limburg
PC
,
Mesander
G
,
van der Waaij
D
.
In vivo IgA coating of anaerobic bacteria in human faeces.
.
Gut.
1996;
;
38
:
:348.
–
354
.
13.
Bunker
JJ
,
Erickson
SA
,
Flynn
TM
,
et al.
Natural polyreactive IgA antibodies coat the intestinal microbiota.
.
Science.
2017;
;
358
:
:eaan6619.
.
14.
Bunker
JJ
,
Flynn
TM
,
Koval
JC
,
et al.
Innate and adaptive humoral responses coat distinct commensal bacteria with immunoglobulin A.
.
Immunity.
2015;
;
43
:
:541.
–
553
.
15.
Chen
JW
,
Rice
TA
,
Bannock
JM
,
et al.
Autoreactivity in naive human fetal B cells is associated with commensal bacteria recognition.
.
Science.
2020;
;
369
:
:320.
–
5
.
16.
Bunker
JJ
,
Bendelac
A
.
IgA responses to microbiota.
.
Immunity.
2018;
;
49
:
:211.
–
224
.
17.
Lécuyer
E
,
Rakotobe
S
,
Lengliné-Garnier
H
,
et al.
Segmented filamentous bacterium uses secondary and tertiary lymphoid tissues to induce gut IgA and specific T helper 17 cell responses.
.
Immunity.
2014;
;
40
:
:608.
–
620
.
18.
Schnupf
P
,
Gaboriau-Routhiau
V
,
Gros
M
,
et al.
Growth and host interaction of mouse segmented filamentous bacteria in vitro.
.
Nature.
2015;
;
520
:
:99.
–
103
.
19.
Bunker
JJ
,
Drees
C
,
Watson
AR
,
et al.
B cell superantigens in the human intestinal microbiota.
.
Sci Transl Med.
2019;
;
11
:
:eaau9356.
.
20.
New
JS
,
Dizon
BLP
,
Fucile
CF
,
et al.
Neonatal exposure to commensal-bacteria-derived antigens directs polysaccharide-specific B-1 B cell repertoire development.
.
Immunity.
2020;
;
53
:
:172.
–
86.e6
.
21.
Planer
JD
,
Peng
Y
,
Kau
AL
,
et al.
Development of the gut microbiota and mucosal IgA responses in twins and gnotobiotic mice.
.
Nature.
2016;
;
534
:
:263.
–
266
.
22.
Cunningham-Rundles
C.
.
Physiology of IgA and IgA deficiency.
.
J Clin Immunol.
2001;
;
21
:
:303.
–
309
.
23.
Fadlallah
J
,
El Kafsi
H
,
Sterlin
D
,
et al.
Microbial ecology perturbation in human IgA deficiency.
.
Sci Transl Med.
2018;
;
10
:
:eaan1217.
.
24.
Chemouny
JM
,
Gleeson
PJ
,
Abbad
L
,
et al.
Modulation of the microbiota by oral antibiotics treats immunoglobulin A nephropathy in humanized mice.
.
Nephrol Dial Transplant.
2019;
;
34
:
:1135.
–
1144
.
25.
Oruc
Z
,
Oblet
C
,
Boumediene
A
,
et al.
IgA structure variations associate with immune stimulations and IgA mesangial deposition.
.
J Am Soc Nephrol.
2016;
;
27
:
:2748.
–
2761
.
26.
Wehbi
B
,
Oblet
C
,
Boyer
F
,
et al.
Mesangial deposition can strongly involve innate-like IgA molecules lacking affinity maturation.
.
J Am Soc Nephrol.
2019;
;
30
:
:1238.
–
1249
.
27.
Pascal
V
,
Laffleur
B
,
Debin
A
,
et al.
Anti-CD20 IgA can protect mice against lymphoma development: evaluation of the direct impact of IgA and cytotoxic effector recruitment on CD20 target cells.
.
Haematologica.
2012;
;
97
:
:1686.
–
1694
.
|