| |
| Med Sci (Paris). 37(3): 235–241. doi: 10.1051/medsci/2021009.Il était une fois l’hépatotoxicité… Brendan Le Daré,1,2* Pierre-Jean Ferron,1** and Thomas Gicquel1,2*** 1Univ Rennes, Inserm, INRAE, CHU de Rennes, Institut Nutrition, métabolisme et cancer (NuMeCan), Réseau PREVITOX
,
F-35000Rennes
,
France 2CHU de Rennes, Laboratoire de toxicologie biomédicale et médico-légale
,
2 rue Henri Le Guilloux
,
F-35000Rennes
,
France |
Vignette (Photo © Inserm U49).
Le foie assure une grande part du catabolisme des xénobiotiques
1
, ces substances étrangères apportées par l’alimentation ou l’environnement, grâce à son équipement enzymatique, sa localisation anatomique et sa vascularisation abondante. Ce processus, appelé détoxification, a pour but de rendre ces xénobiotiques plus hydrophiles, afin de faciliter leur élimination. Ces particularités du foie en font néanmoins une cible pour les composés toxiques. En effet, bien que la plupart des réactions de catabolisme conduisent à la production d’un composé moins toxique que la molécule dont ce dernier est issu, il est relativement fréquent que ces modifications conduisent à un métabolite plus toxique. Nous présenterons dans cette revue les hépatotoxicités intrinsèques, qui surviennent de manière prévisibles et reproductible à des doses connues, et les hépatotoxicités idiosyncrasiques, qui surviennent de manière non prévisible, chez des individus qui présentent des susceptibilités individuelles. Les hépatotoxicités idiosyncrasiques à médiation immune (HIMI) seront plus particulièrement détaillées.
|
Les xénobiotiques hépatotoxiques
Les hépatotoxicités liées aux xénobiotiques, comme les médicaments, les substances d’origine naturelle et les agents chimiques, constituent une cause importante d’atteinte hépatique. Elles constituent un véritable défi pour les cliniciens, l’industrie pharmaceutique, et les agences de santé [
1
]. Ces hépatites n’ont pas de traitement spécifique, hormis le cas des intoxications au paracétamol, contre lesquelles la N-acétyl-cystéine a démontré son efficacité [
2
]. Leur prise en charge repose donc sur l’interruption de l’exposition à l’agent responsable afin d’éviter une aggravation de l’atteinte hépatique. Les hépatotoxicités sont classées de différentes façons
(
Tableau I
)
. Dans un but diagnostic, la classification clinique distingue les atteintes hépatocellulaires, cholestatiques ou mixtes. Le critère chronologique différencie les hépatotoxicités aiguës, si les anomalies des examens évaluant les fonctions hépatiques durent moins de trois mois, des atteintes chroniques [
3
]. La classification histologique permet également d’apporter des éléments quant à la cause et la sévérité de l’atteinte [
4
]
(
Tableau I
)
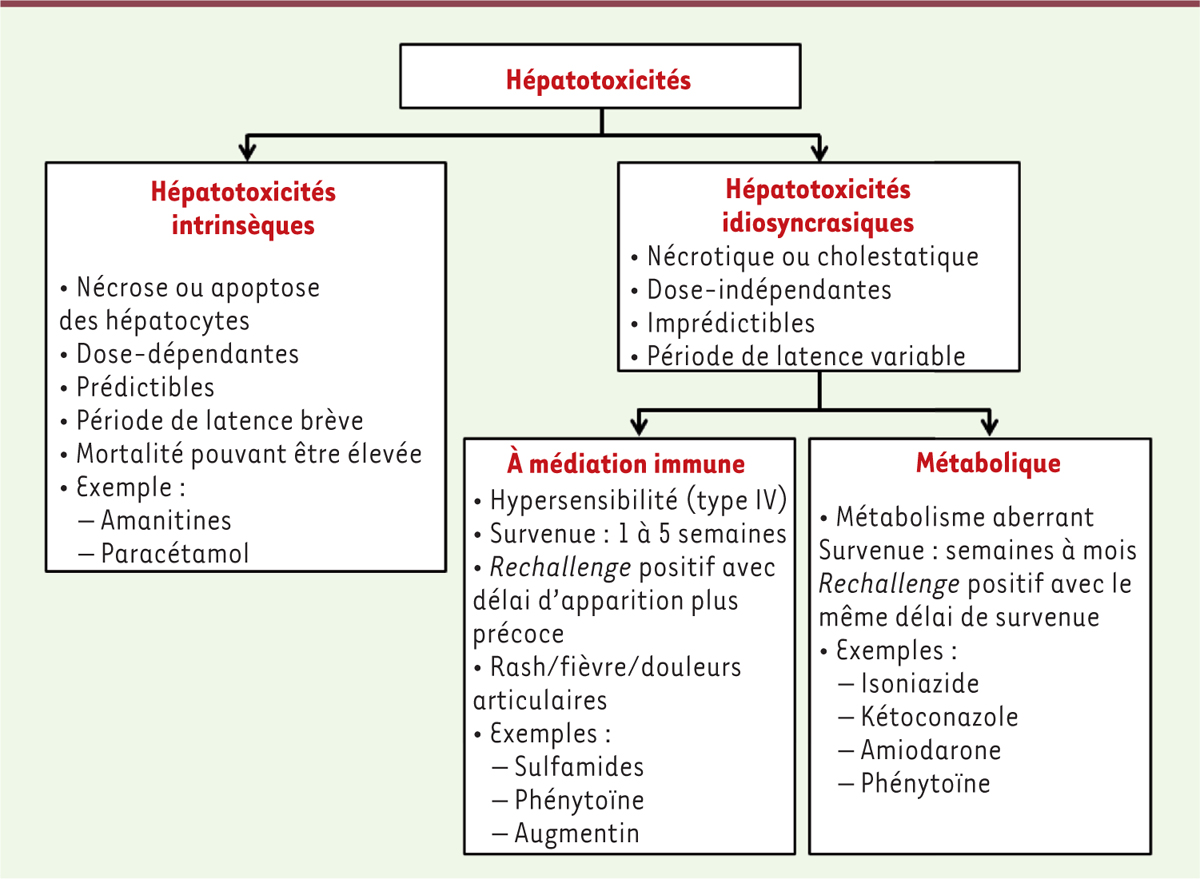
. Une classification reposant sur les mécanismes de toxicité induite permet de différencier les hépatotoxicités intrinsèques (prévisibles et dose-dépendantes, comme celle due au paracétamol) des hépatotoxicités idiosyncrasiques (imprévisibles, dont les médiateurs sont immunitaires ou métaboliques)
(
Figure 1
)
.
 | Figure 1. Classification des hépatotoxicités par mécanisme d’action. Rechallenge positif : nouvelle administration du médicament avec récidive de l’événement à la réintroduction. |
Tableau I.
| Classification |
Type d’atteinte |
Résultats biologiques |
|
Clinique
|
Hépatocellulaire
ou cytolytique
|
ALAT > 2N ou ALAT/PAL ≥ 5 |
| Cholestatique |
PAL > 2N ou ALAT/PAL ≤ 2 |
| Mixte |
ALAT et PAL > 2N et ALAT/PAL entre 2 et 5 |
|
|
Caractéristiques
|
|
|
Histologique
|
Hépatocellulaire aiguë ou chronique |
| Cholestatique aiguë ou chronique |
| Stéatoses et stéatohépatites |
| Granulomes |
| Zones nécrotiques |
| Signes d’obstruction veineuse hépatique |
| Syndrome d’obstruction sinusoïdale |
| Phospholipidose ou surcharge lysosomale |
| Péliose hépatique |
Classifications clinique et histologique des atteintes hépatotoxiques.
ALAT : alanine aminotransférases, PAL : phosphatase alcaline.
|
|
Les hépatotoxicités intrinsèques
Les hépatotoxicités intrinsèques font référence aux xénobiotiques capables de causer une nécrose hépatocellulaire prévisible et reproductible chez l’homme, lorsqu’une dose seuil est dépassée. Elles ont pour origine la substance elle-même ou l’un de ses métabolites [
5
]. La période de latence entre l’exposition et le début de l’hépatotoxicité est brève, de quelques heures à quelques jours. Les mécanismes de toxicité sont variés, souvent spécifiques de chaque molécule
(
Tableau II
)
[
6
]. Il est cependant possible de classer les mécanismes des hépatotoxicités intrinsèques selon un modèle ayant trois étapes : 1) les mécanismes initiaux de toxicité (stress cellulaire direct, altération mitochondriale, etc.) ; 2) l’activation des cascades de signalisation ; et 3) la mort des cellules stimulées par apoptose ou nécrose [
7
]. Les évènements déclencheurs des mécanismes toxiques sont majoritairement liés aux métabolites de la molécule mère, bien que celle-ci puisse être directement impliquée. Le métabolisme oxydatif
via
les cytochromes P450 (CYP) joue un rôle important dans ces mécanismes. Ces métabolites exercent en effet un stress sur les cellules, au travers de nombreux mécanismes, comme la déplétion en glutathion, ou la liaison à des protéines, des lipides, des acides nucléiques ou à diverses structures cellulaires. L’atteinte des mitochondries par ces composés toxiques peut également découpler ou inhiber la chaîne respiratoire, provoquant une déplétion en ATP, une augmentation de la production des espèces réactives de l’oxygène, des dommages à l’ADN mitochondrial, la création de pores de transition de perméabilité mitochondriale
2,
ou une inhibition de la β-oxydation des acides gras [
7
].
Tableau II.
| Mécanismes toxiques |
Détails |
Exemples |
|
Formation de liaisons covalentes à des protéines
|
Formation d’adduits par liaison d’un toxique ou de son métabolite réactif à des protéines, lipides, acides nucléiques, ou à diverses structures cellulaires. |
NAPQI (métabolite du paracétamol) en phase initiale |
|
|
Inhibition enzymatique directe
|
Inhibition de l’ARN polymérase II, entraînant une diminution de la synthèse protéique |
Amanitines (toxines de l’amanite phalloïde) |
|
|
Inhibition de la
b
-oxydation des acides gras
|
La substance provoque une déplétion en coenzyme A extramitochondrial et/ou une inhibition d’une ou plusieurs enzymes de la β-oxydation |
Amiodarone, acide valproïque, tétracyclines |
|
|
Trouble de l’excrétion biliaire
|
Inhibition du cytosquelette, des microfilaments d’actine ou des transporteurs d’efflux (BSEP) |
Chlorpromazine, troglitazone, bosentan |
|
|
Déclenchement de l’apoptose
|
Voies du récepteur du TNF-α/Fas/caspases ou
via
d’autres cytokines pro-inflammatoires. Relargage du cytochrome c et d’autres protéines pro-apoptotiques mitochondriales vers le cytosol. Activation des caspase-2, 3, 6, 7, et 9 menant à l’apoptose.
|
Paracétamol (en phase tardive) |
|
|
Peroxydation lipidique
|
Production de radicaux libres avec les acides gras polyinsaturés des membranes, entraînant des troubles de la fluidité, de la perméabilité et de la stabilité membranaires |
Tétrachlorure de carbone |
|
|
Déplétion en ATP
|
Découplage de la phosphorylation oxydative mitochondriale |
Acide valproïque |
| Altération de l’homéostasie calcique cytoplasmique |
Fer |
|
|
Lésions des cellules endothéliales
|
Destruction des filaments d’actine des cellules endothéliales et activation des métalloprotéinases entraînant un syndrome d’occlusion sinusoïdal |
Alcaloïdes pyrrolizidiniques |
|
|
Lésions de l’ADN
|
Lésions directes de l’ADN conduisant à la mort cellulaire |
Agents alkylants (cyclophosphamide) |
| Transformation néoplasique |
Stéroïdes |
|
|
Lésion des organites intracellulaires
|
Réticulum endoplasmique |
Tétrachlorure de carbone |
| Mitochondrie |
Hydrazine |
|
|
Ischémie
|
Vasospasme entraînant une diminution d’apport d’oxygène et de nutriments |
Cocaïne |
Principaux mécanismes moléculaires pouvant aboutir à une lésion cellulaire hépatique toxique.
|
Ces atteintes spécifiques convergent vers des cascades de signalisation communes non spécifiques. Elles constituent la deuxième étape des mécanismes de toxicité intrinsèque. L’activation de la voie du réticulum endoplasmique, la perméabilisation lysosomale ou l’activation des JNK (
c-Jun N-terminal kinases
) sont classiquement impliquées. Les protéines pro-apoptotiques (Bax, Bak, Bad) sont alors activées et les protéines anti-apoptotiques (Bcl-2, Bcl-xL) désactivées, ce qui conduit à la création de pores de transition de perméabilité mitochondriale [
7
,
8
]. L’altération des fonctions mitochondriales et donc de la production d’énergie conduit alors à l’apoptose ou la nécrose de la cellule. Lors d’une intoxication, ces deux mécanismes coexistent, en proportion variable selon la dose de substance toxique administrée et de la vulnérabilité des hépatocytes. La mitochondrie reste cependant au centre de ces différents mécanismes, car ce sont elles qui produisent la majorité de l’ATP et des espèces réactives de l’oxygène intracellulaires et qui orientent éventuellement vers un certain type de mort cellulaire [
7
,
9
]. Dans le cas de la nécrose, le gonflement et la lyse des cellules qui suivent une perturbation des fonctions cellulaires induisent des réponses inflammatoires, incluant la production de cytokines. Ces mécanismes, qui sensibilisent les hépatocytes environnants, peuvent ainsi amplifier les lésions initiales et provoquer d’autres dommages [
7
].
|
Les hépatotoxicités idiosyncrasiques
Contrairement aux hépatotoxicités intrinsèques, les hépatotoxicités idiosyncrasiques ne concernent que certains sujets qui présentent des facteurs individuels de sensibilité. La période de latence entre exposition au médicament et réaction toxique est dans ce cas variable, généralement entre un et trois mois, bien que des atteintes aient été rapportées comme ayant une latence pouvant aller jusqu’à un an [
10
]. Les présentations cliniques sont plus variées et la relation dose-effet est moins évidente que dans les toxicités intrinsèques. Les hépatotoxicités allergiques à l’halothane surviennent ainsi plus fréquemment à des doses élevées du médicament [
11
]. Selon l’
American College of Gastroenterology
, ces hépatotoxicités seraient le résultat d’interactions complexes entre l’environnement, le xénobiotique et l’hôte (facteurs génétiques, âge, sexe, facteurs immunitaires, maladies pré-existantes) [
5
]. Deux types d’hépatotoxicités idiosyncrasiques sont cependant distinguées : métaboliques ou à médiation immune
(
Figure 1
)
.
Hépatotoxicité idiosyncrasique métabolique
Des déterminants génétiques, à l’origine de métabolismes aberrants, ont été incriminés dans le développement de ces toxicités. Une accumulation locale de métabolites toxiques, altérant les protéines, les lipides et l’ADN, a été suggérée. Ces modifications biochimiques produiraient un stress oxydant à l’origine d’un déséquilibre de la balance redox et de la peroxydation lipidique, entraînant la nécrose des hépatocytes [
12
]. Les mitochondries, les microtubules et le réticulum endoplasmique peuvent également être affectés, altérant la signalisation cellulaire [
13
,
14
]. La régulation des transporteurs d’efflux
3
est également altérée et des mécanismes immunologiques ont été mis en évidence [
15
]. Ainsi, des néoantigènes peuvent être formés à la suite de l’interaction du métabolite avec des protéines exprimées par l’hépatocyte, pouvant conduire à une immunogénicité et une activation du système immunitaire [
14
]. Cependant, aucune manifestation d’hypersensibilité n’est observée en pratique médicale. L’amiodarone, le diclofenac ou le valproate de sodium sont des médicaments connus pour induire ce type d’hépatotoxicité
(
Tableau III
)
.
Tableau III.
| Hépatotoxicités intrinsèques |
Hépatotoxicités idiosyncrasiques |
|
Immunologique |
Métabolique |
| Paracétamol |
Sulfamides |
Isoniazide |
|
| Amanitines |
Phénytoïne |
Kétoconazole |
|
| Tolcapone |
Amoxicilline/acide clavulanique |
Amiodarone |
|
| Alcaloïdes pyrrolizidiniques |
Allopurinol |
Phénytoïne |
|
| Pyrazinamide |
Halothane |
Diclofénac |
|
| Rifampicine |
Minocycline, flucloxacilline |
Pyrazinamide |
|
| Névirapine |
Ximélagatran
6
|
Acide valproïque |
|
| Troglitazone |
Phénothiazines |
Dantrolène |
|
| Felbamate |
Antidépresseurs tricycliques |
Isotrétinoïne |
Exemples de xénobiotiques hépatotoxiques classés selon leurs mécanismes de toxicité.
|
Hépatotoxicité idiosyncrasique à médiation immune
Les hépatotoxicités idiosyncrasiques à médiation immune (HIMI) constituent les formes d’hépatotoxicité les moins bien connues. Elles sont rares : elles concernent moins de 1 sujet sur 10 000 pour les atteintes sévères. Leur caractère imprévisible ne permet pas de les identifier avant les dernières étapes du développement clinique [
16
]. La détermination des susceptibilités individuelles conduisant à la survenue des HIMI est nécessaire pour en comprendre les mécanismes. Ces susceptibilités peuvent être phénotypiques ou génétiques, concernant des gènes de l’immunité ou impliqués dans le métabolisme des médicaments. Ces atteintes peuvent être accompagnées de signes cliniques et histologiques révélant une hypersensibilité. Ainsi, des éruptions cutanées (rashs), accompagnées de fièvre, de douleurs articulaires (de type inflammatoire), d’adénopathies, et d’une augmentation du nombre de granulocytes éosinophiles dans le sang, peuvent être observés. Des formes sévères comme des syndromes de Lyell ou de Stevens-Johnson
4
peuvent également survenir. Des infiltrats leucocytaires dans le foie ont également été décrits [
17
]. Chez les individus développant ces hépatotoxicités, la durée d’exposition médicamenteuse est en général d’une à huit semaines [
18
]. La récurrence des symptômes en cas de ré-administration survient après la prise d’une ou deux doses [
15
].
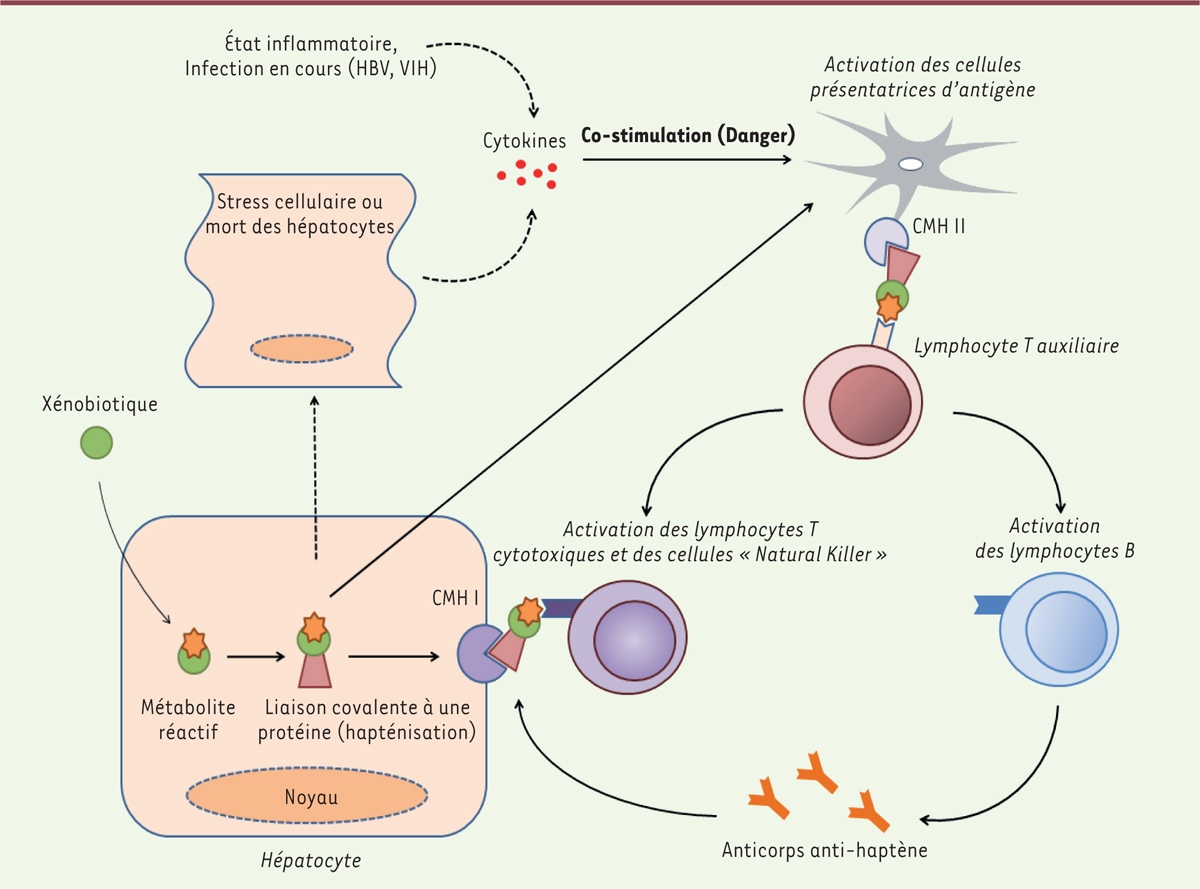
Les facteurs influençant l’apparition d’une hypersensibilité médicamenteuse semblent résulter d’une modification des protéines du soi par fixation covalente d’un métabolite qui joue alors le rôle d'un haptène devenu immunogénique, les protéines du soi ainsi modifiées jouant le rôle de protéines « porteuses » (
carriers
)
5,
. Ces néoantigènes, présentés par les molécules de classe II du complexe majeur d’histocompatibilité (CMH II) des cellules présentatrices d’antigènes aux lymphocytes T auxiliaires, induisent le recrutement et l’activation de lymphocytes T cytotoxiques, de cellules NK (
natural killer
) et de lymphocytes B [
10
,
12
,
14
]
(
Figure 2
)
. Les mécanismes à l’origine de la mort des cellules exposant ces néoantigènes sont variés, dépendant des cellules impliquées. Notamment, les lymphocytes T cytotoxiques induisent une apoptose
via
le ligand de Fas et le granzyme B. Les hépatocytes sont également soumis à un stress oxydant menant à la formation d’espèces réactives de l’oxygène endommageant l’ADN, les protéines et les lipides. Ces modifications aggravent des dommages hépatiques dus à l’activation du système immunitaire [
19
]. Il semble également que les dysfonctionnements mitochondriaux induits jouent un rôle important dans la pathogenèse des atteintes, avec notamment l’activation des kinases JNK [
20
].
 | Figure 2. Mécanismes généraux des hépatotoxicités idiosyncrasiques à médiation immune. |
Ce mécanisme de couplage à des protéines du soi rendant le métabolite immunogénique ne serait pas toujours suffisant pour déclencher une réaction immunitaire de type allergique. Le concept, appelé « hypothèse des dangers », suggère en effet qu’un signal additionnel provoquerait son déclenchement [
21
]. Dans le cas où des métabolites réactifs causeraient un stress modéré des hépatocytes, la production de cytokines en résultant pourrait constituer un signal de danger induisant alors une présentation de l’antigène par les molécules de classe II du CMH par les cellules présentatrices d’antigènes conduisant alors à une hépatotoxicité autoimmune. Ces cytokines sensibiliseraient également les hépatocytes aux effets létaux du TNF-α (
tumor necrosis factor alpha
), du ligand de Fas et de l’interféron-γ produit par les cellules de Kupffer (les macrophages du foie) et les lymphocytes T cytotoxiques [
7
]. Des études récentes ont évalué
in vitro
l’activation de monocytes cultivés en présence de surnageants de culture d’hépatocytes exposés à différents xénobiotiques. Une augmentation de la sécrétion de cytokines a été observée dans le cas d’hépatocytes ayant été mis en présence de xénobiotiques à l’origine d’HIMI [
22
-
26
]. Un état inflammatoire ou infectieux pourrait également participer à la constitution de ce signal additionnel, par la sécrétion de cytokines pro-inflammatoires
(
Figure 2
)
.
Certains haplotypes du système HLA (
human leukocyte antigen
) sont associés au développement d’hépatotoxicités idiosyncrasiques. HLA-DRB1*15 :01, HLA-B*5701, HLA-DRB1*03 et DQB1*02:02 ont été associés aux hépatotoxicités induites par, respectivement, l’association amoxicilline-acide clavulanique, la flucloxacilline, l’isoniazide et le lapatinib [
27
,
28
]. Kullak-Ublick
et al.
ont suggéré la possibilité d’une interaction pharmacologique directe, dans laquelle une substance ou son métabolite pourrait se lier à une molécule HLA (comme dans le cas du ximélagatran et de HLA-DRB1*0701), ou à un TCR (
T-cell receptor
) particulier, provoquant l’activation de certains lymphocytes T [
29
]. Ces interactions pharmacologiques peuvent être modélisées
in silico
[
30
]. Ces approches de modélisation par informatique (
docking
) permettent de déterminer les régions impliquées dans les liaisons entre un médicament ou ses métabolites et le complexe HLA [
31
]. Ces modèles utilisent des bases de données recensant les déclarations d’interactions entre médicaments et haplotypes HLA [
32
] combinées à des méthodes d’apprentissage
in silico
(
machine learning
) pour prédire les caractéristiques moléculaires d’un xénobiotique et sa propension à induire une immunotoxicité.
6
Les hépatotoxicités induites par les xénobiotiques peuvent finalement avoir un profil similaire à celui d’une atteinte hépatique d’origine auto-immune. Dans ce cas, les patients présentent généralement des taux de gamma-globulines augmentés, des anticorps anti-nucléaires et/ou des anticorps anti-muscle lisse. Bien que très semblables, ces formes iatrogènes se différencient des hépatites auto-immunes par leur absence de réponse au traitement par corticoïdes [
33
].
|
Le test de provocation par réexposition à la substance reste la méthode de diagnostic clinique de référence des réactions idiosyncrasiques. Il n’est cependant pas utilisé en routine en raison des questions éthiques qu’il soulève et des éventuelles graves conséquences qu’il peut avoir sur la santé du patient. Plusieurs autres tests ont donc été proposés. Par exemple, le test de transformation lymphocytaire (TTL)
7
consiste à évaluer
ex vivo
, en réponse à la substance responsable, la prolifération de lymphocytes isolés de patients ayant présenté une réaction d’hypersensibilité. Des réponses positives ont été rapportées en cas d’HIMI, avec une positivité du test comprise entre 12 % et 95 % selon les substances [
34
]. Récemment Whritenour
et al.
ont évalué la prolifération cellulaires non pas par l’incorporation de thymidine, mais par la production de granzyme B et de cytokines par les cellules stimulées. Ce nouveau test a ainsi permis le diagnostic d’atteintes hépatiques dues à l’isoniazide [
34
]. Benesic
et al.
ont par ailleurs rapporté l’utilisation de cellules « hepatocyte-like » (cellules de Kupffer, qui sont des macrophages dérivés de monocytes isolés de patients) pour le diagnostic d’HIMI et la détermination du xénobiotique en cause. Incubées avec les substances incriminées, ces cellules ont présenté des toxicités spécifiques, révélant la responsabilité de ces molécules dans les atteintes hépatiques des patients [
35
]. Dans une étude réalisée sur 13 patients atteints d’HIMI, ce test a ainsi permis l’identification de la substance responsable des hépatotoxicités avec une sensibilité de 92 % et une spécificité de 100 % [
36
]. Bien que ces tests aient permis d’appréhender le rôle de l’immunité adaptative dans la pathogenèse des HIMI, leur utilisation n’est pas répandue en pratique, notamment en raison du temps long et de la logistique nécessaires à leur réalisation.
|
Les autres mécanismes d’hépatotoxicité
Dans certains cas, la toxicité est liée à une atteinte des tissus hépatiques non parenchymateux. Les atteintes de l’épithélium biliaire, par les métabolites de la flucloxacilline [
37
], la fibrose hépatique, par activation des cellules stellaires par le méthotrexate [
38
], et les syndromes d’obstruction sinusoïdale par les alcaloïdes pyrrolizidiniques [
39
] en sont des exemples.
Un dernier mécanisme d’hépatotoxicité est lié à la diminution de l’apport sanguin au foie (foie ischémique), due à l’action du xénobiotique [
6
]. De cause variable, cette ischémie peut résulter d’un épisode de bas débit périphérique (après une intoxication par un cardiotrope), ou d’une hypoxémie extrême (par intoxication par un psychotrope), ou d’un vasospasme (après intoxication par la cocaïne) [
6
].
|
Les facteurs favorisant des hépatotoxicités
Plusieurs facteurs ont été identifiés comme contribuant à la pathogenèse des hépatotoxicités induites par les xénobiotiques. Quel que soit leur mécanisme, ces facteurs aggravants altèrent le niveau d’exposition au produit toxique et augmentent le risque de survenue de ces atteintes. Parmi ceux-ci, citons : 1) les facteurs génétiques, dont les polymorphismes de gènes codant les CYP, les molécules HLA, et des enzymes impliquées dans le métabolisme [
40
] ; 2) la consommation d’alcool, responsable d’une induction de CYP2E1 et d’une déplétion cellulaire en glutathion [
41
] ; 3) la prise de certains aliments ou médicaments inducteurs ou inhibiteurs d’enzymes [
42
] ; 4) l’âge [
43
] ; 5) les maladies hépatiques sous-jacentes [
44
] ; et 6) les doses utilisées et les caractéristiques de la molécule (lipophilie) [
7
,
45
].
|
Les hépatotoxicités liées aux xénobiotiques constituent un sujet très vaste, du fait de la multitude de mécanismes et d’acteurs impliqués. Très peu de traitements spécifiques existent. La connaissance des mécanismes d’hépatotoxicité reste donc à ce jour la meilleure option, afin de développer de nouvelles thérapies adaptées et d’améliorer la prise en charge médicale des patients. L’implication de multiples types cellulaires dans la pathogenèse des hépatotoxicités idiosyncrasiques à médiation immune, ajoutée à leur caractère imprévisible, constitue une limite majeure au développement de modèles expérimentaux permettant leur étude. Cependant, la mise au point d’outils pour améliorer la prédiction et la compréhension de ces atteintes devrait permettre d’identifier des facteurs de risque et de nouveaux mécanismes de toxicité. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Larrey
D.
.
Foie, médicaments et agents chimiques.
.
Gastroenterol Clin Biol.
2009;
;
33
:
:1136.
–
1146
.
2.
Chiew
AL
,
Gluud
C
,
Brok
J
, et al.
Interventions for paracetamol (acetaminophen) overdose.
.
Cochrane Database Syst Rev.
2018
Feb. CD003328.
.
3.
Bénichou
C.
.
Criteria of drug-induced liver disorders.
.
J Hepatol.
1990;
;
11
:
:272.
–
276
.
4.
Zhang
X
,
Ouyang
J
,
Thung
SN
.
Histopathologic manifestations of drug-induced hepatotoxicity.
.
Clin Liver Dis.
2013;
;
17
:
:547.
–
564
.
5.
Chalasani
NP
,
Hayashi
PH
,
Bonkovsky
HL
,
et al.
ACG Clinical guideline: the diagnosis and management of idiosyncratic drug-induced liver injury.
.
Am J Gastroenterol.
2014;
;
109
:
:950.
–
966
.
6.
Megarbane
B
,
Deye
N
,
Baud
F
.
Foie toxique : mécanismes lésionnels et thérapeutiques pharmacologiques spécifiques.
.
Réanimation.
2007;
;
16
:
:632.
–
642
.
7.
Russmann
S
,
Kullak-Ublick
G
,
Grattagliano
I
.
Current concepts of mechanisms in drug-induced hepatotoxicity.
.
Curr Med Chem.
2009;
;
16
:
:3041.
–
3053
.
8.
Gunawan
BK
,
Liu
Z
,
Han
D
,
et al.
c-Jun N-Terminal kinase plays a major role in murine acetaminophen hepatotoxicity.
.
Gastroenterology.
2006;
;
131
:
:165.
–
178
.
9.
Leist
M
,
Single
B
,
Castoldi
AF
,
et al.
Intracellular adenosine triphosphate (atp) concentration: a switch in the decision between apoptosis and necrosis.
.
J Exp Med.
1997;
;
185
:
:1481.
–
1486
.
10.
Uetrecht
J.
.
Immunoallergic Drug-induced liver injury in humans.
.
Semin Liver Dis.
2009;
;
29
:
:383.
–
392
.
11.
Touloukian
J
,
Kaplowitz
N
.
Halothane-induced hepatic disease.
.
Semin Liver Dis.
1981;
;
1
:
:134.
–
142
.
12.
Gunawan
BK
,
Kaplowitz
N
.
mechanisms of drug-induced liver disease.
.
Clin Liver Dis.
2007;
;
11
:
:459.
–
475
.
13.
Kaplowitz
N.
.
Biochemical and cellular mechanisms of toxic liver injury.
.
Semin Liver Dis.
2002;
;
22
:
:137.
–
144
.
14.
Kaplowitz
N.
.
Idiosyncratic drug hepatotoxicity.
.
Nat Rev Drug Discov.
2005;
;
4
:
:489.
–
499
.
15.
Björnsson
ES
,
Bergmann
OM
,
Björnsson
HK
,
et al.
Incidence, presentation, and outcomes in patients with drug-induced liver injury in the general population of iceland.
.
Gastroenterology.
2013;
;
144
:
:1419.
–
25e3
.
16.
Mosedale
M
,
Watkins
PB
.
Understanding idiosyncratic toxicity: lessons learned from drug-induced liver injury.
.
J Med Chem.
2020;
;
63
:
:6436.
–
61
.
17.
Kleiner
DE
.
The histopathological evaluation of drug-induced liver injury.
.
Histopathology.
2017;
;
70
:
:81.
–
93
.
18.
Gunawan
B
,
Kaplowitz
N
.
Clinical perspectives on xenobiotic-induced hepatotoxicity.
.
Drug Metab Rev.
2004;
;
36
:
:301.
–
312
.
19.
Jaeschke
H
,
McGill
MR
,
Ramachandran
A
.
Oxidant stress, mitochondria, and cell death mechanisms in drug-induced liver injury: lessons learned from acetaminophen hepatotoxicity.
.
Drug Metab Rev.
2012;
;
44
:
:88.
–
106
.
20.
Han
D
,
Dara
L
,
Win
S
,
et al.
Regulation of drug-induced liver injury by signal transduction pathways: critical role of mitochondria.
.
Trends Pharmacol Sci.
2013;
;
34
:
:243.
–
253
.
21.
Séguin
B
,
Uetrecht
J
.
The danger hypothesis applied to idiosyncratic drug reactions.
.
Curr Opin Allergy Clin Immunol.
2003;
;
3
:
:235.
–
242
.
22.
Kato
R
,
Uetrecht
J
.
Supernatant from hepatocyte cultures with drugs that cause idiosyncratic liver injury activates macrophage inflammasomes.
.
Chem Res Toxicol.
2017;
;
30
:
:1327.
–
1332
.
23.
Oda
S
,
Matsuo
K
,
Nakajima
A
,
et al.
A novel cell-based assay for the evaluation of immune- and inflammatory-related gene expression as biomarkers for the risk assessment of drug-induced liver injury.
.
Toxicol Lett.
2016;
;
241
:
:60.
–
70
.
24.
Kegel
V
,
Pfeiffer
E
,
Burkhardt
B
,
et al.
Subtoxic concentrations of hepatotoxic drugs lead to Kupffer cell activation in a human in vitro liver model: an approach to study DILI.
.
Mediators Inflamm.
2015;
;
2015
:
:1.
–
14
.
25.
Ogese
MO
,
Faulkner
L
,
Jenkins
RE
,
et al.
Characterization of drug-specific signaling between primary human hepatocytes and immune cells.
.
Toxicol Sci.
2017;
;
158
:
:76.
–
89
.
26.
Mak
A
,
Kato
R
,
Weston
K
,
et al.
Editor’s highlight: an impaired immune tolerance animal model distinguishes the potential of troglitazone/pioglitazone and tolcapone/entacapone to cause IDILI.
.
Toxicol Sci.
2018;
;
161
:
:412.
–
420
.
27.
Kim
SH
,
Naisbitt
DJ
.
Update on advances in research on idiosyncratic drug-induced liver injury.
.
Allergy Asthma Immunol Res.
2016;
;
8
:
:3.
.
28.
Spraggs
CF
,
Budde
LR
,
Briley
LP
,
et al.
HLA-DQA1 * 02:01 is a major risk factor for lapatinib-induced hepatotoxicity in women with advanced breast cancer.
.
J Clin Oncol.
2011;
;
29
:
:667.
–
673
.
29.
Kullak-Ublick
GA
,
Andrade
RJ
,
Merz
M
,
et al.
Drug-induced liver injury: recent advances in diagnosis and risk assessment.
.
Gut.
2017;
;
66
:
:1154.
–
1164
.
30.
Illing
PT
,
Vivian
JP
,
Dudek
NL
,
et al.
Immune self-reactivity triggered by drug-modified HLA-peptide repertoire.
.
Nature.
2012;
;
486
:
:554.
–
558
.
31.
Schrey
AK
,
Nickel-Seeber
J
,
Drwal
MN
,
et al.
Computational prediction of immune cell cytotoxicity.
.
Food Chem Toxicol.
2017;
;
107
:
:150.
–
166
.
32.
Ghattaoraya
GS
,
Dundar
Y
,
González-Galarza
FF
, et al.
A web resource for mining HLA associations with adverse drug reactions: HLA-ADR.
.
Database.
2016;
;
2016
:
:baw069.
.
33.
Leise
MD
,
Poterucha
JJ
,
Talwalkar
JA
.
Drug-induced liver injury.
.
Mayo Clin Proc.
2014;
;
89
:
:95.
–
106
.
34.
Whritenour
J
,
Ko
M
,
Zong
Q
,
et al.
Development of a modified lymphocyte transformation test for diagnosing drug-induced liver injury associated with an adaptive immune response.
.
J Immunotoxicol.
2017;
;
14
:
:31.
–
38
.
35.
Benesic
A
,
Leitl
A
,
Gerbes
AL
.
Monocyte-derived hepatocyte-like cells for causality assessment of idiosyncratic drug-induced liver injury.
.
Gut.
2016;
;
65
:
:1555.
–
1563
.
36.
Benesic
A
,
Rotter
I
,
Dragoi
D
,
et al.
Development and validation of a test to identify drugs that cause idiosyncratic drug-induced liver injury.
.
Clin Gastroenterol Hepatol.
2018;
;
16
:
:1488.
–
94e5
.
37.
Lakehal
F
,
Dansette
PM
,
Becquemont
L
,
et al.
Indirect cytotoxicity of flucloxacillin toward human biliary epithelium via metabolite formation in hepatocytes.
.
Chem Res Toxicol.
2001;
;
14
:
:694.
–
701
.
38.
Jaskiewicz
K
,
Voigt
H
,
Blakolmer
K
.
Increased matrix proteins, collagen and transforming growth factor are early markers of hepatotoxicity in patients on long-term methotrexate therapy.
.
J Toxicol Clin Toxicol.
1996;
;
34
:
:301.
–
305
.
39.
DeLeve
LD
,
Shulman
HM
,
McDonald
GB
.
Toxic injury to hepatic sinusoids: sinusoidal obstruction syndrome (veno-occlusive disease).
.
Semin Liver Dis.
2002;
;
22
:
:27.
–
42
.
40.
DeLeve
LD
,
Kaplowitz
N
.
Mechanisms of drug-induced liver disease.
.
Gastroenterol Clin North Am.
1995;
;
24
:
:787.
–
810
.
41.
Schiodt
FV
,
Lee
WM
,
Bondesen
S
,
et al.
Influence of acute and chronic alcohol intake on the clinical course and outcome in acetaminophen overdose.
.
Aliment Pharmacol Ther.
2002;
;
16
:
:707.
–
715
.
42.
Đakovic´-Švajcer
K
,
Samojlik
I
,
Raškovic´
A
, et al.
The activity of liver oxidative enzymes after single and multiple grapefruit juice ingestion.
.
Exp Toxicol Pathol.
1999;
;
51
:
:304.
–
8
.
43.
Hilmer
SN
,
Shenfield
GM
,
Le Couteur
DG
.
Clinical implications of changes in hepatic drug metabolism in older people.
.
Ther Clin Risk Manag.
2005;
;
1
:
:151.
–
156
.
44.
Verbeeck
RK
.
Pharmacokinetics and dosage adjustment in patients with hepatic dysfunction.
.
Eur J Clin Pharmacol.
2008;
;
64
:
:1147.
–
1161
.
45.
Chen
M
,
Borlak
J
,
Tong
W
.
High lipophilicity and high daily dose of oral medications are associated with significant risk for drug-induced liver injury.
.
Hepatology.
2013;
;
58
:
:388.
–
396
.
|