|
Entretien avec Bruno Canard
Bruno Canard est directeur de recherche au CNRS et responsable de l’équipe « Réplicases virales : structure, mécanisme et drug-design » dans le laboratoire « Architecture et fonction des macromolécules biologiques » (AFMB) à Marseille. Il est spécialiste des coronavirus. Après un doctorat de microbiologie et biochimie obtenu à l’Institut Pasteur à Paris et un post-doctorat à la Harvard Medical School de Boston, il s’intéresse désormais à la structure et à la fonction des enzymes impliquées dans la réplication virale et le coiffage de l’ARN, ainsi qu’à leur utilisation dans la conception de médicaments antiviraux.
Comment en êtes-vous venu à travailler sur la réplication des coronavirus
?
Je me suis tout d’abord installé à Luminy en 1998 pour travailler sur les enzymes de la réplication, en particulier chez le virus de la dengue. Avec ma première étudiante qui effectuait une thèse de doctorat, nous avions déterminé la structure cristallographique d’une méthyltransférase, qui est une protéine associée à la polymérase de la dengue. Ces travaux de recherche m’ont valu d’être invité à un congrès sur les coronavirus en Hollande, dont l’organisateur était Eric Snijder. Il pensait à l’époque que les coronavirus étaient susceptibles de posséder cette méthyltransférase, ce qui s’est avéré vrai par la suite. Ce congrès a eu lieu début 2003, pendant l’épidémie de SRAS, ce qui m’a permis de prendre contact avec des virologistes spécialistes des coronavirus. C’est à ce moment-là que je me suis rendu compte que c’était une famille de virus intéressante étant donné la complexité et la diversité des enzymes que ces virus possèdent. Je me suis dit que les étudier allait me donner beaucoup de travail et pendant très longtemps car, à l’époque, les coronavirus étaient encore très peu étudiés. C’est donc en 2003 que j’ai pu commencer à travailler sur les coronavirus en participant à un projet européen car l’épidémie de SRAS avait contribué à donner un peu d’intérêt à l’étude de ces virus. Par la suite, je me suis passionné pour l’étude de l’ARN polymérase des coronavirus. Je suis biochimiste et j’aime les enzymes qui font des choses complexes. La polymérase est une enzyme qui doit contrôler plein de paramètres et qui possède des performances enzymatiques extraordinaires. Le fait qu’elle puisse catalyser 500 à 600 réactions par seconde avec une spécificité incroyable m’a fasciné, et j’ai donc décidé de consacrer une partie de ma vie à étudier son fonctionnement.
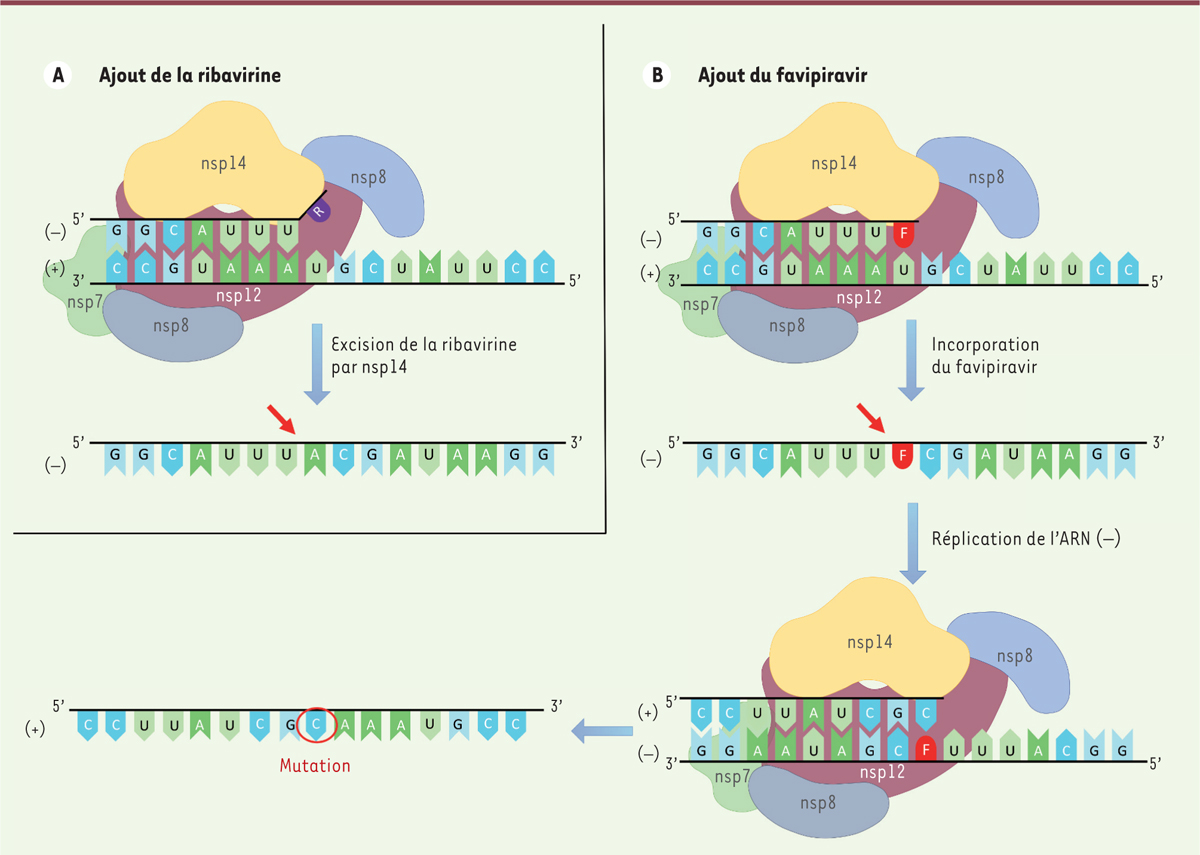
Dans votre article traitant de la RdRp, vous avez décrit la sous-unité nsp14 comme ayant une activité N7-MTase en plus de son activité d’exonucléase. à ce jour, toutes les guanine N7-MTase qui permettent la méthylation de la coiffe de l’ARN font partie de la famille des « Rossman fold », caractérisée par un motif particulier de repliement. Comment expliquez-vous que la sous-unité nsp14 n’en fasse pas partie
?
C’est une excellente question ; je pense que nous avons 20 à 30 ans de recherche devant nous pour y répondre. Le repliement de type « Rossman fold » est un repliement très ancien, présent chez les méthyltransférases, qui leur permet d’interagir avec un cofacteur appelé S adénosine méhionine (SAM) afin de méthyler la coiffe de l’ARN en cours de synthèse. Ce type de repliement primitif, apparu aux origines de la synthèse d’ARN, a été très conservé au cours de l’évolution grâce à sa stabilité et ses propriétés physico-chimiques qui permettent aux méthyltransférases d’être très spécifiques de SAM. La découverte d’une méthyltransférase chez les coronavirus ne possédant pas de repliement de type « Rossman fold » est absolument incroyable et totalement inexpliquée. On ne comprend pas pourquoi ce repliement présent chez la méthyltransférase des coronavirus n’a pas été remplacé par le « Rossman fold » au cours de l’évolution. On peut supposer que ce repliement différent a probablement émergé au même moment que le « Rossman fold » et qu’il a été conservé car il aurait conféré des propriétés différentes aux méthyltransférases. Toute la question est de savoir quelles pourraient être ces différences entre méthyltransférases.
À ce jour, quels sont vos objectifs en termes de recherche pour l’avenir ? Quelles sont les pistes que vous aimeriez explorer
?
Premièrement, le SARS-CoV-2. C’est un sujet d’actualité pour lequel il y a une urgence et qui est bien financé. Ce qui m’intéresse à ce jour, c’est de mieux comprendre les mécanismes de réplication pour pouvoir faire du design de médicament dans le but de contrôler l’épidémie. C’est une chance dans le sens où c’est un virus qui est extrêmement intéressant. Au-delà du fait de trouver rapidement un traitement, il reste encore quelques mécanismes à comprendre, notamment la manière dont la polymérase démarre la synthèse de l’ARN, ainsi que le coiffage des ARN par la guanylyltransférase. La compréhension de ces mécanismes au niveau moléculaire est importante pour aider à développer des antiviraux. Deuxièmement, ce qui m’intéresse particulièrement chez ces virus, c’est qu’ils ont un génome très grand constitué d’un ARN très long. Il existe certainement une raison pour laquelle ce virus a un génome aussi grand et pour que cette longueur ait été maintenue au cours de l’évolution, contrairement à d’autres virus. Une longue molécule d’ARN est moins stable, elle peut être la cible de nucléases issues de l’immunité innée de l’hôte. Le virus a dû acquérir de nouvelles enzymes pour lui permettre de conserver ce long génome. Comprendre les mécanismes impliqués dans la stabilité de ce génome, très anciens dans l’histoire de l’évolution, permettrait la mise au point de nouveaux antiviraux. Le défi, c’est d’arriver à faire financer des recherches sur des virus qui ont un grand génome constitué d’un long ARN mais qui n’ont aucune importance d’un point de vue médical. La communauté scientifique n’est pas prête actuellement à laisser les chercheurs explorer des pistes un peu extravagantes, peu connectées avec la réalité des gens (le confinement, le coronavirus, etc.). Ce type de recherche est extrêmement créatif et excitant, et pourrait être très fertile pour aboutir à de nombreuses découvertes très variées, y compris sur les coronavirus. Il est compliqué de faire financer la recherche sur des virus qui n’ont pas d’intérêt immédiat, mais qui en réalité sont importants pour la compréhension de mécanismes moléculaires.
Qu’est-ce que vous proposeriez pour empêcher de nouvelles crises comme celle de la pandémie actuelle et pour qu’à l’avenir, il n’y ait plus ce genre de problèmes
?
Une recherche fondamentale comme la nôtre conduit à proposer une voie d’action différente de la vaccination dans la mesure où, si nous sommes confrontés à un virus inconnu, quand on obtient la séquence de son génome, on remarque la plupart du temps que finalement, il ressemble à quelque chose de connu. À ce moment-là, on peut retrouver les protéines et les enzymes qui sont les plus conservées dans cette famille. Et si on a un médicament qui a été conçu auparavant pour agir contre les protéines de cette famille – en particulier les polymérases – mais aussi les protéases ou d’autres enzymes qui sont connues pour être des cibles thérapeutiques, alors on disposera à l’avance de cet antiviral sur notre étagère.
La voie du traitement antiviral est une approche beaucoup plus large et anticipatrice que celle consistant à préparer des vaccins qu’on va devoir adapter à chaque nouvel isolat qui va apparaître lors de l’épidémie. Les vaccins sont faits contre les protéines d’enveloppe du virus, qui sont soumises à une pression sélective extrême et qui varient beaucoup, même au sein d’une même famille. Cela pose problème pour la vaccination. Mais dès que les vaccins seront disponibles
*
, et nous l’espérons tous, les traitements antiviraux devraient aussi prendre leur place dans la stratégie de contrôle de la maladie.
Est-ce que vous pensez que la pandémie actuelle a permis de valoriser la recherche fondamentale
?
Ça s’est effectivement traduit par une valorisation par des mots. Si on écoute les ministres et les politiques, ils font reposer beaucoup d’espoirs sur les chercheurs et en pensent beaucoup de bien. L’avis selon lequel, sans recherche efficace et contrôlée, on ne va nulle part, est partagé. Cependant, dans les faits, on n’en est pas encore là. Par exemple, les chercheurs n’ont pas été beaucoup consultés dans les laboratoires concernant la Loi de Programmation de la Recherche (LPR), et je dirais même que la loi vient de passer contre l’avis de l’immense majorité des chercheurs. La mise en œuvre de soutiens efficaces à la recherche laisse beaucoup à désirer ; c’est dommage, car dans la crise actuelle, qui devient une crise économique et financière, on voit mal comment on arrivera à trouver de l’argent et à le mettre ensuite dans la recherche, alors que la société va en avoir besoin pour relancer l’économie. Cela a commencé il y a une dizaine d’années avec la perte de la considération de la recherche par les hommes politiques. Et pour le moment, rien n’a été fait pour remettre la France à niveau par rapport à l’Allemagne, la Chine (ndlr, la République populaire de Chine, RPC) ou les États-Unis.
Vous avez vivement critiqué le financement de la recherche publique en France, est-ce que vous auriez une solution à proposer pour l’améliorer
?
Selon moi, ce qui a le plus péché ces dernières années dans le financement de la recherche en France et qu’il faudrait changer, c’est le manque de soutien de base aux équipes. Dans mon domaine, ça s’est traduit par un manque total de préparations et d’équipements, en particulier en biologie structurale. La France est complètement sous-équipée en cryo-microscopes. Il y en a 3 en France, alors qu’il y en a 25 en Allemagne, plus de 20 en Angleterre, et des quantités industrielles en Chine. Même l’objectif de doubler la quantité de cryo-microscopes n’a pas été atteint en 5 ans. Cela signifie qu’on a été lâchés, abandonnés, et maintenant, on nous demande de faire l’impossible pour le lendemain en étant complètement démunis. C’est comme si on vous demandait de rapporter le trophée en vous donnant un Solex pour aller courir contre les voitures de formule 1. C’est ce qu’on nous demande à l’heure actuelle, et la nouvelle loi n’a rien envisagé là-dessus.
*
Entretien réalisé en novembre 2020.
|