Le virus de l’hépatite E (HEV) est une cause majeure d’hépatite aiguë dans le monde, et il est responsable d’hépatites chroniques chez les personnes immunodéprimées [ 1 - 3 ] ( → ).
(→) Voir les Nouvelles de J. Izopet et N. Kamar, m/s n° 12, décembre 2008, page 1023, et M. Ankavay, et al. , m/s n° 12, décembre 2018, page 1071
Il est aussi responsable de manifestations extra-hépatiques de mieux en mieux connues, notamment neurologiques [ 3 ]. Ce virus appartient à la famille des Hepeviridae et au genre Orthohepevirus . Les espèces Orthohepevirus A, comportant 8 génotypes (HEV 1-8), et Orthohepevirus C peuvent infecter l’homme, HEV 1-4 étant les virus les plus fréquemment détectés. HEV 1 et HEV 2 infectent uniquement l’espèce humaine, par voie hydrique, dans les pays à ressources limitées, où ils sont responsables d’hépatites aiguës, alors que HEV 3 et HEV 4 provoquent des infections aiguës ou chroniques d’origine zoonotique à partir d’un large réservoir animal, principalement porcin.
Le génome de HEV est un ARN simple brin à polarité positive d’environ 7,2 kilobases, et sa capside est icosaédrique. Une caractéristique essentielle de ce virus est qu’il existe sous une forme nue dans les selles des sujets infectés ou dans l’environnement, et sous une forme enveloppée dans le sang ou dans le surnageant de culture. L’enveloppe étant constituée de lipides mais dépourvue de péplomères, protéines codées par le génome viral, HEV est qualifié de virus quasi-enveloppé, au même titre que le virus de l’hépatite A [ 4 ].
Bien que la transmission entérique de HEV soit parfaitement établie, les modalités de franchissement de la barrière épithéliale intestinale restaient jusqu’à présent inconnues. L’infection du tractus digestif était cependant suspectée sur la base d’observations faites dans des modèles animaux [ 5 , 6 ] et la mise en évidence d’une réplication de HEV dans les cellules de la lignée d’adénocarcinome colique Caco-2 [ 7 ]. Une avancée sur ce sujet a pu être obtenue grâce au développement de différents systèmes cellulaires incluant des cellules intestinales humaines primaires, des entérocytes primaires polarisés, et des explants tissulaires obtenus à partir de résections d’intestin grêle [ 8 ].
Dans un premier temps, une infection productive a été objectivée dans des cellules intestinales humaines primaires avec des souches cliniques de HEV-1 et HEV-3. Par la suite, un système de culture d’entérocytes primaires polarisés a permis de montrer la production de particules virales infectieuses au pôle basal (vaisseaux sanguins) et au pôle apical (lumière intestinale) des entérocytes. Des expériences d’ultracentrifugation en gradient d’iodixanol ont montré que les particules virales produites aux deux pôles étaient quasi-enveloppées, ce qui expliquait leur faible densité. Une production virale plus marquée au pôle apical a été observée, comme cela avait été précédemment décrit dans des hépatocytes polarisés [ 9 ]. Ainsi, HEV sous une forme enveloppée (eHEV) pourrait franchir l’endothélium vasculaire intestinal, atteindre le foie par la veine porte, et infecter les hépatocytes à leur pôle basolatéral ( Figure 1 ) .
| Figure 1.
Représentation schématique de la réplication du virus de l’hépatite E (HEV) dans les entérocytes et dans les hépatocytes.
Les entérocytes infectés à leur pôle apical par la forme nue de HEV (nHEV) produisent des particules enveloppées (eHEV) à leurs pôles apical et basal. Les particules eHEV libérées au pôle basal sont véhiculées par la veine porte jusqu’au foie, où elles infectent les hépatocytes. Les particules virales produites par les hépatocytes sont libérées à leur pôle basolatéral (vasculaire) et à leur pôle apical (biliaire), et deviennent des particules nues (nHEV) après dégradation de l’enveloppe lipidique par les sels biliaires. Complexe ESCRT :
endosomal sorting complex required for transport.
pORF1 : polyprotéine non-structurale ; pORF2 : protéine de capside ; pORF3 : phosphoprotéine multifonctionnelle.
|
L’influence de l’infection par HEV 1 ou HEV 3 sur le sécrétome des entérocytes polarisés a également été étudiée en mesurant les concentrations de facteurs solubles (interférons de type I et III, interleukines et chimiokines). Une induction marquée d’interféron de type III a été observée, de manière similaire à ce qui a été décrit pour l’infection des hépatocytes [ 10 ]. L’interféron de type III pourrait donc contribuer à limiter l’infection des cellules intestinales, sans qu’il n’y ait de différence entre HEV 1 et HEV 3, contrairement à ce qui a été observé dans des explants de décidua ou de placenta, où l’infection par HEV 1 est associée à une réduction d’interféron de type III [ 11 ].
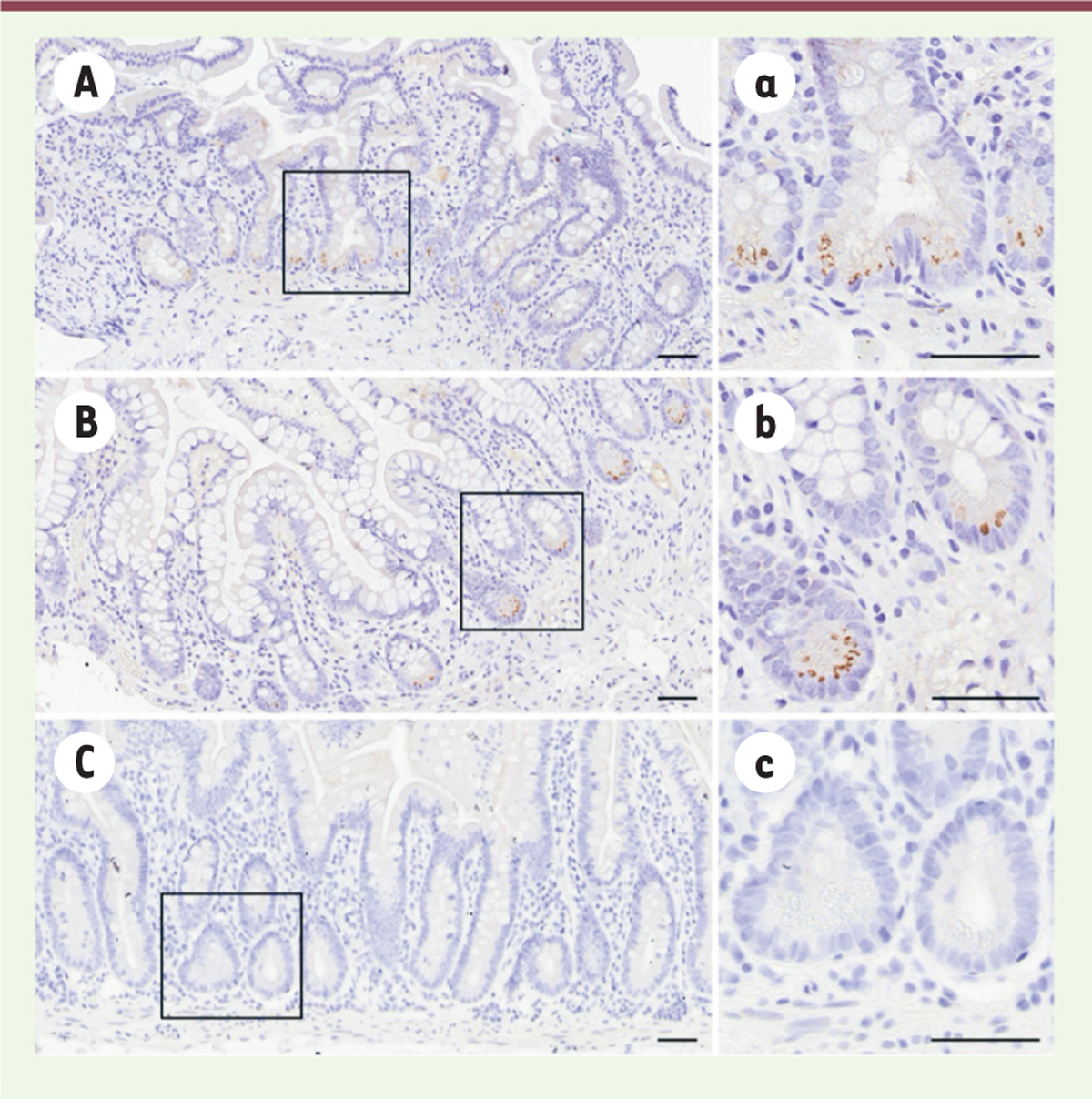
Des explants de muqueuse intestinale ont pu être infectés par HEV 1 ou HEV 3 avec production de virus quasi-enveloppés sans qu’aucune différence dans le niveau de réplication entre HEV 1 et HEV 3 ne soit détectée. Un argument complémentaire en faveur de l’infection du tractus digestif a été apporté par la réalisation de biopsies duodénales et iléales chez une patiente immunodéprimée chroniquement infectée par HEV 3, présentant des douleurs abdominales, une diarrhée, et une perte de poids. La protéine de capside ORF2 du HEV a été détectée par immunohistochimie dans les cryptes intestinales de cette patiente ( Figure 2 ) .
| Figure 2.
Détection de l’antigène de capside du virus de l’hépatite E (HEV) dans les entérocytes d’une patiente chroniquement infectée par ce virus.
Marquage immunohistochimique de la protéine de capside ORF2 dans les biopsies intestinales.
(A, a)
duodénum ;
(B, b)
iléum ;
(C, c)
témoin non infecté. Barre d’échelle : 50 µm.
|
La ribavirine en monothérapie constitue le traitement antiviral de choix chez les personnes ayant une hépatite E chronique [ 12 ]. Si un traitement de 3 mois à la posologie de 600 mg / jour permet l’éradication du virus dans plus de 80 % des cas [ 13 , 14 ], des échecs peuvent survenir après l’arrêt du traitement. Ces échecs se caractérisent par une nouvelle détection du virus dans le sang après amplification génique par PCR, alors que le virus était indétectable sous traitement. Le compartiment intestinal pourrait constituer un réservoir de HEV, où les concentrations tissulaires de ribavirine pourraient être insuffisantes pour supprimer définitivement la production du virus. En effet, les systèmes cellulaires expérimentaux ont montré que la ribavirine bloquait plus efficacement la production de particules virales au pôle basal des entérocytes (> 80 %) qu’à leur pôle apical (< 20 %). [ 8 ]
La mise en évidence de la réplication de HEV dans les entérocytes conduit à proposer un nouveau scénario de l’infection, dans lequel l’intestin est le site initial d’infection et d’amplification virale, avant le transport par le système vasculaire de particules quasi-enveloppées vers le foie et l’infection des hépatocytes. Une réplication virale résiduelle dans le tractus digestif pourrait être une des causes d’échec au traitement par la ribavirine.