| |
| Med Sci (Paris). 37(4): 333–341. doi: 10.1051/medsci/2021021.Implication de la cascade du complément dans les formes sévères de COVID-19 Nassima Chouaki Benmansour,1,2,3* Julien Carvelli,4,5 and Éric Vivier6,7,8 1Assistance Publique des Hôpitaux de Marseille
,
80 rue Brochier
,
13005Marseille
,
France 2Département universitaire de médecine générale, Aix-Marseille Université
,
27 boulevard Jean Moulin
,
13385Marseille Cedex 05
,
France 3Institut Paoli Calmettes
,
232 boulevard de Sainte-Marguerite
,
13009Marseille
,
France 4Assistance Publique des Hôpitaux de Marseille, Hôpital de la Timone, Réanimation des urgences
,
264 rue Saint-Pierre
,
13005Marseille
,
France 5Aix-Marseille Université
,
27 boulevard Jean Moulin
,
13385Marseille Cedex 05
,
France 6Innate Pharma
,
117 avenue de Luminy
,
BP 30191
,
13276Marseille Cedex 9
,
France 7Aix Marseille Université, CNRS, Inserm, CIML, Parc Scientifique et Technologique de Luminy, Case 906
,
13288Marseille Cedex 09
,
France 8Assistance Publique des Hôpitaux de Marseille, Marseille Immunopole, Hôpital de la Timone
,
264 rue Saint Pierre
,
13385Marseille Cedex 5
,
France |
Vignette (Photo © Philippe Roingeard et Sébastien Eymieux, Université de Tours, France)
L’infection par le nouveau coronavirus SARS-CoV-2 (
severe acute respiratory syndrome-coronavirus-2
), à l’origine de la COVID-19 (
coronavirus disease-19
), est responsable d’une pandémie mondiale aux conséquences sanitaires et économiques dévastatrices. Depuis son apparition en République populaire de Chine durant l’hiver 2019, plus de 119 millions de cas et plus de 2,6 millions de décès ont été enregistrés en moins d’un an.
Dans plus de 85 % des cas, la COVID-19 est une maladie bénigne. Une grande majorité des sujets contaminés sont asymptomatiques ou présentent une maladie paucisymptomatique
1
caractérisée par de la fièvre, un syndrome grippal, une anosmie (perte de l’odorat), et une agueusie (perte du goût). Dans 10 à 15 % des cas, la COVID-19 justifie une hospitalisation. Il s’agit essentiellement d’une pneumonie hypoxémiante. La forme la plus sévère de la maladie (touchant 5 à 10 % des patients hospitalisés) correspond à un syndrome de détresse respiratoire aiguë (SDRA) justifiant l’admission du patient en réanimation.
La compréhension de la physiopathologie de la maladie, notamment dans ses formes graves, est essentielle pour proposer des traitements ciblés permettant de freiner l’aggravation de la pathologie respiratoire. Dans cette contribution, nous détaillons et discutons le rôle particulier que semblent jouer le système du complément et l’anaphylatoxine C5a dans les formes sévères de COVID-19. |
Physiopathologie générale des formes sévères de COVID-19 Schématiquement, deux phases physiopathologiques se succèdent dans la COVID-19 : la phase d’invasion virale et la phase immunopathologique définie par une réaction immunologique incontrôlée, responsable de l’inflammation pulmonaire, parfois générale. La phase d’invasion virale
Mesurant 125 nanomètres de diamètre, le SARS-CoV-2 est un virus à ARN enveloppé appartenant à la famille des
Coronaviridae
, du genre betacoronavirus [
1
]. Le SARS-CoV-2 partage 80 % d’identité génétique avec le SARS-CoV-1, responsable de l’épidémie qui a sévi de 2002 à 2004, et 96 % d’identité avec un coronavirus de chauve-souris (RaTG13). Le génome du SARS-CoV-2 comporte environ 30 000 bases, ce qui en fait le plus long des génomes de virus à ARN connus.
La transmission interhumaine se fait surtout par voie respiratoire (gouttelettes), plus rarement par voie manuportée directe (poignées de mains, embrassades) ou indirecte (surfaces contaminées). L’ARN viral est détecté chez les personnes contaminées 1 à 3 jours avant l’apparition des symptômes ; la charge virale est maximale le jour de leur apparition. Elle diminue ensuite progressivement, en une à deux semaines en moyenne.
L’infection virale débute par la fixation des particules virales à des cellules cibles. Le SARS-CoV-2 infecte les poumons en se fixant aux cellules épithéliales respiratoires (les pneumocytes alvéolaires de type II). Sa protéine de surface S (
« S »
pour
Spike
) se lie au récepteur cellulaire ACE2 (
angiotensin-converting enzyme 2
) [
2
], une peptidase exprimée par les cellules de la majorité des tissus, en particulier les voies aériennes dont les poumons, mais aussi les reins, le cerveau, le cœur et les endothéliums. Cette distribution d’ACE2 explique le tropisme du virus dans les formes bénignes de l’infection (infection respiratoire « banale ») et dans ses formes graves (pneumonie, insuffisance rénale, encéphalite, myocardite et thromboses).
Le système immunitaire peut jouer un double rôle dans la COVID-19. Dans plus de 85 % des cas, une réponse immunitaire proportionnée permet d’éliminer le virus. Le patient sera alors asymptomatique ou paucisymptomatique, et la maladie se terminera après une phase d’invasion virale isolée. Cependant, dans 10 à 15 % des cas, la réponse immunitaire des patients est trop intense et disproportionnée. Une phase immunopathologique succède alors à l’invasion virale et le patient développe une forme sévère de la maladie. L’inflammation pulmonaire est à l’origine de la pneumonie, voire du SDRA, caractéristique. L’inflammation peut aussi toucher d’autres organes. Les interférons de type I (IFN I), IFN-α/β, sécrétés par les cellules épithéliales et immunitaires après reconnaissance du virus, joueraient un rôle important dans l’immunité antivirale. Chez les patients développant une forme sévère de la maladie, une réponse IFN I diminuée a été décrite [
3
] et la présence d’anticorps anti-IFN I ainsi que l’existence de variants génétiques réduisant la réponse IFN I [
4
] ont été rapportées. Alors qu’aucune stratégie thérapeutique antivirale n’a démontré son efficacité, des études sont en cours pour évaluer l’efficacité des IFN-α/β lors de la phase d’invasion virale, afin d’améliorer la clairance du virus et d’éviter l’évolution vers une forme sévère (phase immunopathologique) [
5
].
La phase immunopathologique Une réponse inflammatoire excessive : l’orage cytokinique
L’excès d’inflammation en réponse à l’infection virale est responsable des formes graves de la maladie, caractérisées par une pneumonie hypoxémiante, pouvant aller jusqu’au SDRA, parfois associée à d’autres défaillances d’organe. Cela illustre ainsi la nécessité d’un « juste équilibre » des réponses immunitaires à l’infection : en cas de déficit, l’infection se propage, mais en cas de réponse excessive, l’hyper-inflammation aboutit à des lésions organiques. On parle alors de « tempête immunitaire » ou d’« orage cytokinique » [
6
]. Les cytokines pro-inflammatoires sont produites par les cellules du système immunitaire inné (surtout myéloïdes : monocytes/macrophages/polynucléaires), qui reconnaissent des motifs exprimés par le virus (les PAMP, pour
pathogen-associated molecular patterns
) grâce à des récepteurs dédiés, les PRR (
pathogen recognition receptors
), comme les TLR
(Toll-like receptors)
-7 et -8 qui interagissent avec l’ARN viral. Cette liaison entre PAMP et PRR induit une cascade de signalisation intracellulaire à l’origine de l’expression des cytokines pro-inflammatoires, comme l’IL(interleukine)-6, le TNF-α (
tumor necrosis factor
-
alpha
) [
7
] ou l’IL-1b. L’IL-6 est synthétisée par les cellules immunitaires mais également par d’autres types cellulaires, tels que les cellules endothéliales. Elle active les cellules de l’immunité innée, les polynucléaires neutrophiles et les monocytes, ainsi que les cellules de l’immunité adaptative, notamment les lymphocytes T
helper
Th17 et Th folliculaires. Importante pour la régulation de la réponse immunitaire, l’IL-6 peut cependant être néfaste si elle est produite de manière excessive, entretenant alors l’inflammation et les lésions tissulaires [
8
]. Si l’orage cytokinique qui découle de cet excès de production de cytokines est associé aux formes sévères de COVID-19, sa persistance au cours de la maladie est également corrélée à sa gravité [
9
].
Certaines immunothérapies ciblant directement l’orage cytokinique sont en cours d’évaluation dans la COVID-19. Les glucocorticoïdes sont les seuls à avoir prouvé un bénéfice clinique sur la mortalité des patients (dexaméthasone dans l’essai RECOVERY [
10
]). Ils inhibent la transcription des gènes codant les cytokines pro-inflammatoires, comme l’IL-6, l’IL-8 et le TNF-α. Parmi les traitements immunomodulateurs, un anticorps monoclonal ciblant le récepteur de l’IL-6 (le tocilizumab) [
11
] a été évalué. Les résultats concernant son efficacité sont discordants [
12
,
13
] et ne permettent pas de recommander son utilisation en pratique courante en France. Dans l’étude EMPACTA (NCT04372186), évaluant l’efficacité et l’innocuité de cet anticorps chez 379 participants atteints de pneumonie liée à la COVID-19 et hospitalisés, mais n’ayant pas reçu de ventilation mécanique, cet anticorps entraînerait un moindre recours à l’intubation orotrachéale, mais sans amélioration de la survie [
14
]. L’étude COVACTA (NCT04320615), dont le but était de déterminer, chez 450 patients hospitalisés en réanimation, son efficacité, son innocuité, sa pharmacodynamique et sa pharmacocinétique, par rapport à l’association placebo-soins standards, n’a pas non plus montré d’amélioration significative de l’atteinte respiratoire [
15
]. D’autres thérapies anti-cytokiniques ciblées, telles que l’utilisation d’un antagoniste du récepteur de l’IL-1 (l’anakinra), n’ont également pas montré de bénéfice significatif [
16
].
Si elles freinent l’orage cytokinique, ces thérapies interfèrent cependant avec l’action bénéfique du système immunitaire. Introduites à un stade trop précoce de la maladie (lors de la phase virale), elles pourraient être responsables d’un défaut d’élimination du virus et donc d’une aggravation du pronostic. Endothélite et thromboses
Si le virus n’a pas été éliminé par le système immunitaire au niveau de la barrière épithéliale, il progressera alors vers l’endothélium vasculaire. Les cellules endothéliales qui le composent expriment ACE2 [
17
] et la pénétration virale dans ces cellules sera à l’origine d’une inflammation endothéliale, appelée endothélite ou endothélialite [
18
,
19
]. L’endothélite est associée aux phénomènes thrombotiques que l’on observe dans la COVID-19, comme les microthromboses [
20
] et les thromboses macrovasculaires, ainsi que les embolies pulmonaires, notamment [
21
].
|
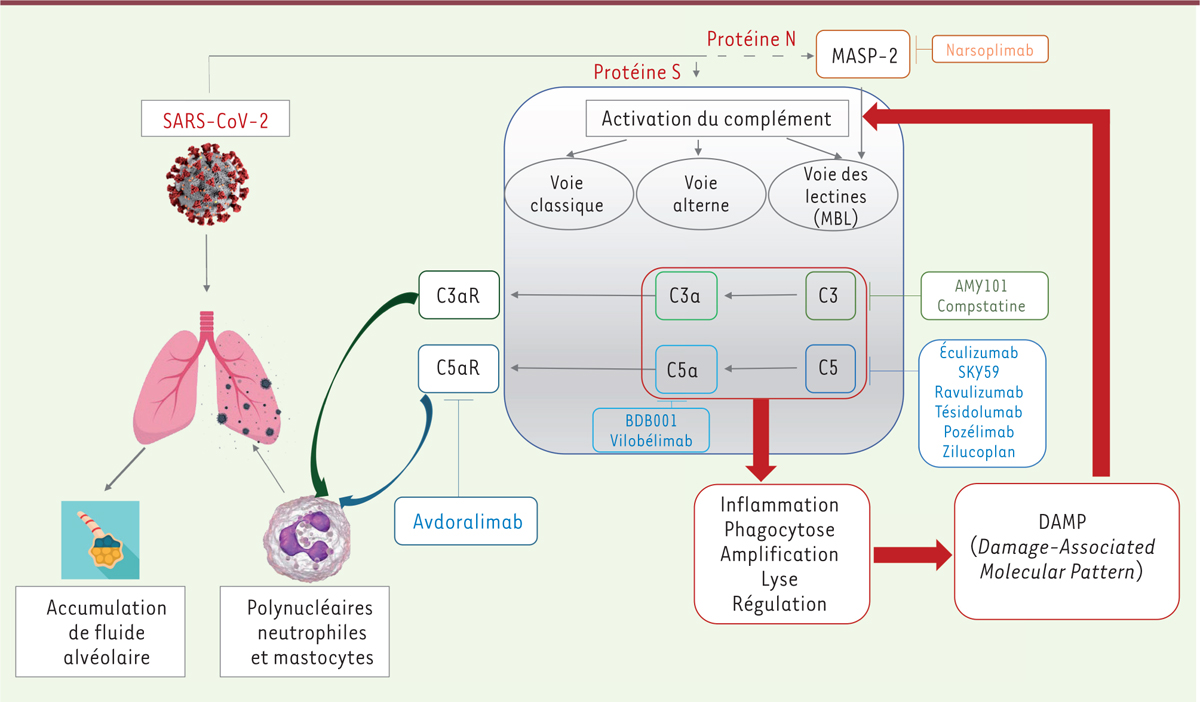
La cascade du complément en phase immunopathologique des formes graves de COVID-19 Le système du complément
Le système du complément a été découvert à la fin du XIX
e
siècle. Composant du système immunitaire inné, ce système peut être activé par trois voies : la voie classique, à laquelle participent les anticorps, la voie des lectines et la voie alterne
(
Figure 1
)
(
→
).
(→) Voir le Repère de J.M. Cavaillon
et al.
,
m/s
n° 8-9, août-septembre 2020, page 803
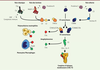 | Figure 1.
Voies d’activation du complément par le SARS-CoV-2.
L’activation de la voie classique est initiée par la fixation du complexe C1 à des immunoglobulines ou à des ligands endogènes. Ce complexe va pouvoir cliver le C4 et le C2 pour former la C3 convertase classique (C4b2a). La voie des lectines est activée par la fixation d’un complexe MBL-MASP-2 à la surface d’un pathogène. Ce complexe, lié au pathogène, permet alors de cliver le C4 et le C2. Ces clivages forment ainsi une C3 convertase (C4b2a). La voie alterne agit comme un système de surveillance en maintenant un faible niveau d’activation du système du complément par un processus connu sous le nom de « tick-over ». Le tick-over est l’hydrolyse spontanée du C3 en C3(H2O), forme bio-active du C3, dans la phase fluide. Le C3(H2O) peut se fixer au facteur B, qui est ensuite clivé par le facteur D pour former la C3 convertase alterne en phase fluide : C3(H2O)Bb. À la surface des pathogènes, le facteur B fixé au C3b pourra ensuite être clivé par le facteur D pour former la C3 convertase alterne (C3bBb). Ces trois voies conduisent à la formation d’une C3 convertase permettant de cliver le C3 en C3a, une anaphylatoxine, et en C3b, à l’origine de la formation de la C5 convertase (C4b2a3b ou C3bBb3b). Le C5 est ensuite clivé en C5a et en C5b, qui va initier les dernières étapes de la cascade du complément. Cela conduit à la formation du complexe d’attaque membranaire (C5b-9, MAC) et permet de lyser les pathogènes. Le système du complément est hautement régulé par des protéines sériques (C1inh, FI, C4BP, FH, clustérine, vitronectine) et membranaires (CR1, MCP, DAF, CD59) [
22
]. Les protéines N et S du SARS-CoV-2 vont respectivement activer la voie des lectines et la voie alterne du complément. MBL-MASP-2 :
mannose-binding protein-mannose-binding lectin serine protease 2
; C1inh : inhibiteur du C1 ; FI, FH : facteur I, facteur H ; C4BP :
C4-binding protein
; CR1 : récepteur 1 du complément ; MCP :
membrane cofactor protein
; DAF :
decay-accelerating factor
.
|
L’activation de ces voies conduit à des réactions enzymatiques qui impliquent des composants du complément (C3 et C5), à l’origine de l’activation des mastocytes et des neutrophiles par les anaphylatoxines (C3a et C5a), de la formation d’un complexe d’attaque membranaire (MAC), et de l’opsonisation
2
des pathogènes. La cascade du complément correspond à une succession de réactions protéolytiques qui ont un destin commun, la formation d’une C3 convertase, qui clive le C3, le produit central du système, en C3a et en C3b, qui activeront une C5 convertase. Les produits essentiels de cette cascade sont ainsi :
Cette cascade est régulée par différentes protéines, et permet de freiner une activation qui pourrait être délétère : le C1-inhibiteur (C1inh), inhibiteur de la C1 estérase, les facteurs H et I, et CD55, ou DAF (
decay acceleration factor
), qui inactivent le C3b et le C4b, ainsi que CD59 qui, lui, inhibe le complexe d’attaque membranaire (MAC). À l’image des autres composants du système immunitaire, le complément a un rôle ambivalent en pathologie humaine. Il joue un rôle essentiel dans la lutte contre les infections, mais une dysfonction de la régulation de son activation est à l’origine de lésions tissulaires, comme dans le lupus, le syndrome hémolytique et urémique atypique (SHUa), les vascularites autoimmunes positives aux ANCA (anticorps anti-cytoplasme des polynucléaires neutrophiles), ou dans les microangiopathies thrombotiques, par exemple.
|
Le SARS-CoV-2 active le complément
La cascade du complément est directement activée par le SARS-CoV-2 : la protéine N (
nucleocapsid
) du virus activerait en effet la voie des lectines,
via
MASP-2 (
mannose-binding protein-associated serine protease 2
) [
23
], et la protéine S induirait l’activation de la voie alterne [
24
]. À un stade plus avancé de la maladie, une activation de la voie classique par les complexes immuns qui se forment à partir des immunoglobulines produites, et la protéine C réactive (CRP), a également été envisagée [
23
]. Néanmoins, si le rôle délétère de la cascade du complément dans les formes sévères de la COVID-19 commence à être reconnu, sa participation à l’élimination du virus reste indéterminée.
Complément et lésions tissulaires dans les formes sévères de COVID-19
Le rôle pathogénique de la cascade du complément dans la génération des lésions tissulaires, notamment pulmonaires [
25
], a été mis en évidence grâce à des modèles murins d’infection virale : le complément a en effet une action délétère sur les tissus, en participant à la fois à l’orage cytokinique et à l’endothélite [
20
].
Complément et inflammation dans la COVID-19
Les fragments C5a et C5b sont produits lors du clivage de C5 par la protéase C5 convertase. C5a est un peptide présentant une importante activité inflammatoire. Il favorise en effet l’attraction des cellules immunitaires innées et la libération d’histamine, impliquée dans les réponses allergiques [
26
]. Il est principalement d’origine hépatocytaire, mais les macrophages le produisent également, provoquant une augmentation locale de sa concentration.
Le C5a pourrait promouvoir et entretenir l’inflammation lors de la phase immunopathogénique de la maladie.
Via
son récepteur, le C5aR1 (ou CD88), exprimé par les cellules myéloïdes, il permet le recrutement de ces cellules au niveau pulmonaire [
27
]. Bien qu’un deuxième récepteur du C5a (C5aR2) ait été décrit, son rôle physiopathologique dans l’inflammation et l’immunité reste discuté [
28
].
Stimulés par le C5a, les monocytes/macrophages et les polynucléaires neutrophiles produisent des cytokines pro-inflammatoires (IL-6, TNF-a) qui participent à « l’orage cytokinique ». Les taux de C5a sériques et alvéolaires sont ainsi corrélés à la gravité de la COVID-19 et les macrophages isolés de lésions pulmonaires de patients décédés de COVID-19 expriment fortement le récepteur C5aR1.
Le C3a, libéré plus en amont dans la cascade, pourrait jouer le même rôle que le C5a dans la COVID-19. L’inhibition de C3, qui bloque la génération de C3a et de C5a, permet en effet de réduire l’inflammation pulmonaire [
29
].
Complément, endothélite et thromboses dans la COVID-19
Le complément a été associé aux lésions d’endothélite observées dans les formes sévères de COVID-19. Des dépôts histologiques de MASP-2, de C4 et de MAC, ainsi que des macrophages surexprimant le récepteur du C5a, C5aR1 [
30
], ont en effet été retrouvés dans les lésions d’endothélite et les microthrombus [
31
]. Complément et coagulation (phase contact, ou voie intrinsèque de la coagulation
3
) sont étroitement liés [
32
]. Comme le suggèrent les observations réalisées en utilisant des modèles murins de déficit en protéines régulatrices du complément [
33
], les lésions microvasculaires (purpura cutané, vasculopathie thrombogène avec dépôt de C5b-9 et C4d [
20
]) auraient pour origine le MAC. Les thromboses macrovasculaires dépendraient, quant à elles plus de l’action de C5a [
21
]. Le mécanisme par lequel l’hyperactivation de l’axe C5a-C5aR1 induirait des thromboses reste cependant incertain. Les polynucléaires neutrophiles pourraient jouer un rôle
via
les NET (
neutrophil extracellular traps
), les pièges extracellulaires qu’ils émettent [
34
], et par la libération du facteur tissulaire (FT), le récepteur des facteurs VII et VIIa, qui active la voie extrinsèque de la coagulation [
35
].
C3, C5 et convertases sont considérés actuellement comme des cibles potentielles dans la COVID-19 [
36
,
37
]. Les anaphylatoxines, telles que C3a et C5a, qui en dérivent, sont en effet impliquées dans plusieurs désordres inflammatoires. Ces fragments sont ainsi considérés comme des cibles thérapeutiques potentielles [
38
]. Il a en effet été montré que C5a et C5b-9 sont associés aux lésions tissulaires observées chez les patients [
20
,
23
,
39
].
|
Cibler le complément dans les formes sévères de COVID-19
Bloquer le complément dans les formes sévères de COVID-19 est une approche séduisante pour freiner l’orage cytokinique et l’endothélite
(
Figure 2
)
. Différentes étapes de la cascade du complément peuvent être bloquées par des médicaments inhibant des molécules de cette cascade : des anticorps monoclonaux, des protéines ou des peptides, des oligonucléotides, des petites molécules et des métabolites de phytothérapie
(
Tableau I
)
. La tolérance et l’efficacité de ces médicaments sont en cours d’évaluation. Aucun n’est encore approuvé pour le traitement de la COVID-19.
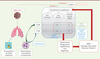 | Figure 2.
Rôle des inhibiteurs de la cascade du complément au cours de l’infection par le SARS-CoV-2.
Le SARS-CoV-2 affecte d’abord le tractus respiratoire et les cellules alvéolaires par l’intermédiaire des récepteurs ACE2 (enzyme de conversion de l’angiotensine 2). Il interagit ensuite directement avec MASP-2 (
mannose-binding lectin serine protease
) et active la voie des lectines (MBL
, mannose-binding protein) via
sa protéine N. Les voies classique et alterne, parties intégrantes de la réponse antivirale innée, seront également activées (la voie alterne par la protéine S du SARS-CoV-2). Elles activeront à leur tour la fraction C3 du complément, ce qui aboutit à la sécrétion de C3a et de C5a. Ces anaphylatoxines vont déclencher l’orage cytokinique, la dégranulation des mastocytes, l’activation des leucocytes et leurs infiltrations dans les alvéoles pulmonaires. L’activation de la cascade du complément se fait également par des DAMP (
damage-associated molecular pattern
) produits par les cellules. Elle fragilise les poumons suite au dépôt des protéines du complément et de l’infiltration neutrophilique. L’inhibition des voies du complément en amont, telles que les fractions C3 et C5 et leurs récepteurs, constituent ainsi une approche possible pour endiguer la pathogénie du SDRA (d’après [
55
]).
|
Tableau I.
| Numéro |
Molécule |
Cible |
Compagnie |
Essai clinique/Phase (ClinicalTrials.gov) |
|
Anticorps monoclonaux inhibiteurs
|
|
|
1
|
Éculizumab |
C5 |
Alexion |
NCT02574403/IV, NCT04288713, NCT04346797, NCT04355494 |
|
|
2
|
Ravulizumab |
C5 |
Alexion |
NCT03131219, NCT02949128/III, NCT04570397, NCT04390464, NCT04369469 |
|
|
3
|
Narsoplimab (OMS721) |
MASP-2 |
Omeros |
NCT02682407, NCT03205995/II |
|
|
4
|
AMY101 |
C3 |
Amyndas |
NCT03316521/I, NCT04395456 |
|
|
5
|
BDB-001 |
C5a |
Staidon Biopharmaceutical |
NCT04449588/II |
|
|
6
|
Sutimlimab |
C1s |
Sanofi/Bioverativ |
NCT03347422, NCT03347396/III |
|
|
7
|
Lampalizumab |
Facteur D |
Genentech/Roche |
NCT02247531, NCT02247479/III |
|
|
8
|
Avdoralimab (IPH5401) |
C5aR1 |
Innate Pharma |
NCT03665129/I, NCT04371367 |
|
|
9
|
Tésidolumab (LFG-316) |
C5 |
Novartis |
NCT02878616 /I |
|
|
10
|
Pozélimab/REGN3918 |
C5 |
Regeneron |
NCT03115996/I |
|
|
11
|
SKY59/RO7112689 |
C5 |
Hoffmann-La Roche |
NCT03157635/I-II |
|
|
12
|
ABP959 |
C5 |
Amgen |
NCT03818607/III |
|
|
13
|
SB12 |
C5 |
Samsung Bioepis |
NCT03722329/I |
|
|
14
|
Vilobélimab (IFX-1) |
C5a |
InfaRx |
NCT03712345/III, NCT04333420 |
|
|
Peptides ou protéines inhibiteurs (
Peptide/protein-based inhibitors
)
|
|
|
15
|
Contestat alfa |
C1 estérase |
Pharming Group |
NCT04414631/II, NCT04530136 |
|
|
16
|
CINRYZE |
C1 estérase |
ShirePharmaceuticals Ltd |
NCT02052141/Approved |
|
|
17
|
APL-2 |
C3 |
Apellis |
NCT03453619/II |
|
|
18
|
APL-9 |
C3 |
Apellis |
NCT04402060/II |
|
|
19
|
Coversin/rVA576 |
C5 |
Akari Therapeutics |
NCT03829449/III |
|
|
20
|
Zilucoplan |
C5 |
Ra Pharma |
NCT04115293/III, NCT04382755 |
|
|
21
|
PMX-53 |
C5a/C5aR |
|
|
|
|
22
|
C1-INH/Berinert |
C1r/C1s |
Cedars-Sinai Medical Center |
NCT02134314/I |
|
|
23
|
Mirococept |
C3 et C5 convertases |
|
|
|
|
24
|
TP10/ CDX1135 |
C3 et C5 convertases |
Avant Immunotherapeutics |
NCT00082121/II |
|
|
Oligonucléotides inhibiteurs (
Oligonucleotide-based inhibitors
)
|
|
|
25
|
Cemdisiran or ALN-CC5 |
C5 |
Alnylam Pharmaceuticals |
NCT03841448/II |
|
|
Petites molécules inhibitrices (
Small molecule-based inhibitors
)
|
|
|
26
|
CCX168 |
C5aR1 |
ChemoCentryx |
NCT02384317/II |
|
|
27
|
ACH0144471 |
Facteur D |
Achillion |
NCT03459443, NCT03124368/II |
|
|
28
|
ACH145951 |
Facteur D |
|
[
24
]
|
|
|
29
|
LPN023 |
Facteur B |
Novartis |
NCT03373461/II |
|
|
30
|
1-(3,4-Diméthoxyphényl)-
3-(1-phényléthyl) urée |
C5 convertase |
|
[57] |
|
|
Inhibiteurs issus de plantes (
Plant metabolite-based inhibitors
)
|
|
|
31
|
Rosmarinic acid |
C3 convertase |
|
[58] |
|
|
32
|
Boswellic acid |
C3 convertase |
|
[59, 60] |
Modulateurs du complément en cours d’essai dans la COVID-19.
|
Cibler la molécule C5 du complément
Parmi les bloqueurs du complément, l’éculizumab (
Soliris
,
Alexion Pharmaceuticals Inc.
), un anticorps monoclonal qui inhibe la molécule C5 [
40
], est le seul médicament à avoir reçu une approbation de la FDA (
Food and Drug Administration
) américaine pour le traitement des évènements thromboemboliques veineux (TEV) dans l’hémoglobinurie paroxystique nocturne (HPN) [
41
] et le syndrome hémolytique et urémique atypique [
42
]. L’HPN est liée à une mutation, qui empêche la liaison de protéines régulatrices du complément (CD55 et CD59) à la surface des globules rouges. Il en résulte une hémolyse par le C5b-9 (MAC). En se fixant à la molécule C5 humaine, cet anticorps inhibe la génération de C5a et C5b-9 [
40
]. Dans des maladies où le complément est délétère, comme les maladies autoimmunes, l’utilisation de ces médicaments inhibiteurs qui bloquent le MAC réduit la survenue des évènements thrombotiques. Le traitement reposant sur un anticorps anti-C5 comme l’éculizumab représente ainsi une stratégie potentielle pour le traitement des patients diagnostiqués positifs pour le SARS-Co V-2 et qui sont au stade de pneumonie sévère ou de SDRA [
43
].
Une étude de « preuve de concept », non randomisée, suggère l’efficacité de l’éculizumab dans les formes sévères de la COVID-19 [
43
]. Des essais randomisés sont nécessaires. Néanmoins, le blocage du MAC par l’anticorps rend difficile son utilisation en réanimation, en raison d’un risque élevé de surinfections bactériennes, notamment respiratoires (pneumonies acquises sous ventilation mécanique).
L’utilisation du ravulizumab (Ultomiris,
Alexion Pharma GmbH
), un anticorps qui inhibe également C5, n’a pas présenté d’intérêt pour le traitement des formes sévères de COVID-19. Le recrutement des patients dans une étude de phase III a été arrêté, suite à une analyse intermédiaire montrant l’absence d’efficacité du traitement chez les patients nécessitant une ventilation mécanique [
44
]. D’autres anticorps ciblant la molécule C5, tels que le pozélimab (
Regeneron Pharmaceuticals, Inc.
) [
45
], le tésidolumab (
Novartis
) [
46
], le crovalimab/SKY59 (
Chugai Pharmaceutical/Roche
) [
47
], et l’ABP 959 (
Alexion Pharmaceuticals
) [
48
], sont aussi testés dans des essais cliniques pour le traitement de la COVID19.
Bloquer l’axe C5a-C5aR1
L’anaphylatoxine C5a est une molécule inflammatoire [
49
]. Des taux sériques importants de C5a sont considérés comme un marqueur de SDRA [
50
]. Au début de l’épidémie, une équipe chinoise avait rapporté l’amélioration clinique de deux patients atteints de COVID-19 sévère par l’utilisation du vilobélimab (ou IFX-1,
InflaRx
, Allemagne), un anticorps monoclonal bloquant le C5a [
51
]. L’étude PANAMO (NCT04333420) a souligné l’efficacité et la tolérance de cet anticorps dans les formes sévères de COVID-19 [
52
] et une étude de phase III a été initiée. Le vilobélimab et un peptide antagoniste du C5aR, le PMX-53, constituent des espoirs pour le traitement du SDRA dans l’infection par le SARS-CoV-2 [
53
].
L’axe C5a-C5aR1 influence la régulation des réponses inflammatoires, en activant les polynucléaires neutrophiles et les monocytes au cours du SDRA en particulier. Bloquer le récepteur C5aR1 plutôt que les autres composants de la cascade du complément présente plusieurs avantages. Tout d’abord, la préservation de la formation du C5b et du MAC. La perte du MAC pourrait augmenter en effet les co-morbidités (telles que les infections bactériennes) liées à la COVID-19. Le blocage de C5aR1 a également l’avantage de n’avoir aucun effet sur le deuxième récepteur du C5a, le C5L2, car même si sa fonction reste à définir, un rôle de récepteur leurre, avec un rôle anti-inflammatoire, a été proposé [
54
]. L’objectif est donc de bloquer l’action pro-inflammatoire du C5a sans bloquer le MAC, afin de limiter les complications dues aux infections bactériennes.
L’essai contrôlé, randomisé et en double aveugle FORCE (
NCT04371367
) évalue, dans les formes sévères de COVID-19, la tolérance et l’efficacité de l’avdoralimab (
Innate Pharma
), un anticorps monoclonal bloquant le récepteur du C5aR1.
In vitro
, cet anticorps permet de freiner l’orage cytokinique et l’endothélite.
In vivo
, dans un modèle murin de SDRA, il permet de réduire l’infiltration des polynucléaires neutrophiles et des macrophages au niveau pulmonaire.
|
Le complément pourrait jouer un rôle important dans la phase immunopathologique de la COVID-19. Il pourrait en effet participer à l’orage cytokinique, aux lésions endothéliales et aux thromboses, par l’action des anaphylatoxines, notamment du C5a. Le blocage du C5 pourrait cependant entraîner une immunodépression, en raison de l’inhibition du MAC. Bloquer le récepteur de C5a, le C5aR1, permettrait d’inhiber l’action de cette anaphylatoxine et de limiter l’emballement de la réponse inflammatoire. Le ciblage thérapeutique de la voie C5a-C5aR1 est une piste en cours d’évaluation dans le traitement des formes sévères de la maladie. Les résultats de l’essai FORCE permettront de répondre à cette question. |
Éric Vivier est salarié d’Innate Pharma.
Nassima Chouaki et Julien Carvelli déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Fisher
D
,
Heymann
D
.
Q&A: The novel coronavirus outbreak causing COVID-19.
.
BMC Med.
2020;
;
18
:
:57.
.
2.
Ziegler
CGK
,
Allon
SJ
,
Nyquist
SK
,
et al.
SARS-CoV-2 Receptor ACE2 is an interferon-stimulated gene in human airway epithelial cells and is detected in specific cell subsets across tissues.
.
Cell.
2020;
;
181
:
:1016.
–
35.e19
.
3.
Hadjadj
J
,
Yatim
N
,
Barnabei
L
,
et al.
Impaired type I interferon activity and inflammatory responses in severe COVID-19 patients.
.
Science.
2020;
;
369
:
:718.
–
24
.
4.
Zhang
Q
,
Bastard
P
,
Liu
Z
,
et al.
Inborn errors of type I IFN immunity in patients with life-threatening COVID-19.
.
Science.
2020;
;
370
:
:eabd4570.
.
5.
Lee
JS
,
Shin
EC
.
The type I interferon response in COVID-19: implications for treatment.
.
Nat Rev Immunol.
2020;
;
20
:
:585.
–
6
.
6.
Zhou
Y
,
Fu
B
,
Zheng
X
,
et al.
Pathogenic T-cells and inflammatory monocytes incite inflammatory storms in severe COVID-19 patients.
.
Natl Sci Rev.
2020;
;
7
:
:998.
–
1002
.
7.
Giamarellos-Bourboulis
EJ
,
Netea
MG
,
Rovina
N
,
et al.
Complex immune dysregulation in COVID-19 patients with severe respiratory failure.
.
Cell Host Microbe.
2020;
;
27
:
:992.
–
1000.e3
.
8.
Kang
S
,
Tanaka
T
,
Inoue
H
,
et al.
IL-6 trans-signaling induces plasminogen activator inhibitor-1 from vascular endothelial cells in cytokine release syndrome.
.
Proc Natl Acad Sci USA.
2020;
;
117
:
:22351.
–
6
.
9.
Lucas
C
,
Wong
P
,
Klein
J
,
et al.
Longitudinal analyses reveal immunological misfiring in severe COVID-19.
.
Nature.
2020;
;
584
:
:463.
–
9
.
10.
RECOVERY Collaborative Group.
;
Horby
P
,
Lim
WS
,
Emberson
JR
,
et al.
Dexamethasone in hospitalized patients with Covid-19 - Preliminary report.
.
N Engl J Med.
2020
;
NEJMoa2021436.
.
11.
Guaraldi
G
,
Meschiari
M
,
Cozzi-Lepri
A
,
et al.
Tocilizumab in patients with severe COVID-19: a retrospective cohort study.
.
Lancet Rheumatol.
2020;
;
2
:
:e474.
–
e484
.
12.
Stone
JH
,
Frigault
MJ
,
Serling-Boyd
NJ
,
et al.
Efficacy of tocilizumab in patients hospitalized with Covid-19.
.
N Engl J Med.
2020;
;
383
:
:2333.
–
44
.
13.
Hermine
O
,
Mariette
X
,
Tharaux
P-L
,
et al.
Effect of tocilizumab vs usual care in adults hospitalized with COVID-19 and moderate or severe pneumonia: a randomized clinical trial.
.
JAMA Intern Med.
2021;
;
181
:
:32.
–
40
.
14.
Salama
C
,
Han
J
,
Yau
L
,
et al.
Tocilizumab in patients hospitalized with Covid-19 pneumonia.
.
N Engl J Med.
2021;
;
384
:
:20.
–
30
.
16.
Mehta
P
,
Cron
RQ
,
Hartwell
J
,
et al.
Silencing the cytokine storm: the use of intravenous anakinra in haemophagocytic lymphohistiocytosis or macrophage activation syndrome.
.
Lancet Rheumatol.
2020;
;
2
:
:e358.
–
e367
.
17.
Hamming
I
,
Timens
W
,
Bulthuis
MLC
,
et al.
Tissue distribution of ACE2 protein, the functional receptor for SARS coronavirus. A first step in understanding SARS pathogenesis.
.
J Pathol.
2004;
;
203
:
:631.
–
637
.
18.
Ackermann
M
,
Verleden
SE
,
Kuehnel
M
,
et al.
Pulmonary vascular endothelialitis, thrombosis, and angiogenesis in Covid-19.
.
N Engl J Med.
2020;
;
383
:
:120.
–
8
.
19.
The Lille COVID-19 ICU and Anatomopathology Group.
,
Copin
MC
,
Parmentier
E
,
et al.
Time to consider histologic pattern of lung injury to treat critically ill patients with COVID-19 infection.
.
Intensive Care Med.
2020;
;
46
:
:1124.
–
6
.
20.
Magro
C
,
Mulvey
JJ
,
Berlin
D
,
et al.
Complement associated microvascular injury and thrombosis in the pathogenesis of severe COVID-19 infection: a report of five cases.
.
Transl Res.
2020;
;
220
:
:1.
–
13
.
21.
Llitjos
JF
,
Leclerc
M
,
Chochois
C
,
et al.
High incidence of venous thromboembolic events in anticoagulated severe COVID-19 patients.
.
J Thromb Haemost.
2020;
;
18
:
:1743.
–
6
.
22.
Daugan
M
,
Noe
R
,
Fridman
WH
,
et al.
Le système du complément - Une épée à double tranchant dans la progression tumorale.
.
Med Sci (Paris).
2017;
;
33
:
:871.
–
877
.
23.
Gao
T
,
Hu
M
,
Zhang
X
,
et al.
Highly pathogenic coronavirus N protein aggravates lung injury by MASP-2-mediated complement over-activation.
.
medRxiv 2020.03.29.20041962.
; doi:
https://doi.org/10.1101/2020.03.29.20041962
.
24.
Yu
J
,
Yuan
X
,
Chen
H
,
et al.
Direct activation of the alternative complement pathway by SARS-CoV-2 spike proteins is blocked by factor D inhibition.
.
Blood.
2020;
;
136
:
:2080.
–
9
.
25.
Gralinski
LE
,
Sheahan
TP
,
Morrison
TE
,
et al.
Complement activation contributes to severe acute respiratory syndrome coronavirus pathogenesis.
.
mBio.
2018;
;
9
:
:e01753.
–
18
.
26.
Manthey
HD
,
Woodruff
TM
,
Taylor
SM
,
et al.
Complement component 5a (C5a).
.
Int J Biochem Cell Biol.
2009;
;
41
:
:2114.
–
2117
.
27.
Bosmann
M
,
Ward
PA
.
Role of C3, C5 and anaphylatoxin receptors in acute lung injury and in sepsis.
. In:
Lambris
JD
,
Hajishengallis
G
, eds.
Current topics in innate immunity II. advances in experimental medicine and biology.
.
New York, NY:
:
Springer;
,
2012
:
:147.
–
59
.
28.
Zhang
T
,
Garstka
MA
,
Li
K
.
The controversial c5a receptor C5aR2: its role in health and disease.
.
J Immunol Res.
2017;
;
2017
:
:e8193932.
.
29.
Mastellos
DC
,
Pires da Silva
BGP
,
Fonseca
BAL
,
et al.
Complement C3 vs C5 inhibition in severe COVID-19: early clinical findings reveal differential biological efficacy.
.
Clin Immunol.
2020;
;
220
:
:108598.
.
30.
Carvelli
J
,
Demaria
O
,
Vély
F
,
et al.
Association of COVID-19 inflammation with activation of the C5a–C5aR1 axis.
.
Nature.
2020;
;
588
:
:146.
–
50
.
31.
Eriksson
O
,
Hultström
M
,
Persson
B
,
et al.
Mannose-binding lectin is associated with thrombosis and coagulopathy in critically ill COVID-19 patients.
.
Thromb Haemost.
2020;
;
120
:
:1720.
–
4
.
32.
Kenawy
HI
,
Boral
I
,
Bevington
A
.
Complement-coagulation cross-talk: a potential mediator of the physiological activation of complement by low pH.
.
Front Immunol.
2015;
;
6
:
:215.
.
33.
Ueda
Y
,
Mohammed
I
,
Song
D
,
et al.
Murine systemic thrombophilia and hemolytic uremic syndrome from a factor H point mutation.
.
Blood.
2017;
;
129
:
:1184.
–
1196
.
34.
Middleton
EA
,
He
X-Y
,
Denorme
F
,
et al.
Neutrophil extracellular traps contribute to immunothrombosis in COVID-19 acute respiratory distress syndrome.
.
Blood.
2020;
;
136
:
:1169.
–
79
.
35.
Ritis
K
,
Doumas
M
,
Mastellos
D
,
et al.
A novel C5a receptor-tissue factor cross-talk in neutrophils links innate immunity to coagulation pathways.
.
J Immunol.
2006;
;
177
:
:4794.
–
4802
.
36.
Mastaglio
S
,
Ruggeri
A
,
Risitano
AM
,
et al.
The first case of COVID-19 treated with the complement C3 inhibitor AMY-101.
.
Clin Immunol.
2020;
;
215
:
:108450.
.
37.
Diurno
F
,
Numis
FG
,
Porta
G
,
et al.
Eculizumab treatment in patients with COVID-19: preliminary results from real life ASL Napoli 2 Nord experience.
.
Eur Rev Med Pharmacol Sci.
2020;
;
24
:
:4040.
–
7
.
38.
Mastellos
DC
,
Ricklin
D
,
Lambris
JD
.
Clinical promise of next-generation complement therapeutics.
.
Nat Rev Drug Discov.
2019;
;
18
:
:707.
–
729
.
39.
Ueda
Y
,
Miwa
T
,
Ito
D
,
et al.
Differential contribution of C5aR and C5b–9 pathways to renal thrombic microangiopathy and macrovascular thrombosis in mice carrying an atypical hemolytic syndrome-related factor H mutation.
.
Kidney Int.
2019;
;
96
:
:67.
–
79
.
40.
Rother
RP
,
Rollins
SA
,
Mojcik
CF
,
et al.
Discovery and development of the complement inhibitor eculizumab for the treatment of paroxysmal nocturnal hemoglobinuria.
.
Nat Biotechnol.
2007;
;
25
:
:1256.
–
1264
.
41.
Morgan
BP
,
Harris
CL
.
Complement, a target for therapy in inflammatory and degenerative diseases.
.
Nat Rev Drug Discov.
2015;
;
14
:
:857.
–
877
.
42.
Zuber
J
,
Fakhouri
F
,
Roumenina
LT
,
et al.
Use of eculizumab for atypical haemolytic uraemic syndrome and C3 glomerulopathies.
.
Nat Rev Nephrol.
2012;
;
8
:
:643.
–
657
.
43.
Annane
D
,
Heming
N
,
Grimaldi-Bensouda
L
,
et al.
Eculizumab as an emergency treatment for adult patients with severe COVID-19 in the intensive care unit: a proof-of-concept study.
.
EClinicalMedicine.
2020
;
:100590.
.
45.
Latuszek
A
,
Liu
Y
,
Olsen
O
,
et al.
Inhibition of complement pathway activation with pozelimab, a fully human antibody to complement component C5.
.
PLoS One.
2020;
;
15
:
:e0231892.
.
46.
Jordan
SC
,
Kucher
K
,
Bagger
M
,
et al.
Intravenous immunoglobulin significantly reduces exposure of concomitantly administered anti-C5 monoclonal antibody tesidolumab.
.
Am J Transplant.
2020;
;
20
:
:2581.
–
8
.
47.
Röth
A
,
Nishimura
JI
,
Nagy
Z
,
et al.
The complement C5 inhibitor crovalimab in paroxysmal nocturnal hemoglobinuria.
.
Blood.
2020;
;
135
:
:912.
–
20
.
48.
Chow
V
,
Pan
J
,
Chien
D
,
et al.
A randomized, double-blind, single-dose, three-arm, parallel group study to determine pharmacokinetic similarity of ABP 959 and eculizumab (Soliris®) in healthy male subjects.
.
Eur J Haematol.
2020;
;
105
:
:66.
–
74
.
49.
Guo
RF
,
Ward
PA
.
Role of C5a in inflammatory responses.
.
Annu Rev Immunol.
2005;
;
23
:
:821.
–
852
.
50.
Hammerschmidt
D
,
Hudson
L
,
Weaver
LJ
.
et al.
Association of complement activation and elevated plasma-C5a with adult respiratory distress syndrome: pathophysiological relevance and possible prognostic value.
.
Lancet.
1980;
;
315
:
:947.
–
949
.
52.
Vlaar
APJ
,
de Bruin
S
,
Busch
M
,
et al.
Anti-C5a antibody IFX-1 (vilobelimab) treatment versus best supportive care for patients with severe COVID-19 (PANAMO): an exploratory, open-label, phase 2 randomised controlled trial.
.
Lancet Rheumatol.
2020;
;
2
:
:e764.
–
e73
.
53.
Lu
JD
,
Milakovic
M
,
Ortega-Loayza
AG
,
et al.
Pyoderma gangrenosum: proposed pathogenesis and current use of biologics with an emphasis on complement C5a inhibitor IFX-1.
.
Expert Opin Investig Drugs.
2020;
;
29
:
:1179.
–
85
.
54.
Gerard
NP
,
Lu
B
,
Liu
P
,
et al.
An Anti-inflammatory function for the complement anaphylatoxin C5a-binding protein, C5L2.
.
J Biol Chem.
2005;
;
280
:
:39677.
–
39680
.
55.
Ram Kumar Pandian
S
,
Arunachalam
S
,
Deepak
V
,
et al.
Targeting complement cascade: an alternative strategy for COVID-19.
.
3 Biotech.
2020;
;
10
:
:479.
.
56.
Cavaillon
JM
,
Sansonetti
P
,
Goldman
M
.
Jules Bordet, un homme de convictionCentenaire de l’attribution de son prix Nobel.
.
Med Sci (Paris).
2020;
;
36
:
:803.
–
9
.
|