| |
| Med Sci (Paris). 37(4): 406–408. doi: 10.1051/medsci/2021043.Le rituximab dans le traitement du lymphome diffus à grandes cellules B L’expression de la sous-unité CACNA1C du canal Cav 1.2 liée à certaines formes de résistance Sonia Bouabdallah,1a Mohamed Lamine Mariko,1c Jeremy Besson,1b and Olivier Dellis2d 1M1 Biologie Santé, Université Paris-Saclay
,
91405Orsay
,
France
.
2Inserm U1193 Physiopathologie et traitement des maladies du foie, Université Paris-Saclay
,
France
.
MeSH keywords: Antinéoplasiques immunologiques, Protocoles de polychimiothérapie antinéoplasique, Canaux calciques de type L, Cyclophosphamide, Doxorubicine, Résistance aux médicaments antinéoplasiques, Humains, Lymphome B diffus à grandes cellules, microARN, Prednisone, Rituximab, Vincristine, usage thérapeutique, métabolisme, traitement médicamenteux |
Les lymphomes non hodgkiniens (LNH) constituent un ensemble de maladies touchant le système immunitaire à cause d’une prolifération anormale de lymphocytes B (LB) ou lymphocytes T (LT) [
1
]. Parmi les LNH, le lymphome diffus à grandes cellules B (DLBCL), qui a une origine B, est le plus courant chez l’adulte et touche généralement des individus âgés. La première ligne de traitement standard pour le DLBCL consiste en une combinaison de chimiothérapies (CHOP) associées au rituximab, un anticorps monoclonal thérapeutique anti-CD20, et porte le nom de protocole R-CHOP [
2
]
1
. Ce dernier induit la mort cellulaire des LB tumoraux par 3 mécanismes [
3
]: cytotoxicité à médiation cellulaire dépendante des anticorps (ADCC), cytotoxicité dépendante du complément (CDC) et induction d’une signalisation apoptotique
(
Figure 1A
)
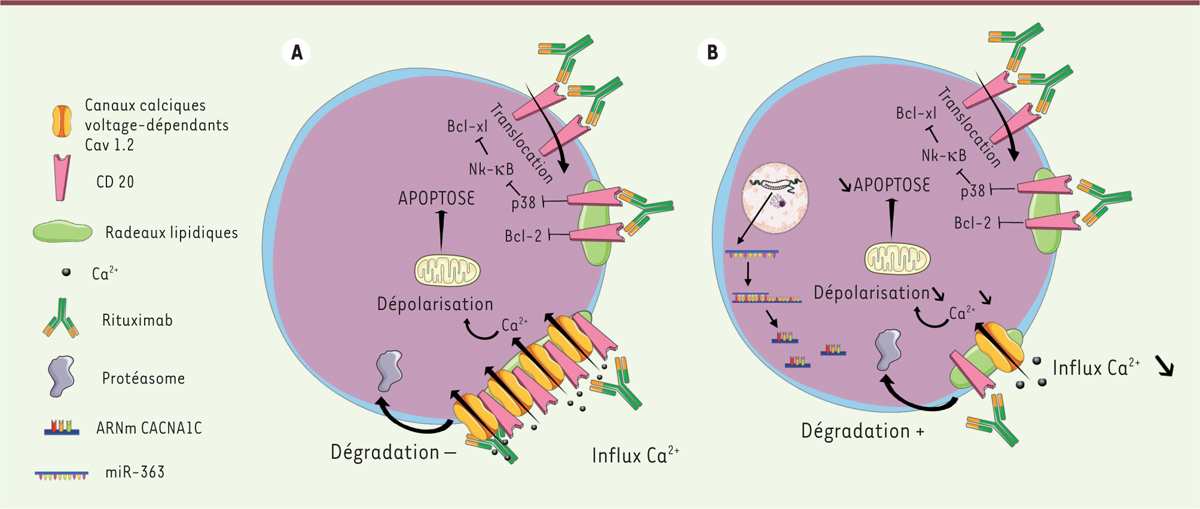
. Le mécanisme de signalisation directe de l’apoptose est lié à la liaison du RTX à sa cible, le CD20, une phosphoprotéine glycosylée membranaire exprimée par les lymphocytes B à tous les stades de différenciation des LB (à l’exception des précurseurs B et des plasmocytes) et impliquée dans la régulation des transports calciques transmembranaires. La fixation de l’anticorps induit une redistribution des molécules CD20 au niveau des radeaux lipidiques, phénomène menant à l’apoptose de la cellule [
4
]. En effet, cette redistribution permet à la fois d’inhiber l’expression de gènes anti-apoptotiques (Bcl-2, Bcl-xl) et d’augmenter le flux calcique intracellulaire qui
in fine
engendre l’apoptose des cellules
(
Figure 1A
)
. Les lymphomes B, comme les lymphocytes B non tumoraux, expriment un large éventail de canaux ioniques, y compris des canaux calciques voltage-dépendants (Cav). Ces canaux calciques sont constitués de 5 sous-unités : a1, a2/d, β et g, la sous-unité a formant le pore du canal, les autres ayant une fonction régulatrice. Selon leurs propriétés cinétiques et pharmacologiques, les canaux Cav sont répartis en plusieurs familles, dont celle des canaux de type-L. Parmi les canaux de type L, la sous-unité a peut être codée par plusieurs gènes différents (ajoutant de la diversité au sein de ces canaux), dont le CACNA1C (
calcium voltage-gated channel subunit alpha 1C
) pour la sous-unité a1C. L’association de la sous-unité a1C avec les autres sous-unités forme le canal Cav1.2, qui est exprimé dans les lymphocytes B et participe à l’influx calcique. L’expression du gène CACNA1C est donc un marqueur à prendre en compte dans le DLBCL et peut orienter
in fine
sa prise en charge.
 | Figure 1.
Mécanisme d’action du rituximab et résistance des LB tumoraux à son action. A.
Le rituximab provoque la mort cellulaire en induisant l’interaction entre la molécule CD20 et le canal calcique voltage-dépendant Cav1.2 au niveau des radeaux lipidiques conduisant ainsi à un plus grand influx calcique permettant l’apoptose.
B..
La résistance au rituximab est induite par une faible expression de canaux calciques voltage-dépendants à la membrane et par conséquent un plus faible influx calcique. Cette faible expression est due à l’ARN interférent miR-363 qui cible l’ARNm de la sous-unité CACNA1C du canal.
|
Suite à l’addition du RTX au protocole CHOP de chimiothérapie (R-CHOP), la survie globale des patients DLBCL s’est significativement améliorée [
5
]. Cependant, 30 à 40 % des patients atteints de DLBCL ont une réponse insuffisante au protocole R-CHOP et la résistance au RTX jouerait un rôle essentiel dans l’échec du traitement R-CHOP. Zang
et al.
ont donc étudié le rôle potentiel des canaux calciques Cav1.2 dans la résistance au RTX [
6
].
|
Mécanisme d’action du RTX via la sous unité a1C du canal CaV1.2
Le récepteur CD20, qui est présent à tous les stades de différenciation des LB à l’exception des précurseurs B et des plasmocytes [
7
-
8
], participe à la régulation des transports calciques transmembranaires, ce qui en fait une cible dans le traitement au RTX. Comme stipulé précédemment, le mécanisme d’induction directe de l’apoptose est lié à la liaison du RTX à sa cible, le CD20, qui induit une redistribution de celle-ci au niveau des radeaux lipidiques. Dans l’étude menée par Zang
et al
., les auteurs ont mis en évidence que la baisse de l’expression de la sous-unité a1C par l’utilisation d’ARN interférents, réduit l’apoptose induite par le RTX dans deux lignées de DLBCL. De plus, après 12 h de traitement au RTX, il est possible d’observer une co-localisation de CD20 et de la sous-unité a1C au niveau des radeaux lipidiques de la membrane plasmique des LB tumoraux. Il est aussi à noter que des ARN interférents dirigés contre la sous-unité a1C entraînent une baisse de l’expression de CD20, sans modifier l’expression de son transcrit. Lorsque les auteurs ont alors inhibé le protéasome par du bortezomib, l’expression de CD20 était restaurée, démontrant que la sous-unité a1C joue un rôle dans la stabilité de ce récepteur membranaire, contribuant ainsi indirectement à l’efficacité du RTX. Les auteurs ont également analysé dans la même étude le lien entre la sensibilité des cellules tumorales à l’apoptose induite par le RTX et les variations de flux calcique dans les cellules.
Comme il n’existe pas d’effecteurs spécifiques du canal Cav1.2, les auteurs ont mesuré les variations de calcium cytosolique induite par le RTX en présence d’un agoniste (BayK8644) ou d’un antagoniste (nimodipine) des canaux de type L, dont fait partie Cav1.2. C’est ainsi que le BayK8644 potentialise les entrées de calcium, alors que la nimodipine les inhibe, démontrant le rôle des canaux de type L dans les effets du RTX. Parallèlement, l’apoptose induite par RTX dans les cellules de deux lignées DLBCL était augmentée en présence de BayK8644, et réduite en présence de nimodipine. Dans le modèle de souris DLBCL, PDX, seul le BayK8644 est capable de renforcer les effets du RTX avec une réduction accrue de la taille des tumeurs induite par le RTX. Ces résultats démontrent donc que la sensibilité et l’efficacité au traitement par RTX peut être modulée par action sur le flux calcique via le canal Cav1.2. |
MiR-363 régule l’expression de la sous-unité a1C du canal Cav1.2
In silico
, les auteurs ont ensuite montré que la sous-unité a1C est la cible de miR-363, un micro-RNA connu pour jouer un rôle dans certains cancers. En plaçant le gène codant la luciférase derrière la partie 3’-UTR du gène CACNA1C, ils ont pu observer une inhibition de l’activité de la luciférase dans les cellules cotransfectées avec miR-363, inhibition qui pouvait être levée en mutant la région 3’-UTR. De plus, quand miR-363 est exprimé par des cellules de lignées de DLBCL, l’expression de la sous-unité a1C est réduite, ainsi que celle du CD20, ce qui inhibe très fortement l’apoptose induite par le RTX. Inversement, l’utilisation de la technique CRISPR-Cas9 dans les cellules d’une lignée DLBCL pour éliminer le locus miR-363, induit une augmentation de l’expression de la sous-unité a1C du canal Cav1.2, ainsi que celle de l’apoptose induite par le RTX. Il est à noter que des études précédentes avaient montré que des patients DLBCL résistants au traitement R-CHOP ont une forte expression de miR-363. Ainsi, la capacité de miR-363 à réduire l’expression de la sous-unité a1C du canal Cav1.2 pourrait jouer un rôle dans la résistance au traitement R-CHOP.
|
L’ajout du RTX au protocole CHOP a amélioré significativement la survie des patients atteints de DLBCL, même si une partie des patients ont un mauvais pronostic malgré cette amélioration thérapeutique. Dans l’article de Zhang
et al.
, les auteurs ont montré que l’action du RTX permet l’induction de l’apoptose dans les lymphocytes B tumoraux en augmentant le flux calcique à travers les canaux Cav1.2. De plus, la résistance au RTX pourrait avoir deux origines : 1) une faible expression de la sous-unité a1C du canal Cav1.2 codée par le gène CACNA1C ; 2) une surexpression de miR-363 qui réduit l’expression de la sous-unité a1C. Le miR-363 pourrait donc servir de biomarqueur prédictif de la résistance au traitement R-CHOP, mais aussi de cible thérapeutique.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Li
S
,
Young
KH
,
Medeiros
LJ
.
Diffuse large B-cell lymphoma.
.
Pathology.
2018;
;
50
:
:74.
–
87
.
2.
Wästerlid
T
,
Harrysson
S
,
Andersson
TM
,
et al.
Outcome and determinants of failure to complete primary R-CHOP treatment for reasons other than non-response among patients with diffuse large B-cell lymphoma.
.
Am J Hematol.
2020;
;
95
:
:740.
–
8
.
3.
Smith
MR
.
Rituximab (monoclonal anti-CD20 antibody): mechanisms of action and resistance.
.
Oncogene.
2003;
;
22
:
:7359.
–
7368
.
4.
Janas
E
,
Priest
R
,
Wilde
JI
,
et al.
Rituxan (anti-CD20 antibody)-induced translocation of CD20 into lipid rafts is crucial for calcium influx and apoptosis.
.
Clin Exp Immunol.
2005;
;
139
:
:439.
–
446
.
5.
Coiffier
B
,
Thieblemont
C
,
Van Den Neste
E
,
et al.
Long-term outcome of patients in the LNH-98.5 trial, the first randomized study comparing rituximab-CHOP to standard CHOP chemotherapy in DLBCL patients: a study by the Groupe d’Etudes des Lymphomes de l’Adulte.
.
Blood.
2010;
;
116
:
:2040.
–
2045
.
6.
Zhang
JY
,
Zhang
PP
,
Zhou
WP
,
et al.
L-type Cav 1.2 calcium channel-α-1C regulates response to rituximab in diffuse large B-cell lymphoma.
.
Clin Cancer Res.
2019;
;
25
:
:4168.
–
4178
.
7.
Babiker
HM
,
Glode
AE
,
Cooke
LS
,
Mahadevan
D
.
Ublituximab for the treatment of CD20 positive B-cell malignancies.
.
Expert Opin Investig Drugs.
2018;
;
27
:
:407.
–
412
.
8.
Payandeh
Z
,
Bahrami
AA
,
Hoseinpoor
R
,
et al.
The applications of anti-CD20 antibodies to treat various B cells disorders.
.
Biomed Pharmacother.
2019;
;
109
:
:2415.
–
2426
.
|