| |
| Med Sci (Paris). 37(4): 413–416. doi: 10.1051/medsci/2021054.Vers une thérapie génique pour la progéria ? Bertrand Jordan1* 1UMR 7268 ADÉS, Aix-Marseille, Université /EFS/CNRS ; CoReBio PACA, case 901, Parc scientifique de Luminy
,
13288Marseille Cedex 09
,
France MeSH keywords: Animaux, Modèles animaux de maladie humaine, Technique d'immunofluorescence, Édition de gène, Humains, Lamine A, Souris, Mutation ponctuelle, Progeria, Réparation génique ciblée, méthodes, génétique, métabolisme, thérapie |
La progéria, ou syndrome de Hutchinson-Gilford, est une affection très rare, mais particulièrement cruelle puisqu’elle apparaît très tôt (dès l’âge d’un an) et entraîne un vieillissement accéléré à de multiples niveaux ; les enfants atteints qui, à dix ans, ressemblent à des vieillards, succombent vers 14 ans, généralement en raison de problèmes cardio-vasculaires. La première description de cette maladie date de 1904 ; on a pu démontrer en 2003 [
1
,
2
] qu’elle est provoquées par une mutation (de C vers T) en position 1 824 dans le gène codant la lamine A, situé sur le bras long du chromosome 1. Cette mutation fait apparaître un nouveau site d’épissage sur le gène, ce qui qui entraîne la synthèse d’une forme raccourcie de la lamine A, appelée progérine. Cette dernière s’accumule sous la forme d’un précurseur farnésylé
1,
, qui ne peut plus subir le clivage normalement opéré sur la lamine A. L’accumulation de ce précurseur, restant anormalement farnésylé, entraîne des anomalies de la structure du noyau cellulaire (
Figure 1
, images du milieu) qui se répercutent dans l’ensemble des tissus de l’organisme et provoquent un vieillissement précoce généralisé. L’affection est dominante et la présence d’un seul allèle pathogène suffit à entraîner la maladie. Elle est toujours due à une mutation
de novo
, absente chez les parents
2
.
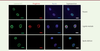 | Figure 1.
Images d’immunofluorescence obtenues sur des cellules de lignées cellulaires établies à partir d’un parent non affecté (en haut), d’un malade atteint de progéria (au milieu), et sur les cellules de la même lignée cellulaire après correction par édition de bases (en bas).
De gauche à droite, détection des lamines A et C (Lamine A/C), de la progérine (Progérine), des noyaux (Nuclei), et superposition des trois images. On voit que la membrane nucléaire est très perturbée dans les cellules de la lignée « progéria », et, qu’après édition, la progérine disparaît et les noyaux reprennent une morphologie normale (extrait partiel et modifié de la figure 1 de [
8
]).
|
Il n’existe pas actuellement de traitement efficace. Des tentatives visant à agir sur les effets cardiovasculaires (en utilisant des statines), à utiliser des inhibiteurs de la farnésylation (pour réduire la quantité de progérine), ou à inhiber la synthèse de la molécule par l’emploi d’ARN antisens (pour inhiber la traduction du gène muté) n’ont pu, au mieux, que ralentir un peu la progression de la maladie [
3
,
4
] (
→
).
(→) V Voir la Synthèse de C.L. Navarro
et al
.,
m/s
n° 10, octobre 2008, page 833
Cependant, de nombreux travaux sont poursuivis pour comprendre et remédier à cette maladie, malgré sa très faible incidence, dans l’espoir d’améliorer les traitements, mais aussi de comprendre à travers ce modèle, certains mécanismes du vieillissement. |
Inactiver le gène de la progeria
Compte tenu des outils aujourd’hui disponibles (le système CRISPR/Cas9 et ses dérivés), la voie semble toute tracée – du moins pour les travaux préliminaires portant sur des cellules et dans des modèles de souris. Deux articles parus simultanément en 2019 [
5
,
6
] montrent la possibilité mais aussi les limites de cette approche. Dans les deux cas, les auteurs ont utilisé un modèle murin portant la mutation du gène humain à l’origine de la progeria à l’état homozygote ou hétérozygote. Ils ont montré qu’ils obtenaient une correction partielle de la mutation dans des cultures de cellules de souris. Ils sont ensuite passés à l’expérimentation sur l’animal et ont injecté leur construction génétique au stade néonatal, par voie faciale ou intrapéritonéale. Ils ont observé une diminution de l’abondance de la progérine et de la laminine A, et une amélioration de l’état des souris «
Progéria
» qui vivent alors plus longtemps et restent plus actives. L’intervention qui a été réalisée n’est pas à proprement parler une
correction
de la mutation. Il s’agit d’une inactivation du gène muté codant la progérine par coupure grâce à Cas9 suivie du rattachement aléatoire des chaînes d’ADN (ou NHEJ,
Non-Homologous End Joining
). Le gène de la laminine A est également inactivé au même niveau, ce qui n’est pas grave puisque celui-ci n’est pas nécessaire chez la souris – mais on ne sait pas ce qu’il en est chez l’homme. Bref, ces travaux sont un premier pas très intéressant vers une éventuelle thérapie génique de la progeria, mais il est clair qu’il va falloir procéder avec plus d’efficacité et de précision avant de pouvoir envisager une application clinique.
|
Corriger précisément la mutation : l’édition de bases
Le système CRISPR/Cas9 est souvent appelé « éditeur », mais il n’aboutit à une modification ponctuelle précise que si l’on introduit, en même temps que le complexe Cas9-ARN guide, la séquence par laquelle on veut remplacer la zone d’ADN visée, et que l’on parvient à favoriser la recombinaison homologue (par rapport au mécanisme de rattachement aléatoire des chaînes d’ADN, NHEJ) ou à sélectionner les (rares) cellules dans lesquelles celle-ci a eu lieu. De véritables éditeurs de bases ont été mis au point récemment [
7
]. Ils sont capables de remplacer une base par une autre sans couper la double hélice de l’ADN. Ils couplent une enzyme de modification agissant sur certaines bases et une protéine Cas modifiée et dirigée par un ARN guide pour effectuer une telle modification à un endroit précis. On dispose d’éditeurs cytosine (CBE,
cytosine base editors
), qui transforment une paire C-G en A-T, et d’éditeurs adénine (ABE,
adenine base editors
) qui transforment une paire A-T en G-C. Dans les deux cas, la nucléase Cas modifiée effectue une coupure simple brin (
nick
en anglais) en face de la base modifiée, ce qui stimule la réparation et l’apparition de la nouvelle paire. La mise au point de ce système permet d’envisager la correction précise de mutations dans différentes situations et, à terme, en thérapie.
C’est ce que présente l’article objet de cette chronique [
8
], paru fin janvier 2021 dans
Nature
, et émanant d’un ensemble de prestigieux laboratoires états-uniens. Les auteurs ont travaillé dans un premier temps sur des lignées de fibroblastes provenant de patients atteints de progeria, qu’ils ont infectées par un vecteur lentiviral portant leur éditeur adénine et un ARN guide ciblant la mutation pathogène (C>T en position 1 824) ; ils ont observé (après 20 jours) une correction à 90 % de la mutation et une quasi-disparition de la protéine progérine, sans que la quantité de lamine A ne soit affectée. Et surtout, la morphologie de la membrane nucléaire, très perturbée dans les cellules des patients, revient à la normale
(
Figure 1
).
Une analyse approfondie d’éventuelles éditions aberrantes (
off-target
, ou hors cible) ne détecte aucun évènement de ce type, que ce soit au niveau de l’ADN ou de l’ARN. En résumé, la correction de la mutation par édition de bases sur des lignées cellulaires présente une bonne efficacité (90 %), sans effets parasites détectables.
|
De la lignée cellulaire à la souris
L’étape suivante concerne naturellement le passage
in vivo
dans un modèle animal. Il s’agit ici d’une souche de souris portant à l’état homozygote le gène humain de la lamine sous sa forme mutante dirigeant la synthèse de progérine. Ces souris présentent un phénotype très analogue à la progéria humaine : déficit en cellules du muscle lisse vasculaire (VSMC, pour
vascular smooth muscle cells
), alopécie, perte de l’adiposité sous-cutanée, anomalies musculo-squelettiques et durée de vie réduite. L’objectif est alors d’introduire, le plus tôt possible, l’éditeur de bases dans ces souris afin qu’il diffuse dans l’organisme et corrige la mutation dans un nombre suffisant de cellules pour provoquer une atténuation du syndrome. Le vecteur employé est le virus adéno-associé (AAV, pour
adeno-associated virus
), choisi en raison de sa bonne efficacité et de son approbation par la FDA américaine (
Food and Drug Administration
) pour des applications cliniques. Comme la capacité d’emport de ce virus est insuffisante pour inclure l’éditeur de bases au complet, les auteurs ont construit deux vecteurs AAV contenant chacun la moitié de l’éditeur et capables de se recombiner dans la cellule infectée pour produire l’éditeur fonctionnel. La souche AAV9 a été choisie pour sa capacité à infecter de nombreux tissus, notamment le cœur et le muscle. Au total, on le voit, une grande sophistication du système pour maximiser les chances de succès…
Ces virus ont été injectés à des doses élevées (de 10
11
à 10
12
génomes viraux par animal) à des souris âgées de 3 ou de 14 jours, par la voie rétro-orbitale ou intrapéritonéale. Les meilleurs résultats sont obtenus par injection intrapéritonéale à 14 jours. On observe alors une correction significative de la mutation, variable selon les tissus, et qui augmente un peu entre les souris analysées à 6 semaines et à 6 mois
(
Figure 2
)
, ce qui suggère que l’éditeur de bases reste actif assez longtemps
in vivo.
 | Figure 2.
Correction de la mutation « progeria » après traitement des souris par un éditeur de bases, évaluée par l’analyse de l’ADN de différents organes.
Le pourcentage de correction (en ordonnée) varie de 10 % (pour le tissu osseux) à plus de 60 % (pour le foie). L’analyse a porté sur 6 souris à 6 semaines (vert clair) et 12 souris à 6 mois (vert foncé). Quad : muscle quadriceps (extrait partiel et modifié de la figure 3 de [
8
]).
|
Ce sont là des valeurs tout à fait respectables pour une thérapie génique
in vivo
dans laquelle on espère que la correction s’étende à l’ensemble de l’animal. Elles sont confirmées par l’analyse des niveaux d’expression de progérine et de lamine A, qui montre notamment une forte réduction de la quantité de progérine dans les différents tissus. Reste à voir le résultat de cette correction sur le phénotype des souris. L’aorte étant un des organes les plus touchés dans la progéria, une étude histologique détaillée est rapportée. Elle montre une normalisation du phénotype chez les souris traitées et une conservation des cellules musculaires lisses vasculaires, qui, chez les patients, disparaissent. Diverses autres anomalies sont plus ou moins corrigées chez les animaux traités. Surtout, la longévité de ces derniers fait un bond
(
Figure 3
)
, sans toutefois atteindre celle des souris normales. Il y a donc bien correction du phénotype, et cette correction est quasiment complète alors même que la correction génique n’est que partielle
(
Figure 2
)
.
 | Figure 3.
Courbe de survie
(exprimée en %) des souris
progeria
(en rouge) et des mêmes souris traitées à 14 jours par édition de bases. L’échelle de temps (en abscisse) est exprimée en jours ; une souris est encore vivante à l’établissement du graphique (extrait partiel et remanié de la figure 4 de [
8
]).
|
|
Perspectives pour la progeria… et au-delà
Ce très joli travail montre la possibilité de corriger par édition de bases la mutation qui provoque la progéria, et de le faire avec une efficacité suffisante pour obtenir une amélioration significative du phénotype d’animaux traités peu après leur naissance. Le fait qu’une correction très partielle, comme pour l’aorte (25 %)
(
Figure 2
)
, entraîne une normalisation presque complète du tissu est particulièrement encourageant. Des perspectives d’amélioration existent, avec notamment la mise au point d’éditeurs plus efficaces qui permettent d’espérer une correction plus complète [
8
]. Le diagnostic de progeria étant précoce (établi à l’âge d’un an), l’emploi d’une telle thérapie en clinique semble envisageable. Il reste néanmoins plusieurs obstacles avant d’en arriver là, notamment le risque de réaction immunitaire contre le vecteur AAV utilisé qui peut être reconnu par le système immunitaire et éliminé, et la possibilité de tumeurs hépatiques induites par l’intégration du virus (des tumeurs ont été observées chez la souris).
L’intérêt de ce travail dépasse de beaucoup le cadre d’une maladie génétique très rare. On a pu envisager la progeria comme un exemple de vieillissement accéléré susceptible d’apporter des informations précieuses sur le processus de vieillissement normal, et donc sur les moyens de le ralentir. Les données actuelles suggèrent que le mécanisme très particulier de cette affection (perturbation importante de la membrane nucléaire) limite sa pertinence à cet égard par rapport aux approches ciblées sur les cellules sénescentes en général [
9
,
10
] (
→
).
(→) Voir la Chronique génomique de B. Jordan,
m/s
n° 10, octobre 2018, page 885, et la Synthèse de D. Veret et J.M. Brondello,
m/s
n° 12, décembre 2020, page 1135
Mais le succès (encore partiel, et chez l’animal) de cette véritable correction génique ouvre d’importantes perspectives. Pratiquée de manière précoce pour les affections qui peuvent être détectées peu après la naissance (on peut penser ici à l’ostéogenèse imparfaite), une telle thérapie peut apporter enfin un espoir pour des maladies jusqu’ici incurables – même si le chemin à parcourir reste long. |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Eriksson
M
,
Brown
WT
,
Gordon
LB
,
et al.
Recurrent de novo point mutations in lamin A cause Hutchinson-Gilford progeria syndrome.
.
Nature.
2003;
;
423
:
:293.
–
298
.
2.
De Sandre-Giovannoli
A
,
Bernard
R
,
Cau
P
,
et al.
Lamin a truncation in Hutchinson-Gilford progeria.
.
Science.
2003;
;
300
:
:2055.
.
3.
Navarro
CL
,
Poitelon
Y
,
Lévy
N
.
Lamines A et syndromes progéroïdes : une farnésylation persistante aux conséquences dramatiques.
.
Med Sci (Paris).
2008;
;
24
:
:833.
–
840
.
4.
Gonzalez
JM
,
Pla
D
,
Perez-Sala
D
,
Andres
V
.
A-type lamins and Hutchinson-Gilford progeria syndrome: pathogenesis and therapy.
.
Front Biosci (Schol Ed).
2011;
;
3
:
:1133.
–
1146
.
5.
Beyret
E
,
Liao
HK
,
Yamamoto
M
,
et al.
Single-dose CRISPR-Cas9 therapy extends lifespan of mice with Hutchinson-Gilford progeria syndrome.
.
Nat Med.
2019;
;
25
:
:419.
–
422
.
6.
Santiago-Fernández
O
,
Osorio
FG
,
Quesada
V
,
et al.
Development of a CRISPR/Cas9-based therapy for Hutchinson-Gilford progeria syndrome.
.
Nat Med.
2019;
;
25
:
:423.
–
426
.
7.
Gaudelli
NM
,
Komor
AC
,
Rees
HA
,
et al.
Programmable base editing of AT to GC in genomic DNA without DNA cleavage.
.
Nature.
2017;
;
551
:
:464.
–
471
.
8.
Koblan
LW
,
Erdos
MR
,
Wilson
C
,
et al.
In vivo base editing rescues Hutchinson-Gilford progeria syndrome in mice.
.
Nature.
2021;
;
589
:
:608.
–
14
.
9.
La
Jordan B.
sénescence en passe d’être vaincue ?
.
Med Sci (Paris).
2018;
;
34
:
:885.
–
890
.
10.
Veret
D
,
Brondello
JM
.
Sénothérapies : avancées et nouvelles perspectives cliniques.
.
Med Sci (Paris).
2020;
;
36
:
:1135.
–
42
.
|




