| |
| Med Sci (Paris). 37(5): 482–490. doi: 10.1051/medsci/2021056.Dépistage néonatal de la drépanocytose en France Valentine Brousse,1,2* Bichr Allaf,3 and Malika Benkerrou1,4 1Centre de référence de la drépanocytose, Hôpital universitaire Robert Debré
,
48 boulevard Sérurier, AP-HP
,
75019Paris
,
France 2Inserm UMRS1134 - Biologie intégrée du globule rouge
,
6 rue Alexandre-Cabanel
,
75015Paris
,
France 3Service de biochimie, Hôpital universitaire Robert Debré
,
48 boulevard Sérurier, AP-HP
,
75019Paris
,
France 4Inserm UMR 1123-Épidémiologie clinique, évaluation économique appliquées aux populations vulnérables (ECEVE)
,
10 avenue de Verdun
,
75010Paris
,
France |
Vignette (© CNCDN). Encore méconnue du grand public, la drépanocytose est actuellement la plus fréquente des maladies rares en France, touchant 1 nouveau-né sur 1 303 testés en période néonatale. C’est une maladie d’origine génétique, chronique, pour laquelle les options thérapeutiques, encore limitées, sont l’objet de recherches fondamentale, translationnelle, clinique et industrielle pharmaceutique très actives depuis une quinzaine d’années. Partout où il a été entrepris, le dépistage néonatal (DNN) a profondément modifié le pronostic de cette maladie. |
La drépanocytose : la maladie et ses complications sévères
La drépanocytose est une hémoglobinopathie autosomique récessive liée à la présence d’une hémoglobine anormale, l’hémoglobine S (HbS : a
2
b
2
S
), du fait d’une substitution d’un acide glutamique par une valine apolaire en position 6 de la chaîne de b-globine (ce qui correspond à une transversion A → T dans le 6
e
codon du gène). On désigne par « syndrome drépanocytaire majeur » (SDM) les formes homozygotes S/S (dans lesquelles les deux chaînes de b-globine de l’hémoglobine sont mutées, β
2
S
) ou les formes hétérozygotes composites (S/X), associant la mutation de la chaîne β
S
sur un allèle (S), et une autre mutation sur le second allèle (X) (S/C, S/D-Punjab, S/O-Arab, S/E, S/Lepore, S/β
+
-thalassémie, S/β°thal), et les rares hétérozygotes (A/SAntilles ou A/SOman).
En situation désoxygénée, l’HbS, contrairement à l’HbA (a
2
b
2
)
1
, se polymérise dans le globule rouge. Elle le déforme alors (falciformation ou
sickling
en anglais), le rigidifie et le fragilise. Ces modifications biochimiques et biophysiques expliquent les trois principales manifestations cliniques de la maladie : l’anémie hémolytique chronique, les complications vaso-occlusives de la microcirculation et des gros troncs artériels cérébraux, ainsi que l’atteinte de la fonction splénique, par fibrose progressive. Sur le plan physiopathologique, au-delà de la polymérisation de l’hémoglobine, l’hémolyse chronique et les épisodes aigus ou chroniques d’occlusion micro-vasculaire, souvent douloureuse, entraînent un déficit fonctionnel en monoxyde d’azote (NO), des lésions d’ischémie/reperfusion, un état pro-oxydant et pro-coagulant, une inflammation chronique avec activation de l’endothélium vasculaire, des polynucléaires neutrophiles et des plaquettes, avec, pour conséquence, une toxicité vasculaire générale [
1
]. La drépanocytose est donc une maladie chronique sévère, émaillée de complications ischémiques aiguës menant potentiellement à une insuffisance d’organe terminale à l’âge adulte, et une espérance de vie diminuée [
2
].
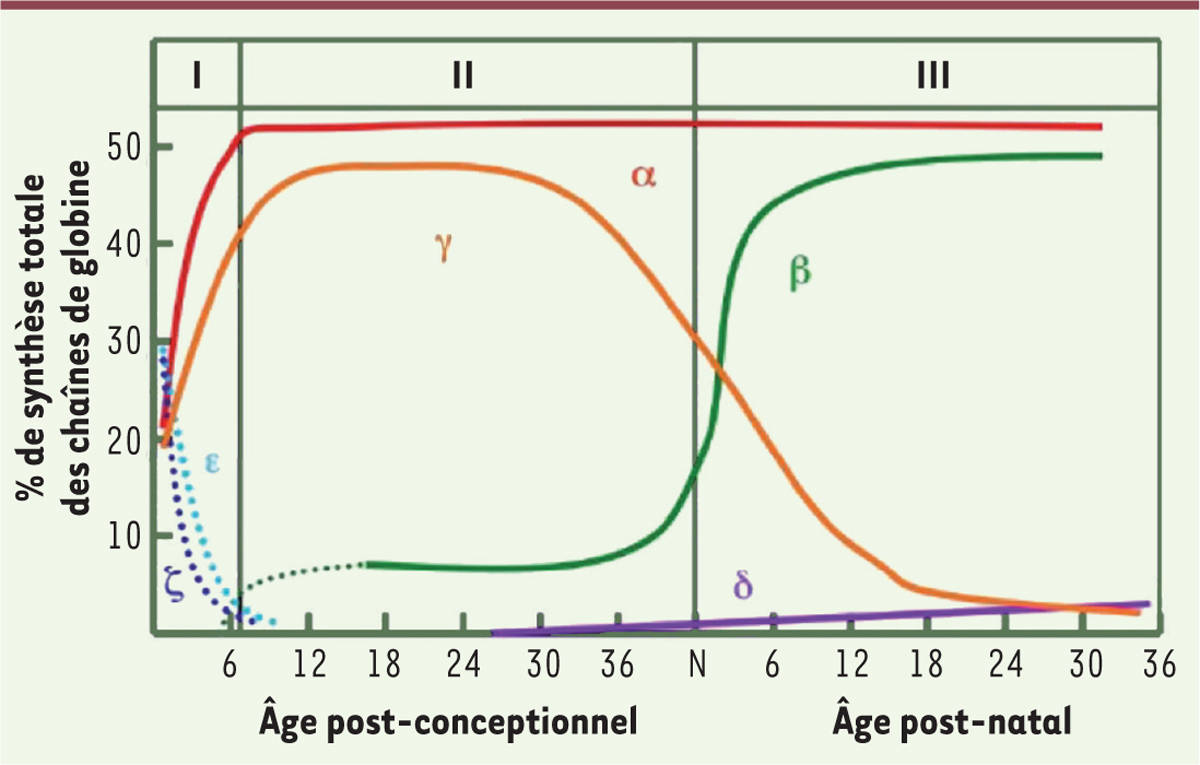
Physiologiquement, l’expression de l’hémoglobine adulte (HbA : a
2
b
2
) débute peu avant la naissance. Elle remplace progressivement l’hémoglobine fœtale (HbF : a
2
g
2
) prédominante et exprimée majoritairement pendant la vie fœtale, puis en période néonatale
(
Figure 1
)
. Le nouveau-né drépanocytaire est donc asymptomatique puisqu’il ne produit pas encore l’hémoglobine adulte (contenant la chaîne b) mutée (HbS) en quantité significative et est encore protégé par la présence d’HbF (qui contient la chaîne g). L’HbS va progressivement remplacer l’HbF au cours des premières années de la vie post-natale [
3
]. Les premiers symptômes de la maladie n’apparaissent de ce fait qu’exceptionnellement au cours du premier trimestre de vie, bien qu’il puisse exister une anémie chronique régénérative bien tolérée. Chez les sujets homozygotes SS (ou les formes de gravité comparables), les premiers symptômes sont essentiellement des évènements vaso-occlusifs ischémiques dans les métacarpes et métatarses, se traduisant par une dactylite douloureuse. C’est également à partir de l’âge de 3-6 mois que débute l’atteinte ischémique de la rate, responsable d’une susceptibilité aux infections à germes encapsulés, notamment par le pneumocoque [
4
]. Une autre complication grave survenant chez le nourrisson (médiane de survenue vers 16-18 mois) est la séquestration splénique aiguë, qui correspond à une congestion brutale de la rate à l’origine d’un syndrome anémique aigu potentiellement fatal.
 | Figure 1.
Commutation physiologique des hémoglobines pendant la vie embryonnaire (I), fœtale (II) et post-natale (III) chez l’enfant normal.
Les chaînes de globine sont représentées en rouge (a-globine), vert (b-globine), orange (g-globine), violet (d-globine), bleu (e-globine), violet pointillé (z-globine). L’âge est indiqué en semaine, et N désigne la naissance.
|
|
Justification du dépistage de la drépanocytose
Wilson et Jungner [
5
] ont défini un certain nombre de critères justifiant la mise en place d’un dépistage néonatal. Parmi ceux-ci, le caractère silencieux de l’expression clinique initiale, empêchant un diagnostic et donc la mise en route de certaines mesures thérapeutiques, correspond bien à la situation dans laquelle se trouve un nouveau-né porteur d’un syndrome drépanocytaire majeur : c’est une maladie sévère dont l’expression clinique est décalée dans le temps, et dont le pronostic est considérablement amélioré par la mise en place de mesures de prévention à une phase encore asymptomatique de la maladie, grâce à un dépistage néonatal.
En l’absence de diagnostic précoce, on estime que 50 à 80 % des enfants décèdent avant l’âge de 5 ans dans les pays à forte prévalence de la maladie [
6
]. La première cause de mortalité chez l’enfant de moins de 5 ans est due aux infections, dont le pneumocoque est le premier agent causal. La seconde cause de mortalité dans l’enfance est due à l’anémie aiguë, dont la plus grande responsable est la séquestration splénique aiguë. Dans les pays où a été instauré un dépistage néonatal, la mortalité pédiatrique a spectaculairement diminué et, comme on le verra plus loin, la mortalité dans l’enfance est désormais proche de celle de la population générale [
7
,
8
]. Il est également bien établi que le diagnostic précoce, accompagné de mesures prophylactiques, fait chuter significativement la morbidité de la maladie dans l’enfance en diminuant le risque d’infections invasives graves, d’épisodes anémiques sévères ou encore les séquelles neurologiques, et améliore considérablement le pronostic à l’âge adulte [
9
-
11
].
|
Historique et organisation du dépistage néonatal de la drépanocytose en France : le dépistage ciblé
Le dépistage néonatal de la drépanocytose est intégré au programme national de dépistage néonatal systématique (universel car intéressant tous les nouveau-nés). L’organisation de ce programme de santé public a été confiée, jusqu’en 2018, à l’Association française pour le dépistage et la prévention des handicaps de l’enfant (AFDPHE). Depuis Mars 2018, il est géré par les Agences régionales de santé (ARS) qui, par délégation, le confient aux Centres régionaux de dépistage néonatal (CRDN). La liste des maladies faisant l’objet d’un dépistage néonatal est fixée par arrêté ministériel [
12
].
Le dépistage néonatal de la drépanocytose a débuté par des expériences pilotes réalisées en Guadeloupe et en Martinique dès 1981. À partir de 1992, il a été généralisé à l’ensemble des nouveau-nés des autres départements (Guyane, La Réunion, Mayotte) et collectivités (Polynésie française, Saint-Barthélemy, Saint-Martin, Saint-Pierre-et-Miquelon et Wallis-et-Futuna) d’outre-mer.
En métropole, le dépistage néonatal de la drépanocytose a été introduit en 1995 en Île-de-France, puis étendu progressivement pour atteindre l’ensemble du territoire en 2000. Mais il est restreint aux nouveau-nés à risque : c’est donc un dépistage ciblé. Ce ciblage signifie que seuls les nouveau-nés dont les parents appartiennent à un groupe à risque sont dépistés. Ces groupes à risque sont définis en fonction des origines géographiques des parents et de la prévalence du trait drépanocytaire dans leurs pays ou département/région d’origine
(
Tableau I
)
. Cette prévalence dans ces pays est étroitement corrélée à celle du paludisme. En effet, c’est la pression de sélection génétique induite par le paludisme, notamment en Afrique subsaharienne, qui a favorisé l’émergence du trait drépanocytaire, celui-ci diminuant la capacité du parasite causal du paludisme (
Plasmodium falciparum
) à se multiplier dans les globules rouges [
13
]. Le choix du ciblage s’est fondé sur l’évaluation du rapport coût/efficacité, en comparant le coût d’un dépistage universel au coût d’un dépistage ciblé, rapporté au nombre de cas dépistés dans les deux populations [
14
]. En 2013, le rapport coût/efficacité du dépistage ciblé a été jugé favorable en métropole [
15
].
Tableau I.
|
1. Les deux parents sont originaires d’une région à risque :
|
|
| Départements (Guadeloupe, Martinique, Guyane, La Réunion, Mayotte) et Collectivités (Polynésie française, Saint-Barthélemy, Saint-Martin, Saint-Pierre-et-Miquelon et Wallis-et-Futuna) d’outre-mer |
|
| Tous les pays d’Afrique subsaharienne, Îles du Cap-Vert |
|
| Amérique du Sud (Brésil), Afro-Américains d’Amérique du Nord |
|
| Inde, océan Indien : Madagascar, Île Maurice, Comores |
|
| Afrique du Nord : Algérie, Tunisie, Maroc |
|
| Pourtour méditerranéen : Italie (Italie du Sud, Sicile), Grèce, Turquie |
|
| Moyen-Orient : Liban, Syrie, Arabie Saoudite, Yémen, Oman |
|
|
2. Un des parents est originaire d’une région à risque et l’autre d’un pays d’Asie
|
|
|
3. La mère est à risque et le père n’est pas connu
|
|
|
4. Un des parents a connaissance d’une anomalie de l’hémoglobine chez lui ou dans sa famille
|
Critères utilisés en métropole pour le ciblage d’un nouveau-né à risque de drépanocytose.
|
|
Résultats du dépistage néonatal de la drépanocytose en France La drépanocytose est actuellement la plus fréquente des maladies dépistées en période néonatale en France. Son incidence est en constante augmentation avec, en 2009, 1 nouveau-né atteint pour 2 089 testés et, en 2019, 1 pour 1 303. Entre 1984 et 2019, sur un total de 6 373 673 nouveau-nés soumis au dépistage, 9 260 enfants souffrant d’un syndrome drépanocytaire majeur ont été identifiés. Le dépistage a également révélé, sur cette même période, 180 687 nouveau-nés hétérozygotes AS, soit 1 nouveau-né sur 35 enfants ciblés.
Les données pour l’année 2019 sont présentées dans le
Tableau II
[
16
]. En France, près de la moitié des naissances ont été ciblées (44,4 %). Il existe cependant une grande variabilité inter-régionale en Métropole, qui dépend de la fréquence de la population à risque sur le territoire considéré. Par exemple, en 2019, le taux de ciblage était de 11,8 % en Bretagne et de 72,9 % en Île-de-France. Plus de la moitié des enfants atteints de syndromes drépanocytaires majeurs repérés en France ont été dépistés en région Parisienne (51 %). Sur 586 nouveau-nés atteints de syndromes drépanocytaires identifiés, 406 étaient des homozygotes SS (78,5 %) et 128 (21,8 %) des hétérozygotes composites SC.
Tableau II.
| Région |
Nombre de NN testés (programme de DNN) |
Nombre de NN testés pour la drépanocytose (programme ciblé) |
% de la population ciblée |
Malades SDM |
Fréquence (parmi tous les NN testés) |
Fréquence (parmi les NN ciblés) |
| Métropole |
715 755 |
299 319 |
41,8 % |
482 |
1/1 485 |
1/621 |
|
| Outre-mer |
47 939 |
39 983 |
83,4 % |
104 |
1/461 |
1/384 |
|
| Total |
763 694 |
339 302 |
44,4 % |
586 |
1/1 303 |
1/579 |
Dépistage de la drépanocytose en France en 2019.
DNN : dépistage néo-natal ; NN : nouveau-né ; SDM : syndrome drépanocytaire majeur.
|
|
Déroulement du dépistage néonatal de la drépanocytose en France Les papiers buvards sur lesquels sont déposées les gouttes de sang prélevées aux talons des nouveau-nés (test de Guthrie) sont adressés aux CRDN, qui vont transmettre les taches de sang concernées par le dépistage de la drépanocytose aux laboratoires dédiés.
Les techniques utilisées nécessitent de pouvoir détecter les fractions normales de l’hémoglobine (HbF et HbA) et les variants d’hémoglobine considérés comme pathogènes (notamment HbS, HbC, HbE, HbD-Punjab et HbO-Arab, etc.). En France, selon les recommandations de la Commission de biologie du dépistage néonatal, les techniques qui peuvent être utilisées en première intention pour le dépistage néonatal de la drépanocytose sont la chromatographie liquide haute performance (HPLC), l’isoélectrofocalisation
2
(IEF), l’électrophorèse capillaire ou la spectrométrie de masse.
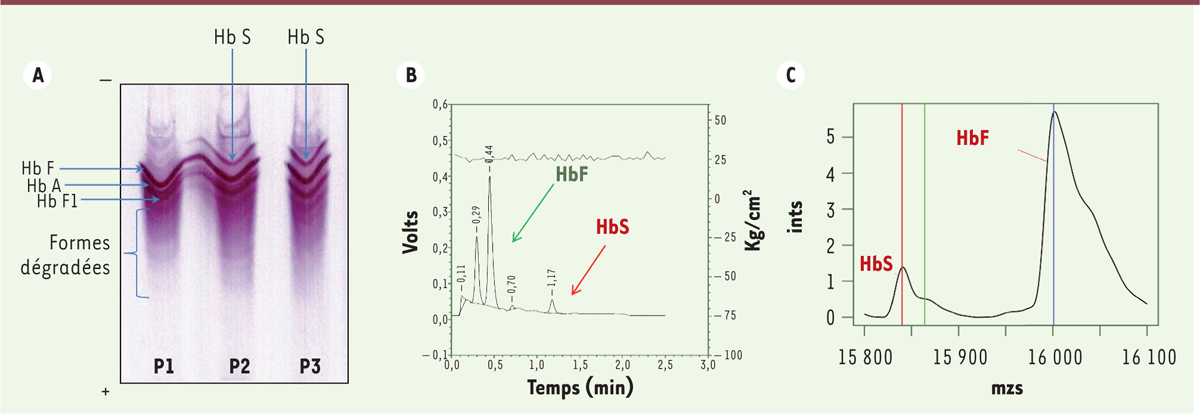
Ces techniques automatisées permettent, d’une part, de séparer les hémoglobines en fonction de leurs caractéristiques physico-chimiques (point isoélectrique, en particulier), et, d’autre part, de les quantifier
(
Figure 2
)
. En ce qui concerne les variants de l’hémoglobine ayant pour origine des mutations ponctuelles qui modifient un acide aminé d’une des chaînes de globine, la modification de charge de la protéine qui s’ensuit (et donc de son point isoélectrique) entraîne une différence de migration électrophorétique, permettant l’identification présomptive du variant par électrophorèse capillaire ou isoélectrofocalisation. Cette substitution d’acide aminé modifie la force d’interaction de l’HbS sur une colonne composée d’une résine échangeuse de cations. Elle permet ainsi l’identification du variant par HPLC. D’autres techniques émergent actuellement, notamment la spectrométrie de masse ou l’analyse génétique par PCR (
polymerase chain reaction
) [
17
,
18
].
 | Figure 2.
Différentes techniques d’étude de l’hémoglobine. A. Étude de l’hémoglobine par isoélectrofocalisation (IEF).
P1 : profil FA (normal) observé chez un nouveau-né, né à terme ; P2 : profil FAS (hétérozygote AS), porteur sain du trait drépanocytaire ; P3 : profil FS (syndrome drépanocytaire majeur homozygote SS, ou S/b
o
-thalassémique).
B. Étude de l’hémoglobine par chromatographie liquide à haute performance sur Variant NBS® (BioRad).
Chromatogramme pathologique chez un nouveau-né présentant un syndrome drépanocytaire majeur : profil FS (SS ou S/b
o
-thalassémique).
C. Étude de l’hémoglobine par spectrométrie de masse MALDI-TOF (NeoSickle® Biomaneo).
Profil FS : spectre de masse pathologique chez un nouveau-né présentant un syndrome drépanocytaire majeur.
|
Les résultats sont rendus qualitativement, en indiquant les fractions d’hémoglobines qui ont été détectées. Un nouveau-né sans hémoglobinopathie présentera un profil comprenant majoritairement de l’HbF et de l’HbA, dont le taux dépend du terme de naissance. Dans ce cas, les familles n’auront pas de retour direct des résultats, mais ceux-ci peuvent être consultés auprès du CRDN (ces résultats restent en effet disponibles pendant 20 ans au minimum). En cas de présence d’un variant de l’hémoglobine, une vérification et une confirmation sont nécessaires, sur le même échantillon (buvard), mais à l’aide d’une technique de seconde intention recourant à un principe analytique différent de celui mis en jeu en première intention.
Si le profil montre l’absence d’HbA et la présence d’HbF et d’HbS, il s’agira d’un profil homozygote SS ou hétérozygote composite S/b
o
-thalassémique. Si le profil montre l’absence d’HbA et la présence d’HbF, d’HbS et d’un autre variant de l’hémoglobine, il s’agira alors d’une hétérozygotie composite SX. Dans ces deux situations, le cas sera signalé par le CRDN au Centre de référence (ou de compétence) de la drépanocytose géographiquement proche de l’adresse de résidence des parents afin que l’enfant soit convoqué,
via
la fiche d’identification d’un nouveau cas. Celle-ci mentionne les données d’identification de l’enfant concerné par la convocation (nom, prénom, date de naissance, terme de naissance, maternité de naissance), le résultat du dépistage, ainsi que les coordonnées de la famille (adresse, numéro de téléphone), reprises à partir des données du buvard réalisé à la maternité.
Si le profil montre la présence d’HbA et la présence d’HbF et d’HbS, il s’agira d’un hétérozygote AS. Le sujet sera alors considéré comme porteur sain. Cette information sera donnée à la famille avec l’explication des résultats, soit par courrier adressé au domicile des parents, soit dans le cadre d’une consultation. Un test de confirmation chez l’enfant doit être systématiquement réalisé au décours immédiat de la première consultation de dépistage, afin de confirmer le résultat du premier dépistage néonatal. Malgré la fiabilité des techniques utilisées, dont la sensibilité et la spécificité avoisinent les 100 %, une analyse de l’hémoglobine réalisée sur un nouveau prélèvement, permettra de poser définitivement le diagnostic. |
Les limites et difficultés du dépistage néonatal de la drépanocytose Les limites du ciblage
Une limite majeure du dépistage néonatal de la drépanocytose, tel qu’il est pratiqué en métropole, concerne le ciblage. Le dépistage ciblé, par opposition au dépistage universel, a comme conséquence principale le risque de ne pas dépister un nouveau-né malade, principalement parce que ses parents n’ont pas été identifiés comme personnes à risque. Cette identification peut être difficile en raison, par exemple, de l’imprécision des réponses données par les parents lors de leur interrogatoire quant à leurs origines géographiques, ou encore à cause du brassage croissant des populations. Quelques situations rendent également l’identification du risque complexe, comme au décours des procréations médicalement assistées. Le ciblage nécessite en outre une formation continue des professionnels de santé, notamment ceux opérant dans les maternités. Le ciblage peut également entraîner un sentiment de stigmatisation par les familles, motivant un refus du dépistage, une situation qui reste, par ailleurs, exceptionnelle (0,04 %, tous dépistages confondus) [
16
].
Une étude récente réalisée entre février et mai 2017 en région parisienne a ainsi montré que le dépistage ciblé était inadapté. En effet, 5 cas (7,5 %) de nouveau-nés atteints de syndrome drépanocytaire majeur et 155 nouveau-nés porteurs de trait AS/AC ont été diagnostiqués, alors qu’ils étaient considérés comme hors ciblage [
19
] (
→
).
(→) Voir la Nouvelle de M. Cavazzana
et al
.,
m/s
n° 4, avril 2018, page 309
Les faux négatifs
Outre ces enfants non dépistés par défaut de ciblage, certaines situations sont à l’origine d’authentiques faux négatifs, comme la grande prématurité, pour laquelle le dépistage est réalisé trop précocement. Celui-ci ne permet pas en effet de détecter les mutants d’hémoglobine qui sont, à ce moment, exprimés à des taux très bas, à la limite de détection des techniques utilisées. Un autre problème, plus fréquent, est lié à la transfusion de culots globulaires effectuée en période néonatale et
in utero
. Réalisée avant le prélèvement et en l’absence de signalement, celle-ci va fausser le résultat, montrant la présence d’hémoglobine adulte normale, mais qui est en fait d’origine transfusionnelle. Dans ces deux situations, l’étude de l’hémoglobine doit être renouvelée à distance. Une étude a ainsi révélé que 31 % des nouveau-nés transfusés n’étaient pas signalés à la naissance, et, qu’
a contrario
, 23 % des nouveau-nés signalés comme ayant été transfusés ne l’étaient pas avec des produits globulaires (transfusion de plaquettes, plasma frais congelé, etc.) [
20
].
Les faux positifs En pratique, les situations d’annonce de syndrome drépanocytaire majeur sans conséquence clinique sont très rares. C’est le cas lorsqu’il existe une coexistence d’un variant génétique entraînant la persistance de l’hémoglobine fœtale chez des patients par ailleurs porteurs d’un syndrome drépanocytaire majeur. La PHHF (persistance héréditaire d’hémoglobine fœtale) est une anomalie d’origine génétique héréditaire, au cours de laquelle les gènes codant la chaîne γ demeurent actifs au cours de la vie adulte, avec une production continue d’HbF. La persistance d’un taux élevé d’HbF va ainsi protéger le sujet des conséquences délétères de l’HbS. Par ailleurs, de rares variants (Hope, HbK Woolwich, etc.) associés au variant S ne sont également pas exprimés à des taux détectables à la naissance. Ils donnent ainsi lieu faussement à un profil FS. Les perdus de vue
Pour la convocation du nouveau-né et de ses parents afin de réaliser le test de confirmation, les coordonnées relevées par la maternité au moment de l’accouchement de la mère sont utilisées. Diverses causes peuvent compromettre la convocation de l’enfant, d’autant qu’une fraction significative des familles se trouve en situation précaire ou irrégulière : erreur sur le numéro de téléphone ou l’adresse, changement de numéro de téléphone portable, déménagement, adresse de domiciliation administrative et non réelle. En pratique, chaque année, malgré de nombreuses relances réalisées par la filière de soin, les centres de PMI (protection maternelle et infantile) ou par la maternité de naissance, des nouveau-nés dépistés avec un syndrome drépanocytaire majeur ne sont pas intégrés dans le circuit de prise en charge. Sur la période 2006-2010, par exemple, 43 nouveau-nés, sur un total de 1 801 dépistés, ont été perdus de vue juste après le dépistage néonatal [
21
].
|
La prise en charge des nouveau-nés dépistés La convocation des familles Une fois le centre clinique averti de l’identification d’un nouveau cas de syndrome drépanocytaire majeur, la première étape consiste à convoquer la famille du nouveau-né sur la base des coordonnées postales et téléphoniques notées sur la fiche de dépistage. Ce premier contact est assuré, selon les équipes, soit par un secrétariat médical, soit par une infirmière coordinatrice, soit encore par un médecin, dans les deux mois suivant la naissance et, idéalement, très peu de temps avant le rendez-vous réel, de manière à réduire le temps d’attente (et donc d’anxiété) de la famille entre l’appel et le rendez-vous. Cette étape est délicate et nécessite un personnel formé. Elle s’appuie essentiellement sur l’annonce d’un résultat qu’il est nécessaire de contrôler au cours d’une nouvelle consultation, sans délivrer de diagnostic. L’annonce diagnostique La consultation d’annonce diagnostique d’un syndrome drépanocytaire majeur nécessite un praticien, ou une équipe de praticiens, expert(s). Elle se déroule généralement en deux phases, avec deux consultations rapprochées dans le temps. Il s’agit en effet d’annoncer à une famille une maladie génétique chronique, potentiellement sévère, pouvant toucher toute la filiation, tout en inscrivant l’enfant dans un projet de vie. Il s’agit là d’un moment fondateur dans la relation entre médecin et malade, scellant très fréquemment une alliance thérapeutique qui va conditionner l’avenir. Compte tenu des différences culturelles et des conditions socio-économiques fréquemment défavorables des familles, la barrière de langue ainsi que la représentation culturelle de la maladie peuvent constituer des écueils notables. Selon les Centres de référence (ou de compétence), l’annonce sera réalisée, initialement ou secondairement, en présence d’une psychologue ou d’une infirmière coordinatrice et, idéalement, d’un(e) traducteur(trice) quand le contact téléphonique a révélé des difficultés de compréhension de langage.
En pratique, au cours de la première consultation, est annoncée la très forte suspicion de drépanocytose. C’est l’occasion d’interroger les parents sur leur connaissance de la maladie et la représentation qu’ils en ont. La drépanocytose est, la plupart du temps, connue des familles, mais souvent sous un autre vocable. Les bases physiopathologiques de la maladie sont expliquées. Après un examen clinique complet, une confirmation biologique fondée sur l’étude de l’hémoglobine est pratiquée chez l’enfant, systématiquement complétée par un hémogramme, avec mesure du nombre de réticulocytes, et un bilan du fer, afin d’éliminer une carence susceptible d’influencer les paramètres hématologiques (microcytose [hématies de faibles tailles], taux réduit d’hémoglobine). Une recherche de déficit en glucose-6-phosphate déshydrogénase (G6PD), l’enzyme qui permet aux hématies de résister au stress oxydant, est généralement couplée à ce bilan initial, compte tenu de sa prévalence élevée dans les populations à risque de drépanocytose et afin de mettre en place précocement les mesures de prévention nécessaires. Enfin, une demande de détermination de groupe sanguin avec phénotype étendu est réalisée, afin d’identifier précocement un groupe sanguin rare associé à la drépanocytose [
22
].
Il est recommandé de compléter l’étude de l’hémoglobine de l’enfant par celle de l’hémoglobine de ses parents, de manière à distinguer les formes homozygotes SS et S/b
o
-thalassémiques, qui présentent un profil biologique identique au dépistage, et de confirmer le statut de couple à risque pour des grossesses ultérieures. Il est aussi souvent très intéressant, dans cette maladie autosomique récessive, de pouvoir expliquer le mode de transmission à travers le statut des deux parents, statut hérité de la génération précédente (et ainsi de suite) pour alléger la culpabilité parentale, notamment maternelle. Le risque de récurrence à chaque grossesse (de 1 sur 4) est ainsi expliqué
3
. C’est aussi l’occasion d’étendre le dépistage à la fratrie, le cas échéant, et d’inciter à un dépistage plus large dans la famille. En cas d’impossibilité de pratiquer une détection par électrophorèse chez les deux parents, il est proposé une analyse génétique moléculaire des mutations du gène codant la b-globine chez l’enfant, pour caractériser pleinement le syndrome drépanocytaire majeur. Il est généralement pratiqué simultanément une analyse des gènes codant la chaîne a, afin de chercher une ou plusieurs délétions qui peuvent influencer le profil de sévérité de la drépanocytose.
La confirmation diagnostique Une seconde consultation rapprochée dans le temps, idéalement dans le mois qui suit la première, permet de confirmer le diagnostic et de débuter le traitement préventif (une antibioprophylaxie par pénicilline orale en 2 prises quotidiennes et une supplémentation en folates). Cette consultation va également permettre de s’assurer de la bonne compréhension des signes de surveillance et de répondre aux questions suscitées par le diagnostic. Des séances d’éducation thérapeutique peuvent être proposées. Les options thérapeutiques futures (hydroxycarbamide, transfusion, greffe de cellules souches hématopoïétiques, voire autres traitements innovants) peuvent être discutées. Le circuit de prise en charge et le circuit d’urgence sont définis. Le carnet de santé est complété pour que l’information circule entre les différents intervenants. La situation sociale de la famille est également abordée et, le cas échéant, la famille est adressée vers les services sociaux. Une demande de prise en charge par l’Assurance maladie au titre d’affection de longue durée (ALD) est systématiquement complétée. |
Les bénéfices du dépistage néonatal de la drépanocytose État de santé des enfants dépistés
Bien qu’il n’existe pas d’étude randomisée évaluant le bénéfice du dépistage néonatal de la drépanocytose, de nombreuses études observationnelles en ont démontré l’impact positif sur le pronostic de la maladie [
23
]. Associé à un tissu sanitaire et social organisé, le dépistage néonatal de cette maladie permet en effet d’instaurer précocement des mesures prophylactiques et d’aider les parents à reconnaître les symptômes des complications cliniques afin de consulter en urgence, le cas échéant.
La première mesure prophylactique instaurée vise à diminuer la susceptibilité aux infections par le pneumocoque, suite à la démonstration de l’efficacité d’une antibioprophylaxie quotidienne par la pénicilline, qui induit une très nette diminution d’infections invasives mortelles ou graves par cette bactérie [
24
]. Cette antibioprophylaxie est complétée par la vaccination anti-pneumococcique, avec une injection supplémentaire d’un vaccin polysaccharidique
4
à 2 ans. Depuis l’instauration de ces mesures, une diminution spectaculaire de l’incidence des infections invasives et de la mortalité due à une infection a été observée chez l’enfant drépanocytaire [
10
,
25
-
27
]. Une supplémentation en acide folique est également mise en place pour permettre une érythropoïèse adaptée à l’hémolyse chronique et éviter d’aggraver l’anémie chronique hémolytique par une carence en cette vitamine. L’éducation des parents à la surveillance des symptômes d’aggravation de l’anémie et à la consultation en urgence (notamment en cas de survenue de séquestration splénique aiguë) a permis une diminution majeure de la mortalité secondaire à cette complication (deuxième cause de mortalité précoce avant 5 ans).
Effectuée avant l’âge de deux ans, la mesure des vitesses de flux sanguin dans les gros troncs artériels cérébraux par écho-doppler transcrânien permet de détecter des rétrécissements vasculaires fonctionnels ou anatomiques et de prévenir la survenue d’accidents vasculaires cérébraux aux séquelles cognitives [
28
].
Globalement, la mortalité de la drépanocytose à l’âge pédiatrique a diminué régulièrement au cours des quatre dernières décennies, avec, à l’heure actuelle, 99 % des enfants atteignant l’âge adulte [
9
]. Aujourd’hui, la mortalité dans l’enfance est très proche de celle de la population pédiatrique générale [
10
,
11
]. À l’inverse, dans une étude portant sur les enfants dépistés dans le nord et l’est de l’Île-de-France, une absence de compliance au suivi médical et au traitement prophylactique a été associée à une surmortalité [
7
,
10
,
11
,
29
]. L’espérance de vie globale reste cependant diminuée et les complications se sont déplacées à l’âge adulte. C’est tout l’enjeu actuel de la prise en charge pédiatrique que d’empêcher ou de retarder la survenue de ces complications [
9
].
Le dépistage précoce de la maladie permet une intensification thérapeutique avant la survenue de lésions organiques irréversibles. Alors qu’un traitement de fond par hydroxycarbamide (un inhibiteur réversible de la ribonucléotide réductase) ou un traitement curatif par greffe de cellules souches hématopoïétiques était jusqu’à récemment réservé aux enfants très symptomatiques, une approche préventive précoce, fondée sur des essais randomisés, s’est développée [
30
]. Certaines équipes proposent désormais un traitement de fond par hydroxycarbamide à des enfants asymptomatiques, afin de diminuer autant que possible les lésions infra-cliniques de la maladie et retarder, de ce fait, les insuffisances organiques à l’âge adulte [
31
]. Les études futures permettront d’évaluer les bénéfices à l’âge adulte de cette approche, comparativement aux cohortes historiques.
Les autres bénéfices du dépistage néonatal de la drépanocytose
Le dépistage néonatal de la drépanocytose permet l’identification de nouveau-nés hétérozygotes. En France, en 2019 par exemple, 11 597 nouveau-nés hétérozygotes AS et 1 185 hétérozygotes SC ont été identifiés. Ces enfants hétérozygotes sont des porteurs sains et n’ont donc pas de bénéfice direct à avoir été dépistés. Selon les possibilités organisationnelles, le retour d’information du statut d’hétérozygote se fait soit par courrier, soit par consultation téléphonique ou présentielle. Parfois, ce retour d’information n’est pas réalisé, faute de personnel. Une étude a d’ailleurs évalué différentes stratégies pour ce retour d’information. Elle a démontré une meilleure efficacité d’un appel téléphonique suivi de rappels par messages, ce qui suppose du personnel entraîné et dédié [
32
].
Le dépistage néonatal de la drépanocytose permet également la mise en évidence d’autres hémoglobinopathies sévères, telles que les syndromes a- et b-thalassémiques, qui sont des anomalies quantitatives de production des chaînes d’a- ou b-globine, nécessitant également une prise en charge spécialisée. À titre d’exemple, en 2017, 8 syndromes β-thalassémiques ont été identifiés. |
Le dépistage néonatal de la drépanocytose : des pistes d’amélioration
Si le dépistage néonatal a considérablement amélioré le pronostic de la drépanocytose partout où il a été mis en œuvre, plusieurs difficultés subsistent. Le ciblage est actuellement la principale difficulté. D’abord, le défaut de ciblage que l’on constate va nécessairement augmenter en fonction de l’accroissement du métissage de la population. Ensuite, ce ciblage des patients à détecter repose sur une discrimination ethnique qui peut être discutable sur le plan éthique. Enfin, compte tenu de l’augmentation de l’incidence de la drépanocytose, le rapport coût/bénéfice est maintenant en défaveur du ciblage [
19
]. Une généralisation du dépistage néonatal de la drépanocytose à l’ensemble des nouveau-nés permettrait une simplification du processus. Elle répondrait aux recommandations des experts français et européens, et faciliterait la reconnaissance de la drépanocytose comme un problème de santé publique en France, ce d’autant que la prévalence augmente chaque année. À titre de comparaison, le Royaume-Uni, dont la population atteinte de drépanocytose est comparable en taille à celle de la France, pratique depuis 2008 un dépistage universel. Le dépistage universel étendu à tous les nouveau-nés apparaît dorénavant comme une nécessité en France métropolitaine.
Les familles à risque de drépanocytose sont, en métropole, fréquemment des migrants de première génération. Elles sont également souvent défavorisées sur le plan socio-économique, voire en grande précarité [
11
]. Si le dépistage permet justement d’inscrire certaines familles précaires dans des circuits de prise en charge médicale, celle-ci nécessite aussi la contribution de travailleurs sociaux, généralement insuffisamment nombreux pour assurer cette tâche. Pour une prise en charge médicale optimale, il est par ailleurs indispensable, parfois, de comprendre les représentations culturelles de la drépanocytose, variables selon les pays ou les ethnies, en faisant appel à des traducteurs ou des médiateurs transculturels. Ceux-ci sont très peu nombreux et leur contribution n’est pas prise en charge.
Enfin, le retour d’information sur le statut d’hétérozygote d’un nouveau-né dépisté est, par endroits, défaillant. Il existe en effet une grande hétérogénéité sur le territoire quant aux modalités d’information des familles sur le statut hétérozygote de leur enfant, conséquence de la grande disparité nationale de la fréquence de l’hétérozygotie, qui nécessiterait, dans les régions de très grande prévalence, du personnel dédié au retour de cette information. Cette information est indispensable pour que les familles connaissent le risque de transmission à la génération suivante. Ce retour d’information est aussi et surtout l’opportunité de promouvoir une information essentielle en termes de santé publique. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Sundd
P
,
Gladwin
MT
,
Novelli
EM
.
Pathophysiology of Sickle Cell Disease.
.
Annu Rev Pathol.
2019;
;
14
:
:263.
–
292
.
2.
Ware
RE
,
de Montalembert
M
,
Tshilolo
L
.
et al.
Sickle cell disease.
.
Lancet.
2017;
;
390
:
:311.
–
323
.
3.
Maier-Redelsperger
M
,
Noguchi
CT
,
de Montalembert
M
.
et al.
Variation in fetal hemoglobin parameters and predicted hemoglobin S polymerization in sickle cell children in the first two years of life: Parisian Prospective Study on Sickle Cell Disease.
.
Blood.
1994;
;
84
:
:3182.
–
3188
.
4.
Brousse
V
,
Buffet
P
,
Rees
D
.
The spleen and sickle cell disease: the sick(led) spleen.
.
Br J Haematol.
2014;
;
166
:
:165.
–
176
.
5.
Wilson
JM
,
Jungner
YG
.
Principles and practice of mass screening for disease.
.
Bol Oficina Sanit Panam.
1968;
;
65
:
:281.
–
393
.
6.
Grosse
SD
,
Odame
I
,
Atrash
HK
.
et al.
Sickle cell disease in Africa: a neglected cause of early childhood mortality.
.
Am J Prev Med.
2011;
;
41
:
:S398.
–
S405
.
7.
Lee
A
,
Thomas
P
,
Cupidore
L
.
et al.
Improved survival in homozygous sickle cell disease: lessons from a cohort study.
.
BMJ.
1995;
;
311
:
:1600.
–
1602
.
8.
Telfer
P
,
Coen
P
,
Chakravorty
S
.
et al.
Clinical outcomes in children with sickle cell disease living in England: a neonatal cohort in East London.
.
Haematologica.
2007;
;
92
:
:905.
–
912
.
9.
Quinn
CT
,
Rogers
ZR
,
McCavit
TL
.
et al.
Improved survival of children and adolescents with sickle cell disease.
.
Blood.
2010;
;
115
:
:3447.
–
3452
.
10.
Desselas
E
,
Thuret
I
,
Kaguelidou
F
,
et al.
Mortality in children with sickle cell disease in mainland France from 2000 to 2015.
.
Haematologica.
2020;
,
105
:
:e440.
–
e443
.
11.
Couque
N
,
Girard
D
,
Ducrocq
R
.
et al.
Improvement of medical care in a cohort of newborns with sickle-cell disease in North Paris: impact of national guidelines.
.
Br J Haematol.
2016;
;
173
:
:927.
–
937
.
13.
Taylor
SM
,
Parobek
CM
,
Fairhurst
RM
.
Haemoglobinopathies and the clinical epidemiology of malaria: a systematic review and meta-analysis.
.
Lancet Infect Dis.
2012;
;
12
:
:457.
–
468
.
14.
Tsevat
J
,
Wong
JB
,
Pauker
SG
,
Steinberg
MH
.
Neonatal screening for sickle cell disease: a cost-effectiveness analysis.
.
J Pediatr.
1991;
;
118
:
:546.
–
554
.
15.
Haute Autorité de Santé.
.
Dépistage néonatal de la drépanocytose en France, rapport d’orientation.
.
Saint-Denis:
:
HAS;
,
2013
.
17.
Lobitz
S
,
Telfer
P
,
Cela
E
.
et al.
Newborn screening for sickle cell disease in Europe: recommendations from a pan-European consensus conference.
.
Br J Haematol.
2018;
;
183
:
:648.
–
660
.
18.
Detemmerman
L
,
Olivier
S
,
Bours
V
.
et al.
Innovative PCR without DNA extraction for African sickle cell disease diagnosis.
.
Hematology.
2018;
;
23
:
:181.
–
186
.
19.
Cavazzana
M
,
Stanislas
A
,
Rémus
C
.
et al.
Dépistage néonatal de la drépanocytose : des données en faveur de sa généralisation.
.
Med Sci (Paris).
2018;
;
34
:
:309.
–
311
.
20.
Allaf
B
,
Patin
F
,
Elion
J
.
et al.
New approach to accurate interpretation of sickle cell disease newborn screening by applying multiple of median cutoffs and ratios.
.
Pediat Blood Cancer.
2018;
;
65
:
:e27230.
.
21.
Brousse
V
,
Arnaud
C
,
Lesprit
E
,
et al.
Evaluation of outcomes and quality of care in children with sickle cell disease diagnosed by newborn screening: a real-world nation-wide study in France.
.
J Clin Med.
2019
;
:8.
.
22.
Haute Autorité de Santé.
.
Prise en charge de la drépanocytose chez l’enfant et l’adolescent.
.
Paris:
:
HAS;
,
2005
.
23.
Lees
C
,
Davies
SC
,
Dezateux
C
.
Neonatal screening for sickle cell disease.
.
Cochrane Database Syst Rev.
2000
. doi.org/
10.1002/14651858.CD001913
24.
Gaston
MH
,
Verter
JI
,
Woods
G
.
et al.
Prophylaxis with oral penicillin in children with sickle cell anemia. A randomized trial.
.
N Engl J Med.
1986;
;
314
:
:1593.
–
1599
.
25.
Vichinsky
E
,
Hurst
D
,
Earles
A
.
et al.
Newborn screening for sickle cell disease: effect on mortality.
.
Pediatrics.
1988;
;
81
:
:749.
–
755
.
26.
Streetly
A
,
Sisodia
R
,
Dick
M
.
et al.
Evaluation of newborn sickle cell screening programme in England: 2010–2016.
.
Arch Dis Child.
2018;
;
103
:
:648.
–
653
.
27.
Oligbu
G
,
Fallaha
M
,
Pay
L
.
et al.
Risk of invasive pneumococcal disease in children with sickle cell disease in the era of conjugate vaccines: a systematic review of the literature.
.
Br J Haematol.
2019;
;
185
:
:743.
–
751
.
28.
Bernaudin
F
,
Verlhac
S
,
Arnaud
C
.
et al.
Impact of early transcranial Doppler screening and intensive therapy on cerebral vasculopathy outcome in a newborn sickle cell anemia cohort.
.
Blood.
2011;
;
117
:
:1130.
–
1140
.
29.
Emond
AM
,
Collis
R
,
Darvill
D
.
et al.
Acute splenic sequestration in homozygous sickle cell disease: natural history and management.
.
J Pediatr.
1985;
;
107
:
:201.
–
206
.
30.
Wang
WC
,
Ware
RE
,
Miller
ST
.
et al.
Hydroxycarbamide in very young children with sickle-cell anaemia: a multicentre, randomised, controlled trial (BABY HUG).
.
Lancet.
2011;
;
377
:
:1663.
–
1672
.
31.
Yawn
BP
,
Buchanan
GR
,
Afenyi-Annan
AN
.
et al.
Management of sickle cell disease: summary of the 2014 evidence-based report by expert panel members.
.
JAMA.
2014;
;
312
:
:1033.
–
1048
.
32.
Rémus
C
,
Stanislas
A
,
Bouazza
N
,
et al.
An evaluation of three ways of communicating carrier status results to the parents of children in a neonatal sickle cell screening programme.
.
Front Pediatr.
2020;
;
8
:
:300.
.
|