| |
| Med Sci (Paris). 37(5): 547–549. doi: 10.1051/medsci/2021049.
Récepteur 5-HT
6
et mTOR
Un couple hyperactif dans la douleur neuropathique Stéphane Doly,1 Pierre-Yves Martin,1 and Christine Courteix1* 1Université Clermont Auvergne, Inserm U1107, Neuro-Dol
,
28 place Henri-Dunant
,
63000Clermont-Ferrand
,
France
.
MeSH keywords: Dysfonctionnement cognitif, Humains, Névralgie, Récepteurs sérotoninergiques, Agents sérotoninergiques, Sérine-thréonine kinases TOR, étiologie, métabolisme, traitement médicamenteux, effets des médicaments et substances chimiques, pharmacologie |
Les douleurs neuropathiques constituent un groupe hétérogène de douleurs chroniques consécutives à une maladie (ou une lésion) affectant le système nerveux somato-sensoriel [
1
]. Elles touchent 7 à 10 % de la population générale [
2
,
3
]. Elles sont persistantes ou récurrentes, et ne sont généralement pas améliorées par le traitement de la maladie sous-jacente, ou même par sa guérison. Elles se caractérisent par une perception aberrante de douleur spontanée ou provoquée, comme l’hyperalgie
1,
et l’allodynie
2
, et sont souvent associées à des comorbidités cognitives [
4
]. La prise en charge thérapeutique de ces douleurs est difficile, par manque d’efficacité des médicaments de référence et par leurs effets indésirables, qu’il s’agisse des antidépresseurs tricycliques, des antidépresseurs inhibiteurs de la recapture de la noradrénaline et de la sérotonine, ou de la gabapentine, qui inhibe spécifiquement certains canaux calciques [
5
]. La sérotonine est un neurotransmetteur impliqué dans la modulation de la douleur et dans de nombreuses autres fonctions, comme le contrôle de l’appétit, du sommeil, de l’humeur… La sérotonine libérée par des neurones du bulbe ventro-médian rostral projetant leurs axones sur la corne dorsale de la moelle épinière exerce un effet modulateur sur la transmission du message douloureux. Elle agit en activant des récepteurs de la sérotonine exprimés par différents types de neurones, dont le récepteur 5-HT
6
. Ce récepteur métabotrope (couplé aux protéines G) est exprimé par des interneurones excitateurs situés dans une région s’étendant de la couche II interne à la couche IV de la corne dorsale de la moelle épinière, correspondant à la zone de projection des mécanorécepteurs à bas seuil d’excitation (
low-threshold mechanoreceptor-recipient zone
) impliqués dans la perception tactile [
6
]. Des travaux antérieurs ont montré que le récepteur 5-HT
6
interagit avec des protéines de la voie mTOR (
mammalian target of rapamycin
) pour modifier les fonctions cognitives dans des modèles neuro-développementaux de schizophrénie [
7
], et qu’il possède une activité constitutive sur la voie de signalisation de l’AMPc (adénosine monophosphate cyclique)
in vitro
[
8
]. L’activité constitutive du récepteur 5-HT
6
des neurones spinaux et ses conséquences sur la voie de signalisation mTOR n’avaient cependant pas été explorées dans un contexte de douleur neuropathique.
|
L’activité constitutive du récepteur 5-HT6 participe à la douleur neuropathique
Pour étudier le rôle physiopathologique du récepteur 5-HT
6
dans la douleur neuropathique et les comorbidités cognitives associées, nous avons utilisé des agonistes inverses et des antagonistes neutres de ce récepteur
3
dans deux modèles différents de douleur neuropathique chez le rat, où elle est induite soit par la ligature de la racine L5 du nerf spinal, soit par l’injection d’un agent anticancéreux, l’oxaliplatine. Ces deux modèles permettent de mimer les neuropathies traumatiques ou iatrogènes chimio-induites, et de reproduire les symptômes douloureux qui les accompagnent. Une fois la neuropathie douloureuse installée, nous avons traité les animaux avec un agoniste inverse du récepteur 5-HT
6
(SB258585) par voie intrapéritonéale. Nous avons alors observé une nette diminution des symptômes de la douleur induite par le toucher (allodynie tactile) ou le froid (allodynie thermique), ainsi qu’une diminution des déficits cognitifs (mémoire de reconnaissance sociale et mémoire épisodique). En revanche, nous n’avons observé aucun effet des antagonistes neutres du récepteur 5-HT
6
(IIQ ou CPPQ) chez ces rats neuropathiques. Le ligand agoniste inverse n’avait par ailleurs aucun effet antalgique sur la nociception mécanique induite par pression de la patte chez des animaux sains [
9
]. L’ensemble de ces résultats indiquait l’existence d’une activité constitutive du récepteur 5-HT
6
, indépendante de la sérotonine endogène, dans un contexte de douleur neuropathique de cause traumatique ou toxique.
|
Les agonistes inverses du récepteur 5-HT6 réduisent la douleur neuropathique et les troubles cognitifs associés
Une fois démontrée l’activité spontanée du récepteur 5-HT
6
in vivo
, nous avons conçu et breveté un nouvel agoniste inverse (PZ-1388) bloquant cette activité. Lorsqu’elle est administrée par voie intrapéritonéale chez l’animal neuropathique, cette molécule a un effet anti-allodynique rapide et prolongé sur les symptômes d’hypersensibilité tactile et thermique. Parallèlement à l’amélioration de ces symptômes, nous avons observé une amélioration des déficits cognitifs après injection intrapéritonéale ou intrathécale de la molécule. Pour savoir si cet effet était dû à un effet pro-cognitif propre de la molécule, ou s’il était consécutif à la diminution des symptômes douloureux, nous avons utilisé des rats sains chez lesquels un déficit cognitif a été induit par la phencyclidine (un psychotrope dissociatif), et nous avons comparé les effets d’une administration intrathécale ou intrapéritonéale des agonistes inverses du récepteur 5-HT
6
sur le déficit cognitif de ces rats : alors que l’injection intrapéritonéale de l’agoniste inverse améliorait les troubles cognitifs induits par la phencyclidine, l’injection intrathécale n’avait pas d’effet [
9
]. De l’absence d’efficacité de cette voie d’injection sur les structures cérébrales impliquées dans la cognition, nous avons conclu que l’effet de l’agoniste inverse sur les déficits cognitifs associés aux douleurs neuropathiques dépend de son effet antalgique sous-tendu par le blocage des récepteurs 5‑HT
6
spinaux. En utilisant des souris transgéniques exprimant le récepteur 5-HT
6
couplé à une protéine fluorescente, nous avons d’ailleurs confirmé la présence de ce récepteur dans les neurones de la moelle épinière dorsale et avons montré sa localisation dans le cil primaire de ces neurones [
9
].
|
L’activité constitutive du récepteur 5-HT6 active la voie de signalisation mTOR
L’engagement de la voie mTOR par le récepteur 5-HT
6
[
7
] et l’implication de mTOR dans la douleur neuropathique [
10
] nous ont conduits à rechercher si l’activité constitutive du récepteur 5-HT
6
était à l’origine d’une activation de mTOR et contribuait à la pathogénie de la douleur neuropathique. Après avoir confirmé que la neuropathie douloureuse d’origine traumatique induisait une activation de mTOR dans la moelle épinière dorsale ipsilatérale (du même côté) à la lésion, nous avons montré que l’administration intrapéritonéale d’agonistes inverses du récepteur 5-HT
6
réduisait l’activité de la voie de signalisation mTOR comme le faisait la rapamycine, un inhibiteur de mTOR. L’administration de rapamycine a également amélioré l’allodynie induite par la neuropathie et les déficits de reconnaissance sociale et de discrimination d’un nouvel objet
(
Figure 1
)
[
9
].
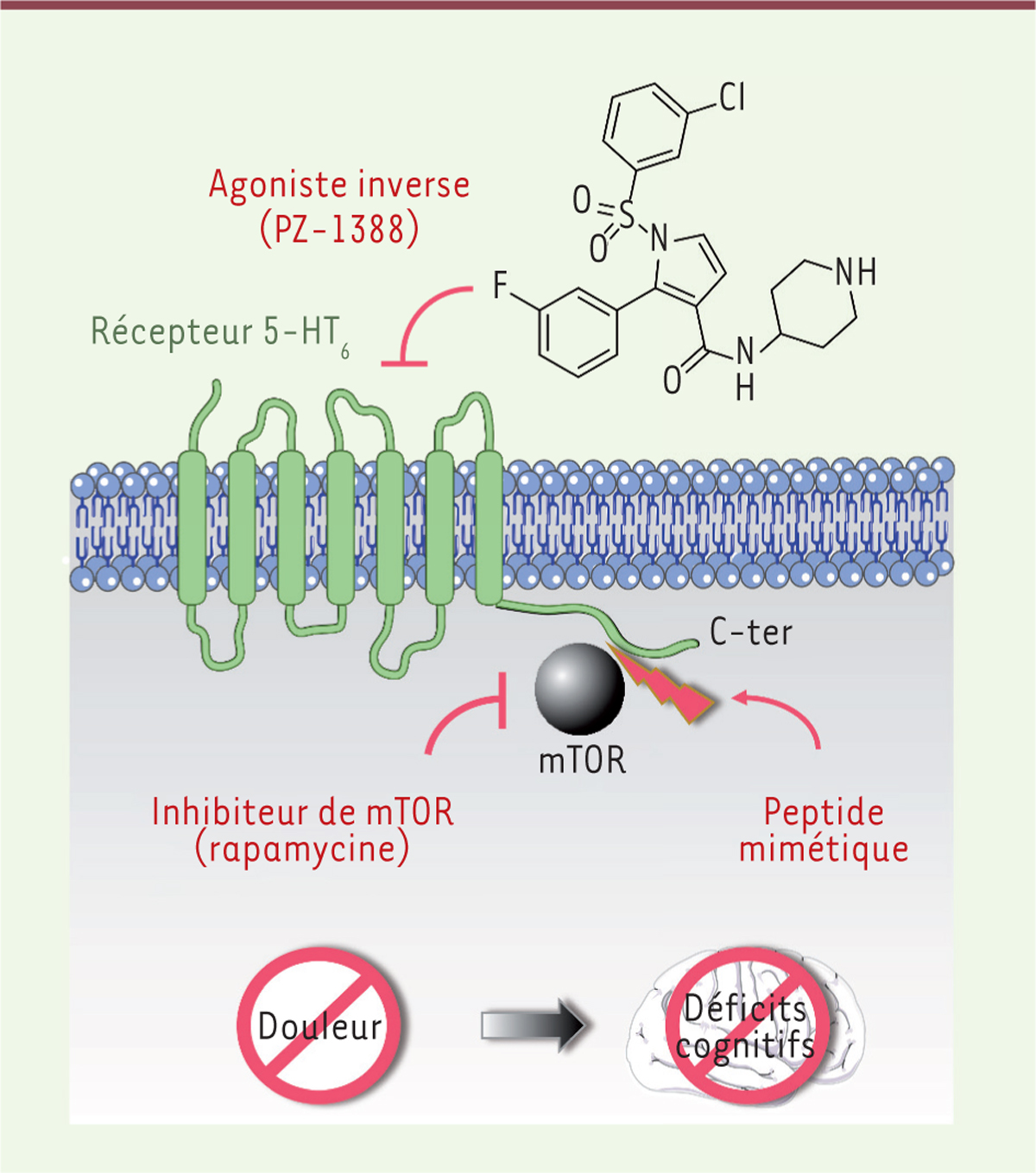
 | Figure 1.
Activation de mTOR dépendante de l’activité constitutive du récepteur 5-HT6 de la sérotonine : implication dans la douleur neuropathique et les déficits cognitifs associés.
Dans un contexte de neuropathie douloureuse, le récepteur 5-HT6 des neurones spinaux présente une activité constitutive se traduisant par l’activation de la protéine mTOR (mammalian target of rapamycin), avec laquelle il interagit physiquement par son extrémité carboxy-terminale (C-ter). Le blocage de cette voie de signalisation avec un agoniste inverse du récepteur 5-HT6 (PZ-1388), avec un inhibiteur de mTOR (rapamycine), ou avec un peptide mimétique supprimant l’interaction entre le récepteur 5-HT6 et mTOR, améliore la douleur et les déficits cognitifs associés.
|
L’identification de la séquence C-terminale du récepteur 5-HT
6
interagissant avec la protéine mTOR a permis de produire un peptide capable de supprimer l’interaction physique du récepteur avec mTOR. Cette stratégie peptido-mimétique, dont l’efficacité de découplage a été vérifiée
in vitro
, s’est révélée analgésique
in vivo
puisque l’administration intrathécale de ce peptide a considérablement réduit l’allodynie tactile et les troubles cognitifs
(
Figure 1
)
[
9
].
|
Ces travaux ont permis de montrer le rôle crucial de l’activité constitutive (indépendante de la sérotonine endogène) du récepteur 5-HT
6
de la sérotonine dans les douleurs neuropathiques de différentes causes, et l’intérêt thérapeutique d’agonistes inverses de ce récepteur. Ils ont révélé que l’activité constitutive du récepteur 5-HT
6
s’accompagne de l’activation d’une voie de signalisation non canonique, la voie mTOR, et suggèrent une nouvelle stratégie pharmacologique fondée sur la possibilité de découpler le récepteur 5-HT
6
et mTOR.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Ce travail a été financé par l’Agence nationale de la recherche (ANR-19-CE18-0018), le programme Investissements d’avenir (16-IDEX-0001 CAP20-25) et la région Auvergne-Rhône-Alpes.
|
Footnotes |
1.
Treede
R-D
,
Jensen
TS
,
Campbell
JN
,
et al.
Neuropathic pain: redefinition and a grading system for clinical and research purposes.
.
Neurology.
2008;
;
70
:
:1630.
–
1635
.
2.
Bouhassira
D
,
Lantéri-Minet
M
,
Attal
N
,
et al.
Prevalence of chronic pain with neuropathic characteristics in the general population.
.
Pain.
2008;
;
136
:
:380.
–
387
.
3.
Chenaf
C
,
Delorme
J
,
Delage
N
,
et al.
Prevalence of chronic pain with or without neuropathic characteristics in France using the capture-recapture method: a population-based study.
.
Pain.
2018;
;
159
:
:2394.
–
2402
.
4.
Radat
F
,
Margot-Duclot
A
,
Attal
N
.
Psychiatric co-morbidities in patients with chronic peripheral neuropathic pain: a multicentre cohort study.
.
Eur J Pain.
2013;
;
17
:
:1547.
–
1557
.
5.
Finnerup
NB
,
Attal
N
,
Haroutounian
S
,
et al.
Pharmacotherapy for neuropathic pain in adults: a systematic review and meta-analysis.
.
Lancet Neurol.
2015;
;
14
:
:162.
–
173
.
6.
Abraira
VE
,
Kuehn
ED
,
Chirila
AM
,
et al.
The cellular and synaptic architecture of the mechanosensory dorsal horn.
.
Cell.
2017;
;
168
:
(295–310)
:e19.
.
7.
Meffre
J
,
Chaumont-Dubel
S
,
Mannoury la Cour
C
,
et al.
5-HT
6
receptor recruitment of mTOR as a mechanism for perturbed cognition in schizophrenia
.
.
EMBO Mol Med.
2012;
;
4
:
:1043.
–
1056
.
8.
Deraredj Nadim
W
,
Chaumont-Dubel
S
,
Madouri
F
,
et al.
Physical interaction between neurofibromin and serotonin 5-HT
6
receptor promotes receptor constitutive activity
.
.
Proc Natl Acad Sci USA.
2016;
;
113
:
:12310.
–
5
.
9.
Martin
PY
,
Doly
S
,
Hamieh
AM
,
et al.
mTOR activation by constitutively active serotonin6 receptors as new paradigm in neuropathic pain and its treatment.
.
Prog Neurobiol.
2020;
;
193
:
:101846.
.
10.
Duan
Z
,
Li
J
,
Pang
X
,
et al.
Blocking mammalian target of rapamycin (mTOR) alleviates neuropathic pain induced by chemotherapeutic Bortezomib.
.
Cell Physiol Biochem.
2018;
;
48
:
:54.
–
62
.
|