| |
| Med Sci (Paris). 37(6-7): 575–577. doi: 10.1051/medsci/2021068.Combattre l’accident vasculaire cérébral en inhibant une enzyme liée à la voie de synthèse des polyamines Nicolas Blondeau1* 1Université Côte d’Azur, CNRS, UMR 7275 IPMC
,
660 route des Lucioles, Sophia-Antipolis
,
06560Valbonne
,
France MeSH keywords: Voies de biosynthèse, Humains, Polyamines, Accident vasculaire cérébral, métabolisme |
L’accident vasculaire cérébral (AVC), par sa fréquence et sa gravité, constitue un fardeau économique et humain pour nos sociétés [
1
] (
→
).
(→) Voir la Synthèse de Y. Béjot
et al
.,
m/s
n° 8-9, août-septembre 2009, page 727
L’AVC ischémique, forme la plus fréquente (plus de 70 %), est consécutif à l’occlusion d’une artère intracrânienne par un thrombus, qui provient généralement de la circulation sanguine, mais qui peut aussi, plus rarement, se former
in situ
. Pour limiter les dommages neuronaux et les séquelles fonctionnelles d’un AVC ischémique, l’objectif prioritaire est de restaurer la perfusion cérébrale le plus rapidement et le plus complètement possible afin de limiter l’extension de la mort cellulaire (nécrose) ischémique. Malheureusement, la plupart des individus victimes d’un AVC ne peuvent pas bénéficier des thérapies médicamenteuses ou mécaniques de « reperfusion » tissulaire visant à rétablir le flux sanguin dans les artères concernées. D’où l’importance de rechercher des thérapies alternatives neuroprotectrices contre les effets délétères de l’ischémie cérébrale.
|
Un concept novateur pour découvrir de nouvelles cibles thérapeutiques contre l’AVC
Au cours des dernières décennies, plus de 200 essais cliniques ont évalué l’efficacité de différents candidats neuroprotecteurs dans l’AVC ischémique, mais sans succès pour presque tous [
2
]. Les sociétés pharmaceutiques se sont alors désengagées durablement des essais cliniques et de la recherche préclinique sur l’AVC. L’idée à l’origine de notre projet de recherche préclinique était de chercher une nouvelle cible thérapeutique, non pas spécifique des neurones, mais plutôt à l’intersection de différents modèles expérimentaux, ayant fait indépendamment la preuve de leur efficacité, pour identifier de nouveaux couples cible/médicament qui n’ont pas encore d’applications cliniques.
Pour une telle stratégie, une des options est d’exploiter des résultats obtenus dans un organisme modèle. Nous nous sommes tournés vers la mouche drosophile, un modèle invertébré largement utilisé en génétique du développement. Le cerveau humain est certes très différent de celui d’une drosophile, mais le système cellulaire d’utilisation de l’oxygène comme source d’énergie et la réponse de ce système en situation d’hypoxie sont en revanche très conservés au cours de l’évolution [
3
]. Une autre option est d’utiliser une méthode de pré-conditionnement ischémique expérimental [
4
] (
→
) grâce auquel une tolérance à l’ischémie a pu être obtenue dans de multiples organes (cœur, rein, cerveau), indiquant que leurs types cellulaires respectifs possèdent un ou plusieurs systèmes d’autoprotection contre l’ischémie.
Chez la drosophile, Michel Tauc et ses collaborateurs ont identifié un lien entre la résistance à l’hypoxie et la voie de synthèse des polyamines [
5
], suggérant l’idée que cibler cette voie pourrait améliorer la tolérance d’un organe à l’hypoxie. De même, un lien entre concentration de polyamines élevée et ischémie cardiaque et cérébrale a été signalé dans des modèles murins [
6
,
7
]. Enfin,
in vitro
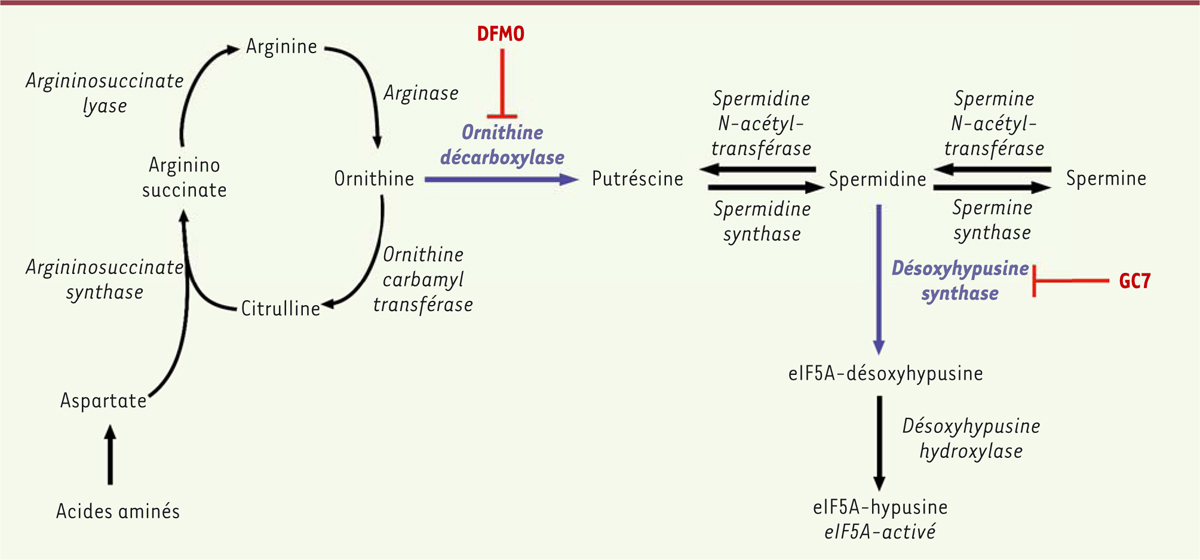
, l’inhibition pharmacologique de l’ornithine décarboxylase, enzyme de la première étape de biosynthèse des polyamines
(
Figure 1
)
, prolonge jusqu’à trois fois la survie des drosophiles soumises à une hypoxie chronique [
5
], et protège également les cultures cellulaires de cardiomyoblastes ou de neurones contre les effets délétères de l’ischémie [
8
].
(→) Voir la Synthèse de N. Blondeau et C. Heurteaux,
m/s
n° 12, décembre 2004, page 1109
 | Figure 1.
Schéma du cycle de l’urée, impliqué dans le catabolisme des acides aminés et conduisant à la synthèse de polyamines par catalyse enzymatique séquentielle et à l’activation par hypusination du facteur d’initiation de la traduction eIF5A.
|
Chez les eucaryotes, la voie de synthèse des polyamines produit la spermidine, qui permet l’activation par hypusination
1
du facteur d’initiation de la traduction eI5A, un facteur impliqué dans l’initiation de la traduction des ARN messagers, dans l’élongation des peptides synthétisés et dans leur terminaison, ainsi que dans la respiration mitochondriale [
9
]. L’hypusination de eI5A consiste en l’addition d’un résidu 4-aminobutyle, issu du clivage de la spermidine, sur le groupe e-amine d’une lysine spécifique (Lys50), suivie de l’hydroxylation de ce résidu. Elle est catalysée par deux enzymes : la désoxyhypusine synthase (DHS) et la désoxyhypusine hydroxylase (DHH)
(
Figure 1
)
. Le facteur eIF5A est le seul substrat connu de la DHS chez la drosophile et chez les mammifères. Nous avons d’abord recherché un possible effet bénéfique de l’inhibition de l’hypusination de eIF5A dans l’ischémie rénale, et avons ainsi montré qu’un traitement avec un inhibiteur spécifique de la DHS, le GC7 (N1-guanyl-1,7-diaminoheptane), protège les cellules rénales contre les effets délétères de l’anoxie
in vitro
et
in vivo
[
10
].
|
La perspective d’une cible thérapeutique innovante pour traiter l’accident ischémique cérébral
Nous avons alors cherché à savoir si le GC7 pouvait également avoir un effet protecteur en cas d’AVC ischémique. L’effet de l’inhibition de la DHS par le GC7 a d’abord été testé
in vitro
, en utilisant des cultures primaires de neurones corticaux, d’abord soumis à une privation d’oxygène et de glucose, puis confrontés à deux situations neurotoxiques également impliquées dans l’AVC : l’excitotoxicité du glutamate induite par la stimulation incontrôlée des récepteurs de ce neurotransmetteur excitateur, et le stress oxydant induit par la surproduction de radicaux libres. Dans tous les cas, le traitement avec du GC7 a entraîné une protection significative des neurones en culture [
11
].
Nous avons ensuite évalué l’effet anti-ischémique du GC7, administré selon différents protocoles
in vivo
, sur la survie neuronale
(
Figure 2A
)
et la récupération fonctionnelle spontanée
(
Figure 2B
)
après un AVC chez la souris. Un effet bénéfique sur ces deux paramètres a été obtenu même lorsque le GC7 est administré après le déclenchement de l’AVC, dans une fenêtre temporelle compatible avec la prise en charge des patients victimes d’un AVC. L’effet anti-ischémique du GC7 a également été observé, chez le porc, dans un modèle de transplantation rénale, qui comporte obligatoirement une période plus ou moins longue d’ischémie du transplant [
12
].
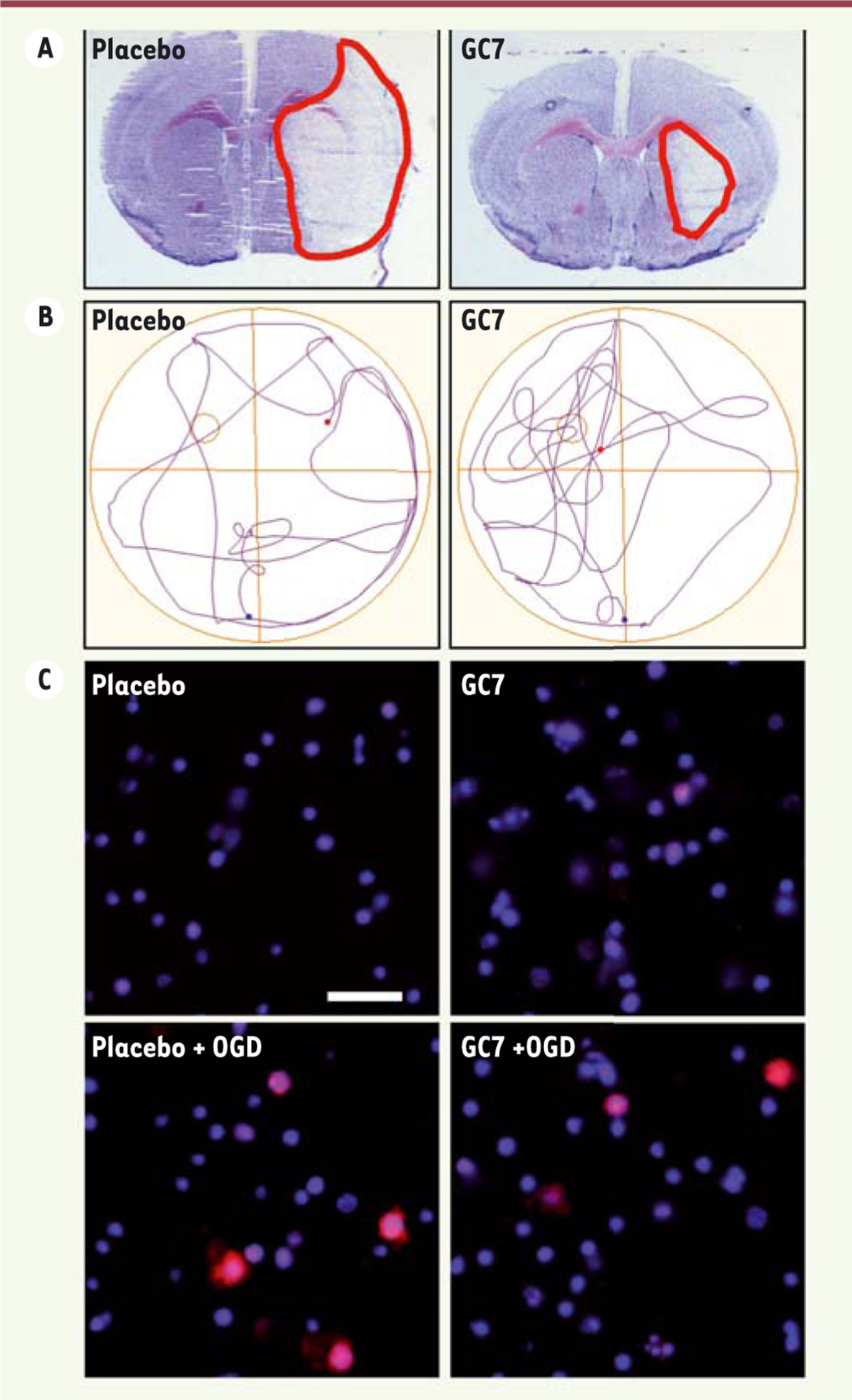
 | Figure 2.
L’inhibition de la désoxyhypusine synthase par le GC7 réduit la lésion cérébrale après un AVC ischémique et améliore la récupération fonctionnelle spontanée. A.
Un traitement par le GC7 réduit l’infarctus cérébral (délimité en rouge) induit par un AVC ischémique focal.
B.
Les souris traitées par le GC7 ont une meilleure récupération cognitive après un AVC. Chez les rongeurs, l’étude de la cognition se limite généralement à une évaluation de l’apprentissage et de la mémoire spatiale. Pour évaluer l’effet du post-traitement avec le GC7 sur la récupération cognitive des animaux après un AVC, le test le plus couramment utilisé est celui de la piscine de Morris, une piscine circulaire dans laquelle une plateforme est cachée par une eau opacifiée. L’animal « apprend », par entraînement, à retrouver la plateforme grâce aux indices visuels extérieurs placés autour de la piscine. Puis, pour évaluer la mémoire spatiale des animaux, ils sont de nouveau placés, 18 jours après l’AVC, dans la piscine dont la plateforme a été retirée, et un enregistrement des trajectoires de nage indique la capacité de la souris à se rappeler l’endroit où était placée la plateforme pendant la phase d’apprentissage post-AVC : si la souris se rappelle la position de la plateforme, sa trajectoire reflète une recherche focalisée sur le quadrant correspondant. La différence des trajectoires entre les souris traitées par un placebo et celles traitées par le GC7 indique un effet bénéfique du traitement sur la capacité de mémorisation des animaux après l’AVC.
C.
Dans un modèle d’AVC
in vitro
par privation de neurones en oxygène et en glucose (
oxygen-glucose deprivation
, OGD), le GC7 réduit la surproduction, par la mitochondrie, d’espèces réactives de l’oxygène (MitoSOX Red, en rouge), toxique pour la cellule. Les noyaux cellulaires sont colorés en bleu (colorant Hoechst marquant l’ADN). Barre d’échelle : 20 mm.
|
Au-delà de l’identification d’un nouveau couple cible/médicament dans l’AVC, notre étude apporte de nouvelles connaissances mécanistiques en identifiant la mitochondrie comme une cible principale des effets anti-ischémiques du GC7. Les résultats d’une étude récente suggèrent que le niveau d’activation de eIF5A orienterait le métabolisme cellulaire vers l’oxydation phosphorylante ou la glycolyse anaérobie et pourrait ainsi contrôler l’activité cellulaire [
9
]. Cette démonstration d’un lien étroit entre eIF5A et la chaîne respiratoire mitochondriale corrobore nos résultats montrant que le GC7 inhibe le cycle de Krebs tout en préservant la synthèse glycolytique de l’ATP [
10
]. Cette production d’ATP en dehors du cycle de Krebs, par la glycolyse anaérobie, permettrait à la cellule de subvenir à ses besoins essentiels en énergie lorsque l’apport en oxygène est réduit, et pourrait donc être bénéfique dans des conditions ischémiques. De plus, la mitochondrie, par l’intermédiaire de sa chaîne respiratoire, est responsable de la quasi-totalité de la production cellulaire des espèces réactives de l’oxygène, très réactives, et qui endommagent aussi bien les lipides que les protéines ou que l’ADN [
13
]. Leur production excessive et dérégulée au cours d’un AVC conduit à des dégâts cellulaires responsables d’un dysfonctionnement ou de la mort des cellules. Nous avons montré que le GC7 augmente la résistance de la mitochondrie à l’excitotoxicité [
11
] et qu’il réduit la surproduction cytotoxique des espèces réactives de l’oxygène lors d’un AVC
(
Figure 2C
)
. Ainsi, les différents effets du GC7 sur la mitochondrie concourent à augmenter la résistance cellulaire à l’ischémie.
Nous avons donc montré l’intérêt de cibler l’axe polyamine-eIF5A-hypusine avec le GC7 pour limiter les conséquences d’un AVC. Cette découverte ouvre une perspective thérapeutique nouvelle de recherche d’autres cibles moléculaires en rapport avec l’activation de eIF5A contre l’AVC, d’autant plus que la voie de synthèse des polyamines a déjà fait l’objet d’un développement de modulateurs pharmacologiques pour traiter d’autres maladies, notamment en cancérologie [
14
] (
→
).
(→) Voir la Synthèse de V. Catros-Quemener
et al
.,
m/s
n° 10, octobre 1999, page 1078
|
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
L’auteur remercie P. Lebrun pour sa relecture attentive du manuscrit, et tous les co-auteurs de l’article original [
11
], particulièrement M. Tauc pour son soutien constant. Ces travaux de recherche ont été financés par la Fondation pour la recherche médicale (FRM, DPM 20121125559) et la Société d’accélération de transfert de technologie (ValorPACA/SATT Sud-Est).
|
Footnotes |
1.
Béjot
Y
,
Touzé
E
,
Jacquin
A
,
et al.
Épidémiologie des accidents vasculaires cérébraux.
.
Med Sci (Paris).
2009;
;
25
:
:727.
–
732
.
2.
O’Collins
VE
,
Macleod
MR
,
Donnan
GA
,
et al.
1,026 experimental treatments in acute stroke.
.
Ann Neurol.
2006;
;
59
:
:467.
–
477
.
3.
Zhou
D
,
Haddad
GG
Genetic analysis of hypoxia tolerance and susceptibility in Drosophila and humans.
.
Annu Rev Genom Hum Genet.
2013;
;
14
:
:25.
–
43
.
4.
Blondeau
N
,
Heurteaux
C
La tolérance cérébrale : un choix prometteur vers de nouvelles thérapies contre les maladies neurologiques.
.
Med Sci (Paris).
2004;
;
20
:
:1109.
–
1114
.
5.
Vigne
P
,
Tauc
M
,
Frelin
C
Strong dietary restrictions protect Drosophila against anoxia/reoxygenation injuries.
.
PLoS One.
2009;
;
4
:
:e5422.
.
6.
Longo
LD
,
Packianathan
S
,
McQueary
JA
,
et al.
Acute hypoxia increases ornithine decarboxylase activity and polyamine concentrations in fetal rat brain.
.
Proc Natl Acad Sci USA.
1993;
;
90
:
:692.
–
696
.
7.
Zhao
YJ
,
Xu
CQ
,
Zhang
WH
,
et al.
Role of polyamines in myocardial ischemia/reperfusion injury and their interactions with nitric oxide.
.
Eur J Pharmacol.
2007;
;
562
:
:236.
–
246
.
8.
Babu
GN
,
Sailor
KA
,
Beck
J
,
et al.
Ornithine decarboxylase activity in in vivo and in vitro models of cerebral ischemia.
.
Neurochem Res.
2003;
;
28
:
:1851.
–
1857
.
9.
Puleston
DJ
,
Buck
MD
,
Klein Geltink
RI
,
et al.
Polyamines and eIF5A hypusination modulate mitochondrial respiration and macrophage activation.
.
Cell Metab.
2019;
;
30
:
:352.
–
363
.
10.
Melis
N
,
Rubera
I
,
Cougnon
M
,
et al.
Targeting eIF5A hypusination prevents anoxic cell death through mitochondrial silencing and improves kidney transplant outcome.
.
J Am Soc Nephrol.
2017;
;
28
:
:811.
–
822
.
11.
Bourourou
M
,
Gouix
E
,
Melis
N
,
et al.
Inhibition of eIF5A hypusination pathway as a new pharmacological target for stroke therapy.
.
J Cereb Blood Flow Metab.
2020
. doi :
10.1177/0271678X20928882
.
12.
Giraud
S
,
Kerforne
T
,
Zely
J
,
et al.
The inhibition of eIF5A hypusination by GC7, a preconditioning protocol to prevent brain death-induced renal injuries in a preclinical porcine kidney transplantation model.
.
Am J Transplant.
2020;
;
20
:
:3326.
–
40
.
13.
Balaban
RS
,
Nemoto
S
,
Finkel
T
Mitochondria, oxidants, and aging.
.
Cell.
2005;
;
120
:
:483.
–
495
.
14.
Quatros-Quemener
V
,
Chamaillard
L
,
Bouet
F
Les polyamines : rôle diagnostique et cible thérapeutique en cancérologie.
.
Med Sci (Paris).
1999;
;
15
:
:1078.
–
1085
.
|