| |
| Med Sci (Paris). 37(6-7): 632–638. doi: 10.1051/medsci/2021087.La paramécie, un organisme modèle pour étudier la ciliogenèse et les maladies ciliaires Khaled Bouhouche,1 Pierrick Le Borgne,1 Michel Lemullois,1 and Anne-Marie Tassin1* 1Université Paris-Saclay, CEA, CNRS, Institut de biologie intégrative de la cellule (I2BC)
,
1 avenue de la Terrasse
,
91198Gif-sur-Yvette
,
France |
Vignette © Anne-Marie Tassin.
Le cil est un organite essentiel qui est présent à la surface de la plupart des cellules eucaryotes, depuis les protistes jusqu’aux mammifères [
1
]. Chez les mammifères, deux grandes catégories de cils existent : les cils motiles et les cils non motiles. Le cil primaire, localisé à la surface de la quasi-totalité des cellules quiescentes (en phase G0 du cycle cellulaire), est un cil non motile, généralement présent en une seule copie, et doté de fonctions sensorielles impliquées dans la communication intercellulaire [
2
]. Le cil motile peut, quant à lui, être présent en copie unique, comme dans les spermatozoïdes, ou en plusieurs copies à la surface de certaines cellules épithéliales, comme les cellules des ventricules cérébraux. Grâce à leurs battements coordonnés, ces cils sont capables de produire un mouvement de fluide, afin de permettre l’évacuation du mucus, la circulation d’un liquide, ou le mouvement des ovocytes [
3
]. Que les cils soient motiles ou pas, leur structure est conservée au cours de l’évolution. D’architecture cylindrique, composée de neuf doublets ou triplets de microtubules, le cil est constitué de trois parties distinctes : le corps basal (dérivé du centriole père), ancré à la membrane plasmique
1
; la zone de transition ; et l’axonème, qui forme une projection externe à la cellule et qui est entouré de sa propre membrane [
4
]. La zone de transition, située à la base de l’axonème, constitue une véritable barrière physique qui contrôle les échanges bidirectionnels de protéines et de lipides entre cytoplasme et compartiment ciliaire [
4
]. Les cils motiles se distinguent essentiellement des cils non-motiles par la présence de bras de dynéines, des moteurs moléculaires dépendant de l’ATP et associés aux microtubules, qui assurent leur battement.
La formation de ces cils, ou ciliogenèse, est une succession d’étapes cytoplasmiques, coordonnées dans le temps et dans l’espace. Elle comprend plusieurs phases clés communes à tous les cils : maturation, migration et ancrage du corps basal à une membrane (membrane vésiculaire ou membrane plasmique), puis croissance [
4
]. Une fois le cil formé, le corps basal nécessite d’être convenablement orienté [
4
]. Chez l’homme, chaque étape de la ciliogenèse peut présenter des anomalies qui sont à l’origine d’altérations des fonctions ciliaires se traduisant par un spectre d’atteintes cliniques large et complexe. Les maladies qui en découlent, à hérédité mendélienne, sont regroupées sous le terme de ciliopathies [
5
]. Le nombre de ces maladies témoigne de l’importance de ces structures dans le fonctionnement cellulaire des eucaryotes. Plus de 180 gènes, dont des mutations ont été associées à une ciliopathie, ont été identifiés [
5
]. Les nouveaux gènes détectés concernent désormais un nombre restreint de familles de patients, ce qui pose le problème de l’identification de la mutation causale parmi le polymorphisme génétique des individus. L’utilisation d’organismes modèles, dont la paramécie, permettant de valider très rapidement l’implication de gènes candidats dans la fonction ciliaire, est donc particulièrement importante.
Nous présentons les propriétés qui font de la paramécie un organisme de choix pour découvrir de nouveaux acteurs moléculaires impliqués dans certaines étapes de la ciliogenèse, notamment l’ancrage des corps basaux, pour identifier de nouvelles fonctions de certaines protéines déjà connues, et pour valider de nouveaux gènes candidats impliqués dans les ciliopathies. |
La paramécie, un modèle d’étude des cils
La paramécie est un protozoaire cilié unicellulaire de la famille des
Parameciidae
, abondant dans les eaux douces et saumâtres. Sa taille est d’environ 150 µm. Son corps est recouvert de 4 000 cils vibratiles dont les battements sont nécessaires à la prise de nourriture et à la locomotion, mais aussi à la conjugaison (reproduction sexuée par fécondation réciproque). Les corps basaux des cils s’organisent en rangées longitudinales et parallèles, selon l’axe antéro-postérieur
(Figure 1A1)
, et sont insérés dans le cytosquelette sous-jacent, l’épiplasme, qui est divisé en unités corticales [
6
]. La polarité des corps basaux est déterminée par la position asymétrique des appendices auxquels ils sont associés. À la différence des métazoaires, chez lesquels les corps basaux dérivent de centrioles, la paramécie ne possède pas de centrosomes. Les corps basaux sont donc issus de corps basaux parentaux déjà ancrés et ciliés. Après duplication, les corps basaux nouvellement formés se redressent pour s’ancrer
(
Figure 1C
)
. Cet assemblage s’effectue selon une chorégraphie très précise dans le temps et dans l’espace. Des anomalies affectant cette organisation conduisent à l’apparition de phénotypes anormaux facilement détectables chez la paramécie, touchant sa viabilité, sa nage et/ou sa forme, et directement observables et analysables en microscopie [
7
,
8
]. Cette organisation corticale complexe et la facilité de détection et d’analyse des phénotypes font ainsi de la paramécie un excellent modèle pour étudier une panoplie de processus cellulaires, comme la duplication, la structure des corps basaux ou la motilité ciliaire. La paramécie offre également de nombreux avantages techniques qui permettent des analyses moléculaires et biochimiques rapides : (1) un outil d’inactivation génique performant, l’interférence d’ARN (ARNi), qui présente une bonne efficacité par ingestion de bactéries produisant de l’ARN double brin, et qui permet ainsi une analyse phénotypique dès la première division, aussi bien dans des cellules isolées que dans une population clonale [
9
] ; (2) un protocole de transgenèse suivie de marquages par des anticorps spécifiques, faciles à réaliser en microscopie à fluorescence ou électronique [
10
] ; (3) et des données génomiques et post-génomiques disponibles et répertoriées dans plusieurs bases de données [
11
,
12
].
 | Figure 1.
Organisation de l’appareil ciliaire de la paramécie. A.
Organisation corticale d’une paramécie,
Paramecium tetraurelia
, après immunomarquage par l’anticorps ID5 qui se lie spécifiquement aux corps basaux (A1). Le champ invariant comportant des doublets de corps basaux ciliés est délimité par les pointillés blancs, immunomarqués par un anticorps anti-tubuline polyE marquant spécifiquement les cils (A2) (barre d’échelle : 20 μm).
B.
Organisation ultra-structurale de l’appareil ciliaire. Vue longitudinale d’une unité corticale présentant deux corps basaux dont seul le corps basal postérieur est cilié (B1). Vue longitudinale d’une unité corticale du champ invariant montrant deux corps basaux ciliés (B2). Les flèches indiquent la position des trois plaques constituant la zone de transition (terminale T, intermédiaire I et axosomale A). On notera l’augmentation de la taille de cette zone lorsque le corps basal est cilié (barre d’échelle : 200 nm).
C.
Représentation schématique du processus de duplication et d’ancrage du corps basal.Corps basal déjà ancré et cilié (1). Début de la duplication d’un nouveau corps basal (2). Élongation (3). Détachement et redressement (4). Ancrage (5).
|
|
La ciliature chez la paramécie : structure et organisation
Chez la paramécie, la ciliature est organisée en deux types d’unités corticales, selon qu’elles contiennent en leur centre un (« singulet ») ou deux (« doublet ») corps basaux
(
Figure 1
)
. Dans la région antérieure de sa face ventrale, les unités corticales ne contiennent que des doublets de corps basaux ciliés. La région postérieure est, quant à elle, constituée uniquement de singulets ciliés. Entre ces deux régions, les unités corticales possèdent soit des singulets soit des doublets, dont seul le corps basal antérieur est cilié [
6
]. La duplication des corps basaux, comme celle des centrioles, est couplée à la division de la cellule. La paramécie duplique tous ses corps basaux et assemble des milliers de cils tout en continuant à nager. L’ancrage du corps basal fils n’est pas systématiquement suivi de la formation de l’axonème, et un certain nombre de corps basaux néoformés resteront sans cil ; ils deviendront ciliés au cours du cycle cellulaire suivant [
7
,
13
].
|
Le processus d’ancrage des corps basaux nécessite l’interaction de leur partie distale avec la membrane plasmique. Cette étape sera à l’origine de la formation de la zone de transition, qui comporte trois plaques : terminale, intermédiaire et axosomale visible en microscopie électronique
(Figure 1B1 et B2)
[
6
]. Chez l’homme, des défauts d’ancrage des corps basaux ou de la formation de la zone de transition sont associés à des ciliopathies sévères, comme les syndromes de Meckel-Gruber (MKS)
2,
, oro-facio-digital (OFD)
3
[
14
], de Joubert
4,
, ou la néphronophtise
5
(NPHP) [
15
]. Christel Thauvin-Robinet
et al.
ont montré l’implication de la protéine OFD1 (
oral-facial-digital syndrome 1 protein
) et de certains de ses partenaires de liaison dans cette étape d’ancrage [
16
,
17
]. Chez la paramécie, cette protéine assure une fonction similaire à celle décrite chez l’homme. Cette conservation fonctionnelle, des protistes à l’homme [
18
], valide la paramécie comme modèle d’étude du processus d’ancrage des corps basaux. L’organisation ciliaire précise de la paramécie se prête à la dissection du mécanisme moléculaire qui le contrôle. En effet, les défauts d’ancrage des corps basaux chez ce cilié sont à l’origine d’un phénotype spécifique, qui se caractérise par une altération de l’organisation corticale, et par l’apparition de corps basaux nouvellement formés dans le cytoplasme [
19
]. La paramécie offre ainsi une facilité d’analyse par rapport aux cellules de mammifères dans lesquelles ces défauts conduisent à une absence de cil dont l’origine nécessite d’être identifiée par des observations de coupes sériées en microscopie électronique.
Au cours de la dernière décennie, l’étude de plusieurs gènes conservés au cours de l’évolution, comme
Cen2
(
centrine2
),
Cen3
(
centrine3
),
FOR20/FOPNL
(
FOP-related protein of 20 kDa
),
OFD1
et
VFL3
(
variable flagellar number mutant 3
), a été entreprise chez la paramécie
(
Figure 2
)
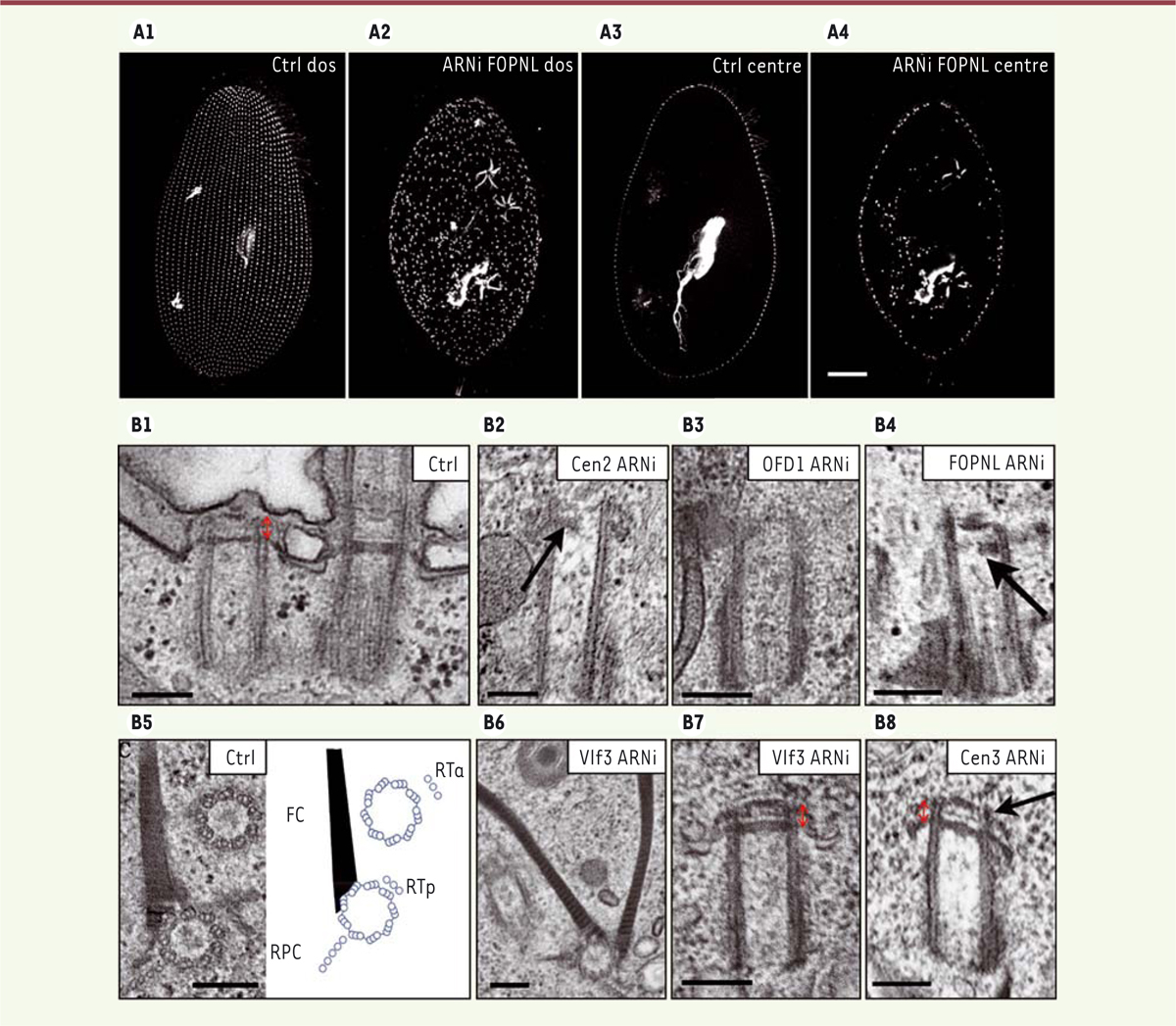
. La déplétion de chacune de ces protéines conduit à un ensemble de phénotypes caractéristiques : arrêt de croissance de la cellule, diminution de sa taille, réduction du nombre de corps basaux présents sur le cortex et accumulation de corps basaux néoformés dans le cytoplasme
(Figure 2A2, A4)
. Alors que les protéines Cen2, FOR20/FOPNL et OFD1 sont localisées à la partie distale du corps basal [
18
-
20
], les protéines Cen3 et VFL3 se situent au niveau de la partie proximale du corps basal père, respectivement au niveau des fibres striées [
18
] et d’une structure cytosquelettique appelée ALF (
anterior left filament
) [
21
]. Cen2, FOR20 et OFD1 seraient donc impliquées dans la formation de la partie distale du corps basal néoformé et seraient nécessaires à son ancrage
(
Figure 2
B1-B4)
. VFL3 définirait, quant à elle, la polarité rotationnelle du corps basal qui est nécessaire à son positionnement [
18
]
(
Figure 2
B6 et B7)
. Cen3 contrôlerait son redressement et son orientation dans le cortex [
21
]
(
Figure 2
B8)
. La chronologie d’action de ces protéines indique que Cen2 agit au début du processus. Elle sera suivie de l’action d’OFD1 et de FOR20, recrutées de façon interdépendante. Contrairement à OFD1, le recrutement de FOR20 nécessite la localisation correcte de Cen2 tandis que VFL3 permet le recrutement de Cen3. Des résultats similaires ont été obtenus chez certains mammifères [
17
] et plathelminthes [
22
], ce qui suggère une conservation de ces fonctions au cours de l’évolution et démontre, une fois encore, que la paramécie est un modèle puissant pour examiner et analyser ces processus.
 | Figure 2.
Phénotypes correspondant à l’inactivation de gènes intervenant dans le positionnement des corps basaux. A.
Paramécies marquées par l’anticorps ID5. Organisation corticale dorsale d’une cellule témoin (Ctrl) (A1) et d’une cellule dont le gène
FOPNL
a été inactivé (A2). Coupes optiques du cytoplasme d’une cellule témoin (A3) et d’une cellule dont le gène
FOPNL
a été inactivé (A4). On observe une désorganisation de l’agencement des corps basaux accrochés à la membrane et la présence de nombreux corps basaux néoformés et intracytoplasmiques.
B..
Observation ultrastructurale des corps basaux. Vue longitudinale d’une unité corticale avec deux corps basaux, dont un seul est cilié, dans une cellule témoin (Ctrl) (B1) ou après inactivation des gènes :
Cen2
(B2),
OFD1
(B3),
FOPNL
(B4),
Vfl3
(B7) et
Cen3
(B8). La flèche montre les défauts dans la partie distale du corps basal. Vue transversale d’une unité corticale avec deux corps basaux au niveau des racines ciliaires et représentation schématique de cette unité corticale (B5). Fc : fibre cinétodesmale, RTC : racine microtubulaire post-ciliaire, RTa : racine microtubulaire transverse antérieure, RTp : racine microtubulaire transverse postérieure. Après inactivation du gène
Vfl3
(B6), on note la présence d’une fibre cinétodesmale surnuméraire, suggérant la perte de la polarité rotationnelle. La double flèche rouge indique la hauteur de la zone de transition (barre d’échelle : 200 nm). Toutes les images de microscopie électronique sont réalisées par M. Lemullois et ont été adaptées à partir des articles [
18
] et [
20
].
http://creativecommons.org/licenses/by/4.0/
) [
20
].
|
|
L’implication de la zone de transition dans la cassure des cils
La zone de transition contrôle le trafic des molécules entre le compartiment cytoplasmique et le compartiment ciliaire [
4
]. Ce contrôle semble être effectué par les fibres de transition localisées à la base de ce dernier, et par des liens, en Y, qui relient les doublets de microtubules de l’axonème à la membrane du cil. De nombreuses protéines de la zone de transition ont été identifiées [
23
] : les protéines CEP290 (
centrosomal protein 290
) et RPGRIP1L (
retinitis pigmentosa GTPase regulator-interacting protein 1-like protein
), permettant le recrutement de deux complexes protéiques majeurs, MKS (
Meckel-Gruber syndrome
) et NPHP (
nephronophtysis
), qui agissent ensemble pour assurer la biogenèse et le bon fonctionnement de cette zone. Son importance dans le fonctionnement ciliaire a été démontrée : des mutations touchant des gènes codant des protéines localisées dans cette zone sont en effet associées à des ciliopathies sévères [
5
]. Les protéines TMEM (
transmembrane protein
)216 et TMEM107 qui appartiennent au module MKS, la protéine NPHP4 du complexe NPHP, et les deux protéines pivots CEP290 et RPGRIP1L, sont conservées chez la paramécie [
7
]. Comme dans les autres modèles ciliaires étudiés, elles s’organisent en symétrie d’ordre 9, autour de l’axonème. Elles assurent la biogenèse et la fonction de la zone de transition. Delphine Gogendeau
et al.
[
7
] ont découvert une nouvelle fonction pour ces protéines : le contrôle de la déciliation. Chez la paramécie, la déciliation peut être physiologique, comme lors de la conjugaison [
24
], ou induite expérimentalement par un traitement chimique (Ca
2+
/éthanol [EtOH]) et mécanique [
7
]. Les paramécies qui n’expriment plus ces protéines présentent en effet un comportement de nage anormal, associé à un ralentissement de leur croissance, mais sans altération des étapes de duplication et d’ancrage des corps basaux. Les cils de cellules dont les gènes
TMEM216
ou
TMEM107
ont été inactivés, sont libérés dans le milieu extracellulaire, puis de nouveaux cils repoussent. L’absence de ces deux protéines semble ainsi affaiblir les cils qui ne résistent plus à la force exercée par les battements ciliaires. Les observations en microscopie électronique révèlent que le plan de cassure de ces cils coïncide avec la plaque axosomale de la zone de transition. Contrairement à TMEM107 et TMEM216, la déplétion des gènes codant CEP290, RPGRIP1L ou NPHP4 empêche la déciliation induite chimiquement. Cela est sans doute dû à une dérégulation du flux des ions Ca
2+
au niveau de la zone de transition [
7
]. En plus de leurs fonctions déjà établies, ces protéines conservées de la zone de transition sont donc impliquées dans un autre processus cellulaire, la déciliation.
La déciliation est observée dans les épithéliums multiciliés des vertébrés. Par exemple, dans l’oviducte des oiseaux et des mammifères, les cellules rompent leurs cils lors de la phase lutéale du cycle menstruel [
25
]. De même, dans les cellules rénales de la lignée IMCD3 (
inner medullary collecting duct
) en culture, la perte de cil, qui est un comportement normal du cil primaire lors du cycle cellulaire, s’effectue majoritairement par cassure [
26
]. Comme chez les protistes, la cassure du cil chez les vertébrés s’effectue au niveau de la zone de transition, suggérant une conservation de ce processus assuré par les protéines de cette zone, au cours de l’évolution. Ces données ouvrent ainsi de nouvelles perspectives dans la compréhension du processus de ciliation/déciliation.
|
La paramécie : organisme modèle de la dyskinésie ciliaire primitive La grande majorité des ciliopathies connues sont causées par le dysfonctionnement des cils primaires. Les défauts des cils motiles entraînent, quant à eux, un syndrome nommé dyskinésie ciliaire primitive (DCP). Les analyses approfondies des mécanismes moléculaires contrôlant l’assemblage et la fonction des cils, menées au cours de ces dernières années grâce à l’utilisation d’organismes modèles, ont permis de comprendre les bases moléculaires de ces ciliopathies.
La DCP est caractérisée principalement par des infections récurrentes des voies respiratoires supérieures et inférieures, causées par une altération de l’épuration mucociliaire, par une stérilité masculine, ou par une disposition des organes internes inversée (
situs inversus
)
6,
[
3
,
27
]. Une quarantaine de gènes ayant des mutations à l’origine de la DCP ont été identifiés. L’un des défauts structuraux ciliaires le plus fréquemment retrouvés est l’absence des bras de dynéine internes et externes, du fait de mutations touchant les gènes codant des protéines impliquées dans l’assemblage et/ou le transport de ces bras de dynéine [
3
].
La paramécie permet de tester en quelque semaines l’implication de nouveaux gènes candidats dans la DCP. Une collaboration fructueuse entre équipes travaillant sur ce modèle et des généticiens cliniciens a permis d’identifier trois gènes candidats de la maladie :
C11orf70
(
chromosome 11 open reading frame 70
)
7
,
DNAH9
(
dynein axonemal heavy chain 9
) et
TTC12
(
tetratricopeptide repeat domain 12
) [
28
-
30
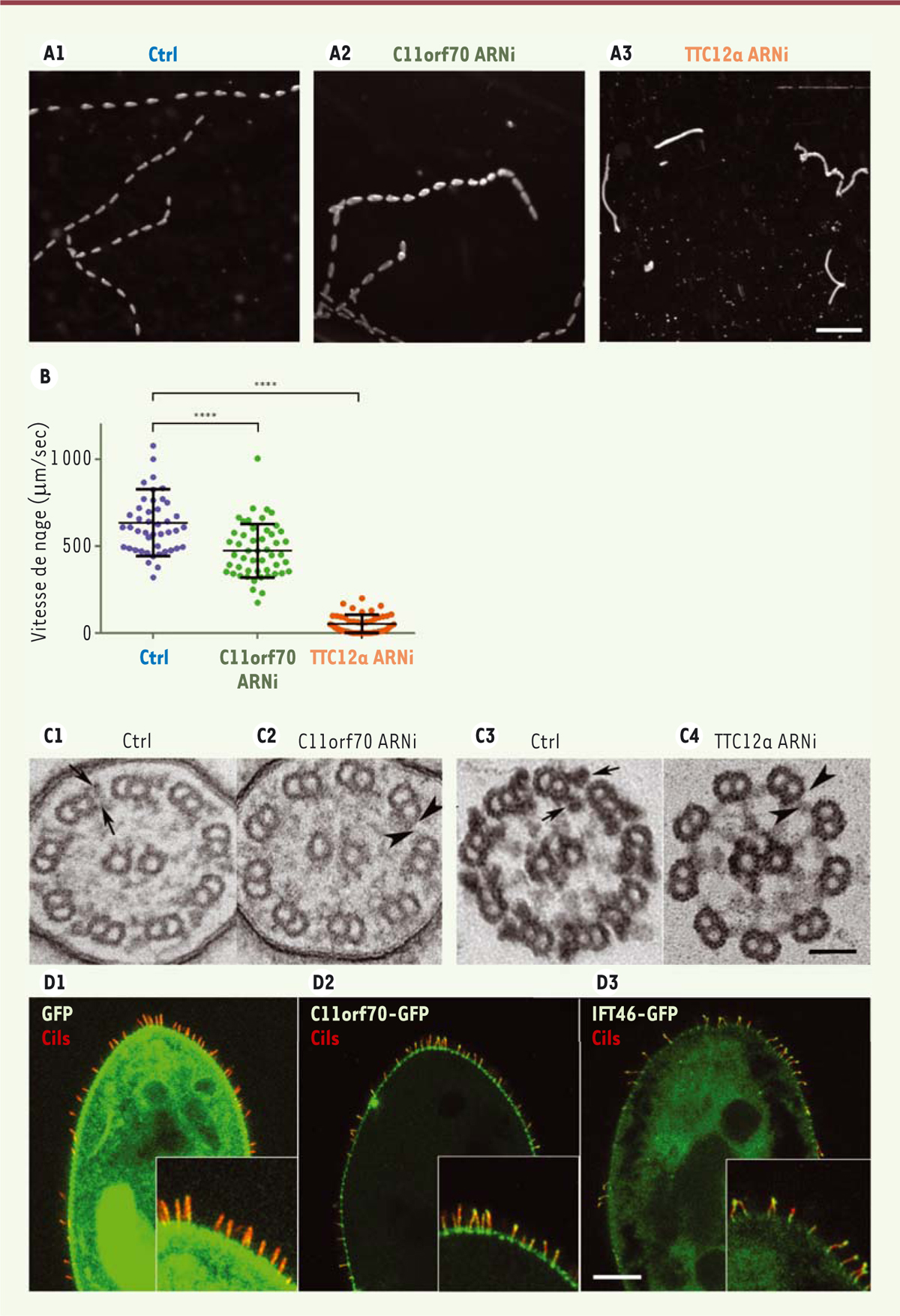
]. Les expériences d’interférence par ARN (ARNi) réalisées sur la paramécie ont en effet montré que la perte de fonction de chacun de ces gènes conduit à une diminution de sa vitesse de nage
(
Figure 3A
et
B
)
et de la fréquence de battement ciliaire, ainsi qu’à une formation partielle, voire à l’absence, des bras de dynéines
(
Figure 3C
)
. Les analyses de localisation subcellulaire, de même que des expériences biochimiques, ont révélé que C11orf70 est majoritairement présente dans le cytoplasme mais aussi au niveau des cils. La combinaison des expériences de déciliation/reciliation, de déplétion d’un des IFT (
intraflagellar transport
)
8,
, et de localisation a montré que la protéine codée par
C11orf70
se comportait comme un IFT
(
Figure 3D
)
. Cette protéine pourrait donc assurer le repliement correct des complexes dynéines dans le cytoplasme, et interagir avec les complexes IFT et transporter ces derniers dans le cil jusqu’à leur étape d’ancrage [
28
].
 | Figure 3.
La paramécie, un modèle d’étude pour les dyskinésies ciliaires primitives (DCP). A.
Suivi de la trajectoire de nage des cellules témoins (Ctrl) (A1), ou dont les gènes
C11orf70
(A2) ou
TTC12a
(A3) ont été inactivés, analysée par vidéo microscopie pendant une durée de 10 s, avec une acquisition toutes les 0,3 s. Une projection en Z de toutes les images du film permet d’obtenir la trajectoire. L’espacement entre deux points est directement relié à la vitesse de nage.
B..
Quantification de la vitesse moyenne de nage d’une cinquantaine de cellules par condition. Chaque point représente la vitesse moyenne de nage d’une paramécie. Les barres d’erreurs représentent la déviation standard à la moyenne. Test t de Student : **** : p < 0,0001.
C.
Coupes transverses en microscopie électronique d’un axonème de cil, issues de cellule témoins (Ctrl) ou dont le gène
C11orf70
a été inactivé (C2), obtenues après une fixation par glutaraldéhyde/acide osmique. La perméabilisation suivie d’une fixation glutaraldéhyde/acide tannique/acide osmique permet de mieux visualiser les bras de dynéines de la cellule témoin (C3) et de la cellule dont le gène
TTC12
a été inactivé (C4). Les flèches indiquent la présence des bras internes et externes de dynéines et les têtes de flèche indiquent l’absence de ces bras (barre d’échelle : 50 nm).
D.
Localisation des protéines couplées à la GFP (
green fluorescent protein
), C11orf70-GFP et IFT46-GFP au cours de la reciliation chez la paramécie. Les cellules sont déciliées transitoirement par une solution Ca
2+
/EtOH. Après lavage en milieu de culture (15 min), les cellules sont fixées et immunomarquées par un anticorps anti-tubuline polyE (rouge) pour observer les cils. La localisation de la GFP (D1), de C11orf70-GFP (D2) et IFT46-GFP (D3) est observée par fluorescence directe (barre d’échelle 20 μm).
|
|
La paramécie représente donc un modèle de choix pour comprendre les mécanismes moléculaires gouvernant les processus de la ciliogenèse et pour décrire l’architecture moléculaire sous-jacente des cils. L’étude comparative de ces processus cellulaires dans des organismes modèles éloignés d’un point de vue évolutif (paramécie, planaire,
Caenorabditis elegans
, drosophile, poisson-zèbre et mammifères) permettra d’identifier des mécanismes communs ou spécifiques pouvant être responsables des divergences potentielles observées chez l’homme dans différents tissus.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Les auteurs saluent la mémoire de Janine Beisson (1931-2020), qui a introduit le modèle de paramécie en France et a largement contribué à la connaissance de ce modèle et des processus ciliaires. Nous remercions les co-auteurs des publications originales et particulièrement France Koll pour la lecture critique du manuscrit. Les auteurs remercient l’ANR
ANR-15-CE11-0002-01 to AMT.
|
Footnotes |
1.
Hodges
ME
,
Scheumann
N
,
Wickstead
B
,
et al.
Reconstructing the evolutionary history of the centriole from protein components.
.
J Cell Sci.
2010;
;
123
:
:1407.
–
1413
.
2.
Eggenschwiler
JT
,
Anderson
KV
.
Cilia and developmental signaling.
.
Annu Rev Cell Dev Biol.
2007;
;
23
:
:345.
–
373
.
3.
Mitchison
HM
,
Valente
EM
.
Motile and non-motile cilia in human pathology: from function to phenotypes.
.
J Pathol.
2017;
;
241
:
:294.
–
309
.
4.
Reiter
JF
,
Blacque
OE
,
Leroux
MR
.
The base of the cilium: roles for transition fibres and the transition zone in ciliary formation, maintenance and compartmentalization.
.
EMBO Rep.
2012;
;
13
:
:608.
–
618
.
5.
Reiter
JF
,
Leroux
MR
.
Genes and molecular pathways underpinning ciliopathies.
.
Nat Rev Mol Cell Biol.
2017;
;
18
:
:533.
–
547
.
6.
Tassin
A-M
,
Lemullois
M
,
Aubusson-Fleury
A
.
Paramecium tetraurelia basal body structure. Cilia.
2015;
;
5
:
:6.
.
7.
Gogendeau
D
,
Lemullois
M
,
Le Borgne
P
,
et al.
MKS-NPHP module proteins control ciliary shedding at the transition zone.
.
PLoS Biol.
2020;
;
18
:
:e3000640.
.
8.
Ponsard
C
,
Skowron-Zwarg
M
,
Seltzer
V
,
et al.
Identification of ICIS-1, a new protein involved in cilia stability.
.
Front Biosci J Virtual Libr.
2007;
;
12
:
:1661.
–
1669
.
9.
Beisson
J
,
Bétermier
M
,
Bré
M-H
,
et al.
Silencing specific Paramecium tetraurelia genes by feeding double-stranded RNA.
.
Cold Spring Harb Protoc.
2010;
;
2010
:
:pdb.prot5363.
.
10.
Beisson
J
,
Bétermier
M
,
Bré
MH
,
et al.
DNA microinjection into the macronucleus of paramecium.
.
Cold Spring Harb Protoc.
2010;
;
2010
:
:pdb.prot5364.
.
11.
Arnaiz
O
,
Cain
S
,
Cohen
J
,
et al.
ParameciumDB: a community resource that integrates the Paramecium tetraurelia genome sequence with genetic data.
.
Nucleic Acids Res.
2007;
;
35
:
:D439.
–
D434
.
12.
Arnaiz
O
,
Cohen
J
,
Tassin
A-M
,
et al.
Remodeling Cildb, a popular database for cilia and links for ciliopathies.
.
Cilia.
2014;
;
3
:
:9.
.
13.
Iftode
F
,
Fleury-Aubusson
A
.
Structural inheritance in Paramecium: ultrastructural evidence for basal body and associated rootlets polarity transmission through binary fission.
.
Biol Cell.
2003;
;
95
:
:39.
–
51
.
14.
Bruel
AL
,
Franco
B
,
Duffourd
Y
,
et al.
Fifteen years of research on oral-facial-digital syndromes: from 1 to 16 causal genes.
.
J Med Genet.
2017;
;
54
:
:371.
–
380
.
15.
Failler
M
,
Gee
HY
,
Krug
P
,
et al.
Mutations of CEP83 cause infantile nephronophthisis and intellectual disability.
.
Am J Hum Genet.
2014;
;
94
:
:905.
–
914
.
16.
Thauvin-Robinet
C
,
Thomas
S
,
Sinico
M
,
et al.
OFD1 mutations in males: phenotypic spectrum and ciliary basal body docking impairment.
.
Clin Genet.
2013;
;
84
:
:86.
–
90
.
17.
Chevrier
V
,
Bruel
A-L
,
Van Dam
TJP
,
et al.
OFIP/KIAA0753 forms a complex with OFD1 and FOR20 at pericentriolar satellites and centrosomes and is mutated in one individual with oral-facial-digital syndrome.
.
Hum Mol Genet.
2016;
;
25
:
:497.
–
513
.
18.
Bengueddach
H
,
Lemullois
M
,
Aubusson-Fleury
A
,
et al.
Basal body positioning and anchoring in the multiciliated cell Paramecium tetraurelia: roles of OFD1 and VFL3.
.
Cilia.
2017;
;
6
:
:6.
.
19.
Ruiz
F
,
Garreau de Loubresse
N
,
Klotz
C
,
et al.
Centrin deficiency in Paramecium affects the geometry of basal-body duplication.
.
Curr Biol CB.
2005;
;
15
:
:2097.
–
2106
.
20.
Aubusson-Fleury
A
,
Lemullois
M
,
Garreau de Loubresse
N
,
et al.
The conserved centrosomal protein FOR20 is required for assembly of the transition zone and basal body docking at the cell surface.
.
J Cell Sci.
2012;
;
125
:
:4395.
–
4404
.
21.
Jerka-Dziadosz
M
,
Koll
F
,
Włoga
D
,
et al.
A Centrin3-dependent, transient, appendage of the mother basal body guides the positioning of the daughter basal body in paramecium.
.
Protist.
2013;
;
164
:
:352.
–
368
.
22.
Basquin
C
,
Ershov
D
,
Gaudin
N
,
et al.
Emergence of a bilaterally symmetric pattern from chiral components in the planarian epidermis.
.
Dev Cell.
2019;
;
51
:
:516.
–
25.e5
.
23.
Gonçalves
J
,
Pelletier
L
.
The ciliary transition zone: finding the pieces and assembling the gate.
.
Mol Cells.
2017;
;
40
:
:243.
–
253
.
24.
Watanabe
T
.
A scanning electron-microscopic study of the local degeneration of cilia during sexual reproduction in paramecium.
.
J Cell Sci.
1978;
;
32
:
:55.
–
66
.
25.
Brenner
RM
.
Renewal of oviduct cilia during the menstrual cycle of the rhesus monkey.
.
Fertil Steril.
1969;
;
20
:
:599.
–
611
.
26.
Mirvis
M
,
Siemers
KA
,
Nelson
WJ
,
et al.
Primary cilium loss in mammalian cells occurs predominantly by whole-cilium shedding.
.
PLoS Biol.
2019;
;
17
:
:e3000381.
.
27.
Lucas
JS
,
Burgess
A
,
Mitchison
HM
,
et al.
Diagnosis and management of primary ciliary dyskinesia.
.
Arch Dis Child.
2014;
;
99
:
:850.
–
856
.
28.
Fassad
MR
,
Shoemark
A
,
Le Borgne
P
,
et al.
C11orf70 Mutations disrupting the intraflagellar transport-dependent assembly of multiple axonemal dyneins cause primary ciliary dyskinesia.
.
Am J Hum Genet.
2018;
;
102
:
:956.
–
972
.
29.
Fassad
MR
,
Shoemark
A
,
Legendre
M
,
et al.
Mutations in outer dynein arm heavy chain dnah9 cause motile cilia defects and situs inversus.
.
Am J Hum Genet.
2018;
;
103
:
:984.
–
994
.
30.
Thomas
L
,
Bouhouche
K
,
Whitfield
M
,
et al.
TTC12 Loss-of-Function mutations cause primary ciliary dyskinesia and unveil distinct dynein assembly mechanisms in motile cilia versus flagella.
.
Am J Hum Genet.
2020;
;
106
:
:153.
–
69
.
|