| |
| Med Sci (Paris). 37(8-9): 704–705. doi: 10.1051/medsci/2021097.Un nouvel acteur dans la perception gustative des lipides alimentaires : le canal calcique TRPC3 Amira Sayed Khan,1 Aziz Hichami,1 and Naim Akhtar Khan1* 1Inserm U1231, Équipe Physiologie de la nutrition et toxicologie, université Bourgogne Franche-Comté( UBFC)
,
6 boulevard Gabriel
,
21000Dijon
,
France
.
MeSH keywords: Calcium, Canaux calciques, Humains, Lipides, Perception du goût, métabolisme, génétique |
Le sens du goût (gustation) joue un rôle clé dans le choix des aliments. Il existe cinq modalités gustatives: amer, salé, acide, sucré, et umami
1
[
1
]. Le goût sucré permet la détection de substances énergétiques riches en calories, tandis que le goût amer permet d’éviter ou de rejeter les substances toxiques ou nocives. Ces deux modalités gustatives sont bien conservées phylogénétiquement. Les hommes et les rongeurs manifestent une préférence spontanée pour les lipides alimentaires. Les résultats d’études récentes suggèrent qu’il pourrait exister une sixième modalité gustative pour la détection orosensorielle des acides gras alimentaires à longue chaîne (AGLC) [
2
]. Nous avons montré que la préférence pour les AGLC alimentaires est modifiée chez les individus obèses, hommes et animaux, et que ce phénomène est associé à l’altération des mécanismes de la perception des lipides [
3
]. Nous avons identifié deux récepteurs des lipides (CD36 et GPR120 [
G-protein-coupled receptor 120
]), situés dans la partie apicale des bourgeons du goût, et qui sont impliqués respectivement dans la détection sensorielle orale des AGLC et dans le contrôle post-ingestif de la prise alimentaire [
3
]. Par ailleurs, notre équipe a confirmé, dans des populations tunisienne, algérienne et tchèque d’obèses, qu’un polymorphisme génétique de CD36 réduisant l’expression de cette protéine augmente le seuil de détection orosensorielle des AGLC alimentaires chez les sujets obèses, et pourrait par conséquent expliquer leur consommation excessive de lipides [
4
].
|
Signalisation gustative des lipides
Nous avons montré que l’interaction d’un AGLC avec son récepteur gustatif active la phospholipase C (PLC), qui catalyse l’hydrolyse du phosphatidyl-inositol-4,5-biphosphate (PIP
2
) en inositol-1,4,5-triphosphate (IP
3
) et diacylglycérol (DAG). L’IP
3
, en se liant à ses récepteurs dans la membrane du réticulum endoplasmique, libère des ions Ca
2+
dans le cytoplasme, ce qui contribue à l’augmentation de la concentration intracellulaire de Ca
2+
([Ca
2+
]
i
), suivie d’un efflux puis d’un influx d’ions Ca
2+
via
l’ouverture de canaux calciques, composés de protéines ORAI (aussi appelées
calcium release-activated calcium channel proteins
). Ces canaux sont soit homomériques, comme ORAI1, soit hétéromériques, comme ORAI1/3 [
3
,
6
]. Ils sont activés seulement lorsque la réserve d’ions Ca
2+
du réticulum endoplasmique est mobilisée, et appartiennent donc à la famille des canaux SOC (
store-operated calcium
). L’ouverture des canaux SOC est sous le contrôle de la protéine STIM1 (
stromal interaction molecule 1
), qui détecte la quantité d’ions Ca
2+
nécessaire pour remplir le réticulum endoplasmique [
6
,
7
]. Restait à savoir si le DAG était, comme l’IP
3
, impliqué dans la signalisation gustative des lipides.
|
Des canaux TRPC sont responsables de l’influx d’ions Ca2+ lors de la perception gustative des lipides
Les canaux SOC incluent vraisemblablement aussi des canaux de la famille TRP (
transient receptor potential
). Les canaux TRP sont regroupés en 7 familles, en fonction de leurs homologies de séquence d’acides aminés: TRPC, TRPM, TRPV, TRPA, TRPP, TRPML et TRPN. Chaque sous-unité d’un canal TRP est constituée de six domaines transmembranaires, avec un pore situé entre le cinquième et le sixième segment transmembranaires, une structure semblable à celle des canaux potassiques sensibles au potentiel de membrane [
8
]. L’activité de la plupart des canaux de la famille TRPC (TRP « canoniques ») est modulée par les acides gras, sous forme libre ou estérifiée en position médiane (sn-2) du glycérol du DAG. Tous les canaux TRPC (TRPC1, TRPC2, TRPC3/6/7 et TRPC4/5) peuvent être activés en réponse à la stimulation de récepteurs couplés aux protéines G (
G-protein-coupled receptors, GPCR
), dont font partie les récepteurs de la vision, de l’olfaction et de la gustation. Ils sont activés par la PLC
via
l’hydrolyse de PIP
2
en IP
3
et DAG, mais alors que les canaux TRPC3/6/7 sont plus spécifiquement activés par le DAG, les canaux TRPC1/4/5 ne le sont pas, et leur mécanisme d’activation par la PLC reste controversé [
8
]. Nous avons montré que les cellules gustatives fongiformes de la souris expriment les canaux TRPC3 (mais pas TRPC6 ou TRPC7), et que ces canaux sont aussi sous le contrôle de STIM1, comme le sont les canaux calciques ORAI1 et ORAI1/3 [
9
]
(
Figure 1
)
. Dans ces cellules, l’acide linoléique (un acide gras alimentaire à longue chaîne [AGLC]), en se liant au lipido-récepteur CD36, induit la production de DAG d’une manière PLC-dépendante. Une analyse par spectroscopie de masse a permis de montrer que cet AGLC exogène s’incorpore dans le diacylglycérol (DAG) en position médiane du glycérol (sn-2), produisant du 1-stéaroyl-2-linoléoyl-sn-glycérol (SLG) [
10
].
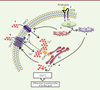 | Figure 1.
Implication des canaux TRPC3 dans la détection orosensorielle des acides gras alimentaires.
La liaison d’un acide gras à la protéine CD36 de la membrane plasmique
(1)
active la phospholipase C (PLC)
(2)
, qui hydrolyse le phosphatidyl inositol-4,5-biphosphate (PIP
2
) en inositol-1,4,5-triphosphate (IP
3
) et diacylglycérol (DAG)
(3)
. La liaison de l’IP
3
à son récepteur (IP
3
R) dans la membrane du réticulum endoplasmique (RE) entraîne la libération intracellulaire d’ions Ca
2+
, tandis que le DAG active les canaux TRPC3, ce qui contribue aussi à l’augmentation de la concentration intracellulaire de Ca
2+
([Ca
2+
]
i
)
(4)
. La libération de Ca
2+
dans le cytoplasme par l’IP
3
est détectée par STIM1, qui active les canaux ORAI1/3 et TRPC3 présents dans la membrane plasmique
(5)
, et provoque l’augmentation prolongée de [Ca
2+
]
i
(6 et 7)
nécessaire à la transmission nerveuse du message orogustatif vers le cerveau.
|
Afin de prouver l’implication physiologique de TRPC3 dans la perception gustative des AGLC, nous avons analysé le comportement alimentaire de souris dont les gènes
TRPC3
(
Transient Receptor Potential Cation Channel Subfamily C Member 3
),
TRPC6
, ou
TRPC7
ont été invalidés. Alors que les souris témoins ont une préférence alimentaire pour l’acide linoléique, cette préférence était plus faible chez les souris mutantes
Trpc3
-
/
-
(mais pas chez les souris
Trpc6
-
/
-
ou
Trpc7
-
/
-
). Une diminution de la préférence pour l’huile de colza a également été observée chez ces souris [
9
]. Enfin, nous avons montré que l’activation des canaux TRPC3 des cellules sensorielles gustatives par les AGLC est couplée à des mécanismes physiologiques d’anticipation de la prise alimentaire, en observant, après l’application d’un AGLC sur la partie apicale de la langue, que la libération de deux peptides anorexigènes intestinaux (cholécystokinine et peptide YY) dans le sang (
via
le circuit neuronal langue-cerveau-intestin) était diminuée chez les souris
Trpc3
-
/
-
par rapport à des souris témoins [
9
].
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Chaudhari
N
Roper
SD
The cell biology of taste.
.
J Cell Biol.
2010;
;
190
:
:285.
–
296
.
2.
Besnard
P
Passilly-Degrace
P
Khan
NA
Taste of fat: a sixth taste modality?
.
Physiol Rev.
2016;
;
96
:
:151.
–
176
.
3.
Khan
AS
,
Keast
R
,
Khan
NA
.
Preference for dietary fat: from detection to disease.
.
Prog Lipid Res.
2020;
;
78
:
:101032.
.
4.
Khan
AS
Murtaza
B
Hichami
A
Khan
NA
A cross-talk between fat and bitter taste modalities.
.
Biochimie.
2019;
;
159
:
:3.
–
8
.
5.
Gilbertson
TA
Khan
NA
Cell signaling mechanisms of oro-gustatory detection of dietary fat: advances and challenges.
.
Prog Lipid Res.
2014;
;
53
:
:82.
–
92
.
6.
Dramane
G
Abdoul-Azize
S
Hichami
A
et al.
STIM1 regulates calcium signaling in taste bud cells and preference for fat in mice.
.
J Clin Invest.
2012;
;
122
:
:2267.
–
2282
.
7.
Ozdener
MH
Subramaniam
S
Sundaresan
S
et al.
CD36- and GPR120-mediated Ca
2+
signaling in human taste bud cells mediates differential responses to fatty acids and is altered in obese mice
.
.
Gastroenterology.
2014;
;
146
:
:995.
–
1005
.
8.
Chen
X
,
Sooch
G
,
Demaree
IS
, et al.
Transient receptor potential canonical (TRPC) channels: then and now.
.
Cells.
2020;
;
9
:
:1983.
.
9.
Murtaza
B
,
Hichami
A
,
Khan
AS
, et al.
Implication of TRPC3 channel in gustatory perception of dietary lipids.
.
Acta Physiol (Oxf).
2021;
;
231
:
:e13554.
.
10.
Madani
S
Hichami
A
Legrand
A
et al.
Implication of acyl chain of diacylglycerols in activation of different isoforms of protein kinase C.
.
FASEB J.
2001;
;
15
:
:2595.
–
2601
.
|


