La vaccination de la population mondiale contre la COVID-19 ( coronavirus disease 2019 ) repose sur l’induction de la production d’anticorps neutralisants dirigés contre spike, la protéine d’enveloppe du virus responsable de la maladie, le SARS-CoV-2 ( severe acute respiratory syndrome-coronavirus-2 ). Ces anticorps ont le potentiel d’empêcher l’attachement du virus à son récepteur, la protéine ACE-2 ( angiotensin-converting enzyme 2 ), exprimée notamment par les cellules épithéliales du poumon. Le suivi de la protection offerte par ces anticorps a constitué la base des essais cliniques ayant permis la validation des différents vaccins, mais la réponse lymphocytaire B à l’origine de leur production, que ce soit au cours de la maladie ou au cours de la vaccination, n’a été étudiée que plus récemment. Plusieurs équipes, dont la nôtre [ 1 ], ont décrit, au début de cette année, donc avec un recul de 6 à 9 mois après les premiers cas d’infection, la mise en place de la réponse lymphocytaire B à mémoire au cours de la maladie [ 2 , 4 ].
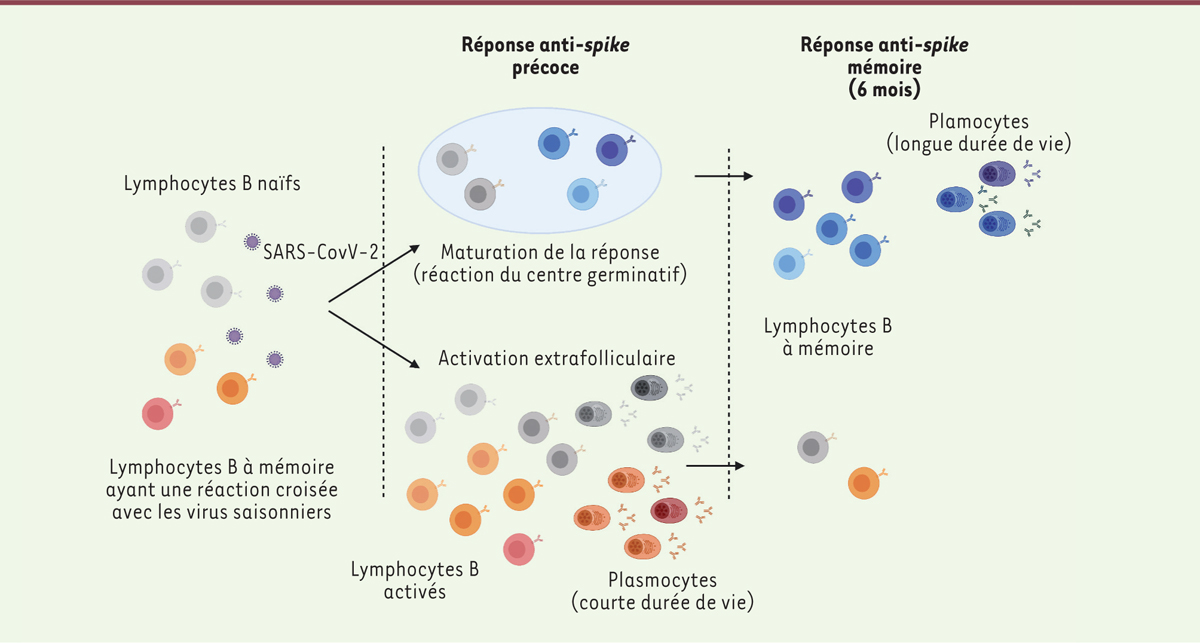
La rencontre avec un nouveau microorganisme pathogène active des lymphocytes B naïfs et induit leur différenciation en plasmocytes, des cellules spécialisées dans la sécrétion des immunoglobulines ou anticorps 1 . Si le pathogène présente des similitudes avec un agent rencontré précédemment, des lymphocytes B à mémoire qui reconnaissent des structures communes aux deux pathogènes (« cross -réaction » ou réaction croisée) vont aussi s’activer. Les plasmocytes produits lors de cette première réponse, appelée réponse extra-folliculaire, ont une courte durée de vie. En parallèle de cette réponse se met en place une réponse plus lente, dite réaction du centre germinatif, qui s’étale sur plusieurs mois. Au cours de celle-ci, les anticorps produits par les lymphocytes B, dirigés contre le pathogène, vont subir des mutations dans les gènes codant leurs domaines variables, un mécanisme d’hypermutation sélectif remarquable n’affectant que ces gènes. Les lymphocytes B produisant les anticorps mutés ayant les plus fortes affinités pour le pathogène sont alors activés et sélectionnés positivement ; ils vont constituer, souvent pour toute la vie, un compartiment de lymphocytes B à mémoire et de plasmocytes produisant des anticorps de forte affinité contre le pathogène, mobilisables très rapidement en cas de réinfection par le même pathogène ou des pathogènes présentant de fortes similarités dans les molécules qu’ils expriment [ 5 , 6 ].
La réponse immunitaire contre le SARS-CoV-2 est conforme à ce scénario classique, avec quelques propriétés remarquables, comme son tropisme majeur pour la protéine spike et son domaine RBD ( receptor-binding domain ) responsable de la liaison du virus à son récepteur cellulaire (ACE-2) et cible privilégiée (mais non-exclusive) des anticorps neutralisants dirigés contre ce virus. Au cours de la réponse extra-folliculaire, qui survient dans les quelques jours ou semaines qui suivent l’infection, des lymphocytes B à mémoire, reconnaissant la protéine spike de coronavirus saisonniers rencontrés auparavant (et responsables de rhumes banals) sont activés ( Figure 1 ) . Ils produisent cependant peu ou pas d’anticorps neutralisant le SARS-CoV-2, en raison de la divergence des séquences des domaines RBD entre les protéines spike de ces différents virus, mais ils participent peut-être à une première tentative de contrôle partiel de l’infection. Des lymphocytes B naïfs sont également activés. Remarquablement, ceux-ci présentent des réarrangements de gènes codant les anticorps anti-SARS-CoV-2 qu’ils produisent similaires entre individus, et cela, de façon récurrente chez de nombreux sujets [ 7 , 8 ]. Certains de ces lymphocytes B ont la caractéristique unique de produire des anticorps reconnaissant le virus en utilisant des domaines VH (domaine variable de la chaîne lourde, en anglais, variable heavy ) 2 spécifiques ayant subi peu de mutations, et sans que, étonnamment, leur région hypervariable CDR3 (pour third complementarity determining region ) joue un rôle central dans cette reconnaissance. Cette région CDR3, qui correspond à la séquence d’acides aminés codés par une partie de la séquence réarrangée V-D-J, est en effet la partie la plus variable des anticorps et joue habituellement un rôle majeur dans la reconnaissance des antigènes par la plupart des anticorps spécifiques [ 16 ] ( → ).
(→) Voir la Nouvelle de B. Laffleur et al ., m/s n° 8-9, août-septembre 2016, page 677
| Figure 1.
Maturation de la réponse lymphocytaire B contre le SARS-CoV-2.
Une première vague de réponse mobilise des lymphocytes B naïfs, ainsi que des lymphocytes reconnaissant les coronavirus saisonniers et présentant une affinité suffisante pour le SARS-CoV-2, cellules qui vont se différencier en plasmocytes et produire une première vague d’anticorps spécifiques. Pendant quelques semaines ou quelques mois, suivant la gravité de l’infection, la maturation des lymphocytes B naïfs (et présentant peut-être des réactions croisées) va se produire par prolifération et mutation de leurs gènes d’immunoglobulines dans les centres germinatifs. La sélection opérée au cours de cette réaction va permettre l’émergence de plasmocytes à longue durée de vie, capables de produire des anticorps neutralisants, et des cellules à mémoire, dont la longévité dans le cas du SARS-CoV-2 est encore inconnue.
|
Il s’agit là d’un cas assez spectaculaire de sélection au sein du génome de gènes VH présentant une bonne spécificité pour un pathogène pourtant émergent et dont les capacités de liaison à la protéine spike reposent principalement sur les régions hypervariables CDR1 et CDR2.
La forte réponse extra-folliculaire initiale explique certaines observations contradictoires sur la persistance sérologique des anticorps anti-SARS-CoV-2 : la décroissance des IgG anti- spike , initialement observée au cours du suivi sérologique de la réponse anticorps, correspond en fait à la première partie d’une réponse biphasique ; la diminution de la production des anticorps issus de la réponse folliculaire initiale se produit en effet avant que la production continue d’anticorps provenant des plasmocytes à longue vie ne se mette en place [ 9 , 10 ].
Les lymphocytes B à mémoire et des plasmocytes à longue durée de vie, spécifiques du virus, vont progressivement émerger de la réaction du centre germinatif. Ces cellules produisent des anticorps présentant des profils de reconnaissance variés des différents éléments 3 de la structure de la protéine spike , avec des affinités et des capacités de neutralisation grandement améliorées, grâce au mécanisme d’hypermutation dont ils ont fait l’objet et à la sélection qui s’ensuit, comme nous l’avons rappelé au début de cette Nouvelle ( Figure 1 ) .
L’originalité de notre étude a notamment consisté dans le suivi longitudinal, sur une période de 6 mois, de cohortes de patients atteints de formes modérées ou sévères de la COVID-19, ce qui nous a permis de suivre des évolutions clonales des lymphocytes B engagés dans la réponse contre le virus, tant au niveau de la réponse extra-folliculaire qu’au niveau de la maturation ultérieure de ces clones de lymphocytes B [ 1 ].
Chez les individus infectés, plus la maladie a été sévère (sans atteindre un stade critique), plus la réponse mémoire s’est avérée être forte et puissante, puisqu’elle est stimulée par l’importante charge virale, avant de pouvoir la contrôler. Dans tous les cas, cette réponse se développe pendant plusieurs mois suivant l’infection, comme le démontre l’accumulation progressive des mutations somatiques dans les gènes VH des cellules mémoire, indiquant une persistance de composants viraux stimulant la réponse immunitaire. Des éléments viraux ont en effet été détectés dans des biopsies intestinales, quatre mois après l’infection, ce qui suggère que des complexes antigènes viraux-anticorps puissent également persister au sein des centres germinatifs des tissus lymphoïdes [ 2 ]. La réponse anti-virale de ces patients présente une fonctionnalité remarquable, avec une augmentation au cours du temps des anticorps ciblant le site de liaison au récepteur ACE-2, le domaine RBD. Malgré les ravages planétaires provoqués par ce virus, l’issue favorable de la pandémie résidera sans doute dans le fait que le SARS-CoV-2 a développé, jusqu’à présent, peu de mécanismes d’évitement de la réponse immunitaire, à la différence d’autres microorganismes pathogènes qui utilisent la glycosylation de leurs récepteurs pour échapper à la reconnaissance du système immunitaire, ou qui trompent ce dernier en présentant comme structures les plus immunogènes des épitopes correspondant à des sites inefficaces de la protéine en termes de contrôle de l’infection et d’élimination de l’agent infectieux.
Cependant, un mécanisme d’échappement a été développé par le SARS-CoV-2 : il s’agit de la variation de la séquence de sa protéine spike . Cette variabilité est relativement modeste comparée à celle du virus de la grippe, mais clairement préoccupante pour certains variants 4 récemment apparus ( variants of concern ). Il faut cependant signaler que le variant dit « anglais » (appelé désormais par l’Organisation mondiale de la santé [OMS], variant a), même s’il est plus infectieux, n’échappe pas à la réponse immunitaire développée suite à une infection par le virus original. La réponse immunitaire aux variants dits « sud-africain » et « brésilien » (désormais appelés respectivement variants b et g) est, quant à elle, moins efficace, presque d’un facteur dix au niveau sérologique [ 11 ]. Mais c’est là où les lymphocytes B à mémoire interviennent : en quelques divisions cellulaires, une fraction, même restreinte, de ces lymphocytes reconnaissant une forme variante du virus va pouvoir dominer la réponse immunitaire et produire des anticorps spécifiques efficaces contre ce variant ( Figure 2 ) . Cela constitue l’autre faiblesse du virus : la latence de quelques jours avant l’apparition des symptômes, qui offre, si les anticorps sériques sont insuffisamment opérants, une fenêtre de temps permettant la multiplication des cellules mémoires les mieux adaptées, et une nouvelle vague de production d’anticorps plus efficaces.
| Figure 2.
La diversité de la population des lymphocytes B à mémoire contre le SARS-CoV-2 permet une réponse contre les variants.
On considère généralement que, si les plasmocytes issus de la réponse du centre germinatif sont fortement et étroitement sélectionnés pour la reconnaissance de l’antigène qui les a induits, les lymphocytes B à mémoire présentent, quant à eux, un répertoire plus large. Ils sont donc plus adaptés pour faire face aux mutations du virus, et leur forte capacité proliférative leur permet de dominer rapidement la réponse immunitaire lors d’une rencontre avec un variant [
15
]. Le répertoire des cellules à mémoire produites chez les patients infectés lors de la première vague épidémique contient des cellules capables de reconnaître et de neutraliser les variants du SARS-CoV-2, notamment les variants b (ex-sud-africain) et d (ex-indien) [
4
] (Sokal
et al.
, résultats non publiés).
|
Concernant les vaccins, les premiers travaux sur la mémoire immunitaire produite commencent à être publiés, avec un peu plus de recul. La réponse mémoire, en plus des anticorps sériques circulants, est bien présente après la vaccination, mais à un niveau plus faible qu’après une infection par le virus [ 12 , 13 ]. L’issue de la compétition entre le virus et le système immunitaire des personnes vaccinées dépendra de la dose minimale d’anticorps - encore inconnue - requise pour assurer le maintien de la protection et leur capacité neutralisante face aux variants. Il est ainsi possible que des vaccinations de rappel soient nécessaires pour instaurer une protection durable.
Dans un éditorial récent du journal Science , Antoni Fauci décrit les différents travaux, certains datant de plus d’une décennie, qui ont permis la réalisation rapide d’un vaccin contre le SARS-CoV-2 : la mise au point de techniques de vaccination reposant sur l’utilisation de l’ARN messager, et les études réalisées sur le VIH (virus de l’immunodéficience humaine) qui ont permis de concevoir l’assemblage de la protéine virale spike en trimères stables 5 [ 14 ]. Il faut également mentionner le caractère paradoxal de l’infection par le SARS-CoV-2, qui a facilité la conception même des différents vaccins, à savoir, la forte immunogénicité de ce virus et la capacité du système immunitaire à produire une réponse forte et durable chez la grande majorité des individus.