| |
| Med Sci (Paris). 37(8-9): 817–819. doi: 10.1051/medsci/2021128.Le récepteur neuronal de l’interleukine-1 induit la douleur dans les maladies inflammatoires chroniques Astrid Dauchez,1a* Antoine Hankard,1b* and Steve Lacroix2c 1Master 2 Immunologie Intégrative et Systémique (I2S), Parcours Immunologie, Mention BMC, Sorbonne Université
,
Paris
,
France
.
2Axe Neurosciences du Centre de recherche du CHU de Québec-Université Laval et Département de médecine moléculaire de l’Université Laval
,
Québec
,
Canada
.
MeSH keywords: Humains, Hyperalgésie, Interleukine-1, Neurones, Douleur, Récepteurs à l'interleukine-1 |
La douleur chronique est un symptôme majeur des maladies inflammatoires chroniques (MIC). Ses mécanismes sont complexes et potentiellement attribuables à l’inflammation et à des lésions neuronales persistantes. La surproduction de médiateurs pro-inflammatoires est impliquée dans différentes maladies inflammatoires chroniques, telles que la polyarthrite rhumatoïde (PR), l’arthrose et la sclérose en plaques (SEP). Parmi ces médiateurs, l’IL(interleukine)-1b a un rôle dans la genèse et la persistance de la douleur, en induisant directement la libération de nombreux médiateurs hyperalgésiques par les neurones et les cellules gliales [
1
]. Sa fonction est assurée
via
son récepteur de type 1, l’IL-1R1, exprimé au niveau des cellules endothéliales, mais aussi au niveau de la corne dorsale (relai des voies nociceptives) de la moelle épinière [
2
]. Il a été suggéré que le mécanisme conduisant à l’exacerbation de la douleur de la maladie autoimmune implique des neurones sensoriels exprimant les récepteurs TRPV1 (
transient receptor potential cation channel subfamily V member 1
) (canal ionique à potentiel de récepteur transitoire vanilloïde de type 1), eux-mêmes impliqués dans la douleur inflammatoire [
3
]. Cependant, le lien entre ce type de récepteurs et les médiateurs inflammatoires restent mal connus. Cette Nouvelle présente les acteurs impliqués dans la voie algique impliquant l’IL-1b à travers la présentation d’une étude récente réalisée par Mailhot
et al.
[
4
]
(
Figure 1
)
.
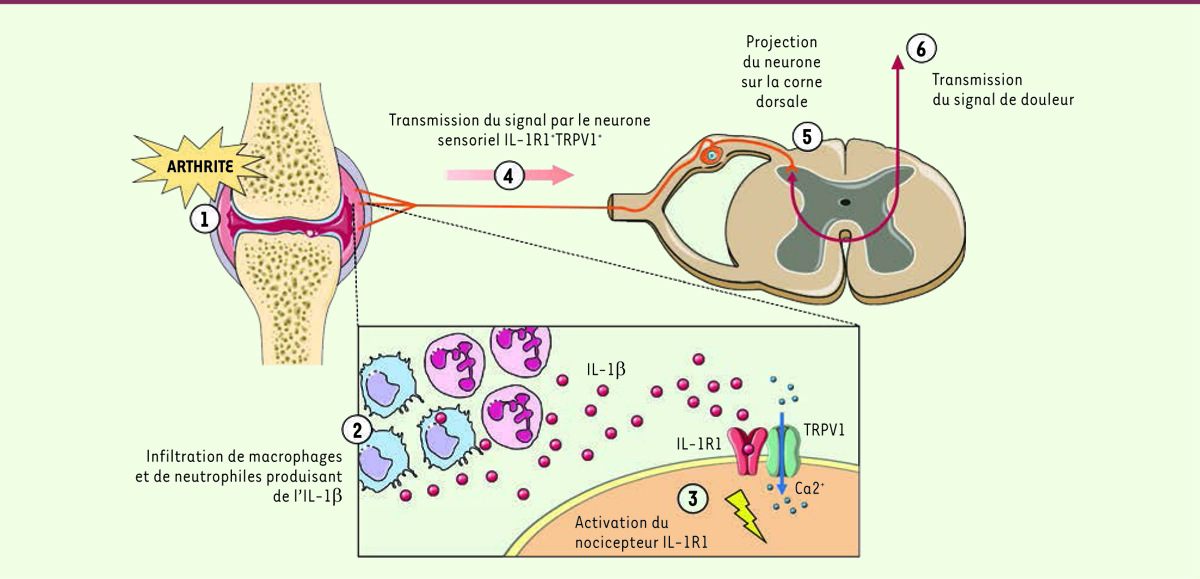
 | Figure 1.
Transmission du signal douloureux médié par les récepteurs neuronaux de l’IL-1 au cours de la polyarthrite rhumatoïde.
L’inflammation articulaire
(1)
se manifeste par le recrutement de cellules myéloïdes productrices d’IL-1β
(2)
. L’IL-1β ainsi produite active l’IL-1R1 fortement exprimé par une sous-population de neurones du ganglion spinal TRPV1+
(3)
. Le signal douloureux est transmis
(4)
vers leur premier relais central, situé dans la corne dorsale de la moelle épinière
(5)
. Puis il est ensuite acheminé vers le cortex cérébral
(6)
où l’information est intégrée. IL-1 : interleukine 1 ; IL-1R1 : récepteur de l’IL-1 de type 1 ; TRPV1 : canal ionique à potentiel de récepteur transitoire vanilloïde de type 1 ; Ca
2+
: ion calcium.
|
|
Implication de l’IL-1b dans la douleur inflammatoire
Les cytokines pro-inflammatoires ont un rôle important dans l’initiation et le phénomène de sensibilisation (augmentation de l’excitabilité des nocicepteurs) lors de la phase aiguë douloureuse de la maladie. L’hyperalgésie est ensuite entretenue par l’inflammation chronique [
1
]. Dans les MIC, la persistance de la douleur est liée à la sensibilisation des neurones sensoriels, mais aussi à l’activation des nocicepteurs
via
l’accumulation de cellules inflammatoires dans le système nerveux central et particulièrement au niveau du ganglion spinal, dans la corne dorsale [
5
]. La corne dorsale lombaire innerve les articulations atteintes dans la PR et l’arthrose. Les cytokines pro-inflammatoires sont également impliquées dans le développement de l’encéphalomyélite auto-immune expérimentale (EAE), le modèle animal le plus couramment étudié pour la SEP. Le ganglion spinal est supposé être une plateforme impliquée dans la genèse de la douleur chronique au cours des MIC. Les principales cellules productrices d’IL-1b sont retrouvées au niveau des racines dorsales spinales dans l’EAE, entourées d’axones exprimant les récepteurs IL-1R1. De même, dans des modèles murins de PR et d’arthrose, les nocicepteurs articulaires terminaux sont entourés de cellules myéloïdes productrices d’IL-1b. Ces régions sont innervées par des axones sensoriels exprimant le TRPV1 et l’IL-1R1. Cela suggère que l’IL-1b, qui joue un rôle clé dans l’initiation de l’inflammation, peut également déclencher des réponses neuronales de nocicepteurs spécialisés [
4
].
|
Identification d’un sous-type de nocicepteurs exprimant l’IL-1R1
La capacité de percevoir et discriminer diverses sensations est liée à l’existence de différents types de neurones sensoriels du ganglion spinal. Les nocicepteurs, des neurones spécialisés dans la douleur, sont identifiés par des marqueurs spécifiques [
6
]. Les neurones exprimant l’IL-1R1 dans la corne postérieure médullaire coexpriment un marqueur de nocicepteurs peptidergiques
1,
, TRPV1, et un marqueur de nocicepteurs non-peptidergiques, chez la souris et chez l’homme. Ils semblent donc avoir des propriétés mixtes et être un sous-type de neurones sensoriels qui répondraient à la libération d’IL-1β [
6
].
|
Rôle fonctionnel de l’IL-1R1 dans les neurones sensoriels exprimant TRPV1
Pour examiner le rôle fonctionnel de l’IL-1R1 exprimé par ces neurones, la réponse à l’IL-1β a été évaluée chez des souris sauvages (WT), des souris transgéniques n’exprimant pas l’IL-1R1 (
Il1r1-/-)
, et des souris chez lesquelles le gène
Il1r1
a été invalidé spécifiquement dans les neurones TRPV1+ (souris
Trpv1Cre :: Il1r1fl/fl
).
L’activation de l’IL-1R1 dans les neurones TRPV1
+
induit un comportement douloureux chez la souris. L’injection d’IL-1β murine recombinante (IL-1bmr) dans le nerf sciatique induit une activation cellulaire neuronale chez les souris WT, à la différence des souris
Trpv1Cre::Il1r1fl/fl
. L’injection intra-articulaire de l’IL-1βmr ne provoque pas de douleur chez les souris
Il1r1
-/-
, contrairement aux souris WT et aux souris dans lesquelles l’expression de l’IL-1R1 a été spécifiquement restaurée dans les nocicepteurs (souris
Trpv1Cre::Il1r1r/r
). Ces résultats indiquent que l’IL-1β peut stimuler directement les neurones sensoriels TRPV1
+
et que les neurones IL-1R1
+
jouent un rôle important dans la perception de la douleur durant l’inflammation.
|
Pour cette Nouvelle, Astrid Dauchez et Antoine Hankard, étudiants du Master 2 I2S, ont pris l’initiative de contacter l’auteur de l’article d’origine, le Professeur Steve Lacroix, et de lui proposer de guider leur travail et d’être tuteur et co-auteur de leur Nouvelle. Steve Lacroix a accepté avec enthousiasme et bienveillance et leur a donné de nombreux conseils précieux ! Il a également accepté de répondre à deux de leurs questions en lien avec sa thématique de recherche.
Deux questions à l’auteur, Steve Lacroix, professeur au Département de médecine moléculaire de l’Université Laval et directeur de l’axe Neurosciences du Centre de recherche du CHU de Québec–Université Laval (Canada).
Vous avez été la première équipe à décrire que l’activation des récepteurs neuronaux par l’IL-1 joue un rôle dans la douleur au cours des maladies inflammatoires chroniques. Pensez-vous qu’elle pourrait avoir, par des mécanismes de compensation, une action paradoxale analgésique au long terme ?
SL :
Je reste prudent à m’approprier le titre d’une telle découverte, car la recherche se bâtit en équipe et de façon incrémentale par des améliorations successives de découvertes antérieures. Quoi qu’il en soit, c’est avec humilité que notre équipe s’est donné comme but, dans les années à venir, d’étudier le potentiel analgésique du blocage des effets de l’IL-1β sur les nocicepteurs IL-1R1
+
. Je reste convaincu du potentiel d’une telle approche, sans toutefois réfuter l’existence de mécanismes compensatoires qui viendront sans aucun doute compliquer notre démarche.
Vous évoquez, dans votre étude, les situations infectieuses pour lesquelles il serait souhaitable de contrôler la douleur sans agir sur l’inflammation. Pensez-vous que cette stratégie est applicable en clinique ?
SL
: Oui, je pense que cette stratégie sera applicable en clinique mais nécessitera d’abord une meilleure compréhension des corécepteurs et des voies de signalisation associées aux effets de l’IL-1β sur les nocicepteurs, par opposition aux effets de cette cytokine sur les autres types cellulaires exprimant l’IL-1R1, tels que les cellules endothéliales et les cellules immunitaires. J’anticipe le fait que les protéines de signalisation sollicitées, suite à l’activation de l’IL-1R1 par l’IL-1β, puissent différer d’un type cellulaire à un autre, et que le fait de cibler l’une de ces protéines puisse devenir une cible thérapeutique encore plus prometteuse que l’IL-1R1 lui-même.
|
Le rôle de l’IL-1R1 dans la douleur a ensuite été étudié dans des modèles de MIC, notamment chez les souris
Trpv1Cre :: Il1r1fl/fl
, un modèle dans lequel les mécanismes immunitaires sous-jacents à l’induction d’une EAE sont inchangés. Le déficit d’expression de l’IL-1R1 dans les nocicepteurs empêche le développement de la douleur sans affecter l’évolution de la maladie (durée, gravité). Des résultats similaires ont été obtenus dans un modèle d’arthrite, et même dans un modèle d’arthrose. Dans le modèle d’arthrite, les souris
Trpv1Cre :: Il1r1fl/fl
développent moins d’allodynie
2
que les souris WT dans les moments précédant le pic inflammatoire. Dans le modèle de l’arthrose, la restauration
Trpv1Cre :: Il1r1r/r
rétablit les seuils de sensibilité à la douleur à des niveaux observés chez les souris WT. Ces résultats démontrent que la neutralisation de l’IL-1R1 dans les neurones sensoriels du ganglion spinal pourrait aider à prévenir la douleur associée à diverses MIC.
Ainsi, Mailhot
et al.
montrent qu’au cours des MIC, le recrutement de cellules myéloïdes productrices d’IL-1β active l’IL-1R1 exprimé par une sous-population de neurones TRPV1
+
du ganglion spinal. Le signal est transmis vers leur premier relai central situé dans la corne dorsale de la moelle épinière. Il est ensuite acheminé vers le cortex cérébral où l’information est intégrée
(
Figure 1
)
.
|
Vers des perspectives thérapeutiques
La contribution des cellules myéloïdes productrices d’IL-1β au développement de la douleur après une lésion d’un nerf périphérique a déjà été démontrée [
7
], suggérant que leur inhibition est une cible thérapeutique potentielle dans le traitement des MIC. Cependant, les mécanismes par lesquels cette production d’IL-1b stimule les nocicepteurs n’étaient pas bien compris jusqu’alors. Les résultats recueillis par Mailhot
et al.
[
4
] révèlent une proximité cellulaire entre les cellules productrices d’IL-1β et leur cible axonale IL-1R1
+
, dont la stimulation induit une activation directe et rapide des neurones sensoriels TRPV1
+
, qui précède l’apparition de la réponse douloureuse.
La voie IL-1β/IL-1R1 serait donc une cible thérapeutique de choix, et des injections intrathécales d’antagonistes du récepteur de l’IL-1 ont montré leur intérêt antalgique dans un modèle de douleur neuropathique chez le rat [
8
]. Un récent essai clinique randomisé de phase I a révélé que le lutikizumab, un anticorps monoclonal humanisé ciblant l’IL-1α et β, réduit l’inflammation chez les patients arthrosiques [
9
]. Cependant, cibler l’IL-1 dans cette maladie a été décevant au regard de la progression des dommages structuraux et de l’absence de bénéfice fonctionnel pour les patients [
10
]. Les résultats de l’étude de Mailhot
et al.
suggèrent que la production locale d’IL-1β peut directement déclencher la douleur par l’activation de l’IL-1R1 neuronal. Les thérapies ciblées sur l’axe IL-1β /IL-1R1 pourraient donc avoir un double effet sur l’inflammation et la douleur.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Oprée
A
Kress
M
Involvement of the proinflammatory cytokines tumor necrosis factor-alpha, IL-1 beta, and IL-6 but not IL-8 in the development of heat hyperalgesia: effects on heat-evoked calcitonin gene-related peptide release from rat skin.
.
J Neurosci.
2000;
;
20
:
:6289.
–
6293
.
2.
Lévesque
SA
Paré
A
Mailhot
B
et al.
Myeloid cell transmigration across the CNS vasculature triggers IL-1β-driven neuroinflammation during autoimmune encephalomyelitis in mice.
.
J Exp Med.
2016;
;
213
:
:929.
–
949
.
3.
Premkumar
LS
Sikand
P
TRPV1: a target for next generation analgesics.
.
Curr Neuropharmacol.
2008;
;
6
:
:151.
–
163
.
4.
Mailhot
B
,
Christin
M
,
Tessandier
N
, et al.
Neuronal interleukin-1 receptors mediate pain in chronic inflammatory diseases.
.
J Exp Med.
2020;
;
217
.
:e20191430.
.
5.
Arima
Y
Harada
M
Kamimura
D
et al.
Regional neural activation defines a gateway for autoreactive T cells to cross the blood-brain barrier.
.
Cell.
2012;
;
148
:
:447.
–
457
.
6.
Usoskin
D
Furlan
A
Islam
S
et al.
Unbiased classification of sensory neuron types by large-scale single-cell RNA sequencing.
.
Nat Neurosci.
2015;
;
18
:
:145.
–
153
.
7.
Nadeau
S
Filali
M
Zhang
J
et al.
Functional recovery after peripheral nerve injury is dependent on the pro-inflammatory cytokines IL-1β and TNF: implications for neuropathic pain.
.
J Neurosci.
2011;
;
31
:
:12533.
–
12542
.
8.
Sweitzer
S
Martin
D
DeLeo
JA
Intrathecal interleukin-1 receptor antagonist in combination with soluble tumor necrosis factor receptor exhibits an anti-allodynic action in a rat model of neuropathic pain.
.
Neuroscience.
2001;
;
103
:
:529.
–
539
.
9.
Wang
SX
Abramson
SB
Attur
M
et al.
Safety, tolerability, and pharmacodynamics of an anti-interleukin-1α/β dual variable domain immunoglobulin in patients with osteoarthritis of the knee: a randomized phase 1 study.
.
Osteoarthritis Cartilage.
2017;
;
25
:
:1952.
–
1961
.
10.
Persson
MSM
Sarmanova
A
Doherty
M
Zhang
W
Conventional and biologic disease-modifying anti-rheumatic drugs for osteoarthritis: a meta-analysis of randomized controlled trials.
.
Rheumatology (Oxford).
2018;
;
57
:
:1830.
–
1837
.
|