| |
| Med Sci (Paris). 37(11): 1062–1065. doi: 10.1051/medsci/2021161.Les sénolytiques contre la Covid-19 ? Chroniques génomiques Bertrand Jordan1* 1ADÉS (Anthropologie bioculturelle, droit, éthique et santé) UMR CNRS 7268, Aix Marseille université, Établissement français du sang. CoReBio PACA, case 901, Parc scientifique de Luminy
,
13288Marseille Cedex 09
,
France MeSH keywords: Vieillissement, Animaux, COVID-19, Vieillissement de la cellule, Essais cliniques de phase II comme sujet, Humains, Souris, SARS-CoV-2, Sénothérapie, effets des médicaments et substances chimiques, traitement médicamenteux |
Les cellules sénescentes, et leur élimination, continuent à intéresser de nombreuses équipes [
1
] (
→
).
(→) Voir la Chronique génomique de B. Jordan,
m/s
n° 5, mai 2018, page 885
Rappelons qu’il s’agit de cellules « presque mortes », qui ont cessé de se diviser et d’avoir une activité normale, mais qui persistent dans les tissus et libèrent un ensemble de molécules inflammatoires et de facteurs (protéases, facteurs de croissance, lipides bioactifs, pro-coagulants, etc.) qui constituent ce que l’on a appelé le phénotype sécrétoire associé à la sénescence (ou SASP pour
senescence-associated secretory phenotype
). Normalement, ce SASP stimule l’élimination des cellules sénescentes par le système immunitaire, mais chez les sujets âgés, cette élimination devient moins efficace et ces cellules s’accumulent dans différents tissus, causant une inflammation chronique et provoquant ou aggravant de nombreuses maladies (
→
).
(→) Voir le numéro thématique
Vieillissement et mort : de la cellule à l’individu
,
m/s
n° 12, décembre 2020
Plusieurs études menées chez la souris ont montré que l’élimination d’une partie des cellules sénescentes grâce à l’administration de molécules « sénolytiques », comme la fisétine
1,
ou le datasinib
2,
, améliorait l’état d’individus âgés et augmentait leur longévité [
1
] ; des essais cliniques en cours explorent l’effet de ces molécules sur différentes maladies chroniques liées à l’âge, avec des premiers résultats prometteurs [
2
]. Les caractéristiques cliniques de l’infection par le virus SARS-CoV-2 (
severe acute respiratory syndrome-coronavirus-2
), principalement sa gravité très fortement accrue chez les sujets âgés, amènent naturellement à s’intéresser au rôle des cellules sénescentes dans la COVID-19 (
coronavirus disease 2019
) et à la contribution du SASP à sa sévérité. C’est l’objet d’un article récemment paru dans la revue
Science
[
3
] et dont nous allons présenter les principaux résultats. Cet article, qui émane de plusieurs équipes américaines appartenant principalement à la
Mayo Clinic
(Rochester, Minnesota), rapporte des études effectuées sur des cellules de lignées humaines ainsi que chez la souris, et annonce deux essais cliniques de phase II.
|
Exacerbation du SASP lors de l’infection de cellules humaines
La stimulation du SASP peut être détectée par la mesure de l’expression d’une dizaine de gènes (codant des facteurs de transcription, ou différentes interleukines telles que MCP1 [
monocyte chemoattractant protein 1
]/CCL2 [
chemokine ligand 2
]
,
TNF-a [
tumor necrosis factor alpha
], etc.). Comme attendu, leur expression est augmentée dans les cellules humaines dont la sénescence a été induite par irradiation, mais l’incubation de ces cellules avec la protéine S1 (
Spike protein
)
3
du virus SARS-CoV-2 exacerbe également ce phénotype et augmente l’expression des protéines du SASP. Comme il s’agit en grande partie de cytokines, on peut envisager une relation avec l’« orage de cytokines » (
cytokine storm
) qui survient souvent dans les formes graves de COVID-19. Les auteurs ont alors étudié l’effet de ce SASP sur d’autres cellules en incubant ces dernières (non sénescentes) avec le milieu de culture (milieu conditionné) de cellules sénescentes. Dans la plupart des cas, ils ont observé une augmentation de l’expression de gènes impliqués dans l’entrée du virus, notamment les gènes
ACE2
(
angiotensin converting enzyme 2
), qui code le récepteur du virus, et
TMPRSS2
(
transmembrane serine protease 2
), qui code une protéase responsable du clivage de Spike. On peut donc en conclure que les cellules sénescentes agissent
via
l’expression du SASP sur les cellules avoisinantes (non sénescentes) et ainsi promeuvent la pathogenèse du SARS-CoV-2 en facilitant son entrée dans ces cellules. Au total, ces expériences réalisées
in vitro
sur des cellules de lignées humaines, montrent qu’en effet les cellules sénescentes sont plus sensibles aux infections virales que les cellules normales, et que leur sécrétion de molécules inflammatoires, stimulée par l’infection, peut agir dans leur environnement et augmenter la sévérité de l’infection.
|
Les souris âgées sont plus sensibles aux infections
La souris de laboratoire n’étant pas sensible au SARS-CoV-2 (à moins d’utiliser des modèles transgéniques très sophistiqués et sans doute peu représentatifs) [
4
], il faut trouver une approche autre que l’infection directe pour étudier dans ce modèle la réponse à ce type de virus. Celle qui est employée dans le présent article repose sur l’infection de souris de laboratoire par le jeu de pathogènes des animaux « sauvages ». Les souris de laboratoire, élevées dans des conditions proches d’une stérilité absolue, ne portent pas de pathogène connu et sont dites SPF (
specified pathogen-free
). Au contraire, les souris sauvages tout comme celles que l’on peut acheter dans les animaleries (
pet-store mice
) sont porteuses de nombreux microbes (bactéries et virus). On peut exposer des souris SPF à cet environnement microbien (que les auteurs baptisent NME pour
normal microbial experience
) en les hébergeant avec des souris du commerce, ou en les mettant en présence de litière précédemment utilisée par ces dernières, et étudier ainsi leur réponse à ces pathogènes [
5
]. Dans ces conditions, les souris SPF jeunes (3 mois) réagissent bien aux infections ainsi provoquées et survivent à 89 %, alors que des souris âgées (20 à 24 mois) succombent en quelques jours (
Figure 1
).
 | Figure 1.
Survie de souris jeunes (en gris) ou âgées (en noir) après mise en présence de la flore microbienne de souris « sauvages ».
NME (
normal microbial experience
) : période d’exposition à la litière de souris « sauvages ». Extrait partiel et modifié de la figure 3 de [
3
].
|
De plus, l’expression des gènes du SASP après infection est fortement augmentée chez les souris âgées par rapport aux souris jeunes. L’analyse des virus présents dans les souris SPF âgées survivantes 11 jours après le début de l’expérience, montre que l’espèce virale majoritaire est le virus MHV (
mouse hepatitis virus
), un coronavirus murin qui fait partie de la même famille que les SARS-CoV-1 et 2. Pour confirmer le rôle du MHV, une vaccination de souris SPF âgées par une faible dose de ce virus a été pratiquée avant leur mise en présence avec la litière d’animaux « sauvages ». On constate alors une protection quasiment totale de ces souris, alors même que la litière contient nombre d’autres virus et bactéries : cela montre que la maladie observée chez les souris SPF âgées est due essentiellement à l’infection par ce coronavirus murin. En somme on dispose ainsi d’un modèle murin d’infection par un coronavirus « naturel » montrant une forte influence de l’âge sur la gravité de l’affection, modèle qui va pouvoir maintenant être utilisé pour explorer l’effet des molécules sénolytiques sur le déroulement de la maladie.
|
Les sénolytiques réduisent l’inflammation et la mortalité après exposition au coronavirus
Les auteurs ont alors cherché à réduire le nombre de cellules sénescentes chez les souris âgées afin de savoir si cela améliore leur résistance à l’infection. Cette réduction peut être obtenue en administrant aux animaux, par voie orale, différents composés « sénolytiques » déjà caractérisés [
1
]. Le premier employé, la fisétine, un flavonoïde naturel, a un effet très favorable sur les souris âgées, sans présenter de toxicité [
1
,
6
]. Deux autres sénolytiques, généralement administrés en combinaison, le datasinib et la quercétine, ont également été utilisés [
7
]. Le datasinib est un inhibiteur des tyrosine-kinases, déjà employé en chimiothérapie pour des cancers hématologiques, et la quercétine un flavonoïde végétal dont la structure est proche de celle de la fisétine. De nombreuses combinaisons expérimentales sont possibles selon la durée d’exposition des souris au NME et le régime d’administration de la molécule sénolytique. La
Figure 2
montre le résultat obtenu pour une exposition au NME de 7 jours suivie d’un traitement semi-intermittent par la fisétine (trois jours de traitement, suivi de quatre jours d’arrêt durant au total trois semaines, mais avec une nourriture contenant une faible dose de fisétine).
 | Figure 2.
Survie de souris jeunes (en gris) ou âgées (en noir) exposées une semaine au NME
(normal microbial experience) puis traitées par la fisétine durant trois semaines (respectivement en orange et bleu pour les souris jeunes et âgées). La mortalité des souris âgées est fortement réduite par le traitement. Extrait partiel et modifié de la figure 4 de [
3
].
|
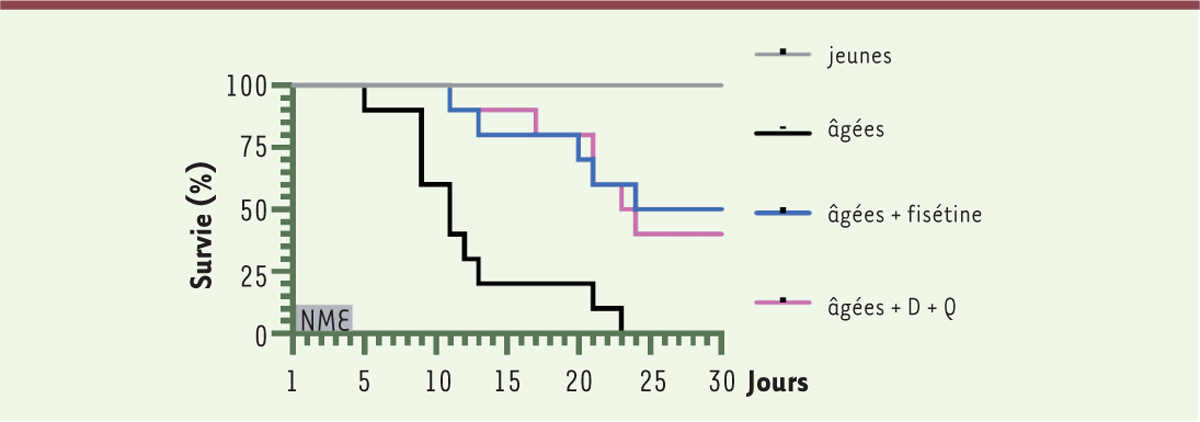
Comme précédemment, en l’absence de traitement, les souris jeunes survivent tandis que les souris âgées meurent en quelques jours ; le traitement par la fisétine annule la faible mortalité des souris jeunes et surtout entraîne une survie d’environ 50 % des souris âgées. La molécule sénolytique employée a donc un important effet protecteur sur les souris âgées infectées ; la mesure du taux d’anticorps anti-MHV (le coronavirus murin principal acteur de l’infection) montre que le niveau de ces anticorps, très diminué chez les souris âgées, remonte après traitement à un niveau comparable à ce qui est observé dans les souris jeunes. Enfin, l’expression des gènes du SASP est fortement réduite chez les souris âgées traitées par la fisétine, tout comme la quantité d’ARN messagers (ARNm) du virus MHV. Tout cela est cohérent avec l’hypothèse d’une élimination de cellules sénescentes grâce à la fisétine, rendant à ces souris âgées la capacité de lutter efficacement contre l’infection par le virus MHV. L’emploi du « cocktail » datasenib plus quercétine (D+Q) aboutit à des résultats similaires, tant en ce qui concerne la survie (
Figure 3
) que la présence d’anticorps anti-MHV.
 | Figure 3.
Effet comparé sur la survie de souris âgées d’un traitement par la fisétine
(en bleu) ou par le cocktail datasinib (D) plus quercétine (Q) (en rouge) après exposition au NME (normal microbial experience). En gris, la survie des souris jeunes après exposition. En noir, la survie des souris âgées dans les mêmes conditions. Extrait partiel et remanié de la figure 5 de [
3
].
|
Une dernière expérience a consisté à examiner si un effet protecteur subsiste lorsque les souris âgées sont traitées par une seule dose de fisétine administrée pendant l’exposition au NME : un allongement modéré mais bien réel (doublement) de leur survie est alors observé. Ce résultat est important car il suggère la possibilité de réduire significativement la mortalité induite par l’infection grâce à un traitement ponctuel par un sénolytique. |
Le modèle murin employé dans cette étude n’est pas parfait : l’infection par une flore microbienne issue de souris « sauvages » (NME) est bien moins précise et contrôlable que ne le serait une infection par le virus SARS-CoV-2, même si les auteurs montrent que l’espèce dominante dans la pathologie observée est le virus MHV, un proche parent. Mais la souris de laboratoire n’est pas sensible au virus responsable de la COVID-19, à moins de construire des souches transgéniques exprimant plusieurs protéines humaines [
4
]. Le système NME reste donc une approche pertinente en pratique [
3
,
5
]. Pour résumer les résultats obtenus, on voit que les cellules sénescentes présentes chez les souris âgées entretiennent un certain niveau d’inflammation liée à la sécrétion des protéines du SASP alors que ce niveau est très faible chez les souris jeunes. L’infection par le virus exacerbe l’inflammation chez les souris âgées, au point d’endommager les tissus avoisinants, alors qu’elle reste modérée chez les souris jeunes. Le traitement par les sénolytiques (fisétine, datasinib et/ou quercétine) élimine une partie des cellules sénescentes et préserve les tissus, augmentant ainsi fortement la survie des animaux traités.
Qu’en est-il chez l’homme ? L’élimination de cellules sénescentes est a priori une piste prometteuse pour soigner une infection virale comme celle du SARS-CoV-2 pour laquelle l’âge est un facteur de risque majeur. Les sénolytiques mentionnés dans cet article ont déjà été employés chez l’homme (principalement comme anticancéreux) et ne requièrent donc pas un essai clinique de phase I vérifiant leur tolérance et leur pharmacodynamique : on peut directement engager des essais de phase II visant à évaluer leur efficacité. Deux essais au moins sont en cours, tous deux émanant du même responsable, James Kirkland (
Mayo Clinic
), qui est l’un des auteurs
senior
de l’article discuté ci-dessus [
3
]. Il s’agit d’essais en bonne et due forme (essai randomisé contre placebo et en double aveugle). Le premier, débuté en août 2020, doit enrôler 70 personnes de plus de 65 ans atteintes de COVID-19 modérée, et vise à déterminer si l’apport de fisétine par voie orale (un traitement de deux jours) inhibe la progression de la maladie et diminue les réactions inflammatoires sévères. Les premiers résultats sont attendus en janvier 2022. Le deuxième essai, toujours de phase II, doit enrôler 150 personnes âgées de plus de 65 ans vivant en institution (
nursing home
, analogue à nos EHPAD
4
) et vise à obtenir la même information, mais cette fois avec deux traitements de deux jours à la fisétine. Il a débuté en août 2021, et les premiers résultats sont attendus en décembre 2023. Ces essais concernent donc un effectif modéré (mais c’est habituel pour une phase II) et ne donneront un résultat significatif que si l’effet thérapeutique est important – mais c’est une espérance raisonnable.
On attend donc ces résultats avec impatience, car les données précliniques sont très prometteuses, et la logique du traitement semble impeccable puisqu’il s’agit de traiter par l’élimination de cellules sénescentes une infection virale dont la sévérité est fortement liée à l’âge. La recherche de thérapies agissant sur la COVID-19 a été jusqu’ici peu fructueuse [
8
], espérons que, cette fois, notre attente ne sera pas déçue !
|
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
La
Jordan B
.
sénescence en passe d’être vaincue ?
.
Med Sci (Paris).
2018;
;
34
:
:885.
–
888
.
2.
Kellogg
DL
,
Kellogg
DL
Jr
,
Musi
N
,
Nambiar
AM
.
Cellular senescence in idiopathic pulmonary fibrosis.
.
Curr Mol Biol Rep.
2021
, pp.
:1.
–
10
, doi:
10.1007/s40610-021-00145-4
.
3.
Camell
CD
,
Yousefzadeh
MJ
,
Zhu
Y
,
et al.
Senolytics reduce coronavirus-related mortality in old mice.
.
Science.
2021;
;
373
:
:eabe4832.
.
5.
Huggins
MA
,
Jameson
SC
,
Hamilton
SE
.
Embracing microbial exposure in mouse research.
.
J Leukoc Biol.
2019;
;
105
:
:73.
–
79
.
6.
Yousefzadeh
MJ
,
Zhu
Y
,
McGowan
SJ
,
et al.
Fisetin is a senotherapeutic that extends health and lifespan.
.
EBioMedicine.
2018;
;
36
:
:18.
–
28
.
7.
Xu
M
,
Pirtskhalava
T
,
Farr
JN
,
et al.
Senolytics improve physical function and increase lifespan in old age.
.
Nat Med.
2018;
;
24
:
:1246.
–
1256
.
8.
Starshinova
A
,
Malkova
A
,
Zinchenko
U
,
et al.
Efficacy of different types of therapy for Covid-19: a Comprehensive Review.
.
Life (Basel).
2021;
;
11
:
:753.
.
|