| |
| Med Sci (Paris). 37(12): 1108–1115. doi: 10.1051/medsci/2021210.
L’imagerie
in vivo
Un outil incontournable pour mieux comprendre la biologie des vésicules extracellulaires Anaïs Bécot,1 Maribel Lara Corona,1 and Guillaume van Niel1,2* 1Inserm U1266, Institut de psychiatrie et neurosciences de Paris (IPNP)
,
102 rue de la Santé
,
75014Paris
,
France 2Groupe hospitalier universitaire (GHU) Paris psychiatrie et neurosciences
,
1 rue Cabanis
,
75014Paris
,
France |
Vignette (© Guillaume van Niel, Aurélie di Cicco, Graça Raposo, Daniel Levy).
La recherche dans le domaine des vésicules extracellulaires (VE) a connu un essor considérable ces dix dernières années, permettant de mieux comprendre leur biogenèse ainsi que leurs différents rôles physiologiques et pathologiques. Aujourd’hui, les efforts se concentrent sur l’utilisation de ces VE comme outils cliniques dans le diagnostic et le traitement de diverses maladies chez l’homme, comme les cancers ou les maladies neurodégénératives. Les VE forment une famille hétérogène de vésicules (ectosomes ou microvésicules, exosomes, etc.) entourées d’une bicouche lipidique et dont le diamètre varie de 50 nanomètres à plusieurs micromètres. Elles sont produites chez tous les organismes vivants et sont libérées par tous les types cellulaires chez les mammifères [
1
]. Leur libération est un processus physiologique qui peut néanmoins être altéré en conditions pathologiques, modifiant la quantité et la composition des VE sécrétées. Ces VE reflètent donc l’état physiopathologique de la cellule qui les produit et sont aujourd’hui considérées comme une nouvelle source de biomarqueurs en clinique [
2
,
3
]. Les VE participent également à de nombreux processus biologiques grâce à leur capacité de signalisation et de transfert de matériel d’une cellule à l’autre [
4
,
5
]. Ces caractéristiques ouvrent donc la voie à leur utilisation en tant que vecteur de diverses molécules thérapeutiques [
6
].
Les VE présenteraient en effet des avantages importants comparés aux biomarqueurs conventionnels et aux vecteurs thérapeutiques actuels, comme les liposomes
1,
: accessibilité, grande stabilité, forte bio-compatibilité, faible immunogénicité, capacité à traverser les barrières biologiques, etc. Leur fort potentiel thérapeutique se heurte cependant à un manque de connaissances fondamentales, notamment
in vivo
. En effet, la majorité des données actuelles repose sur l’analyse de VE isolées à partir de liquides biologiques (contenant des populations hétérogènes
2,
de VE) ou de surnageants
3
de cultures cellulaires (cultivées en masse sur des temps prolongés). En les dissociant de leur environnement initial, les étapes d’isolement utilisées empêchent d’accéder à des paramètres essentiels, tels que la dynamique de leur sécrétion, leur demi-vie, et,
in vivo
, leur origine et leur destinée. Ces méthodes d’isolement peuvent aussi affecter l’intégrité des VE, notamment des composés fragiles à leur surface et ainsi modifier leur fonction intrinsèque. Enfin, la plupart des études ayant été réalisées
in vitro
, il est difficile de savoir dans quelles mesures les connaissances actuelles sur les VE sont transposables aux conditions
in vivo
.
Afin de mieux comprendre la biologie des VE en temps réel et
in vivo
, plusieurs équipes ont développé des stratégies originales pour suivre ces vésicules dans différents organismes modèles vivants. Ces études se fondent principalement sur des techniques d’imagerie de plus en plus innovantes, à l’échelle de l’organe ou de la vésicule unique [
7
]. Le suivi des VE
in vivo
constitue néanmoins de vrais défis technique et translationnel, liés notamment à leur taille, leur hétérogénéité et le modèle
in vivo
choisi. Cette revue a pour but de présenter les différentes stratégies de marquage et d’imagerie développées pour suivre les VE dans plusieurs modèles animaux. Nous nous intéresserons également à l’intérêt de l’imagerie
in vivo
pour combler nos lacunes concernant la biologie des VE et favoriser leur utilisation comme outils cliniques.
|
Les stratégies d’imagerie pour étudier les VE in vivo
Que ce soit pour visualiser les VE libérées par des cellules en culture ou suivre les VE à l’échelle d’un organisme entier, la première étape consiste à trouver une stratégie permettant de les marquer de façon spécifique. Idéalement, cette technique doit permettre de suivre
in vivo
les VE de façon non invasive, unitaire et à une résolution subcellulaire. Actuellement, les stratégies proposées consistent soit à associer une molécule de marquage aux VE après leur isolement, soit à faire exprimer par la cellule productrice des « rapporteurs » génétiques qui seront intégrés aux VE pendant leur biogenèse [
8
-
11
]
(
Figure 1
)
. La stratégie choisie prédétermine donc la nature des VE étudiées : exogènes ou endogènes, mais aussi une population globale ou une sous-population spécifique de VE. La technique de marquage impose également le type d’imagerie à mettre en place, et
vice versa
. La visualisation des VE
in vivo
repose sur trois grands types d’imagerie : la tomographie, la bioluminescence et la fluorescence. Chaque approche a ses propres avantages et inconvénients en termes de résolution spatio-temporelle, de rapport signal/bruit
4,
ou de clairance du marqueur [
8
,
9
,
12
]
(
Figure 2
)
. Ainsi, le choix de la stratégie à utiliser dépendra de la question posée.
 | Figure 1.
Différentes techniques de marquage des vésicules extracellulaires avant ou après leur isolement.
Ces techniques permettent de marquer les VE durant leur biogenèse ou après leur isolement dans le but de les imager [
11
].
|
 | Figure 2.
Étude des VE
: de l’animal à la vésicule unique. Les différentes approches de marquage et d’observation permettent de couvrir l’ensemble des échelles, depuis l’animal entier jusqu’à la vésicule unique.
|
Une première stratégie consiste à marquer les VE après leur isolement à partir de surnageants de cultures cellulaires, de fluides ou de tissus biologiques, pour ensuite les analyser par différentes techniques d’imagerie. Par analogie à la médecine humaine, les techniques d’imagerie nucléaire, telles que la TEP, la TEMP ou l’IRM
5
[
42
] (
→
) ont été adaptées pour le suivi des VE chez la souris vivante. L’approche par TEP ou TEMP nécessite de marquer au préalable les VE isolées avec un radio-isotope
6
(le
99m
Tc par exemple), avant injection chez l’animal. Cette stratégie permet d’étudier la bio-distribution des VE à l’échelle de l’organe [
13
,
14
]. Les techniques d’IRM permettent, quant à elles, d’éviter les radiations et requièrent le marquage des VE par des nanoparticules magnétiques
7
(USPION [
ultra-fine superparamagnetic iron oxide nanoparticles
], GION [
gold-iron oxide nanoparticles
]) permettant une meilleure résolution spatiale que la TEP ou la TEMP [
15
-
17
].
(→) Voir le Forum de J.L. Coatrieux
et al.
,
m/s
décembre 2010, page 1103
Une grande partie des données sur le suivi des VE
in vivo
a néanmoins été obtenue grâce à l’utilisation de molécules bioluminescentes ou fluorescentes, membranaires ou intra-luminales, qui, une fois excitées, vont émettre de la lumière. Les marqueurs lipophiles (PKH 26, DiR/DiD) sont largement utilisés pour le suivi des VE par fluorescence, grâce à leur insertion dans la bicouche lipidique. Ces molécules, disponibles en un large panel de couleurs
8
, permettent de suivre la bio-distribution de populations hétérogènes de VE
in vivo
[
18
-
21
]. Cependant, leur tendance à s’agréger ainsi que leur longue durée de vie imposent de nombreux contrôles pour s’assurer des caractéristiques de l’échantillon marqué [
22
,
23
]. Ces différentes approches permettent d’étudier le comportement de VE exogènes dans leur ensemble et leur bio-distribution à l’échelle de l’organe, principalement [
24
].
Pour suivre les VE libérées
in situ
chez l’animal, plusieurs équipes se sont fondées sur l’expression dans les cellules productrices de protéines détectables par bioluminescence ou fluorescence. Ces protéines, telles que les XFP
9
[
X fluorescent protein
] [
43
] (
→
) permettent de marquer soit une population hétérogène de VE, par exemple avec l’expression cytosolique de la GFP dans des cellules cancéreuses [
25
], soit une sous-population de VE, grâce à la fusion de ces XFP avec un signal d’adressage à la membrane (par palmitoylation) [
26
] ou avec des protéines enrichies dans les VE (tétraspanines, synténine, etc.) [
27
,
28
]. L’utilisation de protéines fluorescentes sensibles au pH, comme la pHluorine
10,
, permet par ailleurs d’éviter que la fluorescence intracellulaire n’interfère avec la détection du signal émis par la VE une fois sécrétée [
27
]. Ces stratégies permettent d’analyser le trajet des VE dans les fluides biologiques et leur bio-distribution chez l’animal vivant en offrant une résolution allant jusqu’à la vésicule unique [
27
,
28
]. La technique de bioluminescence a également été adaptée récemment pour suivre les VE endogènes chez la souris, grâce à la fusion d’une nano-luciférase (Nluc) avec une protéine (la tétraspanine ou CD63) enrichie dans les VE (Nluc-CD63) [
29
]. L’imagerie par bioluminescence repose sur différents types de luciférases (G-luc [
gaussia luciferase
], R-luc [
renilla luciferase
]) émettant de la lumière après oxydation de leur substrat. Elles fournissent un rapport signal/bruit avantageux et permettent d’identifier les organes dans lesquels s’accumulent les VE injectées chez l’animal vivant [
30
-
33
]. Enfin, la récente combinaison de différentes stratégies de marquage se révèle être une approche très prometteuse pour l’étude des VE à différentes échelles [
29
,
31
,
34
].
(→) Voir la Nouvelle de L. Jullien et A. Gautier,
m/s
n° 6-7, juin-juillet 2017, page 576
|
En ce qui concerne les outils d’imagerie, les expériences fondées sur la bioluminescence ou la fluorescence peuvent être observées par microscopie confocale conventionnelle, permettant l’analyse d’évènements de l’ordre de la seconde (par exemple, la capture des VE). Cependant, pour le suivi des VE en mouvement, notamment dans la circulation sanguine, il est préférable d’utiliser des approches d’imagerie à haute vitesse d’acquisition. Ces techniques de marquage peuvent également être analysées en microscopie de super-résolution (STORM [
stochastic optical reconstruction microscopy
], STEM [
scanning transmission electron microscopy
]) ou en microscopie électronique, pour atteindre une résolution allant jusqu’au nanomètre, mais, le plus souvent, sur des échantillons fixés. La microscopie électronique combinée avec de l’imagerie en fluorescence (CLEM [
correlative light electron microscopy
]) permet de confirmer la spécificité du marquage des VE et d’explorer l’environnement des vésicules dans les organismes modèles à l’échelle ultra-structurale.
Les modèles animaux : l’avantage du poisson zèbre (
Figure 2
)
Bien que les études
in vitro
aient apporté des connaissances fondamentales sur les mécanismes de biogenèse, de sécrétion ou de capture des VE, elles n’ont pas permis d’apprécier les propriétés intrinsèques de ces vésicules
in vivo
(dynamique de sécrétion, diffusion, stabilité, cibles naturelles, fonctions). Plusieurs modèles, vertébrés ou invertébrés (nématode, drosophile, souris, poisson zèbre), ont été utilisés pour étudier le comportement des VE
in vivo
. Chaque modèle présente des avantages et des inconvénients, notamment en termes de résolution ou d’application clinique. Le choix du modèle dépendra donc à nouveau de la question posée. Les premières observations
in vivo
ont été réalisées dans différents modèles génétiques, chez le nématode (
Caernorhabditis elegans
) ou chez la drosophile (
Drosophila melanogaster
). Ces modèles permettent de suivre les VE endogènes avec une résolution subcellulaire et à l’échelle de l’animal entier. Ces études ont fourni des informations précieuses sur la biologie des VE et, notamment, sur leur rôle dans le développement, la communication entre les organes ou le comportement des animaux [
35
]. Cependant, ces modèles deviennent limitants pour l’étude des VE dans le contexte de maladies humaines. Les modèles murins (souris et rat) ont donc été largement utilisés pour étudier l’implication des VE dans la physiologie ou les maladies humaines, ainsi que, plus récemment, pour leur utilisation à des fins cliniques. La majorité des données sur le suivi des VE chez la souris se limite néanmoins à des observations à l’échelle de l’organe ou à des analyses
ex vivo
, après excision de l’organe à étudier [
36
]. De plus, en raison de la faible résolution obtenue chez la souris, il est probable que les VE de petite taille ne soient pas facilement détectées en utilisant cet animal. C’est pourquoi le poisson zèbre (Danio rerio), petit animal vertébré et transparent (embryons et larves, notamment
11,
), connaît un intérêt grandissant comme modèle alternatif pour le suivi des VE
in vivo
. En effet, ce modèle permet d’étudier facilement le comportement des VE, endogènes ou exogènes, à l’échelle de la vésicule unique dans le flux sanguin et dans l’organisme entier [
27
,
28
]
(
Figure 3
)
. Il présente de plus une grande homologie de structure, de gènes, de voies de signalisation avec l’homme, ce qui en fait un modèle préclinique très intéressant.
 | Figure 3.
Étude des VE par imagerie dans le poisson zèbre.
Imagerie des VE (en vert) dans la circulation sanguine ou phagocytées par des macrophages (en rouge) chez le poisson zèbre. Les VE ont été purifiées à partir de cellules surexprimant la CD63-pHluorine (rendant les VE vertes), puis injectées dans une lignée de poisson zèbre générant des macrophages exprimant un marqueur rouge (mpeg1:Gal4 ; UAS:nfsB-mCherry) (© M. Couty et V. Verdi).
|
L’imagerie in vivo pour étudier le cycle de vie des VE et leurs applications cliniques
Les récentes stratégies de marquage et de microscopie appliquées à différents modèles animaux ont permis de suivre en temps réel et avec une haute résolution le cycle de vie des VE et leur homéostasie
in vivo (
Figure 4
)
. Elles fournissent ainsi des informations capitales sur les propriétés intrinsèques des VE et sur l’influence des facteurs extrinsèques, qui permettront d’améliorer nos connaissances fondamentales sur l’homéostasie des VE et de développer leurs utilisations en clinique
(
Figure 5
)
.
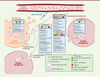 | Figure 4.
Intérêt de l’imagerie pour étudier le cycle de vie des VE.
La palette de stratégies de marquage des VE permet d’étudier les différentes étapes du cycle de vie des VE, depuis leur biogenèse et leur sécrétion jusqu’à leur capture et fonction(s) dans les cellules cibles, en passant par leur propagation par les fluides biologiques.
|
 | Figure 5.
Intérêt de l’imagerie pour étudier l’utilisation des VE en clinique.
L’imagerie permet d’améliorer les applications cliniques des VE comme outil de diagnostic pour détecter et suivre de façon non invasive la progression d’une maladie, mais également comme outil thérapeutique pour soigner les patients, soit en modulant la sécrétion ou la capture de ces VE, soit en utilisant les VE comme vecteurs de médicaments.
|
La biogenèse et la sécrétion des VE
Les mécanismes de biogenèse et de sécrétion des VE [
45
] (
→
) ont été étudiés majoritairement
in vitro
, révélant deux grandes populations de VE : les microvésicules issues de la membrane plasmique et les exosomes issus de la membrane des endosomes. Leur analyse
in vivo
nécessite l’utilisation de modèles produisant des VE endogènes facilement traçables, ce qui est maintenant possible grâce aux rapporteurs génétiques, comme la tétraspanine/CD63 couplée à la pHluorine (CD63-pHluorine). Cet outil a permis d’étudier indirectement les mécanismes de biogenèse d’une sous-population de vésicules dans un modèle génétique de poisson zèbre, en analysant la quantité de VE sécrétées par un type cellulaire donné dans le sang de l’animal, en l’absence de synténine
12,
[
27
]. Des approches similaires, centrées sur l’examen des glandes accessoires isolées de la drosophile, ont permis de suivre directement la formation de potentiels futurs exosomes dans leur compartiment d’origine et d’analyser ex vivo leurs mécanismes de biogenèse [
37
]. Ces approches sont encore restreintes à quelques types cellulaires particuliers et la biogenèse des exosomes reste difficile à analyser dans d’autres modèles animaux, en raison d’une résolution et d’une vitesse d’acquisition trop faible. Néanmoins, le développement de l’imagerie en trois dimensions (3D) à haute vitesse et la combinaison de différents marqueurs devraient permettre d’étudier les sous-populations
in vivo
et leurs fonctions respectives, ainsi que de distinguer les mécanismes impliqués dans la formation des sous-populations de VE, générées respectivement à la membrane plasmique et dans les endosomes. L’imagerie
in vivo
représente également un outil puissant pour répondre aux nombreuses questions concernant la biogenèse des VE (type cellulaire d’origine, fréquence de sécrétion, quantités sécrétées, localisation de la sécrétion) et les paramètres influençant leur sécrétion (environnement local, conditions pathologiques, cycle circadien, etc)
(
Figure 4
)
. Toutes ces notions, qui permettront de définir les caractéristiques de la sécrétion de VE, sont très importantes pour le développement de stratégies thérapeutiques fondées sur la modulation de la sécrétion des VE et leur utilisation en tant que modulateurs intrinsèques [
36
]
(
Figure 5
)
. Une meilleure compréhension de la biogenèse des VE pourrait également permettre d’identifier les types cellulaires produisant des VE en conditions pathologiques, facilitant ainsi l’isolement, à partir de fluides biologiques complexes, de « la » population de VE contenant les biomarqueurs d’intérêt pour le diagnostic d’une maladie donnée.
(→) Voir la Synthèse de R. Ghossoub
et al.
, page 1101 de ce numéro
La bio-distribution et l’adressage des VE
Une fois sécrétées, les VE peuvent éventuellement rejoindre les fluides biologiques puis des organes cibles plus ou moins distants du site de sécrétion. Cette distribution dépend fortement de leur microenvironnement (de la présence de barrière biologique, notamment) et des protéines qu’elles présentent à leur surface. L’imagerie
in vivo
permet de suivre en temps réel le comportement des VE dans ces fluides et d’étudier leur bio-distribution. Cette bio-distribution a été analysée majoritairement grâce à des injections de VE pré-purifiées et marquées, avec une résolution à l’échelle de l’organe chez la souris, ou de la vésicule chez le poisson zèbre. Ces études montrent que les VE s’accumulent préférentiellement dans des tissus (le foie, le rein, la rate, etc.) et des types cellulaires particuliers (cellules phagocytaires, cellules endothéliales « scavenger » [poubelle, en français]) impliqués dans la clairance cellulaire [
24
], et qu’elles pourraient également traverser la barrière hématoencéphalique après leur injection par voie intraveineuse [
38
]. L’injection de VE exogènes présente néanmoins plusieurs limites dans la mesure où les doses injectées ne reflètent pas forcément la physiologie de sécrétion/clairance des VE et contiennent souvent des populations hétérogènes de vésicules, dont il est impossible de différencier le devenir.
Une approche plus physiologique consiste à suivre les VE sécrétées de façon endogène, grâce à un rapporteur fluorescent. L’expression du CD63-pHluorine chez le poisson zèbre, dans un tissu spécifique, a permis de suivre une population endogène de VE dans le flux sanguin, depuis leur site de production jusqu’à leur destination [
27
]. Remarquablement, l’injection de VE exogènes (issues de cellules cancéreuses humaines) dans le poisson zèbre [
44
] (
→
) révèle une bio-distribution comparable aux VE endogènes, ainsi qu’une capture rapide par les macrophages
13,
[
27
,
28
]. Si ces similarités suggèrent des comportements proches entre VE endogènes et exogènes, de nombreux points restent à éclaircir concernant le devenir des VE
in vivo
. L’expression de marqueurs des diverses sous-populations de VE dans différents tissus chez le poisson zèbre permettra notamment d’étudier le comportement de ces sous-populations endogènes. De nombreux autres paramètres sont aussi à prendre en considération pour la bio-distribution et l’adressage des VE, qu’elles soient endogènes ou exogènes : les conséquences d’une condition pathologique pouvant potentiellement affecter la perméabilité des tissus, l’expression de récepteurs à la surface des cellules cibles, les capacités de clairance de l’organisme
(
Figure 4
)
.
(→) Voir la Synthèse de G. Follain
et al.
,
m/s
octobre 2020, page 872
Ces futures études, en cartographiant la distribution des VE en fonction de leur nature et de leur origine en conditions physiologique et pathologique, permettront aussi de définir la fenêtre de temps et le fluide biologique les plus pertinents pour l’isolement de VE qui seront utilisées en tant que biomarqueurs. Ces études renseigneront également sur des paramètres primordiaux pour l’utilisation des VE comme vecteurs de médicaments, notamment le site d’administration, les concentrations à injecter, le moment ou la fréquence d’injection, leur capacité à traverser les barrières biologiques, leur durée de vie et leur stabilité dans les fluides biologiques ou encore leur capacité à atteindre une cible déterminée. Les mécanismes de capture et de clairance des VE sont également très peu décrits
in vivo
, alors qu’ils sont indispensables pour le développement de stratégies thérapeutiques fondées sur la modulation de la capture des VE ou pour l’adressage des VE thérapeutiques vers l’organe cible
(
Figure 5
)
. Dans cette optique, le poisson zèbre, chez lequel de nombreuses maladies humaines ont été reproduites, apparaît comme un modèle préclinique idéal pour évaluer l’efficacité d’adressage de drogues encapsulées dans les VE à l’échelle cellulaire.
Le devenir et la fonction des VE dans la cellule réceptrice
Le devenir et la fonction des VE dans la cellule qui les reçoit, celle-ci pouvant se situer à proximité de la cellule sécrétrice (effet paracrine) ou à distance (effet endocrine), ne sont pas encore bien définis. L’adressage des VE à la cellule receveuse peut induire le transfert d’informations biologiques, soit par induction de voies de signalisation, soit par échange de protéines, de lipides ou d’acides nucléiques qu’elles transportent. Ces actions peuvent s’effectuer à la surface de la cellule receveuse, en particulier la signalisation, mais peuvent aussi requérir l’internalisation des VE et leur acheminent dans des compartiments intracellulaires. Plusieurs études, utilisant l’imagerie pour suivre différents rapporteurs exprimés par les VE, ont montré la libération,
in vivo
, de différents cargos (matériel génétique, enzymes, métabolites, etc.) transportés par les VE dans le cytoplasme des cellules receveuses [
25
,
39
-
41
]. Ces études utilisent néanmoins des stratégies qui ne permettent pas de visualiser directement le déversement du contenu de la VE dans la cellule receveuse. Elles suggèrent néanmoins que l’internalisation des VE est une étape nécessaire à ce transfert [
42
]. L’internalisation des VE ne semble cependant pas toujours associée à la fonction de transfert de cargo. Les VE pourraient également être internalisées après avoir induit une réponse cellulaire par interaction avec des récepteurs membranaires exprimés par les cellules receveuses. Une fois internalisées, les VE pourraient être captées par les lysosomes, comme cela est observé chez le poisson zèbre, où elles seraient dégradées, dans un but de clairance ou de support trophique [
27
,
28
]. Des études futures devront donc déterminer, pour chaque population de VE et pour chaque condition physiopathologique, les fonctions des VE dans la cellule receveuse – dégradation, support trophique, libération du contenu dans le cytoplasme, signalisation –, ainsi que les mécanismes cellulaires sous-jacents
(
Figure 4
)
.
En définissant avec plus de précision leurs fonctions
in vivo
, nous pourrons ainsi améliorer les approches cliniques utilisant les VE en tant que véhicules thérapeutiques ou modulateurs intrinsèques
(
Figure 5
)
. Il devient essentiel à cette fin de pouvoir corréler, à l’échelle de la cellule unique
in vivo
, la capture des VE avec, respectivement, l’induction de voies de signalisation et la délivrance de molécules. Nos connaissances des mécanismes cellulaires favorisant une voie ou une fonction en particulier seront également capitales pour améliorer les capacités de signalisation et de délivrance de ces VE. À nouveau, les avantages du poisson zèbre comme modèle préclinique pour analyser les capacités thérapeutiques des VE, le placent comme un organisme modèle de choix avant de passer à des modèles plus complexes comme les modèles murins.
|
Les avancées récentes réalisées en imagerie
in vivo
permettent à présent d’étudier avec précision les VE, en fournissant un large spectre d’outils de marquage, de microscopie et d’organismes modèles. Le poisson zèbre présente notamment de nombreux avantages pour l’imagerie des VE chez les vertébrés, permettant l’analyse des VE endogènes et exogènes, aux échelles vésiculaire, cellulaire ou de l’animal entier. L’imagerie à haute résolution spatio-temporelle ouvre des perspectives intéressantes pour répondre aux questions fondamentales sur la biologie des VE
in vivo
(biogenèse, sécrétion, trajet, adressage, fonction) en conditions physiologiques et pathologiques. Une meilleure caractérisation des VE
in vivo
permettra ainsi le développement d’outils cliniques innovants, destinés au diagnostic ou au traitement de diverses maladies.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Nous remercions l’ANR ZENITH (ANR-20-CE18-0026_01) pour le financement de Anaïs Bécot et de Maribel Lara Corona. Nous remercions Mickael Couty et Vincenzo Verdi pour les images utilisées en vignette.
|
Footnotes |
1.
van Niel
G
,
D’Angelo
G
,
Raposo
G
.
Shedding light on the cell biology of extracellular vesicles.
.
Nat Rev Mol Cell Biol.
2018;
;
19
:
:213.
–
228
.
2.
Quiroz-Baez
R
,
Hernández-Ortega
K
,
Martínez-Martínez
E
.
Insights Into the Proteomic Profiling of Extracellular Vesicles for the Identification of Early Biomarkers of Neurodegeneration.
.
Front Neurol.
2020;
;
11
:
:580030.
.
3.
Hoshino
A
,
Kim
HS
,
Bojmar
L
,
et al.
Extracellular Vesicle and Particle Biomarkers Define Multiple Human Cancers.
.
Cell.
2020;
;
182
:
:1044.
–
61.e18
.
4.
Yáñez-Mó
M
,
Siljander
PRM
,
Andreu
Z
et al.
Biological properties of extracellular vesicles and their physiological functions.
.
J Extracell Vesicles.
2015;
;
4
:
:1.
–
60
.
5.
Kalluri
R
,
LeBleu
VS
.
The biology, function, and biomedical applications of exosomes.
.
Science.
2020
;
:367.
6.
Fais
S
,
O’Driscoll
L
,
Borras
FE
et al.
Evidence-Based Clinical Use of Nanoscale Extracellular Vesicles in Nanomedicine.
.
ACS Nano.
2016;
;
10
:
:3886.
–
3899
.
7.
Verweij
FJ
,
Balaj
L
,
Boulanger
CM
,
et al.
The power of imaging to understand extracellular vesicle biology in vivo.
.
Nat Methods.
2021;
;
2021
:
:1.
–
14
.
8.
Gangadaran
P
,
Hong
CM
,
Ahn
BC
.
Current Perspectives on in Vivo Noninvasive Tracking of Extracellular Vesicles with Molecular Imaging.
.
Biomed Res Int.
2017
;
:2017.
.
9.
Betzer
O
,
Barnoy
E
,
Sadan
T
,
et al.
Advances in imaging strategies for in vivo tracking of exosomes.
.
Wiley Interdiscip Rev Nanomedicine Nanobiotechnology.
2020;
;
12
:
:e1594.
.
10.
Yi
YW
,
Lee
JH
,
Kim
SY
,
et al.
Advances in analysis of biodistribution of exosomes by molecular imaging.
.
Int J Mol Sci.
2020
;
:21.
.
12.
Lázaro-Ibánez
E
,
Al-Jamal
KT
,
Dekker
N
,
et al.
Selection of fluorescent, bioluminescent, and radioactive tracers to accurately reflect extracellular vesicle biodistribution in vivo.
.
ACS Nano.
2021;
;
15
:
:3212.
–
27
.
13.
Varga
Z
,
Gyurkó
I
,
Pálóczi
K
et al.
Radiolabeling of Extracellular Vesicles with 99mTc for Quantitative in Vivo Imaging Studies.
.
Cancer Biother Radiopharm.
2016;
;
31
:
:168.
–
173
.
14.
Gangadaran
P
,
Hong
CM
,
Oh
JM
,
et al.
In vivo Non-invasive Imaging of Radio-Labeled Exosome-Mimetics Derived From Red Blood Cells in Mice.
.
Front Pharmacol.
2018
;
:9.
.
15.
Hu
L
,
Wickline
SA
,
Hood
JL
.
Magnetic resonance imaging of melanoma exosomes in lymph nodes.
.
Magn Reson Med.
2015;
;
74
:
:266.
–
271
.
16.
Busato
A
,
Bonafede
R
,
Bontempi
P
et al.
Magnetic resonance imaging of ultrasmall superparamagnetic iron oxide-labeled exosomes from stem cells: A new method to obtain labeled exosomes.
.
Int J Nanomedicine.
2016;
;
11
:
:2481.
–
2490
.
17.
Jc Bose
R
,
Uday Kumar
S
,
Zeng
Y
,
et al.
Tumor Cell-Derived Extracellular Vesicle-Coated Nanocarriers: An Efficient Theranostic Platform for the Cancer-Specific Delivery of Anti-miR-21 and Imaging Agents.
.
ACS Nano.
2018;
;
12
:
:10817.
–
32
.
18.
Tian
Y
,
Li
S
,
Song
J
et al.
A doxorubicin delivery platform using engineered natural membrane vesicle exosomes for targeted tumor therapy.
.
Biomaterials.
2014;
;
35
:
:2383.
–
2390
.
19.
Smyth
T
,
Kullberg
M
,
Malik
N
et al.
Biodistribution and delivery efficiency of unmodified tumor-derived exosomes.
.
J Control Release.
2015;
;
199
:
:145.
–
155
.
20.
Hoshino
A
,
Costa-Silva
B
,
Shen
TL
et al.
Tumour exosome integrins determine organotropic metastasis.
.
Nature.
2015;
;
527
:
:329.
–
335
.
21.
Wiklander
OPB
,
Nordin
JZ
,
O’Loughlin
A
et al.
Extracellular vesicle in vivo biodistribution is determined by cell source, route of administration and targeting.
.
J Extracell Vesicles.
2015;
;
4
:
:1.
–
13
.
22.
Pužar Dominkuš
P
,
Stenovec
M
,
Sitar
S
,
et al.
PKH26 labeling of extracellular vesicles: Characterization and cellular internalization of contaminating PKH26 nanoparticles.
.
Biochim. Biophys. Acta - Biomembr.
2018;
;
1860
:
:1350.
–
61
.
23.
Chuo
STY
,
Chien
JCY
,
Lai
CPK
.
Imaging extracellular vesicles: Current and emerging methods.
.
J Biomed Sci.
2018;
;
25
:
:1.
–
10
.
24.
Kang
M
,
Jordan
V
,
Blenkiron
C
,
et al.
Biodistribution of extracellular vesicles following administration into animals: A systematic review.
.
J Extracell Vesicles.
2021
;
:10.
.
25.
Zomer
A
,
Maynard
C
,
Verweij
FJ
et al.
In vivo imaging reveals extracellular vesicle-mediated phenocopying of metastatic behavior.
.
Cell.
2015;
;
161
:
:1046.
–
1057
.
26.
Lai
CP
,
Kim
EY
,
Badr
CE
et al.
Visualization and tracking of tumour extracellular vesicle delivery and RNA translation using multiplexed reporters.
.
Nat Commun.
2015;
;
6
:
:1.
–
12
.
27.
Frederik Verweij
AJ
,
Revenu
C
,
Arras
G
et al.
Live Tracking of Inter-organ Communication by Endogenous Exosomes In Vivo.
.
Dev Cell.
2019;
;
48
:
(573–89)
:e4.
.
28.
Hyenne
V
,
Ghoroghi
S
,
Collot
M
et al.
Studying the Fate of Tumor Extracellular Vesicles at High Spatiotemporal Resolution Using the Zebrafish Embryo.
.
Dev Cell.
2019;
;
48
:
:554.
–
72 e7
.
29.
Luo
W
,
Dai
Y
,
Chen
Z
,
et al.
Spatial and temporal tracking of cardiac exosomes in mouse using a nano-luciferase-CD63 fusion protein.
.
Commun Biol.
2020;
;
3
:
:1.
–
9
.
30.
Takahashi
Y
,
Nishikawa
M
,
Shinotsuka
H
et al.
Visualization and in vivo tracking of the exosomes of murine melanoma B16-BL6 cells in mice after intravenous injection.
.
J Biotechnol.
2013;
;
165
:
:77.
–
84
.
31.
Lai
CP
,
Mardini
O
,
Ericsson
M
et al.
Dynamic biodistribution of extracellular vesicles in vivo using a multimodal imaging reporter.
.
ACS Nano.
2014;
;
8
:
:483.
–
494
.
32.
Kanada
M
,
Bachmann
MH
,
Hardy
JW
et al.
Differential fates of biomolecules delivered to target cells via extracellular vesicles.
.
Proc Natl Acad Sci USA.
2015;
;
112
:
:E1433.
–
E1442
.
33.
Gangadaran
P
,
Li
XJ
,
Lee
HW
et al.
A new Bioluminescent reporter system to study the Biodistribution of systematically injected tumor-derived Bioluminescent extracellular Vesicles in mice.
.
Oncotarget.
2017;
;
8
:
:109894.
–
109914
.
34.
Wu
AYT
,
Sung
YC
,
Chen
YJ
,
et al.
Multiresolution Imaging Using Bioluminescence Resonance Energy Transfer Identifies Distinct Biodistribution Profiles of Extracellular Vesicles and Exomeres with Redirected Tropism.
.
Adv Sci.
2020;
;
7
:
:2001467.
.
35.
Beer
KB
,
Wehman
AM
.
Mechanisms and functions of extracellular vesicle release in vivo – What we can learn from flies and worms.
.
Cell Adhes Migr.
2017;
;
11
:
:135.
–
150
.
36.
Androuin
A
,
Verweij
FJ
,
Niel
G van
.
Zebrafish as a preclinical model for Extracellular Vesicle-based therapeutic development.
.
Adv Drug Deliv Rev.
2021
.
37.
Fan
S
,
Kroeger
B
,
Marie
PP
,
et al.
Glutamine deprivation alters the origin and function of cancer cell exosomes.
.
EMBO J.
2020;
;
39
:
:e103009.
.
38.
Yang
T
,
Martin
P
,
Fogarty
B
et al.
Exosome delivered anticancer drugs across the blood-brain barrier for brain cancer therapy in Danio Rerio.
.
Pharm Res.
2015;
;
32
:
:2003.
–
2014
.
39.
Ridder
K
,
Sevko
A
,
Heide
J
et al.
Extracellular vesicle-mediated transfer of functional RNA in the tumor microenvironment.
.
Oncoimmunology.
2015;
;
4
:
:1.
–
8
.
40.
Thomou
T
,
Mori
MA
,
Dreyfuss
JM
et al.
Adipose-Derived Circulating miRNAs Regulate Gene Expression in Other Tissues.
.
Nature.
2017;
;
542
:
:450.
–
455
.
41.
Sterzenbach
U
,
Putz
U
,
Low
LH
et al.
Engineered Exosomes as Vehicles for Biologically Active Proteins.
.
Mol Ther.
2017;
;
25
:
:1269.
–
1278
.
42.
Bonsergent
E
,
Grisard
E
,
Buchrieser
J
,
et al.
Quantitative characterization of extracellular vesicle uptake and content delivery within mammalian cells.
.
Nat Commun.
2021;
;
12
:
:1.
–
11
.
43.
Coatrieux
JL
,
Velut
J
,
Dillenseger
JL
,
Toumoulin
C
.
De l’imagerie médicale à la thérapie guidée par l’image - Représentation en sciences du vivant (3).
.
Med Sci (Paris).
2010;
;
26
:
:1103.
–
1109
.
44.
Jullien
L
,
Gautier
A
.
Des sondes fluorescentes hybrides pour l’imagerie « à la demande » des protéines cellulaires.
.
Med Sci (Paris).
2017;
;
33
:
:576.
–
578
.
45.
Follain
G
,
Gensbittel
V
,
Benjmin Mary
B
,
et al.
Influence de la mécanique des fluides sur la formation des métastases.
.
Med Sci (Paris).
2020;
;
36
:
:872.
–
8
.
46.
Ghossoub
R
,
Leblanc
R
,
David
G
,
Zimmermann
P
.
Tétraspanines et syndécans : complices dans le « trafic » des exosomes ?
Med Sci (Paris).
2021;
;
37
:
:1101.
–
7
.
|






