La barrière épithéliale de l’intestin, qui dépend de l’intégrité de la muqueuse intestinale, présente une double fonction : elle permet l’absorption des nutriments tout en protégeant l’organisme contre les agressions provenant de l’environnement extérieur, telles que celles des microorganismes pathogènes et des toxines bactériennes présents dans la lumière intestinale. Les cellules de l’épithélium intestinal, organisées en monocouche, sont étroitement liées entre elles par différents complexes jonctionnels, dont celui des jonctions serrées ( tight junctions ), qui ont un rôle majeur dans le contrôle de la perméabilité paracellulaire 1 . Des dysfonctionnements de la fonction barrière de l’intestin, en particulier l’altération des jonctions serrées, sont caractérisés par une augmentation de la perméabilité intestinale, et ont été associés à la sévérité de nombreuses maladies intestinales, notamment les maladies inflammatoires chroniques de l’intestin (maladie de Crohn et rectocolite hémorragique) [ 1 ]. Une augmentation de la perméabilité intestinale a également été associée aux maladies neurodégénératives ou à certaines maladies métaboliques. Ainsi, les altérations de la barrière épithéliale intestinale contribuent, par exemple, au développement de l’obésité et de l’inflammation systémique de bas grade qui l’accompagne [ 2 ]. Le renforcement de la barrière épithéliale intestinale constitue donc une approche thérapeutique intéressante pour limiter les conséquences pathologiques d’une hyperperméabilité intestinale. Cette stratégie nécessite cependant une meilleure compréhension des mécanismes qui contrôlent la perméabilité intestinale afin d’identifier des cibles thérapeutiques.
L’AMPK ( AMP-activated protein kinase ), principalement décrite pour son rôle de senseur cellulaire dans l’homéostasie énergétique, est une protéine kinase activée en réponse à un déficit énergétique. Elle déclenche alors une reprogrammation métabolique qui se caractérise par l’inhibition des processus anaboliques non essentiels consommateurs d’ATP et par l’induction des voies cataboliques produisant de l’ATP, permettant ainsi le rétablissement de l’équilibre énergétique dans la cellule [ 3 , 4 ]. Son action ne se limite cependant pas au contrôle du métabolisme énergétique cellulaire. Elle est également impliquée dans l’assemblage des jonctions serrées et le contrôle de la perméabilité de l’épithélium rénal [ 5 , 6 ]. Plus récemment, des résultats similaires, obtenus avec les cellules épithéliales intestinales de la lignée Caco-2 issue d’un adénocarcinome colique humain, ont montré que l’activation pharmacologique de l’AMPK améliore l’assemblage des jonctions serrées à la suite d’une lésion, tandis que son inhibition provoque une altération de la localisation de la protéine ZO-1 ( zonula occludens 1 ) aux jonctions serrées, un défaut de résistance électrique trans-épithéliale et de la fonction barrière de l’épithélium [ 7 – 9 ]. Dans une nouvelle étude, nous avons cherché à approfondir in vivo la compréhension du rôle de l’activité AMPK dans l’homéostasie de l’épithélium intestinal [ 10 ]. Pour cela, nous avons produit un modèle de souris génétiquement déficientes pour les deux sous-unités catalytiques de cette kinase (AMPKα1 et AMPKα2) spécifiquement dans les cellules épithéliales intestinales. Nous avons ainsi évalué, grâce à ces souris, les conséquences de l’absence locale d’activité AMPK sur la perméabilité de l’intestin, sur sa susceptibilité à l’inflammation, et sur la composition du microbiote intestinal ( Figure 1 ).
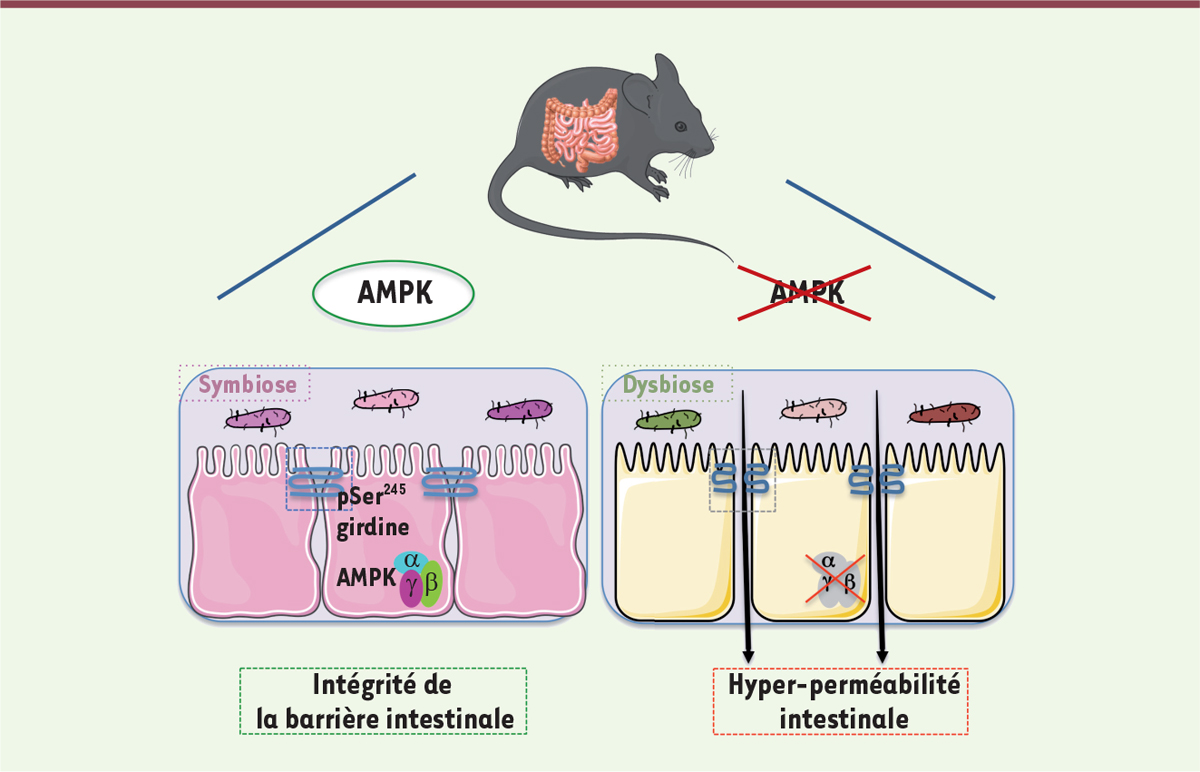
| Figure 1.
Conséquences fonctionnelles sur la perméabilité intestinale, la phosphorylation de la girdine et la composition du microbiote du côlon, de la suppression de l’activité de l’AMPK dans l’intestin chez la souris.
pSer245 désigne le résidu sérine de la girdine (en position 245) phosphorylé par l’AMPK.
|
L’intégrité de la barrière intestinale chez les souris dépourvues d’activité AMPK dans l’intestin a été étudiée en mesurant ex vivo la perméabilité transcellulaire et paracellulaire des différents segments de l’intestin grêle et du côlon placés dans une chambre de Ussing 2, . Nous avons ainsi constaté une augmentation de la perméabilité exclusivement dans le côlon distal, suggérant une anomalie de la barrière épithéliale dans ce segment intestinal. Ce phénotype n’était cependant pas associé à une différence dans la réponse immunitaire, comme l’ont montré les taux inchangés de cytokines pro-inflammatoires dans le côlon ou de lipocaline-2 3, dans les fécès chez ces souris. De plus, bien que l’activation de l’AMPK ait été associée à une diminution de la perméabilité paracellulaire in vitro , conjointement à l’augmentation des quantités des protéines de jonctions serrées ZO-1, claudine et occludine [ 7 , 8 , 11 – 13 ], nous n’avons observé aucune modification de l’expression ou de la distribution de ces protéines chez les souris mutantes. En revanche, nous avons constaté une réduction de la phosphorylation de la protéine d’échafaudage girdine, un substrat de la kinase AMPK qui participe à l’intégrité de l’épithélium intestinal en stabilisant les jonctions serrées [ 9 , 10 ] ( Figure 1 ).
Par ailleurs, l’analyse du microbiote fécal chez les animaux dépourvus d’activité AMPK dans l’intestin a révélé un changement significatif dans la composition de la communauté bactérienne intestinale, caractérisé notamment par un enrichissement en bactéries de l’ordre des Clostridiales et de la famille des Desulfovibrionaceae ( Figure 1 ). Ces dernières sont également plus abondantes chez les patients atteints de rectocolite hémorragique. Elles ont été associées à une réduction de l’épaisseur des muqueuses, avec altération de la barrière intestinale, facilitant ainsi le contact entre les antigènes bactériens et le système immunitaire local [ 14 ]. D’autres genres bactériens intestinaux, comme Dubosiella, Roseburia, Alloprevotella, Enterorhabdus et Anaerovorax , sont, eux aussi, plus abondants chez les souris dépourvues d’activité AMPK intestinale. Cependant, nous n’avons pas observé de changement majeur dans la composition des populations bactériennes intestinales chez ces souris mutantes lorsqu’elles sont nourries avec un régime enrichi en graisses, par rapport à des souris témoins soumises au même régime alimentaire. Le rôle de l’activité AMPK sur la composition, mais aussi sur la fonction du microbiote intestinal, reste donc à préciser, par exemple par des expériences de transfert de microbiote.
Bien qu’il existe un lien entre l’augmentation de la perméabilité intestinale et le développement de l’obésité et du diabète de type 2 [ 2 ], nous n’avons pas observé de modification de l’adiposité, de la tolérance au glucose, de la sécrétion de GLP-1 ( glucagon-like peptide 1 ) ou de la sensibilité tissulaire à l’insuline chez les souris dépourvues d’activité AMPK intestinale par rapport à des souris témoins, même après un régime riche en graisses. Par ailleurs, nous avons montré que l’activité AMPK intestinale n’est pas nécessaire pour améliorer la tolérance au glucose des souris après administration de metformine (un médicament anti-diabétique) par voie orale [ 15 , 16 ] ( → ).
(→) Voir la Synthèse de M. Foretz et B. Viollet, m/s n° 1, janvier 2014, page 82
Nous avons donc montré que l’activité AMPK joue un rôle important dans la fonction barrière de l’épithélium intestinal, en particulier dans le segment distal du côlon. Elle participe au contrôle de la perméabilité de cet épithélium en modulant la phosphorylation de la girdine, garante de l’intégrité des jonctions serrées entre les cellules épithéliales. Il existe par ailleurs une interaction complexe entre la composition du microbiote intestinal et l’activité AMPK des cellules intestinales. En effet, l’absence de cette activité est associée à une dysbiose 4 , qui pourrait, à long terme ou en cas d’inflammation locale, mener à des perturbations métaboliques. Il a en effet été suggéré que l’inhibition de l’activité AMPK des cellules intestinales pourrait empêcher les modifications bénéfiques de la diversité et de la composition microbienne induites par un régime riche en fibres [ 17 ]. Il reste donc à examiner si l’activation de la voie de signalisation AMPK par des approches pharmacologiques ou nutritionnelles (régime riche en fibres) pourrait permettre de renforcer la barrière épithéliale de l’intestin, en particulier dans le contexte de maladies associées à une augmentation de la perméabilité intestinale.