| |
| Med Sci (Paris). 38(3): 255–262. doi: 10.1051/medsci/2022024.Rôle de la succinate déshydrogénase dans le cancer Sophie Moog1 and Judith Favier1* 1Université de Paris, PARCC, Inserm UMR970, Équipe labellisée par la Ligue contre le cancer
,
Paris
,
France |
Vignette (© Bertrand Tavitian).
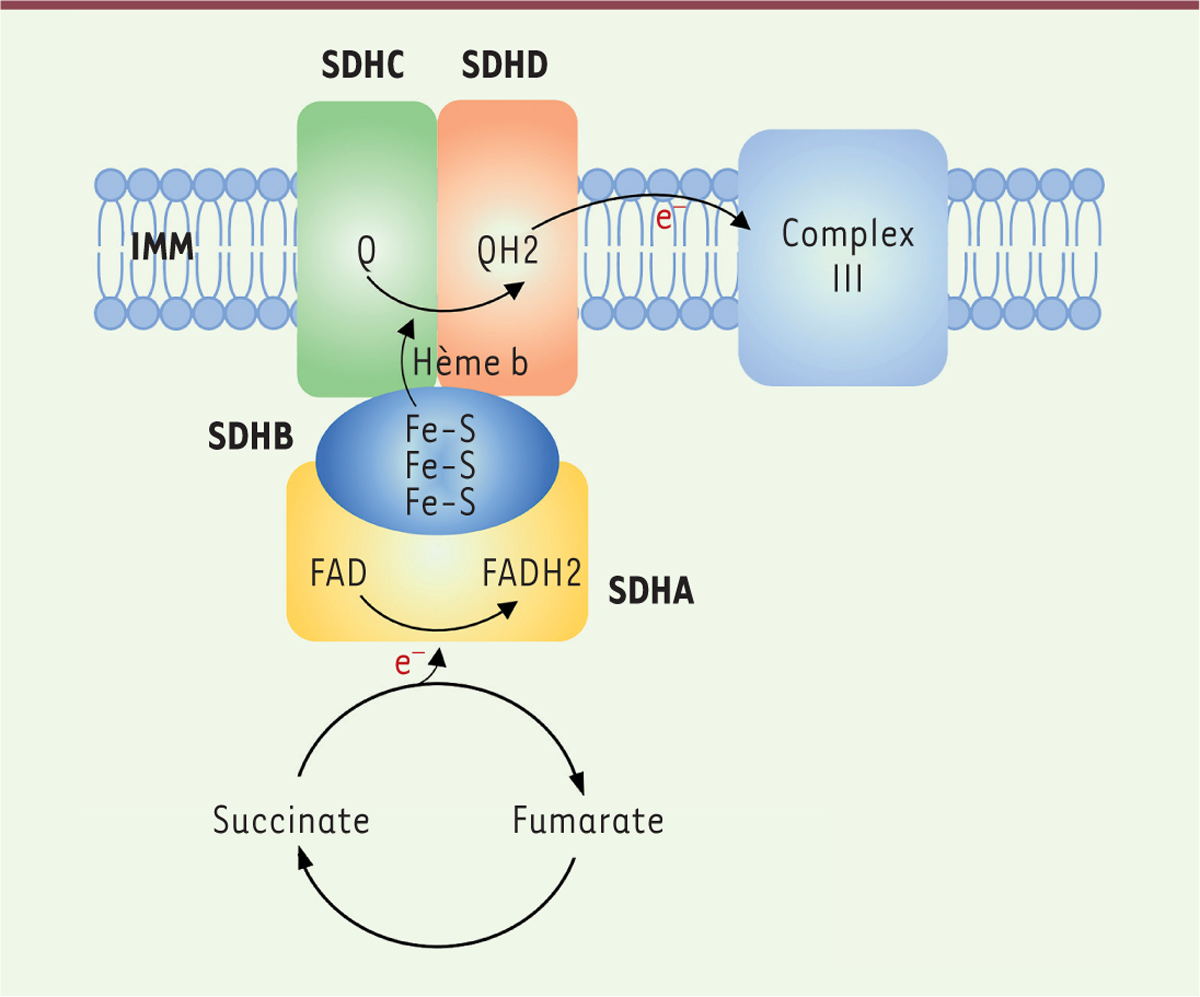
La succinate déshydrogénase (SDH) est une enzyme ancrée dans la membrane interne mitochondriale, qui catalyse l’oxydation du succinate en fumarate au cours du cycle de Krebs, tout en assurant le transfert d’électrons en tant que complexe II de la chaîne respiratoire mitochondriale. Elle est constituée de deux sous-unités d’ancrage (SDHC et SDHD) et de deux sous-unités catalytique (SDHA, SDHB), codées par quatre gènes nucléaires
SDHA, SDHB, SDHC, SDHD (
ou
SDHx).
La protéine SDHAF2 assure, quant à elle, l’assemblage du complexe. SDHA est une flavoprotéine au sein de laquelle le succinate est oxydé en fumarate tandis que les électrons produits par cette réaction sont transportés vers l’ubiquinone à travers les trois clusters Fer-Soufre de la sous-unité SDHB
(
Figure 1
)
. Initialement, des mutations homozygotes de certains des gènes codant la SDH furent décrites dans des encéphalopathies sévères (syndrome de Leigh) [
1
]. Près de 80 ans après l’hypothèse émise par Otto Warburg du lien entre dysfonction du métabolisme et cancer [
2
], l’identification, en 2000, des premières mutations du gène
SDHD
comme responsables de formes héréditaires de paragangliomes et de phéochromocytomes (PPGL), démontra pour la première fois qu’un défaut métabolique pouvait en effet être à l’origine du cancer [
3
]. Il fut par la suite démontré qu’une mutation constitutionnelle affectant chacun des gènes
SDHx
pouvait favoriser l’apparition de ces tumeurs neuroendocrines qui se développent aux dépens de la médullosurrénale pour les phéochromocytomes, ou des ganglions sympathiques (au niveau du thorax, de l’abdomen ou du pelvis) et parasympathiques (au niveau de la tête et du cou) pour les paragangliomes.
 | Figure 1.
Structure schématique de la succinate déshydrogénase (SDH), essentielle au fonctionnement du cycle de Krebs et du complexe II de la chaîne mitochondriale.
IMM : membrane mitochondriale interne ; Fe-S : cluster Fer-Soufre. FAD : flavine adénine dinucléotide ; FADH2 : flavine adénine dinucléotide réduite.
|
Les PPGL se caractérisent par une capacité à produire des catécholamines en excès ; ils sont marqués par un déterminisme génétique dans plus de 80 % des cas et une évolution métastatique dans 15 à 20 % des cas [
4
,
5
]. Les patients porteurs de mutations
SDHx
peuvent, beaucoup plus rarement, développer d’autres tumeurs, telles que les tumeurs stromales gastro-intestinales (GIST) ou les carcinomes rénaux à cellules claires (ccRCC). Quelques cas de tumeurs thyroïdiennes, de neuroblastomes, de ganglioneuromes, de tumeurs neuroendocrines pancréatiques ou d’adénomes hypophysaires ont également été rapportés dans la littérature [
6
-
8
]. Depuis quelques années, un nombre croissant de cancers (prostate, poumon, ovaire, mélanome, etc.) présentant une diminution de l’activité de la SDH et une accumulation de son substrat, le succinate, sans mutation constitutionnelle associée, a par ailleurs été décrit. Ces diminutions d’activité peuvent être liées à une hyperméthylation du promoteur des gènes
SDHC
[
9
] ou
SDHD
[
10
], ou à la surexpression du facteur TRAP1 (
tumor necrosis factor-associated protein 1
) qui inhibe l’activité de la SDH [
11
]. Enfin,
in vitro
, une diminution de l’activité de la SDH a été constatée en présence d’inhibiteurs de la SDH (SDHI), qui entrent dans la composition de pesticides utilisés à grande échelle comme antifongiques en agriculture, et dont les conséquences chez l’homme ne sont pas encore connues [
12
].
Le succinate accumulé en excès agit sur plusieurs voies d’oncogenèse en favorisant un état de « pseudo-hypoxie » et d’hyperméthylation, ainsi que des dérégulations de la réparation de l’ADN, du métabolisme énergétique et de la voie du stress oxydant : on dit alors qu’il joue un rôle « d’oncométabolite » [
13
].
|
Mutations des gènes de la SDH et phénotype clinique
Les gènes
SDHx
sont des gènes suppresseurs de tumeur. Ils suivent donc le modèle de «
two hit
» décrit par Al Knudson en 1971
1
, avec une mutation constitutionnelle hétérozygote associée à une perte d’hétérozygotie conduisant à une suppression complète [
14
] ou fortement altérée de l’activité de la SDH [
15
], dont la spécificité tissulaire reste mal comprise. Dans les PPGL, ces mutations sont transmises de manière autosomique dominante, à l’exception des mutations touchant les gènes
SDHD
et
SDHAF2
, qui sont soumises à empreinte maternelle, avec uniquement quelques cas de transmission maternelle décrits pour les mutations du gène
SDHD
[
16
]. Les mutations des gènes
SDHx
sont associées à différents phénotypes, en fonction de leur pénétrance, de leurs manifestations cliniques et de leur potentiel métastatique. Les PPGL présentant des mutations du gène
SDHB
ont une pénétrance estimée de 50 % à 50 ans, avec une évolution métastatique dans environ 50 % des cas. Ces PPGL représentent ainsi la très grande majorité des PPGL métastatiques [
17
,
18
]. Les mutations du gène
SDHD
conduisent principalement à des paragangliomes multiples de la tête et du cou, avec une pénétrance plus élevée (jusqu’à 80 %) mais avec un très faible potentiel métastatique [
19
]. Les mutations des gènes
SDHA, SDHC
et
SDHAF2
sont plus rares et il existe peu de corrélations entre génotype et phénotype pour ces gènes. Les mutations
SDHx
prédisposent, plus rarement, à d’autres tumeurs, telles que des adénomes hypophysaires, des GIST et des ccRCC
(
Figure 2
)
[
7
,
20
,
21
]. Les GIST SDH-dépendants se développent chez des patients plus jeunes et sont le plus souvent résistants aux inhibiteurs de tyrosine kinase.
 | Figure 2.
Localisations tumorales rares et fréquentes chez les patients porteurs de mutations des gènes codant la succinate déshydrogénase.
GIST : tumeurs stromales gastro-intestinales.
|
|
Le succinate, un oncométabolite
L’inactivation de la SDH entraîne une accumulation importante de son substrat, le succinate, qui exerce un rôle d’oncométabolite
(
Figure 3
)
. De la même façon, une mutation de la FH (fumarate hydratase), ou de l’IDH (isocitrate deshydrogénase), entraîne, dans le cycle de Krebs, un excès de fumarate, ou de 2-hydroxyglutarate, qui exercent ce même rôle d’oncométabolite [
13
]. L’excès de ces métabolites promeut le développement et la progression tumorale en inhibant plusieurs dioxygénases dépendantes du 2-oxoglutarate (2-OGDD) [
22
]. Les 2-OGDD forment une superfamille d’enzymes qui participent à de nombreux processus biologiques, dont l’adaptation à l’hypoxie,
via
les prolyl-hydoxylases (PHD), la reprogrammation épigénétique,
via
les enzymes TET (
Ten-eleven translocation
), des déméthylases de l’ADN, ou KDM (
histone lysine demethylase
), des déméthylases des histones, ou la maturation et la stabilité des fibres de collagène,
via
la prolyl-4-hydoxylase (P4H). Toutes les 2-OGDD partagent le même mécanisme d’action : elles utilisent l’oxygène, le fer à l’état réduit (Fe
2+
) et le 2-oxoglutarate (2-OG), bien que l’affinité de chacune des 2-OGDD pour ces molécules varie considérablement [
22
]. L’ascorbate joue un rôle de co-substrat indirectement en permettant à la réaction de se produire en empêchant l’oxydation du fer. Les oncométabolites, tels que le succinate, sont structurellement similaires au 2-OG. Leur accumulation (ou la diminution relative du 2-OG par rapport à ces analogues endogènes) empêche l’activation des 2-OGDD.
 | Figure 3.
Mécanismes d’oncogenèse associés à la perte d’activité de la succinate déshydrogénase.
Seule la perte de la sous-unité SDHB est associée à une augmentation des espèces réactives de l’oxygène (ROS).
|
|
Angiogenèse et pseudo-hypoxie dans les tumeurs SDH
L’angiogenèse fait partie des 10 «
hallmarks
» (caractéristiques) du cancer décrits par Hanahan et Weinberg [
23
] : elle est en effet indispensable au développement des cellules cancéreuses et à la dissémination métastatique. L’angiogenèse est finement régulée par le taux d’oxygène intracellulaire,
via
les facteurs de réponses à l’hypoxie, HIF1 et 2 (
hypoxia inducible factor 1 et 2
), et par une balance entre agents pro- et anti-angiogéniques, dont le VEGF (
vascular endothelial growth factor
). Parmi les 2-OGDD inhibées par le succinate en excès ou par un déséquilibre de la balance succinate/2-OG, on retrouve les HIF prolyl-hydroxylases (PHD1, 2 ou 3). À l’état physiologique (dans des conditions normoxiques), la sous-unité α des HIF est hydroxylée sur deux prolines spécifiques par l’une des PHD. Cette hydroxylation favorise la liaison des HIFα à pVHL (
von Hippel-Lindau protein
), qui est la sous-unité de reconnaissance de l’ubiquitine ligase qui ubiquitine les HIFα pour qu’ils soient dégradés [
24
,
25
]. Comme cela avait été démontré dans le cas de la perte de pVHL, on observe, dans les cellules tumorales des PPGL, une activation inappropriée des voies de réponse à l’hypoxie, liée aux mutations de
SDHx
, expliquant notamment la vascularisation particulièrement importante de ces tumeurs [
26
,
27
]. Ce phénomène appelé « pseudo-hypoxie » est désormais bien compris : il est lié à une stabilisation anormale des HIFα qui, même en présence d’une concentration normale d’oxygène, ne sont pas normalement hydroxylés, ubiquitinylés et dégradés par le protéasome, du fait de l’inhibition des PHD par le succinate en excès [
28
,
29
]. Les HIFα ainsi stabilisés se dimérisent avec HIF1β dans le noyau et activent la transcription de leurs gènes cibles en se liant à leurs promoteurs au niveau de séquence HRE (
hypoxia responsive element
). Les gènes cibles des HIF sont impliqués dans l’angiogenèse, la prolifération cellulaire, les métastases, la reprogrammation métabolique, la transition épithélio-mésenchymateuse, la résistance à la radiothérapie et à la chimiothérapie, etc. Les études de transcriptomique réalisées sur de larges collections de PPGL ont démontré l’existence de cette signature associée à la pseudo-hypoxie dans les tumeurs mutées sur les gènes
SDHx
et
VHL
[
30
,
31
]. Récemment, l’analyse plus fine de certains gènes cibles de HIF1a et de HIF2a a révélé une signature spécifique suggérant une activation préférentielle de HIF2a dans les tumeurs dont les gènes
SDHx
sont mutés
,
alors que dans les tumeurs dont le gène
VHL
est muté, les deux facteurs de transcription seraient activés [
32
].
In vitro,
différents travaux ont permis de démontrer l’importance de HIF2a dans l’acquisition de capacités métastatiques et de résistance au traitement dans les PPGL en général [
33
,
34
], et dans les cellules déficientes en
Sdhb
en particulier [
35
], dans lesquelles HIF2a est nécessaire à la transition neuroendocrino-mésenchymateuse (NMT), un processus qui permet aux cellules de quitter leur tissu d’origine pour migrer vers d’autres organes [
35
,
36
]. Ces résultats ouvrent la voie vers de nouvelles thérapies ciblant spécifiquement HIF2α [
37
].
|
Perte de la SDH et hyperméthylation de l’ADN et des histones
Parallèlement à cet état pseudo-hypoxique, il existe au sein des PPGL et des GIST SDH-dépendants, un état d’hyperméthylation de l’ADN permettant de réguler l’activité de très nombreux gènes [
38
,
39
]. Plusieurs 2-OGDD sont impliquées dans ce mécanisme : les TET, des dioxygénases qui hydroxylent les cytosines de l’ADN méthylé (5-méthylcytosine [5-mC]) en 5-hydroxyméthylcytosine (5-hmC), et les lysines déméthylases, des histones contenant le domaine JmjD (ou KDM). Contrairement aux mutations génétiques, la méthylation de l’ADN est un processus réversible ; il peut donc être ciblé pharmacologiquement. Dans une étude parue en 2013, nous avions mis en évidence, dans une collection de 145 PPGL issus du réseau COMETE, une méthylation anormalement élevée de plusieurs centaines de gènes entraînant leur répression transcriptionnelle dans les tumeurs dont les gènes
SDHx
sont mutés, et, de façon encore plus marquée, dans celles dont le gène
SDHB
est muté [
38
]. Ce phénotype hyperméthylateur a également été observé dans le modèle murin de cellules chromaffines
2,
immortalisées (imCC) dont le gène
Sdhb
a été délété (
Sdhb
-/-
). Parmi les gènes réprimés, on retrouve des gènes suppresseurs de tumeurs, tels que
RBP1
(
retinol-binding protein 1
), des gènes impliqués dans la synthèse des catécholamines, notamment
PNMT (phényléthanolamine N-méthyltransférase)
, des gènes participant à la réparation de l’ADN, comme
MGMT
(
O(6)-méthylguanine-DNA-méthyltransférase
), ou encore des gènes associés à la transition neuroendocrino-mésenchymateuse, tels que
KRT19
(
kératine 19
) [
36
,
38
]. La répression transcriptionelle de la PNMT, qui transforme la noradrénaline en adrénaline, explique ainsi le phénotype noradrénergique des tumeurs dont les gènes
SDHx
sont mutés [
40
]. Plus récemment, la quantification de 5-mC et de 5-hmC dans le génome des cellules tumorales, effectuée en utilisant la technique de séquencage haut-débit par RRBS (
reduced representation bisulfite sequencing
) oxydant, a permis de confirmer une diminution de l’hydroxyméthylation et une augmentation de 5-mC, suggérant que le phénotype hyperméthylateur était bien causé par une inhibition de la déméthylation oxydante plutôt que par un recrutement des méthyltransférases de l’ADN. Pour explorer cette hypothèse, nous avons établi une lignée de cellules imCC dans lesquelles les gènes codant les enzymes TET1 et TET2 ont été inactivés (imCC TET
KD
). Cette inactivation des enzymes reproduit le phénotype hyperméthylateur ainsi que les modifications fonctionnelles des cellules
Sdhb
-/-
,
telles que l’augmentation de leur adhérence et de leur migration, confirmant ainsi le rôle des TET dans l’oncogenèse des cellules déficientes en
SDHB
[
32
]. Par ailleurs, il existe une synergie entre pseudo-hypoxie et hyperméthylation, nécessaire à l’obtention du phénotype agressif des cellules
Sdhb
-/-
: lorsque les cellules imCC TET
KD
sont soumises à une hypoxie chronique (plus de 72 h), leur morphologie s’oriente vers un phénotype mésenchymateux avec, en regard, une augmentation des marqueurs associés, tels que les facteurs de transcription SNAIL ou TWIST1 (
twist family basic helix-loop-helix transcription factor 1
). Cet effet de l’hypoxie n’est pas observé dans les cellules imCC natives, en l’absence d’hyperméthylation de l’ADN. Cette synergie permet également l’acquisition de traits particulièrement agressifs
in vivo
, avec une augmentation de la capacité des cellules TET
KD
exposées à une hypoxie chronique, à former des métastases pulmonaires. Ces nouvelles données ouvrent là encore la voie vers de futures combinaisons thérapeutiques ciblant à la fois l’hyperméthylation et la pseudo-hypoxie.
|
Défaut de réparation de l’ADN dans les tumeurs SDH
Récemment, une corrélation entre un déficit en SDH ou en FH et l’augmentation des cassures doubles brins de l’ADN, par diminution de la recombinaison homologue, a été mise en évidence [
41
]. En effet, l’inhibition de KDM4B (
lysine déméthylase 4B
) par le succinate ou le fumarate en excès, entraîne un taux basal élevé de H3K9me3 (histone 3 lysine 9 triméthylée), ce qui ne permet pas le pic de triméthylation nécessaire au recrutement des facteurs de recombinaison homologue lorsqu’une cassure apparaît. Par ce mécanisme, les cellules déficientes en SDH ou en FH seraient ainsi plus sensibles aux inhibiteurs de PARP (poly(ADP-ribose) polymérase), une enzyme très conservée réparant les cassures simples brins de l’ADN.
|
Modification du métabolisme énergétique en absence d’activité SDH
Les mutations des gènes
SDHx
conduisent à la perte de l’activité enzymatique de la protéine, et donc, à l’interruption du cycle de Krebs, entraînant une reprogrammation du métabolisme cellulaire. Dans ce contexte métaboliquement compromis, les cellules déficientes en SDH consomment du pyruvate extracellulaire et suractivent la carboxylation du pyruvate (qui catalyse le pyruvate en oxaloacétate) pour se réapprovisionner en aspartate. L’aspartate est en effet un précurseur important pour la biosynthèse des protéines et des acides nucléiques, et l’inactivation de la pyruvate carboxylase par siARN dans les cellules dont le gène
Sdhb
est muté, entraîne un blocage de la prolifération cellulaire [
42
,
43
].
|
Perte de SDHB, dérégulation de la balance fer/cuivre et stress oxydant
Bien que l’ensemble des données que nous avons décrites représente une avancée majeure dans la compréhension de l’oncogenèse liée à un déficit en SDH, il n’explique cependant pas la cause exacte du phénotype métastatique spécifiquement associé aux mutations touchant
SDHB
. Pour répondre à cette question, nous avons récemment généré un nouveau modèle de cellules chromaffines dépourvues du gène
SDHD
par la technique de CRISPR-Cas9 (cellules
Sdhd
-/-
), que nous avons comparées aux cellules imCC
Sdhb
-/-
[
44
]. Cette étude a révélé que les cellules
Sdhd
-/-
et les cellules
Sdhb
-/-
sont toutes deux caractérisées par une accumulation similaire de succinate, mais que les cellules
Sdhb
-/-
présentent une transition neuroendocrino-mésenchymateuse ainsi qu’un phénotype hyperméthylateur et pseudo-hypoxique bien plus important que les cellules n’exprimant pas
Sdhd
, suggérant une inhibition plus importante des dioxygénases 2-OGDD dans ces cellules. En effet, seule la perte de la sous-unité SDHB (qui possède les clusters fer-soufre) entraîne une dérégulation de l’homéostasie du cuivre et du fer, avec une augmentation du cuivre mitochondrial et une augmentation du Fe
2+
cytosolique, engendrant un stress oxydant et la génération importante d’espèces réactives de l’oxygène (ROS) mitochondriales qui participent à l’inhibition plus importante des 2-OGDD [
44
]. Ces données réfutent l’idée que seul l’excès de succinate inhiberait les 2-OGDD dans ces tumeurs. Ainsi, dans les tumeurs dont le gène
SDHB
est muté, la combinaison de l’excès de succinate et de ROS inhiberait les différentes 2-OGDD, faisant de ces tumeurs des tumeurs particulièrement agressives. Il faut souligner qu’un traitement par fortes doses d’ascorbate ou de Mito-tempo, qui sont des anti-oxydants à faibles doses mais pro-oxydants à ces posologies, entraîne une exacerbation de ce stress oxydant mitochondrial menant à la mort cellulaire spécifique des cellules
Sdhb
-/-
[
44
,
45
]. L’ascorbate à forte dose étant bien toléré chez l’homme, son utilisation, seul ou probablement en combinaison avec d’autres thérapies, devrait être explorée dans ce type de cancer, comme c’est déjà le cas pour d’autres tumeurs [
46
].
|
Succinate et microenvironnement tumoral
Bien que son rôle dans le microenvironnement tumoral des PPGL ne soit encore que très peu connu, il est devenu évident ces dernières années que le succinate fonctionne également comme un métabolite de la signalisation extracellulaire et joue un rôle dans le microenvironnement tumoral
via
son récepteur SUCNR1 (également appelé GRP91, pour
G-protein-coupled receptor 91
) dans de nombreux autres types de cancers (poumon, ORL, prostate, ovaire, gastrique [
47
]). Cette production de succinate accompagne une baisse de l’activité de la SDH dans ces tumeurs sans mutation associée. Dans des modèles de cancers du poumon, le succinate agit à la fois de manière autocrine et paracrine sur les cellules du microenvironnement tumoral par la voie de signalisation PI3K (
phosphoinositide 3-kinase
)/HIF1α. Il affecte notamment les macrophages en les polarisant en macrophages associés aux tumeurs (TAM), ce qui favorise la progression tumorale et la dissémination métastatique. D’autres études ont démontré que le succinate promouvait l’angiogenèse tumorale
via
une surexpression du VEGF [
48
] et que l’expression de son récepteur SUCNR1 était liée à l’infiltrat lymphocytaire de la tumeur.
|
Apports diagnostiques et thérapeutiques Diagnostic
Depuis quelques années, il existe des marqueurs immunohistochimiques (IHC) permettant d’orienter l’analyse génétique dans les PPGL (et, par similitude, dans les autres tumeurs dont le gène
SDHx
est muté), avec, en particulier, le développement des analyses IHC spécifiques de la SDHB et de la SDHA. Ainsi, en cas de mutations sur l’un des gènes
SDHx
, le marquage immunohistochimique granulaire mitochondrial de SDHB est négatif, de manière reproductible et fiable
(
Figure 4
)
. Le marquage de la SDHA est, quant à lui, négatif dans les tumeurs dont le gène
SDHA
est muté, mais positif dans les autres tumeurs
SDHx
. L’analyse IHC de SDHD peut être utilisée en cas de difficulté d’interprétation des résultats de l’analyse IHC de SDHB [
49
]. D’autres marqueurs de méthylation de l’ADN, tels que la 5-hmC ou la méthylation d’histones (H3K9me3), peuvent également être utilisés à des fins de recherche [
38
,
50
].
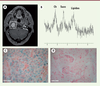 | Figure 4.
Biomarqueurs de tumeurs SDHx. A.
Imagerie par résonance magnétique (IRM) anatomique et
B.
Spectroscopie par résonnance magnétique (1H-MRS) chez un patient porteur d’un PGL dont un gène SDHx est muté. Le pic de succinate (Succ) est mesuré à 2,44 particules par minute. L’immunohistochimie spécifique de SDHB dans une tumeur sporadique
(C)
révèle un marquage granulaire mitochondrial dans les cellules tumorales alors que dans une tumeur SDHx
(D)
, seules les cellules endothéliales sont positives. Ch : pic de choline. Succ : succinate.
|
Dans les tumeurs
SDHx
, l’accumulation massive de succinate constitue un biomarqueur spécifique
in vitro
[
51
] mais aussi
in vivo.
Ainsi, la spectroscopie par résonnance magnétique (
1
H-MRS), optimisée pour la détection de succinate, a été utilisée
in vivo
dans un modèle d’allogreffes de cellules imCC
Sdhb
-/-
, et en clinique chez les patients atteints de PPGL [
52
,
53
]. Dans une étude prospective récente portant sur 49 patients dont 20 présentaient des mutations de
SDHx,
la sensibilité et la spécificité de cette technique ont été évaluées respectivement à 87 % et à 100 %, ce qui en fait un excellent biomarqueur de prédiction de mutations
SDHx
[
54
]. D’autres études sont actuellement en cours pour savoir si ce biomarqueur pourrait être utile dans la réponse au traitement, notamment après radiothérapie de PPGL non opérables.
Enfin, le dosage plasmatique du succinate n’est pas encore disponible en routine clinique mais certaines données laissent penser qu’il pourrait s’agir d’un marqueur diagnostique (voire pronostique) de cancer, évidemment chez les patients porteurs de mutations constitutionnelles dans les gènes
SDHx
, mais aussi chez les patients présentant un cancer du poumon, chez lesquels une augmentation de la concentration de succinate circulant a été récemment décrite [
47
].
Apports thérapeutiques
Les connaissances acquises sur l’oncogenèse dépendante de la SDH permettent d’envisager une médecine de précision
via
l’utilisation de thérapies ciblées. Ainsi, les inhibiteurs de tyrosine kinase, dont le sunitinib qui cible les récepteurs du VEGF, du PDGF (
platelet-derived growth factor
) et RET
3
, qui a une action antiangiogénique, semble particulièrement intéressant dans les PPGL métastatiques. Les résultats d’une étude de phase II (FIRSTMAPP, NCT01371201) seront connus prochainement. Conséquence directe du phénotype hyperméthylateur, le témozolomide, un agent alkylant, a une efficacité plus importante sur les tumeurs mutées
SDHB,
du fait de l’inhibition épigénétique de la méthylguanine méthyltransférase MGMT qui répare les cassures de l’ADN induites par ce traitement [
55
].
Finalement, cibler les conséquences de l’accumulation massive de succinate (et de ROS) dans les cellules cancéreuses est maintenant envisageable à l’aide des inhibiteurs d’HIF2a récemment développés pour le traitement du cancer du rein, d’agents déméthylants, d’inhibiteurs de PARP, ou encore d’agents pro-oxydants [
56
].
|
Depuis la découverte dans les années 2000 de la première mutation du gène
SDHD
dans les PPGL [
3
], les vingt années de recherche translationnelle passées ont permis de mieux appréhender toute la complexité de ces tumeurs et, en particulier, le rôle central des oncométabolites. Elles ont permis la mise en place d’une prise en charge personnalisée engendrant un meilleur pronostic chez ces patients [
57
]. De nombreuses stratégies diagnostiques et thérapeutiques innovantes découlent de ces découvertes ; elles sont ou seront bientôt testées en recherche clinique et permettront, espèrons-le, d’accroître la survie des patients présentant des tumeurs métastatiques.
|
Les auteures déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Bourgeron
T
Rustin
P
,
Chretien
D
,
et al.
Mutation of a nuclear succinate dehydrogenase gene results in mitochondrial respiratory chain deficiency.
.
Nat Genet.
1995;
;
11
:
:144.
–
149
.
2.
Warburg
O
.
On the origin of cancer cells.
.
Science.
1956;
;
123
:
:309.
–
314
.
3.
Baysal
BE
,
Ferrell
RE
,
Willett-Brozick
JE
,
et al.
Mutations in SDHD, a mitochondrial complex II gene, in hereditary paraganglioma.
.
Science.
2000;
;
287
:
:848.
–
851
.
4.
Lenders
JWM
,
Kerstens
MN
,
Amar
L
,
et al.
Genetics, diagnosis, management and future directions of research of phaeochromocytoma and paraganglioma: a position statement and consensus of the Working Group on Endocrine Hypertension of the European Society of Hypertension.
.
J Hypertens.
2020;
;
38
:
:1443.
–
56
.
5.
Favier
J
,
Amar
L
,
Gimenez-Roqueplo
AP
Paraganglioma and phaeochromocytoma: from genetics to personalized medicine.
.
Nat Rev Endocrinol.
2015;
;
11
:
:101.
–
111
.
6.
Ni
Y
,
Seballos
S
,
Ganapathi
S
,
et al.
Germline and somatic SDHx alterations in apparently sporadic differentiated thyroid cancer.
.
Endocr Relat Cancer.
2015;
;
22
:
:121.
–
130
.
7.
Niemeijer
ND
,
Papathomas
TG
,
Korpershoek
E
,
et al.
Succinate Dehydrogenase (SDH)-Deficient Pancreatic Neuroendocrine Tumor Expands the SDH-Related Tumor Spectrum.
.
J Clin Endocrinol Metab.
2015;
;
100
:
:E1386.
–
E1393
.
8.
Xekouki
P
,
Pacak
K
,
Almeida
M
,
et al.
Succinate dehydrogenase (SDH) D subunit (SDHD) inactivation in a growth-hormone-producing pituitary tumor: a new association for SDH?
.
J Clin Endocrinol Metab.
2012;
;
97
:
:E357.
–
E366
.
9.
Haller
F
,
Moskalev
EA
,
Faucz
FR
,
et al.
Aberrant DNA hypermethylation of SDHC: a novel mechanism of tumor development in Carney triad.
.
Endocr Relat Cancer.
2014;
;
21
:
:567.
–
577
.
10.
Weinhold
N
,
Jacobsen
A
,
Schultz
N
,
et al.
Genome-wide analysis of noncoding regulatory mutations in cancer.
.
Nat Genet.
2014;
;
46
:
:1160.
–
1165
.
11.
Sciacovelli
M
,
Guzzo
G
,
Morello
V
,
et al.
The mitochondrial chaperone TRAP1 promotes neoplastic growth by inhibiting succinate dehydrogenase.
.
Cell Metab.
2013;
;
17
:
:988.
–
999
.
12.
Bénit
P
,
Kahn
A
,
Chretien
D
,
et al.
Evolutionarily conserved susceptibility of the mitochondrial respiratory chain to SDHI pesticides and its consequence on the impact of SDHIs on human cultured cells.
.
PLoS One.
2019;
;
14
:
:e0224132.
.
13.
Morin
A
,
Letouze
E
,
Gimenez-Roqueplo
AP
,
et al.
Oncometabolites-driven tumorigenesis: From genetics to targeted therapy.
.
Int J Cancer.
2014;
;
135
:
:2237.
–
2248
.
14.
Gimenez-Roqueplo
AP
,
Favier
J
,
Rustin
P
,
et al.
The R22X mutation of the SDHD gene in hereditary paraganglioma abolishes the enzymatic activity of complex II in the mitochondrial respiratory chain and activates the hypoxia pathway.
.
Am J Hum Genet.
2001;
;
69
:
:1186.
–
1197
.
15.
Kim
E
,
Rath
EM
,
Tsang
VHM
,
et al.
Structural and functional consequences of succinate dehydrogenase subunit B mutations.
.
Endocr Relat Cancer.
2015;
;
22
:
:387.
–
397
.
16.
Burnichon
N
,
Mazzella
J-M
,
Drui
D
,
et al.
Risk assessment of maternally inherited SDHD paraganglioma and phaeochromocytoma.
.
J Med Genet.
2017;
;
54
:
:125.
–
133
.
17.
Amar
L
,
Baudin
E
,
Burnichon
N
,
et al.
Succinate dehydrogenase B gene mutations predict survival in patients with malignant pheochromocytomas or paragangliomas.
.
J Clin Endocrinol Metab.
2007;
;
92
:
:3822.
–
3828
.
18.
Hescot
S
,
Curras-Freixes
M
,
Deutschbein
T
,
et al.
Prognosis of Malignant Pheochromocytoma and Paraganglioma (MAPP-Prono Study): A European Network for the Study of Adrenal Tumors Retrospective Study.
.
J Clin Endocrinol Metab.
2019;
;
104
:
:2367.
–
2374
.
19.
Burnichon
N
,
Rohmer
V
,
Amar
L
,
et al.
The succinate dehydrogenase genetic testing in a large prospective series of patients with paragangliomas.
.
J Clin Endocrinol Metab.
2009;
;
94
:
:2817.
–
2827
.
20.
Janeway
KA
,
Kim
SY
,
Lodish
M
,
et al.
Defects in succinate dehydrogenase in gastrointestinal stromal tumors lacking KIT and PDGFRA mutations.
.
Proc Natl Acad Sci U S A.
2011;
;
108
:
:314.
–
318
.
21.
Ricketts
C
,
Woodward
ER
,
Killick
P
,
et al.
Germline SDHB mutations and familial renal cell carcinoma.
.
J Natl Cancer Inst.
2008;
;
100
:
:1260.
–
1262
.
22.
Losman
J-A
,
Koivunen
P
,
Kaelin
WG
.
2-Oxoglutarate-dependent dioxygenases in cancer.
.
Nat Rev Cancer.
2020;
;
20
:
:710.
–
26
.
23.
Hanahan
D
,
Weinberg
RA
.
Hallmarks of cancer: the next generation.
.
Cell.
2011;
;
144
:
:646.
–
674
.
24.
Jaakkola
P
,
Mole
DR
,
Tian
YM
,
et al.
Targeting of HIF-alpha to the von Hippel-Lindau ubiquitylation complex by O2-regulated prolyl hydroxylation.
.
Science.
2001;
;
292
:
:468.
–
472
.
25.
Ivan
M
,
Kondo
K
,
Yang
H
,
et al.
HIFalpha targeted for VHL-mediated destruction by proline hydroxylation: implications for O2 sensing.
.
Science.
2001;
;
292
:
:464.
–
468
.
26.
Favier
J
,
Brière
JJ
,
Burnichon
N
,
et al.
The Warburg effect is genetically determined in inherited pheochromocytomas.
.
PLoS ONE.
2009;
;
4
(
(9)
):
:e7094.
.
27.
Gimenez-Roqueplo
AP
,
Favier
J
,
Rustin
P
,
et al.
The R22X mutation of the SDHD gene in hereditary paraganglioma abolishes the enzymatic activity of complex II in the mitochondrial respiratory chain and activates the hypoxia pathway.
.
Am J Hum Genet.
2001;
;
69
:
:1186.
–
1197
.
28.
Briere
JJ
,
Favier
J
,
Benit
P
,
et al.
Mitochondrial succinate is instrumental for HIF1alpha nuclear translocation in SDHA-mutant fibroblasts under normoxic conditions.
.
Hum Mol Genet.
2005;
;
14
:
:3263.
–
3269
.
29.
Selak
MA
,
Armour
SM
,
MacKenzie
ED
,
et al.
Succinate links TCA cycle dysfunction to oncogenesis by inhibiting HIF-alpha prolyl hydroxylase.
.
Cancer Cell.
2005;
;
7
:
:77.
–
85
.
30.
Dahia
PL
,
Ross
KN
,
Wright
ME
,
et al.
A HIF1alpha regulatory loop links hypoxia and mitochondrial signals in pheochromocytomas.
.
PLoS Genet.
2005;
;
1
:
:72.
–
80
.
31.
Burnichon
N
,
Briere
JJ
,
Libe
R
,
et al.
SDHA is a tumor suppressor gene causing paraganglioma.
.
Hum Mol Genet.
2010;
;
19
:
:3011.
–
3020
.
32.
Morin
A
,
Goncalves
J
,
Moog
S
,
et al.
TET-Mediated Hypermethylation Primes SDH-Deficient Cells for HIF2α-Driven Mesenchymal Transition.
.
Cell Rep.
2020;
;
30
:
:4551.
–
66.e7
.
33.
Bechmann
N
,
Moskopp
ML
,
Ullrich
M
,
et al.
HIF2α supports pro-metastatic behavior in pheochromocytomas/paragangliomas.
.
Endocr Relat Cancer.
2020;
;
27
:
:625.
–
40
.
34.
Seifert
V
,
Richter
S
,
Bechmann
N
,
et al.
HIF2alpha-Associated Pseudohypoxia Promotes Radioresistance in Pheochromocytoma: Insights from 3D Models.
.
Cancers (Basel).
2021;
;
13
:
:385.
.
35.
Loriot
C
,
Burnichon
N
,
Gadessaud
N
,
et al.
Epithelial to Mesenchymal Transition Is Activated in Metastatic Pheochromocytomas and Paragangliomas Caused by SDHB Gene Mutations.
.
J Clin Endocrinol Metab.
2012;
;
97
:
:E954.
–
E962
.
36.
Loriot
C
,
Domingues
M
,
Berger
A
,
et al.
Deciphering the molecular basis of invasiveness in Sdhb-deficient cells.
.
Oncotarget.
2015;
;
6
:
:32955.
–
32965
.
37.
Toledo
RA
.
New HIF2alpha inhibitors: potential implications as therapeutics for advanced pheochromocytomas and paragangliomas.
.
Endocr Relat Cancer.
2017;
;
24
:
:C9.
–
19
.
38.
Letouze
E
,
Martinelli
C
,
Loriot
C
,
et al.
SDH Mutations Establish a Hypermethylator Phenotype in Paraganglioma.
.
Cancer Cell.
2013;
;
23
:
:739.
–
752
.
39.
Killian
JK
,
Kim
SY
,
Miettinen
M
,
et al.
Succinate dehydrogenase mutation underlies global epigenomic divergence in gastrointestinal stromal tumor.
.
Cancer Discov.
2013;
;
3
:
:648.
–
657
.
40.
Eisenhofer
G
,
Pacak
K
,
Huynh
TT
,
et al.
Catecholamine metabolomic and secretory phenotypes in phaeochromocytoma.
.
Endocr Relat Cancer.
2011;
;
18
:
:97.
–
111
.
41.
Sulkowski
PL
,
Sundaram
RK
,
Oeck
S
,
et al.
Krebs-cycle-deficient hereditary cancer syndromes are defined by defects in homologous-recombination DNA repair.
.
Nat Genet.
2018;
;
50
:
:1086.
–
1092
.
42.
Cardaci
S
,
Zheng
L
,
MacKay
G
,
et al.
Pyruvate carboxylation enables growth of SDH-deficient cells by supporting aspartate biosynthesis.
.
Nat Cell Biol.
2015;
;
17
:
:1317.
–
1326
.
43.
Lussey-Lepoutre
C
,
Hollinshead
KE
,
Ludwig
C
,
et al.
Loss of succinate dehydrogenase activity results in dependency on pyruvate carboxylation for cellular anabolism.
.
Nat Commun.
2015;
;
6
:
:8784.
.
44.
Goncalves
J
,
Moog
S
,
Morin
A
,
et al.
Loss of SDHB Promotes Dysregulated Iron Homeostasis, Oxidative Stress, and Sensitivity to Ascorbate.
.
Cancer Res.
2021;
;
81
:
:3480.
–
94
.
45.
Liu
Y
,
Pang
Y
,
Zhu
B
,
et al.
Therapeutic Targeting of SDHB-Mutated Pheochromocytoma/Paraganglioma with Pharmacologic Ascorbic Acid.
.
Clin Cancer Res.
2020;
;
26
:
:3868.
–
80
.
46.
Ngo
B
,
Van Riper
JM
,
Cantley
LC
,
et al.
Targeting cancer vulnerabilities with high-dose vitamin C.
.
Nat Rev Cancer.
2019;
;
19
:
:271.
–
282
.
47.
Wu
J-Y
,
Huang
T-W
,
Hsieh
Y-T
,
et al.
Cancer-Derived Succinate Promotes Macrophage Polarization and Cancer Metastasis via Succinate Receptor.
.
Mol Cell.
2020;
;
77
:
:213.
–
27.e5
.
48.
Mu
X
,
Zhao
T
,
Xu
C
,
et al.
Oncometabolite succinate promotes angiogenesis by upregulating VEGF expression through GPR91-mediated STAT3 and ERK activation.
.
Oncotarget.
2017;
;
8
:
:13174.
–
13185
.
49.
Broudin
C
,
Favier
J
,
Verkarre
V
,
et al.
[Pathologist contribution in the diagnosis of hereditary predisposition to paranganglioma and pheochromocytoma].
.
Ann Pathol.
2020;
;
40
:
:134.
–
41
.
50.
Hoekstra
AS
,
de Graaff
MA
,
Briaire-de Bruijn
IH
,
et al.
Inactivation of SDH and FH cause loss of 5hmC and increased H3K9me3 in paraganglioma/pheochromocytoma and smooth muscle tumors.
.
Oncotarget.
2015;
;
6
:
:38777.
–
38788
.
51.
Richter
S
,
Peitzsch
M
,
Rapizzi
E
,
et al.
Krebs cycle metabolite profiling for identification and stratification of pheochromocytomas/paragangliomas due to succinate dehydrogenase deficiency.
.
J Clin Endocrinol Metab.
2014;
;
99
:
:3903.
–
3911
.
52.
Lussey-Lepoutre
C
,
Bellucci
A
,
Morin
A
,
et al.
In Vivo Detection of Succinate by Magnetic Resonance Spectroscopy as a Hallmark of SDHx Mutations in Paraganglioma.
.
Clin Cancer Res.
2016;
;
22
:
:1120.
–
1129
.
53.
Varoquaux
A
,
le Fur
Y
,
Imperiale
A
,
et al.
Magnetic resonance spectroscopy of paragangliomas: new insights into in vivo metabolomics.
.
Endocr Relat Cancer.
2015;
;
22
:
:M1.
–
M8
.
54.
Lussey-Lepoutre
C
,
Bellucci
A
,
Burnichon
N
,
et al.
Succinate detection using in vivo 1H-MR spectroscopy identifies germline and somatic SDHx mutations in paragangliomas.
.
Eur J Nucl Med Mol Imaging.
2020;
;
47
:
:1510.
–
7
.
55.
Hadoux
J
,
Favier
J
,
Scoazec
JY
,
et al.
SDHB mutations are associated with response to temozolomide in patients with metastatic pheochromocytoma or paraganglioma.
.
Int J Cancer.
2014;
;
135
:
:2711.
–
2720
.
56.
Moog
S
,
Lussey-Lepoutre
C
,
Favier
J
.
Epigenetic and metabolic reprogramming of SDH-deficient paragangliomas.
.
Endocr Relat Cancer.
2020;
;
27
:
:R451.
–
63
.
57.
Buffet
A
,
Ben Aim
L
,
Leboulleux
S
,
et al.
Positive impact of genetic test on the management and outcome of patients with paraganglioma and/or pheochromocytoma.
.
J Clin Endocrinol Metab.
2019;
;
104
:
:1109.
–
1118
.
|