| |
| Med Sci (Paris). 38(6-7): 579–584. doi: 10.1051/medsci/2022084.La fibrose pulmonaire idiopathique Nathan Hennion,1 Jean-Luc Desseyn,1* Frédéric Gottrand,1 Lidwine Wémeau-Stervinou,2 and Valérie Gouyer1 1Univ. Lille, Inserm, CHU Lille, U1286 Infinite
,
F-59000Lille
,
France 2Service de pneumologie et immuno-allergologie, Centre de référence constitutif pour les maladies pulmonaires rares, CHU Lille
,
F-59000Lille
,
France |
Vignette (© DR).
La fibrose pulmonaire idiopathique (FPI) est une maladie caractérisée par une fibrose progressive du parenchyme pulmonaire, irréversible, de cause inconnue et limitée aux poumons [
1
] (
→
). La destruction de l’épithélium alvéolaire est à l’origine d’une diminution des échanges gazeux et d’une réduction des volumes pulmonaires qui conduisent au décès, avec une médiane de survie entre 2 et 5 ans [
2
]. La FPI est une maladie rare. Sa prévalence en France est estimée à 8,2 pour 100 000 habitants (soit environ 5 500 patients) et son incidence annuelle à 2,8 pour 100 000 habitants (soit environ 1 800 nouveaux cas par an) [
3
]. Trois millions de personnes souffriraient de cette maladie actuellement dans le monde [
4
] et une méta-analyse, publiée en 2015, prédit que ce nombre doublera d’ici 2030 [
5
]. Cette maladie est plus fréquente chez les hommes que les femmes, avec une moyenne d’âge au diagnostic de 65 ans [
6
]. Aucun traitement n’est efficace à ce jour pour guérir les patients atteints de FPI, exceptée la transplantation pulmonaire. Une des raisons principales de cette absence de traitement est que les mécanismes précoces de la maladie sont trop peu connus.
(→) Voir la Nouvelle de G. Savary
et al.
,
m/s
n° 10, octobre 2019, page 739
|
La fibrose
Les maladies fibrosantes seraient responsables de 45 % des décès dans le monde. La fibrose est une accumulation excessive et anormale de matrice extra-cellulaire
1
produite par les fibroblastes et les myofibroblastes, activés par des cytokines et des facteurs de croissance, avec, pour conséquence, une modification et une destruction progressive de l’architecture tissulaire de l’organe atteint [
7
]. Elle peut toucher différents organes, tels que le foie, le cœur, les reins ou les poumons. La fibrose peut, mais ce n’est pas toujours le cas, avoir pour origine une inflammation chronique.
Les pneumopathies interstitielles diffuses fibrosantes
La FPI appartient à une vaste famille de maladies touchant le poumon : les pneumopathies interstitielles diffuses (PID), un ensemble hétérogène de maladies caractérisées par une infiltration de l’interstitium pulmonaire par des cellules, de l’œdème ou une présence importante de matrice extra-cellulaire. Les PID présentent des degrés variables d’inflammation et de fibrose. Cette fibrose peut rester stable, ou progresser de façon autonome, sans besoin du déclencheur initial. La FPI est la plus sévère des PID fibrosantes. Le rôle de l’inflammation dans sa progression est mineur et son évolution est inéluctable
(
Figure 1
)
. Une classification des maladies pulmonaires fibrosantes est présentée dans le
Tableau I
.
 | Figure 1. Répartition des pneumopathies interstitielles. |
Tableau I.
| 1. Exposition (environnementale, médicamenteuse, professionnelle, etc.) |
| 2. Pneumopathies interstitielles idiopathiques (FPI, pneumonie interstitielle non spécifique idiopathique, etc.) |
| 3. Pathologie du tissu conjonctif (sclérodermie systémique, polyarthrite rhumatoïde, etc.) |
| 4. Sarcoïdose
5. Autres (pneumonie à granulocytes éosinophiles, etc.) |
Classification des pneumopathies interstitielles diffuses (d’après [
3
]).
|
La fibrose pulmonaire idiopathique
L’origine de la FPI reste inconnue. Les symptômes de cette maladie ne sont pas spécifiques
(
Tableau II
)
, expliquant le retard au diagnostic, qui est fréquent.
Tableau II.
| Toux sèche |
| Dyspnée d’effort |
| Râles crépitants auscultatoires |
| Hippocratisme digital |
| Cyanose et signes d’insuffisance cardiaque droite à un stade avancé |
| Altération de l’état général (rarement et de mauvais pronostic) |
Les symptômes et les signes cliniques de la FPI. |
|
Si l’origine de la FPI est inconnue, de nombreux facteurs qui la favorisent ont été rapportés, qu’ils soient environnementaux ou génétiques
(
Figure 2
)
.
 | Figure 2.
Facteurs et mécanismes mis en jeu dans le développement de la FPI.
Des facteurs environnementaux et génétiques sont associés à un risque accru de développer une FPI. Les atteintes caractéristiques se situent dans le secteur interstitiel, avec une multiplication des fibroblastes et leur différenciation en myofibroblastes, des dépôts de collagène, une réparation exacerbée, une reprogrammation des pneumocytes de type 2, du mucus riche en mucine gélifiante MUC5B sécrétée par les cellules Club dans la lumière alvéolaire, et une accumulation de cellules immunitaires. Le poumon perd en souplesse et en volume.
|
Les facteurs environnementaux favorisants Des facteurs de risque liés à l’environnement professionnel et extra-professionnel (exposition à la fumée de tabac, agriculture/élevage, oiseaux, coiffure, poussières végétale/animale, textile, métallique, poussières de bois, moisissures, pierre/sable/silice, feux de bois) ont été identifiés. D’autres facteurs de risque sont liés à des comorbidités (diabète, reflux gastro-œsophagien). Mais pour chaque malade, le rôle de ces facteurs de risque est souvent incertain et la cause de la maladie reste inconnue.
Les principaux facteurs environnementaux associés à une augmentation du risque de développer une FPI sont le tabagisme, des infections virales, l’inhalation chronique de particules de bois, de métaux ou de silice, ainsi que la prise de certains médicaments [
8
,
9
].
Les facteurs génétiques
Chez 5 à 10 % des personnes, la FPI survient dans un contexte familial ; le plus souvent, la transmission des caractères responsables est autosomique dominante [
10
].
Formes monogéniques de fibrose pulmonaire familiale
Des mutations touchant principalement deux grandes familles de gènes peuvent être identifiées chez 15 à 20 % des patients atteints de fibrose pulmonaire familiale [
11
] :
-
Des gènes associés à la régulation des télomères :
TERT (telomerase reverse transcriptase), TERC (telomerase RNA component), TINF2 (TERF1-interacting nuclear factor 2), DKC1 (dyskératose congénitale 1), RTEL1 (regulator of telomere elongation helicase 1), PARN (poly (A)-specific ribonuclease), NAF1 (nuclear assembly factor 1 ribonucleoprotein)
. Les mutations affectant ces gènes induisent une diminution de la taille des télomères. Elles modifient l’activité des cellules épithéliales alvéolaires de type 2 (AEC2) [
4
], mais peuvent également entraîner des atteintes hépatiques, médullaires ou cutanées.
-
Des gènes codant des protéines participant à la production de surfactant par les pneumocytes de type 2 :
SFTPA1 (surfactant protein A1), SFTPA2 (surfactant protein A2), SFTPC (surfactant protein C), ABCA3 (ATP-binding cassette sub-family A member 3), NKX2-1 (NK2 homeobox 1)
. La modification structurale de la protéine induite par la mutation est à l’origine d’un stress du réticulum endoplasmique.
Variants et polymorphismes génétiques
Plusieurs études d’association entre génotype et maladie ont identifié des polymorphismes nucléotidiques (ou SNP pour
single nucleotide polymorphism
) associés à une augmentation du risque de fibrose pulmonaire, en particulier de FPI. Il s’agit notamment de SNP situés dans les gènes
MUC5B
(
mucin 5B, oligomeric mucus/gel-forming
),
TERT
,
FAM13A
(
family with sequence similarity 13 member A
),
OBFC1
(
oligonucleotide/oligosaccharide-binding fold-contg 1
),
TOLLIP
(
Toll interacting protein
, inhibiteur du
transforming growth factor-
b
1
,
TGF-
b
1
), ou
ATP11A
(
ATPase phospholipid-transporting 11A
), ou dans des gènes impliqués dans le maintien de l’intégrité structurale des cellules entre elles, comme
DSP
et
DPP9
qui codent respectivement la desmoplakine et la dipeptidyl peptidase 9 [
4
].
Un polymorphisme (rs35705950) situé dans le promoteur du gène
MUC5B
est présent chez 10 % de la population caucasienne. La présence de l’allèle à risque multiplie le risque de développer une FPI par six, chez les porteurs hétérozygotes, et par vingt, chez les porteurs homozygotes. Ce polymorphisme est associé à la surexpression de la mucine gélifiante MUC5B et à sa délocalisation en périphérie du poumon, ce qui pourrait induire une inflammation chronique au niveau des cellules épithéliales alvéolaires. Il représente le SNP le plus communément retrouvé chez les patients atteints de FPI [
12
].
|
Certains des mécanismes moléculaires à l’origine de la FPI sont connus
(
Figure 1
)
, mais le ou les événement(s) déclencheur(s) reste(nt) hypothétique(s). Il est admis qu’une agression chronique de l’épithélium alvéolaire, par des poussières par exemple, stimulerait des voies d’activation de la réparation tissulaire [
12
]. Dans le tissu conjonctif, cette activation se traduit par une multiplication excessive des fibroblastes qui se différencient en myofibroblastes à l’origine de la formation des foyers fibroblastiques que l’on observe à la périphérie du poumon. Ces foyers produisent une importante quantité de facteurs de croissance, comme le TGF-β, et de matrice extracellulaire, qui rigidifie l’épithélium alvéolaire. Cette rigidification entraîne une diminution du volume pulmonaire et, donc, une perte progressive et irréversible des capacités respiratoires.
La délocalisation et l’accumulation de mucus en périphérie du poumon, dans des néo-structures dites en « rayon de miel », sont deux des caractéristiques de la FPI. Ce mucus est riche en mucine gélifiante MUC5B. Cette mucine est exprimée, normalement, uniquement par des glandes localisées dans la trachée et les grandes bronches, et par des cellules de surface spécialisées, appelées cellules Club, dans les petites bronches et les bronchioles. Des cellules ciliées et des cellules à mucus remplacent progressivement les pneumocytes de type 1 et les pneumocytes de type 2 alvéolaires, diminuant les capacités pulmonaires. On observe donc, au cours de la FPI, une « bronchiolisation » de l’épithélium alvéolaire qui est typique de cette maladie. Une hypothèse expliquant cette augmentation de mucus est qu’il ne serait pas évacué. Il constituerait alors un frein à la réparation tissulaire, voire un réservoir pour des agents agressifs à l’origine de l’inflammation. |
La mucine MUC5B, une molécule « émergente » dans la FPI
De tous les polymorphismes associés à la FPI, le variant situé dans la région promotrice du gène
MUC5B
est le facteur de risque génétique le plus important pour la survenue d’une FPI, que celle-ci soit sporadique ou familiale. La mucine MUC5B est ainsi devenue, depuis les premières études de polymorphismes réalisées en 2010, une molécule clé pour expliquer la survenue de la FPI.
MUC5B est une macro-glycoprotéine sécrétée par les cellules caliciformes, les glandes sous-muqueuses, et les cellules séreuses. Cette mucine est gélifiante
2
: elle se polymérise et capte des molécules d’eau pour former un gel de mucus [
14
]. En étant sécrété et en recouvrant les épithéliums, ce mucus participe à la protection des cellules épithéliales contre les particules toxiques et contre les agents pathogènes [
15
] (
→
). Chez la souris, l’invalidation du gène orthologue,
Muc5b
, a révélé que cette mucine était indispensable à la clairance mucociliaire et qu’elle protégeait les poumons d’éventuelles entrées d’agents pathogènes [
16
].
(→) Voir la Nouvelle de J.-L. Desseyn
et al.
,
m/s
n° 5,
mai
2017, page 478
|
Les agents pro-fibrosants
Le rôle de nombreuses molécules, des cytokines ou des facteurs de croissance, a été décrit comme étant à l’origine ou participant à la progression de la fibrose. Le
Tableau III
recense les principales molécules, les cellules qui les produisent, les cellules cibles, et leurs fonctions.
Tableau III.
| Molécules |
Origines |
Cibles |
Fonctions |
Références |
| TGF-β1 |
Macrophages |
Fibroblastes |
Action pléiotrope
:
– Différenciation des fibroblastes en myofibroblastes
– Inhibe la prolifération des cellules épithéliales alvéolaires
– Stimule la synthèse de la matrice extracellulaire
|
[
29
]
|
| IL-13 |
Lymphocytes Th2 |
Cellules souches de l’épithélium alvéolaire |
Bronchiolisation de l’épithélium alvéolaire
: les cellules souches des alvéoles se différencient en cellules à mucus et non en cellules épithéliales alvéolaires
|
[
30
]
|
| IL-1β |
Macrophages |
Fibroblastes Cellules épithéliales pulmonaires Neutrophiles Lymphocytes |
Stimule l’inflammation pulmonaire et la production de collagène, induisant une destruction tissulaire |
[
31
]
|
| TNF-α |
Fibroblastes |
Fibroblastes |
Action paracrine
Stimule la migration des fibroblastes
|
[
32
]
|
| PDGF-AB |
Macrophages |
Fibroblastes |
Substance mitogène
– Stimule la migration de fibroblastes – Augmente la production de collagène
|
[
33
]
|
| LPA |
Synthèse extracellulaire |
Cellules épithéliales Cellules endothéliales Fibroblastes |
– Apoptose des cellules épithéliales – Augmentation de la perméabilité vasculaire – Stimule la prolifération, la persistance et le recrutement des fibroblastes |
[
34
]
|
Les principales molécules pro-fibrosantes intervenant dans la FPI.
TGF-β1 :
transforming growth factor
b
1
; IL-13 : interleukine 13 ; IL-1β : interleukine 1b ; TNF-α :
tumor necrosis factor
a ; PDGF-AB :
platelet-derived growth factor AB
; LPA :
lysophosphatidic acid.
|
|
Le diagnostic de la FPI est désormais bien codifié, et implique des pneumologues, des radiologues et des anatomo-pathologistes spécialisés, au sein d’équipes multidisciplinaires [
17
,
18
]. Il repose sur la présence de signes spécifiques observés sur un scanner thoracique : aspect dit de pneumopathie interstitielle commune, associant des réticulations, des bronchectasies par traction, des images en rayon de miel, avec une distribution sous-pleurale et un gradient apico-dorsal, ainsi que l’exclusion de toute autre cause de fibrose pulmonaire
(
Figure 3
)
. Si la combinaison des données cliniques et des images du scanner thoracique ne permet pas d’établir clairement le diagnostic, une biopsie pulmonaire (chirurgicale ou par cryobiopsie
3
) devient nécessaire. Cependant, cette intervention est invasive et non dénuée de risque pour le patient. D’autres approches diagnostiques sont donc en cours de développement, comme l’identification de marqueurs biologiques circulants, tels que les métalloprotéases MMP1 et MMP7 [
19
], ou l’utilisation d’une approche par intelligence artificielle utilisant les données d’expression de gènes sans
a priori
, obtenues par des analyses réalisées par utilisation de
micro-arrays
ou par séquençage d’ARN [
20
].
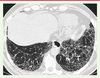 | Figure 3.
Coupe scanographique passant par les bases pulmonaires, montrant les réticulations intralobulaires et les rayons de miel, de topographie prédominante sous-pleurale
(
Bull Acad Natle Méd
2010 ; 194 : 353-65, séance du 2 février 2010).
|
|
Les traitements pharmacologiques
La FPI est une maladie grave, pour laquelle il n’existe pas de traitement curatif en dehors de la transplantation pulmonaire. Celle-ci est envisagée chez tous les patients âgés de moins de 65 ans dont le diagnostic définitif de FPI est établi, si la maladie est sévère ou s’aggrave. Cet âge limite est relatif et dépend des pratiques locales ; les comorbidités doivent être prises en compte [
21
].
Deux médicaments anti-fibrosants, dont les principes actifs sont la pirfénidone et le nintédanib, sont aujourd’hui disponibles. Ils permettent de ralentir l’évolution de la maladie et d’allonger la durée de vie du patient. Les mécanismes d’action de la pirfénidone dans la FPI restent peu compris. On sait néanmoins que cette molécule inhibe l’expression des pro-collagènes de type I et II et la synthèse de TGF-β1 [
22
]. Le nintédanib est, quant à lui, un inhibiteur de tyrosine kinase. Il cible le récepteur du facteur de croissance de l’endothélium vasculaire (VEGF), diminuant l’angiogenèse, ainsi que les récepteurs du FGF (
fibroblast growth factor
) et du PDGF (
platelet-derived growth factor
), réduisant ainsi l’activité et la différenciation des fibroblastes [
23
]. Ces molécules ont montré leur efficacité dans d’autres maladies fibrosantes et progressives du poumon [
24
–
26
]. Leurs effets secondaires sont cependant fréquents (diarrhées, nausées, diminution de l’appétit, augmentation de la photosensibilité, etc.). Ces molécules ne font que ralentir la maladie et l’absence de traitement curatif stimule grandement la recherche pharmaceutique. Plusieurs molécules candidates, en cours d’essais cliniques, pourraient ainsi être mises sur le marché dans les prochaines années.
Les interventions non pharmacologiques
À côté des prescriptions de molécules, les premières mesures de prise en charge des patients consistent à effectuer un sevrage tabagique, si le patient est fumeur, à assurer le maintien d’une activité physique régulière ainsi qu’un suivi nutritionnel, et à vacciner contre la grippe, contre le pneumocoque, et, désormais, contre le virus responsable de la COVID-19 (
coronavirus disease 2019
). La réhabilitation respiratoire, l’oxygénothérapie de déambulation, si elle est indiquée, et les traitements symptomatiques, ont, quant à eux, pour objectif d’améliorer la tolérance à l’effort du patient et sa qualité de vie
4
.
|
Les modèles d’étude de la FPI
L’absence de traitement curatif de la FPI résulte, en partie, de l’absence de modèles expérimentaux de fibrose pulmonaire satisfaisants, permettant d’en comprendre les mécanismes physiopathologiques.
In vivo
, le modèle de référence chez le rongeur, est celui de la fibrose pulmonaire induite par instillation de bléomycine, à l’origine d’une fibrose pulmonaire massive et centrale. Cependant, la FPI se caractérise au contraire par une fibrose localisée à la périphérie du poumon, avec des foyers fibroblastiques et des structures en rayon de miel [
27
], rendant ce modèle murin inadapté. Plus récemment,
in vitro,
plusieurs modèles expérimentaux, comme la culture cellulaire en deux ou trois dimensions, la culture de sphéroïdes ou d’organoïdes, et la technique d’
organ-on-chip
(organe sur puce) ont été développés [
28
]. Cependant, ces modèles ne permettent pas d’étudier les interactions entre épithélium et mésenchyme, pourtant primordiales dans la maladie.
|
Le diagnostic de la FPI reste encore trop tardif, puisque les mécanismes précoces participant à l’instauration et au développement de la maladie demeurent inconnus. L’objectif majeur pour la recherche sur cette maladie, est donc de développer un modèle expérimental, le plus intégré possible, afin de déterminer les gènes impliqués et les mécanismes moléculaires responsables de son installation et de son évolution. Un tel modèle devrait permettre d’identifier de nouveaux biomarqueurs spécifiques de cette maladie et donc de nouvelles cibles thérapeutiques afin de limiter, voire d’empêcher la progression de la FPI. |
Lidwine Wémeau-Stervinou déclare des liens d’intérêt avec les laboratoires Boehringer-Ingelheim, Roche et Sanofi.
|
Nathan Hennion est soutenu par une allocation de doctorat de la région Hauts-de-France et du Centre hospitalo-universitaire de Lille. Ce travail a reçu le soutien de la région Hauts-de-France (Start-AIRR), de l’I-SITE université Lille Nord-Europe et du programme fédératif hospitalo-universitaire (FHU) lillois « 1 000 jours pour la santé ».
|
Footnotes |
1.
Savary
G
,
Pottier
N
,
Mari
B
,
et al.
La fonction d’un long ARN non codant décodée dans la fibrose pulmonaire idiopathique.
.
Med Sci (Paris).
2019;
;
35
:
:739.
–
742
.
2.
Cruwys
S
,
Hein
P
,
Humphries
B
,
et al.
Drug discovery and development in idiopathic pulmonary fibrosis: challenges and opportunities.
.
Drug Discov Today.
2020;
;
25
:
:2277.
–
83
.
3.
Duchemann
B
,
Annesi-Maesano
I
,
Jacobe de Naurois
C
,
et al.
Prevalence and incidence of interstitial lung diseases in a multi-ethnic county of Greater Paris.
.
Eur Respir J.
2017;
;
50
:
:1602419.
.
4.
Martinez
FJ
,
Collard
HR
,
Pardo
A
,
et al.
Idiopathic pulmonary fibrosis.
.
Nat Rev Dis Primer.
2017;
;
3
:
:17074.
.
5.
Hutchinson
J
,
Fogarty
A
,
Hubbard
R
,
et al.
Global incidence and mortality of idiopathic pulmonary fibrosis: a systematic review.
.
Eur Respir J.
2015;
;
46
:
:795.
–
806
.
6.
Hopkins
RB
,
Burke
N
,
Fell
C
,
et al.
Epidemiology and survival of idiopathic pulmonary fibrosis from national data in Canada.
.
Eur Respir J.
2016;
;
48
:
:187.
–
195
.
7.
Wynn
TA
.
Cellular and molecular mechanisms of fibrosis.
.
J Pathol.
2008;
;
214
:
:199.
–
210
.
8.
Ranzieri
S
,
Illica Magrini
E
,
Mozzoni
P
,
et al.
Idiopathic pulmonary fibrosis and occupational risk factors.
.
Med Lav.
2019;
;
110
:
:407.
–
436
.
9.
Sheng
G
,
Chen
P
,
Wei
Y
,
et al.
Viral Infection Increases the Risk of Idiopathic Pulmonary Fibrosis: A Meta-Analysis.
.
Chest.
2020;
;
157
:
:1175.
–
87
.
10.
Kropski
JA
,
Lawson
WE
,
Young
LR
,
et al.
Genetic studies provide clues on the pathogenesis of idiopathic pulmonary fibrosis.
.
Dis Model Mech.
2013;
;
6
:
:9.
–
17
.
11.
Spagnolo
P
,
Grunewald
J
,
du Bois
RM
.
Genetic determinants of pulmonary fibrosis: evolving concepts.
.
Lancet Respir Med.
2014;
;
2
:
:416.
–
428
.
12.
Evans
CM
,
Fingerlin
TE
,
Schwarz
MI
,
et al.
Idiopathic Pulmonary Fibrosis: A Genetic Disease That Involves Mucociliary Dysfunction of the Peripheral Airways.
.
Physiol Rev.
2016;
;
96
:
:1567.
–
1591
.
13.
Demouveaux
B
,
Gouyer
V
,
Magnien
M
,
et al.
La structure des mucines conditionne les propriétés viscoélastiques des gels de mucus.
.
Med Sci (Paris).
2018;
;
34
:
:806.
–
812
.
14.
Portal
C
,
Gouyer
V
,
Gottrand
F
,
et al.
Ocular mucins in dry eye disease.
.
Exp Eye Res.
2019;
;
186
:
:107724.
.
15.
Desseyn
J-L
,
Portal
C
,
Gottrand
F
,
et al.
Différenciation des cellules à mucus et régulation de la mucine gélifiante Muc5b : un nouvel outil pour des études ex vivo et précliniques in vivo.
.
Med Sci (Paris).
2017;
;
33
:
:478.
–
480
.
16.
Roy
MG
,
Livraghi-Butrico
A
,
Fletcher
AA
,
et al.
Muc5b is required for airway defence.
.
Nature.
2014;
;
505
:
:412.
–
416
.
17.
Cottin
V
,
Bonniaud
P
,
Cadranel
J
,
et al.
[French practical guidelines for the diagnosis and management of IPF - 2021 update, short version].
.
Rev Mal Respir.
2022
;
S0761–8425(22)00026–2.
.
18.
Raghu
G
,
Rochwerg
B
,
Zhang
Y
,
et al.
An Official ATS/ERS/JRS/ALAT Clinical Practice Guideline: Treatment of Idiopathic Pulmonary Fibrosis. An Update of the Clinical Practice Guideline.
.
Am J Respir Crit Care Med.
2011;
;
2015
:
:192.e3.
–
19
.
19.
Somogyi
V
,
Chaudhuri
N
,
Torrisi
SE
,
et al.
The therapy of idiopathic pulmonary fibrosis: what is next?
.
Eur Respir Rev.
2019;
;
28
:
:190021.
.
20.
Kim
SY
,
Diggans
J
,
Pankratz
D
,
et al.
Classification of usual interstitial pneumonia in patients with interstitial lung disease: assessment of a machine learning approach using high-dimensional transcriptional data.
.
Lancet Respir Med.
2015;
;
3
:
:473.
–
482
.
21.
Cottin
V
,
Crestani
B
,
Valeyre
D
,
et al.
Diagnosis and management of idiopathic pulmonary fibrosis: French practical guidelines.
.
Eur Respir Rev.
2014;
;
23
:
:193.
–
214
.
22.
Lederer
DJ
,
Martinez
FJ
.
Idiopathic Pulmonary Fibrosis.
.
N Engl J Med.
2018;
;
378
:
:1811.
–
1823
.
23.
Korfei
M
,
Stelmaszek
D
,
MacKenzie
B
,
et al.
Comparison of the antifibrotic effects of the pan-histone deacetylase-inhibitor panobinostat versus the IPF-drug pirfenidone in fibroblasts from patients with idiopathic pulmonary fibrosis.
.
PLoS One.
2018;
;
13
:
:e0207915.
.
24.
Flaherty
KR
,
Wells
AU
,
Cottin
V
,
et al.
Nintedanib in Progressive Fibrosing Interstitial Lung Diseases.
.
N Engl J Med.
2019;
;
381
:
:1718.
–
1727
.
25.
Maher
TM
,
Corte
TJ
,
Fischer
A
,
et al.
Pirfenidone in patients with unclassifiable progressive fibrosing interstitial lung disease: a double-blind, randomised, placebo-controlled, phase 2 trial.
.
Lancet Respir Med.
2020;
;
8
:
:147.
–
57
.
26.
Behr
J
,
Prasse
A
,
Kreuter
M
,
et al.
Pirfenidone in patients with progressive fibrotic interstitial lung diseases other than idiopathic pulmonary fibrosis (RELIEF): a double-blind, randomised, placebo-controlled, phase 2b trial.
.
Lancet Respir Med.
2021;
;
9
:
:476.
–
86
.
27.
Blackwell
TS
,
Tager
AM
,
Borok
Z
,
et al.
Future directions in idiopathic pulmonary fibrosis research. An NHLBI workshop report.
.
Am J Respir Crit Care Med.
2014;
;
189
:
:214.
–
222
.
28.
Sundarakrishnan
A
,
Chen
Y
,
Black
LD
,
et al.
Engineered cell and tissue models of pulmonary fibrosis.
.
Adv Drug Deliv Rev.
2018;
;
129
:
:78.
–
94
.
29.
Saito
A
,
Horie
M
,
Micke
P
,
et al.
The Role of TGF-β Signaling in Lung Cancer Associated with Idiopathic Pulmonary Fibrosis.
.
Int J Mol Sci.
2018;
;
19
:
:E3611.
.
30.
Glisinski
KM
,
Schlobohm
AJ
,
Paramore
SV
,
et al.
Interleukin-13 disrupts type 2 pneumocyte stem cell activity.
.
JCI Insight.
2020;
;
5
:
:131232.
.
31.
Song
C
,
He
L
,
Zhang
J
,
et al.
Fluorofenidone attenuates pulmonary inflammation and fibrosis via inhibiting the activation of NALP3 inflammasome and IL-1β/IL-1R1/MyD88/NF-κB pathway.
.
J Cell Mol Med.
2016;
;
20
:
:2064.
–
2077
.
32.
Epstein
Shochet G
,
Brook
E
,
Israeli-Shani
L
,
et al.
Fibroblast paracrine TNF-α signaling elevates integrin A5 expression in idiopathic pulmonary fibrosis (IPF).
.
Respir Res.
2017;
;
18
:
:122.
.
33.
Antoniades
HN
,
Bravo
MA
,
Avila
RE
,
et al.
Platelet-derived growth factor in idiopathic pulmonary fibrosis.
.
J Clin Invest.
1990;
;
86
:
:1055.
–
1064
.
34.
Tager
AM
.
Autotaxin emerges as a therapeutic target for idiopathic pulmonary fibrosis: limiting fibrosis by limiting lysophosphatidic acid synthesis.
.
Am J Respir Cell Mol Biol.
2012;
;
47
:
:563.
–
565
.
|




