| |
| Med Sci (Paris). 38(11): 926–933. doi: 10.1051/medsci/2022154.Préservation de la fertilité chez les personnes transgenres Vincent Puy,1,2,3 Fanny Magnan,1 Johanna Lousqui,1 Yasmine Boumerdassi,1,2,3 Badria Bennani Smires,1,2 Nicolas Mendes,1 and Florence Eustache1,3,4* 1CECOS, hôpitaux universitaires Paris Seine-Saint-Denis, hôpital Jean Verdier
,
Bondy
,
France 2Biologie de la reproduction, hôpitaux universitaires Paris Seine-Saint-Denis, hôpital Jean-Verdier
,
Bondy
,
France 3Inserm U1016, équipe « Génomique, épigénétique et physiologie de la reproduction », Institut Cochin, université Paris Cité
,
Paris
,
France 4Service de biologie de la reproduction, hôpitaux Universitaires Paris Nord Val de Seine, AP-HP, hôpital Bichat
,
Paris
,
France |
Vignette (© ParaDox).
La transidentité correspond à la discordance entre le genre assigné à la naissance et le genre ressenti d’une personne. En 2012, la WPATH (
world professional association for transgender health
) estimait une prévalence de 1/45 000 à 1/12 000 pour une femme trans (MtF), et de 1/200 000 à 1/30 400 pour un homme trans (FtM) [
1
]. Aux États-Unis, la prévalence d’une identité transgenre autodéclarée chez les enfants, les adolescents et les adultes varierait de 0,5 à 1,3 % [
2
,
3
].
Selon la ligne directrice internationale de la WPATH, les thérapies d’affirmation du genre peuvent comprendre une hormonothérapie, comme, par exemple, les agonistes de l’hormone libérant des gonadotrophines (GnRHa) qui bloquent la puberté, ou encore l’hormonothérapie sexuelle, les œstrogènes pour ceux qui désirent des caractéristiques sexuelles secondaires féminines, ou la testostérone pour ceux qui désirent des caractéristiques sexuelles secondaires masculines [
1
]. Une chirurgie de réassignation sexuelle (CRS) peut aussi être proposée. Bien que ces thérapies soient potentiellement accessibles à toutes les personnes transgenres, une personne peut décider de suivre certaines ou toutes ces modalités de traitement en fonction de ses objectifs spécifiques.
Ces traitements sont malheureusement loin d’être sans risque sur la qualité et la production gamétiques. L’utilisation à long terme des hormones sexuelles d’affirmation du genre peut en effet être à l’origine d’une infertilité [
3
], bien que l’on ne sache toujours pas avec certitude quelle est la durée de traitement hormonal qui entraînerait des effets irréversibles, mais aussi quelle est l’influence de l’âge du début du traitement, de la dose et du traitement en lui-même. Par contre, il est évident que la CRS conduira, que ce soit chez une femme trans ou un homme trans, à une stérilité définitive.
De nombreuses personnes transgenres expriment le désir d’être parents. Chez l’adulte, Wierckx
et al.
ont décrit un désir d’enfant chez les hommes trans de plus de 50 % [
4
]. Une étude portant sur 79 jeunes transgenres a révélé que la majorité d’entre eux souhaitait être parents (respectivement 66 % et 67 % des hommes et femmes transgenres) [
5
]. Une autre étude a montré que le désir d’enfant était présent chez les personnes trans, et surtout qu’il était significativement plus élevé chez les femmes trans (69,9 %) que chez les hommes trans (46,9 % ;
p
= 0,034) [
6
]. Le désir d’enfant est une notion essentielle à évaluer avant la mise sous traitement de la personne. Les questions du désir d’enfant et de la préservation de la fertilité (PF) doivent donc être abordées avant de débuter tout traitement. Malheureusement, ces questions sont rarement abordées au cours du parcours de transidentité. Des études montrent en effet que la question de la PF est abordée dans moins de 15 % des cas, et la réalisation de la cryoconservation de gamètes dans moins de 5 % des cas [
7
,
8
].
Face à ces constats, la question se pose du recours à une PF dans un contexte législatif qui a fortement évolué ces dernières années. La WPATH, la société d’endocrinologie, ou encore le comité éthique de la société américaine de médecine de la reproduction, recommandent aux praticiens de délivrer une information sur la PF avant tout traitement chez les patients transgenres [
9
]. En France, l’article L2141-11 du Code de santé publique indique que toute personne qui va recevoir un traitement à risque pour sa fertilité peut bénéficier d’une PF [
10
]. Depuis 2018, la fédération française des centres d’étude et de conservation des œufs et du sperme humains (CECOS) s’est impliquée dans la prise en charge de la PF chez les personnes transgenres [
11
].
La préservation de la fertilité est une question importante dans le parcours de transidentité. Nous l’aborderons sous différents aspects : 1) l’impact de l’hormonothérapie sur la fertilité, 2) les techniques disponibles et leurs indications, 3) les difficultés à sa réalisation et, enfin, 4) ce que l’on sait du recours au matériel cryoconservé dans la population trans. |
Impact des traitements de réassignation sexuelle sur la fertilité Chez la femme trans (MtF)
Chez l’adulte, l’initiation d’une œstrogénothérapie a un impact sur la qualité du tissu testiculaire dans la majorité des cas, avec une absence de spermatozoïde mature (
Tableau I
). Récemment, de Nie
et al.
ont montré que l’initiation d’une hormonothérapie avant le stade 4 de Tanner
1
résultait en l’absence totale de spermatozoïde à la biopsie testiculaire, que celle-ci ait été arrêtée ou pas avant la chirurgie [
12
]. Lorsque l’hormonothérapie est débutée au-delà du stade 4 de Tanner, des spermatozoïdes peuvent être retrouvés, mais dans seulement 4 % des cas [
12
].
Tableau I.
| Référence |
Effectif |
Âge (ans) |
Traitement |
Histologie |
|
Rodriguez
et al.
, 1977 [
14
]
|
4 |
23-46 |
EE (1-2 mg/j) ≥ 12 mois |
🡾 Diamètre des TS, fibrose, présence uniquement de cellules de Sertoli dans la majorité des TS, cellules germinales rarement retrouvées, absence de spermatozoïde |
|
Lu, Steinberger, 1978 [
30
]
|
4 |
NP |
EE (1-2 mg/j) Durée : NP |
Présence de cellules de Sertoli dans la majorité des TS avec de rares cellules germinales mais sans spermatozoïde |
|
Payer
et al.
, 1979 [
31
]
|
6 |
19-34 |
Œstrogène ± MP pendant un an et quart-huit ans et demi |
Pour deux patients : présence de cellules germinales jusqu’au stade spermatocyte 1, et pour les quatre autres : présence uniquement de spermatogonies |
|
Thiagaraj
et al.
, 1987 [
32
]
|
10 |
21-33 |
Œstrogène pendant 6 à 13 ans |
Pour trois patients : présence d’une spermatogenèse localisée ou étendue, et pour les sept autres : absence totale de spermatogenèse |
|
Venizelos
et al
., 1988 [
33
]
|
5 |
22-57 |
Trois patients : œstrogènes pendant quatre ans ; deux autres : NP |
Absence de spermatozoïdes. Présence de spermatides et spermatocytes dans un seul cas. Pour deux cas (traitement NP), présence uniquement de cellules de Sertoli |
|
Sapino
et al.
, 1987 [
34
]
|
5 |
NP |
Œstrogène (40-50 mg/semaine) pendant une durée NP Arrêt de dix jours avant la chirurgie de réassignation |
Atrophie des TS avec absence de spermatozoïde |
|
Schulze, 1988 [
35
]
|
11 |
NP |
Œstrogène pendant 1 à 12 ans |
Absence de spermatozoïde. Présence essentiellement de cellules de Sertoli et de spermatogonies |
|
Schneider
et al.
, 2015 [
36
]
|
108 |
42* |
Hormonothérapie arrêtée six semaines avant la chirurgie (A, n = 22) ; deux semaines avant (B, n = 51) ; pas d’arrêt (C, n = 35) Durée NP |
Spermatogenèse complète (24 %) pour l’ensemble des groupes. Arrêt de la spermatogenèse (40 %) pour le groupe C |
|
Kent
et al.
, 2018 [
37
]
|
135 |
18-76 |
Œstradiol + SL (n = 76) ; Œstradiol + SL + F ou P (n = 26) ; F + œstradiol (n = 6) ; œstradiol ± P (n = 4) ; œstradiol + lupron (n = 1) ; NP (n = 22) Durée : cinq ans (médiane) |
Absence de spermatogenèse (79 %), spermatogenèse incomplète (17 %), et présence de spermatozoïdes (4 %) |
|
Jindarak
et al.
, 2018 [
38
]
|
173 |
20-32 |
Nombreux protocoles d’hormonothérapie ; durée moyenne = huit ans et demi |
Spermatogenèse normale (11 %) ; hypospermatogenèse (11 %), arrêt de maturation (36,4 %), SCO (20,2 %), hyalinisation des TS (6,4 %) |
|
Jiang
et al.
, 2019 [
39
]
|
72 |
30-53 |
Traitement : NP ; Durée > un an |
Présence de spermatides (40 %), présence de cellules germinales (81 %) |
|
Vereecke
et al.
, 2020 [
40
]
|
97 |
23-46 |
Acétate de cyprotérone + œstrogel ou œstradiol Durée : NP |
Absence de spermatogenèse complète (75/97) ; spermatogenèse partielle (22/97) |
|
Peri
et al.
, 2021 [
41
]
|
74 |
36, 2* |
Acétate de cyprotérone + œstrogel ou œstradiol Durée : deux-trois ans* |
Présence de spermatozoïdes (1 %), présence de spermatocytes (15 %), présence de spermatogonies (70 %), absence de cellules germinales (14 %) |
Principales études traitant de l’impact des traitements hormonaux sur la spermatogenèse.
EE : éthinyl-estradiol ; F : finastéride ; MP : médroxyprogestérone ; NP : non précisé ; P : progestérone ; SCO :
Sertoli cell only
; SL : spironolactone ; TS : tubule séminifère ; * : moyenne.
|
D’autres études se sont intéressées aux paramètres spermatiques. Ainsi, en 2019, Adeleye
et al.
ont comparé rétrospectivement les paramètres spermatiques de 28 patientes transgenres adultes venues réaliser une conservation de leurs spermatozoïdes, à différents stades de leur transition [
13
]. Ces patientes ont été réparties selon trois groupes : groupe 1, patientes n’ayant pas reçu de traitement hormonal (n = 18) ; groupe 2, patientes ayant arrêté leur traitement (pendant une durée moyenne de 4,4 mois, n = 3), et groupe 3, patientes étant toujours sous traitement hormonal (n = 5). Les paramètres spermatiques se sont révélés significativement supérieurs pour le groupe 1 de patientes n’ayant pas reçu de traitement. Ce résultat a été confirmé par d’autres études, comme celle de Rodriguez-Wallberg
et al.
[
14
].
Il semble donc assez clair que l’hormonothérapie a un impact sur la spermatogenèse mais aussi sur l’érection et l’éjaculation [
15
]. Il sera donc important de proposer une PF avant de débuter tout traitement hormonal.
Chez l’homme trans (FtM)
Pour les hommes transgenres, la prise de testostérone ne semble pas avoir d’impact important sur la fonction ovarienne [
16
]. Si certaines études ont montré une association entre l’administration à long terme d’androgènes et des anomalies de l’architecture ovarienne avec, notamment, un aspect d’ovaires polykystiques [
17
], mais aussi l’existence de dysovulations [
16
], d’autres sont plus rassurantes, avec, en particulier, la possibilité de réaliser une PF, voire une fécondation
in vitro
, malgré une hormonothérapie (
Tableau II
). La qualité ovocytaire après traitement n’a été que très peu explorée. Une étude a montré que le traitement hormonal n’influencerait pas la structure du fuseau méiotique ovocytaire, même après un cycle de congélation-décongélation ovocytaire [
18
]. Les études sur le sujet ont essentiellement porté sur des adultes ayant débuté un traitement bien après la puberté ; aucune d’entre elles n’a révélé de conséquences indésirables liées à l’introduction de l’hormonothérapie à la puberté, avec un traitement d’une durée de plus de cinq ans. L’architecture utérine semble être modifiée par la prise de testostérone. Ce traitement est en effet généralement à l’origine d’une atrophie de l’endomètre [
19
]. Néanmoins, plusieurs études font état d’hommes transgenres qui ont mené une grossesse après l’arrêt du traitement par la testostérone [
20
,
21
].
Tableau II.
| Référence |
Effectif |
Âge (ans) |
Traitement |
Résultats |
|
Cho
et al.
, 2020 [
42
]
|
1 |
28 |
Testostérone (0,6 mg IM / semaine).
Arrêt du traitement pendant 24 jours et débutant une semaine avant le début de la stimulation |
PF : 11 ovocytes vitrifiés |
|
Amir
et al.
, 2020 [
43
]
|
9 |
14-19 |
Non débuté |
PF : Nombre moyen d’ovocytes vitrifiés : 25,6 |
|
Gale
et al.
, 2021 [
44
]
|
1 |
20 |
Testostérone débutée depuis 18 mois
Pas d’arrêt |
PF : 22 ovocytes vitrifiés |
|
Greenwald
et al.
, 2022 [
21
]
|
1 |
33 |
Testostérone débutée il y a dix ans
Pas d’arrêt |
FIV : 16 ovocytes métaphases 2 et 5 blastocystes obtenus ; une naissance vivante |
|
Barett
et al.
, 2022 [
45
]
|
20 |
12-23 |
Testostérone débutée, n = 2 (durée : NP) |
PF : 3 à 35 ovocytes vitrifiés |
|
Stark
et al.
, 2022 [
46
]
|
2 |
27 |
Cypionate de testostérone :
Cas 1 : depuis 20 mois ;
Cas 2 : depuis 6 mois
Pas d’arrêt du traitement pour les deux pendant la stimulation |
PF :
Cas 1 : 30 ovocytes vitrifiés ;
Cas 2 : 9 ovocytes vitrifiés |
Résultats de préservation de la fertilité ou tentative de fécondation in vitro chez les hommes trans ayant débuté ou pas une hormonothérapie (principales études).
IM : intra-musculaire ; FIV : fécondation
in vitro
; NP : non précisé ; PF : préservation de la fertilité.
|
|
Quand et quelles techniques de préservation de la fertilité peuvent être proposées ?
Avant de débuter tout traitement d’affirmation du genre, qu’il soit hormonal et/ou chirurgical, il est recommandé d’avoir recours à la préservation de la fertilité (PF) [
15
]. Les techniques proposées dépendent du type de gonade, du statut pubertaire et du stade de transition médicale ou chirurgicale (
Tableau III
).
Tableau III.
|
Prépubère |
Pubère |
|
Femme trans (MtF)
|
CTT* |
CTT*
Congélation de spermatozoïdes éjaculés ou après extraction chirurgicale |
|
Homme trans (FtM)
|
CTO* |
CTO*± MIV
ex vivo
*
Cryoconservation d’ovocytes après stimulation hormonale ou MIV*
|
Techniques de préservation de la fertilité dans la population transgenre.
* : techniques expérimentales ; CTO : cryoconservation de tissu ovarien ; CTT : cryoconservation de tissu testiculaire ; MIV : maturation
in vitro
; FtM :
female to male
; MtF :
male to female.
|
Chez les femmes trans (MtF)
La préservation de spermatozoïdes chez la femme trans doit être recommandée avant toute prise de traitement. Les techniques qui sont proposées dépendent du stade pubertaire, soit pré- ou post-puberté (
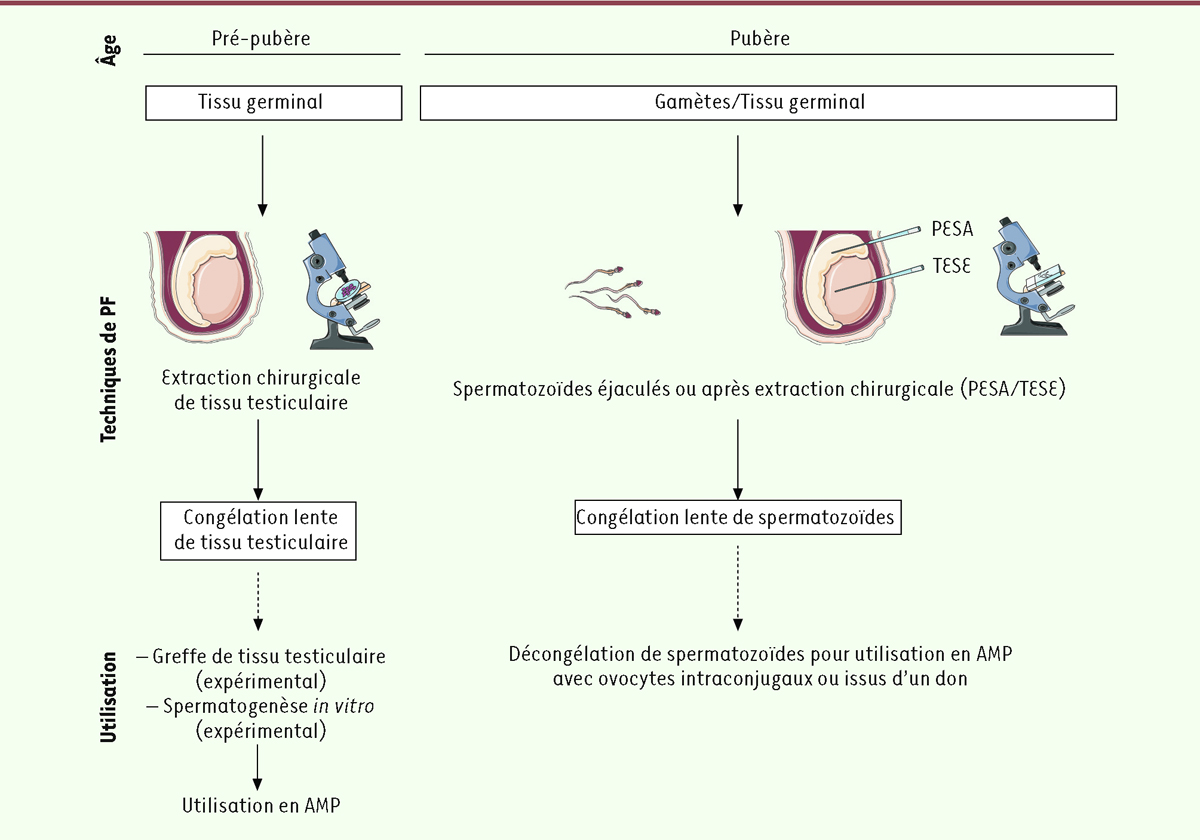
Figure 1
).
 | Figure 1.
Préservation de la fertilité (PF) chez les MtF selon le stade pubertaire.
AMP : assistance médicale à la procréation ; FIV : fécondation
in vitro
; PESA :
percutaneous epididymal sperm aspiration
; TESE :
testicular sperm extraction.
|
Après la puberté, la technique de référence est la congélation de spermatozoïdes éjaculés. Elle peut néanmoins représenter un stress émotionnel important pour la personne, notamment lorsque l’acte de masturbation est rapporté au genre masculin [
22
]. Lorsque les traitements hormonaux sont initiés avant la PF, la baisse de testostérone qu’ils induisent peut être à l’origine de troubles de l’érection et de l’éjaculation [
15
]. Lorsque la masturbation n’est pas réalisable (refus ou échec de recueil) ou en cas d’absence de spermatozoïde congelable après éjaculation, un prélèvement chirurgical épididymaire (PESA, pour
percutaneous epididymal sperm aspiration
) et/ou par biopsie testiculaire avec extraction de spermatozoïdes (TESE, pour
testicular sperm extraction
) est envisageable. Ces techniques peuvent être proposées et réalisées dans le même temps chirurgical que la CRS. Les spermatozoïdes éjaculés, épididymaires ou testiculaires conservés pourront, plus tard, être utilisés pour une insémination ou une fécondation
in vitro
.
Chez la jeune femme trans prépubère, seule la technique de congélation de pulpe testiculaire peut être proposée. Réalisée en France depuis 2007, initialement dans le cadre d’un protocole de recherche, la cryoconservation de tissu testiculaire est désormais possible hors protocole, depuis la loi du 7 juillet 2011 relative à la bioéthique
2,
[
10
]. Elle consiste à prélever chirurgicalement sous anesthésie générale, au moins un quart de chaque testicule, à les découper en plusieurs fragments contenant les spermatogonies souches, qui seront mis en cryotubes puis congelés par congélation lente, et stockés dans l’azote liquide [
23
,
24
]. L’utilisation de cette technique reste soumise à des protocoles de recherche, faisant préférer, en termes d’efficacité de PF, un report du traitement d’affirmation du genre au-delà de la puberté.
Chez les hommes trans (FtM)
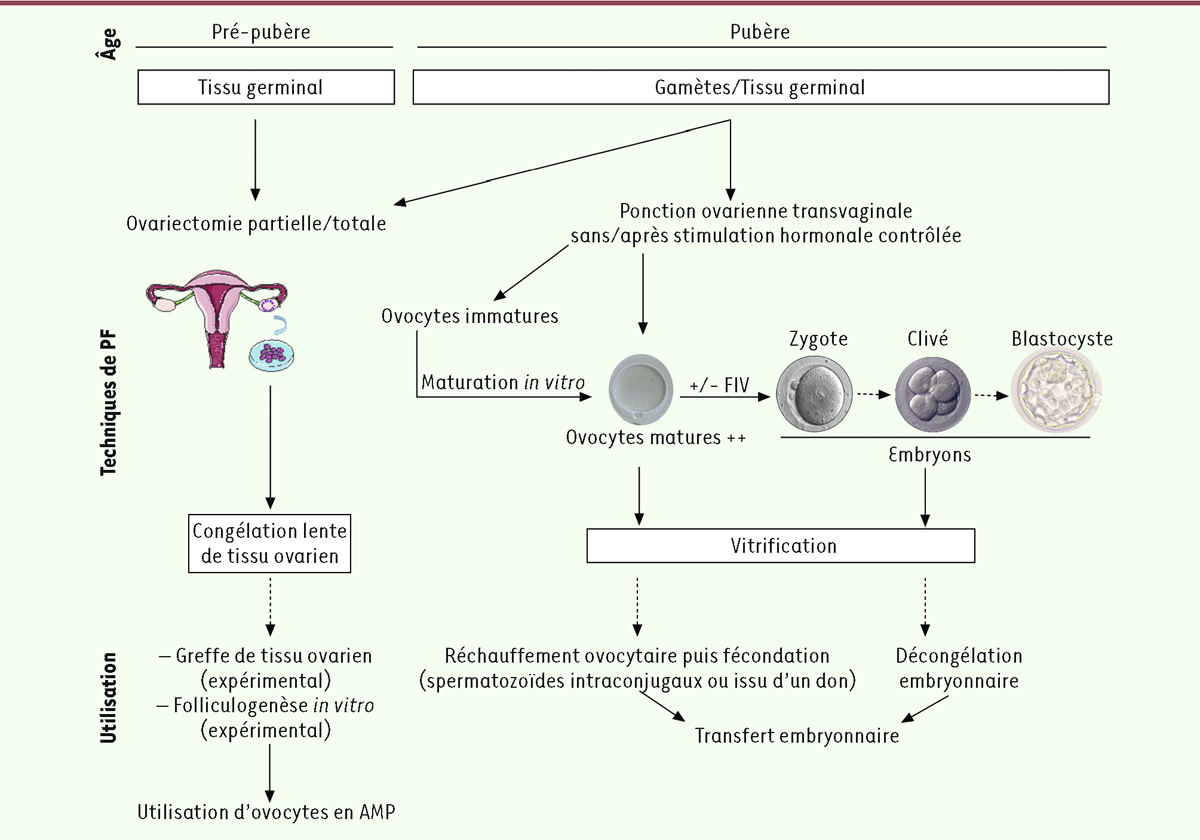
Au vu des données de la littérature, la préservation de la fertilité (PF) peut être envisagée avant ou après l’initiation d’un traitement hormonal chez l’homme trans. Les techniques proposées dépendent, notamment, du stade pubertaire (
Figure 2
).
 | Figure 2.
Préservation de la fertilité (PF) chez les FtM selon le stade pubertaire.
AMP : assistance médicale à la procréation ; FIV : fécondation
in vitro
.
|
Chez la femme cis, après la puberté, la technique de référence est la cryoconservation d’ovocytes matures et/ou d’embryons par vitrification. Néanmoins, cette technique nécessite un geste chirurgical intravaginal, après près de deux semaines de traitement par hormones féminisantes, et plusieurs évaluations échographiques transvaginales, rendant l’acception de ces techniques souvent difficiles chez l’homme trans. En cas de refus, plusieurs techniques de PF expérimentales permettent d’éviter toute incongruence hormonale. Réalisée dans très peu de centres en France, la maturation
in vitro
(MIV) consiste à effectuer une ponction transvaginale et à récupérer les ovocytes immatures contenus dans les follicules antraux [
25
]. Ces ovocytes sont ensuite maturés au laboratoire pendant 24 à 48 h par un traitement hormonal associant FSH (hormone folliculo-stimulante) et LH (hormone lutéinisante). Dans une population de personnes FtM, le taux de maturation final des ovocytes prélevés serait compris entre 34 % et 38 % environ, avec des ovocytes ayant un fuseau de structure normale dans plus de 87 % des cas [
18
,
26
].
Dans le cadre d’un couple avec un homme cis ou avec un donneur de spermatozoïdes, les ovocytes matures obtenus peuvent être fécondés par microinjection pour obtenir des embryons qui pourront être cryoconservés. La PF réalisée dans ce cadre engage la responsabilité des deux membres du couple mais bénéficie d’un meilleur taux de survie à la décongélation que la simple cryoconservation ovocytaire.
La congélation de fragments de cortex ovarien permet de cryoconserver un maximum de follicules ovariens, sans avoir recours à une stimulation hormonale. Chez la personne FtM pubère, elle peut être réalisée dans le même temps chirurgical que la CRS, et les fragments peuvent être greffés à distance. Plus de 200 enfants sont nés grâce à cette approche chez les femmes cis [
27
]. Le traitement du tissu ovarien permet de retrouver des ovocytes immatures susceptibles également de faire l’objet d’une MIV
ex vivo
. Ainsi, le patient peut à la fois bénéficier d’une cryoconservation de tissu ovarien et d’ovocytes maturés au laboratoire [
18
]. Il est important de souligner qu’en cas de CRS avec hystérectomie, la PF du patient FtM ne pourra être utilisée en France, du fait de l’interdiction de la réception d’ovocytes de la partenaire (ROPA), mais aussi de la gestation pour autrui (GPA).
La combinaison de différentes techniques de PF est envisageable dans la population des hommes trans. Bien que, dans la littérature, cette association soit essentiellement pratiquée dans la population cis genre, la ponction ovarienne avec MIV peut en effet être associée à la congélation de tissu ovarien, dans un même temps chirurgical. Au stade pré-pubertaire, seule la cryoconservation de fragments de tissu ovarien est envisageable. |
L’utilisation des cellules germinales autoconservées
Selon l’échantillon qui a été conservé, des gamètes ou du tissu germinal (
Figures 1
,
2
), plusieurs possibilités sont envisageables. Conserver ses gamètes ou ses tissus germinaux ne pose pas de question ; en revanche, leur utilisation semble plus complexe d’un point de vue législatif. La dernière loi de bioéthique, du 2 août 2021, a précisé que «
tout couple formé d’un homme et d’une femme ou de deux femmes ou toute femme non mariée ont accès à l’assistance médicale à la procréation
». L’utilisation future de ces gamètes (ou tissu germinal) dépend donc du sexe d’assignation à la naissance du partenaire et du contexte législatif du pays. En France, elle n’est pas possible dans toutes les situations chez les personnes transgenres (
Tableau IV
). Mais la législation évolue et on ne peut exclure que la ROPA et la GPA deviennent possibles en France dans quelques années.
Tableau IV.
| Femme trans |
Homme trans |
|
Gamètes
autoconservés
|
Spermatozoïdes |
|
|
Ovocytes |
|
|
|
Genre sur la PI
|
Féminin |
Masculin |
Féminin ou masculin |
Masculin |
Féminin |
Féminin ou
masculin |
|
Genre du partenaire
|
Femme cis |
Femme cis |
Femme trans ou homme cis |
Femme cis |
Femme cis |
Femme trans ou
homme cis |
|
Utilisation
|
Oui |
Oui |
Non
GPA et/ou AMP pour un couple d’hommes interdites en France |
Non
AMP possible mais uniquement avec spermatozoïdes de donneur et ovocytes de la femme cis.
ROPA interdite en France |
Oui
AMP avec spermatozoïdes de donneur et ovocytes de l’homme trans avec un transfert de l’embryon chez l’homme trans
ROPA interdite en France |
Non
sauf si l’homme trans a toujours le genre féminin sur sa PI et accepte de porter l’enfant |
Les différentes utilisations possibles pour les personnes transgenres en France.
AMP : assistance médicale à la procréation ; GPA : gestation pour autrui ; PI : pièce d’identité ; ROPA : réception des ovocytes du partenaire.
|
|
Quelles sont les difficultés à la réalisation d’une préservation de la fertilité ?
Lorsqu’ils et elles réalisent l’autoconservation de leurs gamètes, la plupart des femmes transgenres et des hommes transgenres font le souhait d’avoir un enfant (respectivement 67,4 % et 61,9 %). Pourtant, seules 40,4 % des femmes transgenres et 5,8 % des hommes transgenres réalisent une PF [
28
]. Cette pratique apparaît en effet plus difficilement acceptable pour les hommes trans que pour les femmes trans, en raison d’une procédure plus lourde et invasive.
Une des premières causes de non réalisation de la PF est son coût, notamment pour les hommes trans [
3
,
28
]. En effet, si, en France, les personnes trans peuvent bénéficier d’une prise en charge à 100 % par l’Assurance maladie, ce n’est pas le cas dans tous les pays. Le manque d’information délivrée par les professionnels de santé sur les possibilités de PF constitue également une barrière [
29
]. Il existe une proportion croissante de jeunes personnes trans qui ne pensent pas, au moment de l’initiation de l’hormonothérapie, à la création d’une famille, car leurs désirs reproductifs ne sont pas encore définis. L’information par les professionnels de santé a un rôle primordial dans ces situations. Une des causes de cette absence de projection sur la création d’une famille est la peur de devoir retarder le début du traitement hormonal [
5
]. Les facteurs liés au processus de PF en lui-même ont également un rôle important dans sa réalisation. Ils ne sont pas identiques pour les hommes trans et les femmes trans. Ce sont notamment la détresse causée par la technique (60,3 % pour les hommes trans contre 29,3 % pour les femmes trans), la peur de la dysphorie de genre causée par le traitement hormonal (63,5 %
versus
28,3 %) et l’inquiétude face à l’attitude du personnel médical (44 %
versus
19 %) [
28
].
Il apparaît donc important de trouver des moyens de surmonter les obstacles auxquels sont confrontés les personnes transgenres afin de pouvoir préserver leurs gamètes, plus particulièrement pour les hommes transgenres, mais aussi pour les adolescents. |
En France, la prise en charge des personnes transgenres s’est organisée au niveau national depuis une dizaine d’années, avec la mise en place de réseaux multidisciplinaires qui ont permis de cibler les questionnements et de mieux gérer l’information, en créant un lien entre les différentes spécialités médicales intervenant au cours du parcours de transidentité. La majorité des personnes transgenres souhaitent fonder une famille et devenir parents un jour, mais procréer avec leurs propres gamètes n’était pas une évidence. Le plus souvent, ces personnes se tournaient vers d’autres possibilités, comme l’adoption ou le don de gamètes. Depuis quelques années, la possibilité de préserver la fertilité est abordée dans les consultations, et les techniques de PF sont présentées. La PF est de plus en plus réalisée mais de nombreuses barrières demeurent comme, par exemple, son coût et le manque d’information. Quand faut-il la réaliser ? La réponse n’est pas la même pour les hommes trans et les femmes trans. Autant il semble important de réaliser une PF avant d’initier les traitements hormonaux pour les femmes trans, autant cela semble moins urgent pour les hommes trans. Cependant, il n’existe aucune donnée sur les effets des hormonothérapies de longue durée (plus de 5 ans) initiées au moment de l’adolescence, que ce soit chez l’homme trans ou chez la femme trans. En France, l’utilisation des gamètes reste limitée mais il est fort probable que l’évolution de la législation française permette dans un avenir proche, à certaines personnes transgenres, d’y avoir recours plus facilement dans le cadre d’une assistance médicale à la procréation. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1. World Professional Association for Transgender Health. Standards of Care for the Health of Transsexual, Transgender, and Gender Nonconforming People [7th Version]. 2012. 2.
Zucker
KJ
.
Gender identity development and issues.
.
Child Adolesc Psychiatr Clin N Am.
2004;
;
13
:
:551.
–
568
.
3.
Baram
S
,
Myers
SA
,
Yee
S
,
et al.
Fertility preservation for transgender adolescents and young adults: A systematic review.
.
Hum Reprod Update.
2019;
;
25
:
:694.
–
716
.
4.
Wierckx
K
,
Van Caenegem
E
,
Pennings
G
,
et al.
Reproductive wish in transsexual men.
.
Hum Reprod Oxf Engl.
2012;
;
27
:
:483.
–
487
.
5.
Chiniara
LN
,
Viner
C
,
Palmert
M
,
et al.
Perspectives on fertility preservation and parenthood among transgender youth and their parents.
.
Arch Dis Child.
2019;
;
104
:
:739.
–
744
.
6.
Auer
MK
,
Fuss
J
,
Nieder
TO
,
et al.
Desire to Have Children Among Transgender People in Germany: A Cross-Sectional Multi-Center Study.
.
J Sex Med.
2018;
;
15
:
:757.
–
767
.
7.
Chen
D
,
Simons
L
,
Johnson
EK
,
et al.
Fertility Preservation for Transgender Adolescents.
.
J Adolesc Health Off Publ Soc Adolesc Med.
2017;
;
61
:
:120.
–
123
.
8.
Nahata
L
,
Tishelman
AC
,
Caltabellotta
NM
,
et al.
Low Fertility Preservation Utilization Among Transgender Youth.
.
J Adolesc Health Off Publ Soc Adolesc Med.
2017;
;
61
:
:40.
–
44
.
9.
Ethics Committee of the American Society for Reproductive Medicine.
.
Access to fertility services by transgender and nonbinary persons : an Ethics Committee opinion.
.
Fertil Steril.
2021;
;
115
:
:874.
–
8
.
11.
Eustache
F
,
Drouineaud
V
,
Mendes
N
,
et al.
Fertility preservation and sperm donation in transgender individuals: The current situation within the French CECOS network.
.
Androl.
2021;
;
9
:
:1790.
–
8
.
12.
de Nie
I
,
Mulder
CL
,
Meißner
A
,
et al.
Histological study on the influence of puberty suppression and hormonal treatment on developing germ cells in transgender women.
.
Hum Reprod.
2022;
;
37
:
:297.
–
308
.
13.
Adeleye
AJ
,
Reid
G
,
Kao
C-N
,
et al.
Semen Parameters Among Transgender Women With a History of Hormonal Treatment.
.
Urol.
2019;
;
124
:
:136.
–
141
.
14.
Rodriguez-Wallberg
KA
,
Häljestig
J
,
et al.
Sperm quality in transgender women before or after gender affirming hormone therapy—A prospective cohort study.
.
Androl.
2021;
;
9
:
:1773.
–
80
.
15.
Hembree
WC
,
Cohen-Kettenis
PT
,
Gooren
L
,
et al.
Endocrine Treatment of Gender-Dysphoric/Gender-Incongruent Persons: An Endocrine Society Clinical Practice Guideline.
.
J Clin Endocrinol Metab.
2017;
;
102
:
:3869.
–
3903
.
16.
Yaish
I
,
Tordjman
K
,
Amir
H
,
et al.
Functional ovarian reserve in transgender men receiving testosterone therapy: Evidence for preserved anti-Müllerian hormone and antral follicle count under prolonged treatment.
.
Hum Reprod.
2021;
;
36
:
:2753.
–
60
.
17.
Grynberg
M
,
Fanchin
R
,
Dubost
G
,
et al.
Histology of genital tract and breast tissue after long-term testosterone administration in a female-to-male transsexual population.
.
Reprod Biomed Online.
2010;
;
20
:
:553.
–
558
.
18.
Lierman
S
,
Tilleman
K
,
Braeckmans
K
,
et al.
Fertility preservation for trans men : frozen-thawed in vitro matured oocytes collected at the time of ovarian tissue processing exhibit normal meiotic spindles.
.
J Assist Reprod Genet.
2017;
;
34
:
:1449.
–
1456
.
19.
Perrone
AM
,
Cerpolini
S
,
Maria Salfi
NC
,
et al.
Effect of Long-Term Testosterone Administration on the Endometrium of Female-to-Male (FtM) Transsexuals.
.
J Sex Med.
2009;
;
6
:
:3193.
–
3200
.
20.
Light
AD
,
Obedin-Maliver
J
,
Sevelius
JM
,
et al.
Transgender Men Who Experienced Pregnancy After Female-to-Male Gender Transitioning.
.
Obstet Gynecol.
2014;
;
124
:
:1120.
–
1127
.
21.
Greenwald
P
,
Dubois
B
,
Lekovich
J
,
et al.
Successful In Vitro Fertilization in a Cisgender Female Carrier Using Oocytes Retrieved From a Transgender Man Maintained on Testosterone.
.
AACE Clin Case Rep.
2022;
;
8
:
:19.
–
21
.
22.
Hamada
A
,
Kingsberg
S
,
Wierckx
K
,
et al.
Semen characteristics of transwomen referred for sperm banking before sex transition: A case series.
.
Androl.
2015;
;
47
:
:832.
–
838
.
23.
Keros
V
,
Hultenby
K
,
Borgström
B
,
et al.
Methods of cryopreservation of testicular tissue with viable spermatogonia in pre-pubertal boys undergoing gonadotoxic cancer treatment.
.
Hum Reprod.
2007;
;
22
:
:1384.
–
1395
.
24.
Rives
N
,
Milazzo
J-P
,
Travers
A
,
et al.
Cryopréservation du tissu testiculaire chez l’enfant.
.
Bull Académie Natl Médecine.
2013;
;
197
:
:877.
–
886
.
25.
Grynberg
M
,
Hesters
L
,
Bénard
J
,
et al.
Préservation de la fertilité féminine : place de la maturation ovocytaire in vitro.
.
J Gynécologie Obstétrique Biol Reprod.
2011;
;
40
:
:103.
–
108
.
26.
De Roo
C
,
Lierman
S
,
Tilleman
K
,
et al.
Ovarian tissue cryopreservation in female-to-male transgender people: Insights into ovarian histology and physiology after prolonged androgen treatment.
.
Reprod Biomed Online.
2017;
;
34
:
:557.
–
566
.
27.
Dolmans
M-M
,
Falcone
T
,
Patrizio
P
.
Importance of patient selection to analyze in vitro fertilization outcome with transplanted cryopreserved ovarian tissue.
.
Fertil Steril.
2020;
;
114
:
:279.
–
80
.
28.
Alpern
S
,
Yaish
I
,
Wagner-Kolasko
G
,
et al.
Why fertility preservation rates of transgender men are much lower than those of transgender women.
.
Reprod Biomed Online.
2022;
;
44
:
:943.
–
50
.
29.
Quain
KM
,
Kyweluk
MA
,
Sajwani
A
,
et al.
Timing and Delivery of Fertility Preservation Information to Transgender Adolescents, Young Adults, and Their Parents.
.
J Adolesc Health.
2021;
;
68
:
:619.
–
22
.
30.
Lu
CC
,
Steinberger
A
.
Effects of estrogen on human seminiferous tubules : Light and electron microscopic analysis.
.
Am J Anat.
1978;
;
153
:
:1.
–
13
.
31.
Payer
AF
,
Meyer
WJ
,
Walker
PA
.
The Ultrastructural Response of Human Leydig Cells to Exogenous Estrogens.
.
Androl.
2009;
;
11
:
:423.
–
436
.
32.
Thiagaraj
D
,
Gunasegaram
R
,
Loganath
A
,
et al.
Histopathology of the testes from male transsexuals on oestrogen therapy.
.
Ann Acad Med Singapore.
1987;
;
16
:
:347.
–
348
.
33.
Venizelos
ID
,
Paradinas
FJ
Testicular atrophy after oestrogen therapy. Histopathol.
1988;
;
12
:
:451.
–
454
.
34.
Sapino
A
,
Pagani
A
,
Godano
A
,
et al.
Effects of estrogens on the testis of transsexuals : a pathological and immunocytochemical study.
.
Virchows Arch A Pathol Anat Histopathol.
1987;
;
411
:
:409.
–
414
.
35.
Schulze
C.
.
Response of the human testis to long-term estrogen treatment: Morphology of Sertoli cells, Leydig cells and spermatogonial stem cells.
.
Cell Tissue Res.
1988;
;
251
:
:31.
–
43
.
36.
Schneider
F
,
Neuhaus
N
,
Wistuba
J
,
et al.
Testicular Functions and Clinical Characterization of Patients with Gender Dysphoria (GD) Undergoing Sex Reassignment Surgery (SRS).
.
J Sex Med.
2015;
;
12
:
:2190.
–
2200
.
37.
Kent
MA
,
Winoker
JS
,
Grotas
AB
.
Effects of Feminizing Hormones on Sperm Production and Malignant Changes: Microscopic Examination of Post Orchiectomy Specimens in Transwomen.
.
Urol.
2018;
;
121
:
:93.
–
96
.
38.
Jindarak
S
,
Nilprapha
K
,
Atikankul
T
,
et al.
Spermatogenesis Abnormalities following Hormonal Therapy in Transwomen.
.
BioMed Res Int.
2018;
;
2018
:
:1.
–
5
.
39.
Jiang
DD
,
Swenson
E
,
Mason
M
,
et al.
Effects of Estrogen on Spermatogenesis in Transgender Women.
.
Urol.
2019;
;
132
:
:117.
–
122
.
40.
Vereecke
G
,
Defreyne
J
,
Van Saen
D
,
et al.
Characterisation of testicular function and spermatogenesis in transgender women.
.
Hum Reprod.
2020
:
:deaa254.
.
41.
Peri
A
,
Ahler
A
,
Gook
D
,
et al.
Predicting successful sperm retrieval in transfeminine adolescents after testicular biopsy.
.
J Assist Reprod Genet.
2021;
;
38
:
:2735.
–
43
.
42.
Cho
K
,
Harjee
R
,
Roberts
J
,
et al.
Fertility preservation in a transgender man without prolonged discontinuation of testosterone: A case report and literature review.
.
FS Rep.
2020;
;
1
:
:43.
–
7
.
43.
Amir
H
,
Oren
A
,
Klochendler
Frishman E
,
et al.
Oocyte retrieval outcomes among adolescent transgender males.
.
J Assist Reprod Genet.
2020;
;
37
:
:1737.
–
44
.
44.
Gale
J
,
Magee
B
,
Forsyth-Greig
A
,
et al.
Oocyte cryopreservation in a transgender man on long-term testosterone therapy: A case report.
.
FS Rep.
2021;
;
2
:
:249.
–
51
.
45.
Barrett
J
.
Fertility preservation for transgender individuals.
.
Reprod Fertil.
2022;
;
3
:
:C11.
–
3
.
46.
Stark
BA
,
Mok-Lin
E
.
Fertility preservation in transgender men without discontinuation of testosterone.
.
FS Rep.
2022;
;
3
:
:153.
–
6
.
|