| |
| Med Sci (Paris). 38(12): 1008–1015. doi: 10.1051/medsci/2022165.Diversité et importance écologique des virus dans le milieu marin Charles Bachy1* and Anne-Claire Baudoux2 1Sorbonne Université, CNRS, FR2424, Station biologique de Roscoff
,
Roscoff
,
29680
,
France 2Sorbonne université, CNRS, Station biologique de Roscoff, Laboratoire adaptation et diversité en milieu marin, UMR7144
,
Roscoff
,
29680
,
France |
Vignette (© Philippe Roingeard).
Depuis 2020, avec la crise sanitaire engendrée par le virus SARS-CoV-2 (
severe acute respiratory syndrome-coronavirus 2
), jamais le grand public n’a autant appris sur la biologie et l’écologie virale. La vision que nous avons des virus reste toutefois très anthropocentrée. Nous, virologistes écologues, craignons de n’avoir pas réussi à faire passer le message, pourtant très simple, que les virus qui infectent absolument toutes formes de vie, sont essentiels au fonctionnement de la vie elle-même et à l’équilibre de notre planète. Si nous prenons l’exemple des océans, on estime à 4 x 10
30
le nombre de virus qui y sont présents (soit environ la moitié des virus présents sur la Terre), et à 10
23
le nombre d’infections survenant chaque seconde [
1
]. Cela fait des océans, et du milieu aquatique en général, le plus grand réservoir de virus au monde [
2
,
3
]. L’étude des virus marins a d’ailleurs véritablement débuté à la suite de la découverte de cette importance quantitative en 1989 [
4
] (
Figure 1
). Chaque litre d’eau de mer contient entre 0,1 et 100 milliards de particules virales, faisant ainsi des virus les entités biologiques les plus abondantes, dépassant de plusieurs ordres de grandeur l’abondance des formes de vie cellulaire/microbienne représentées par les archées, les bactéries et les protistes (i.e., les eucaryotes unicellulaires). Dans ces écosystèmes, les virus infectent les animaux charismatiques comme les baleines, les étoiles de mer, les poissons ou encore les huîtres, mais ce sont les populations microbiennes, organismes vivants les plus abondants et socle du réseau trophique océanique, qui constituent leurs hôtes de prédilection. Au regard de leur importance écologique, les virus marins restent peu étudiés et mal compris. Nous présenterons dans cette synthèse d’abord les études qui ont cherché à appréhender l’abondance et la diversité considérables des virus marins, puis leur impact sur la mortalité du monde microbien océanique et, enfin, leur rôle dans les grands cycles biogéochimiques de notre planète.
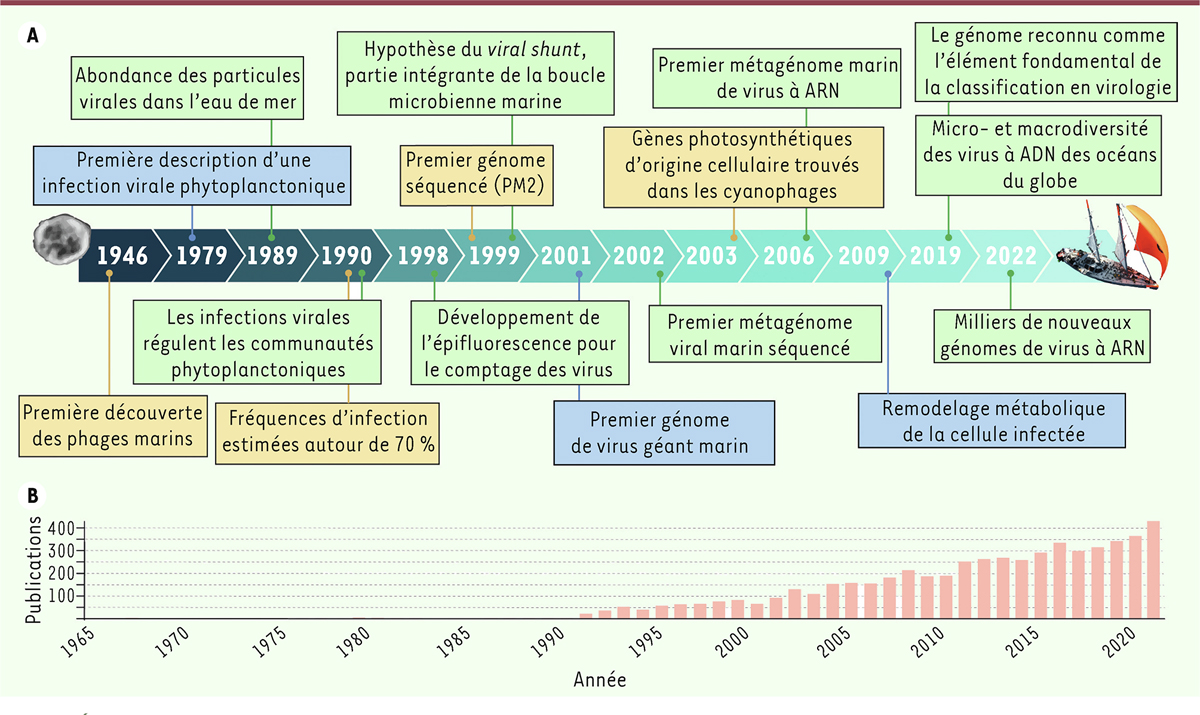
 | Figure 1.
Évolution depuis le milieu du XX
e
siècle des découvertes marquantes de la virologie marine. (A)
Frise temporelle indiquant les publications qui ont eu un impact majeur sur les recherches en écologie, en systématique et en évolution dans le domaine de la virologie marine. Les couleurs des cadres correspondent aux modèles biologiques sur lesquels se sont fondés les travaux de recherche (bleu pour les protistes, jaune pour les bactéries, et vert pour les microbes marins en général).
(B)
Représentation graphique de l’ensemble des publications traitant des « virus marins » (entre 1965 et 2021), réalisée à l’aide de l’outil numérique Journal Citation Report (
Clarivate Analytics
, 2022).
|
|
Abondance, distribution et diversité : un océan de superlatifs
Bien que les premiers virus marins aient été isolés dans les années 1950, la prise de conscience de l’importance des virus dans les écosystèmes océaniques s’est faite bien plus tardivement, après l’observation en microscopie électronique d’abondances très élevées de particules virales libres dans l’eau de mer (plus de 10
7
à 10
8
par millilitre) [
4
] (
Figure 1
). Suite à cette découverte, des techniques de comptage à plus haut débit ont été développées. Les méthodes les plus communes reposent sur l’utilisation de la microscopie à épifluorescence [
5
] ou de la cytométrie en flux [
6
] après marquage des acides nucléiques des virus avec un fluorochrome. Les particules détectées sont alors qualifiées de
virus-like particles
(VLP), compte tenu de possibles contaminations par d’autres particules femtométriques (moins de 0,2 µm de diamètre) naturellement présentes dans l’océan, comme les vésicules membranaires, les agents de transferts de gènes ou des débris cellulaires [
7
], par exemple. L’abondance virale (de ces VLP) est typiquement comprise entre 10
5
et 10
8
par millilitre d’eau de mer, tandis que celle des microbes varient entre 10
3
et 10
7
[
8
]. Le ratio médian entre virus et microbes (virus/microbes), parfois utilisé comme une approximation de l’activité virale, s’élève à 10 mais présente de fortes variations (de moins de 1 jusqu’à 160) en fonction des écosystèmes étudiés [
8
]. Les abondances virales et microbiennes fluctuent en effet dans l’espace avec des concentrations diminuant de la côte vers le large, et de la surface vers le fond de la colonne d’eau
1
, mais aussi dans le temps, avec des concentrations virales plus fortes enregistrées durant les périodes printanières et estivales. Dans l’océan, les sédiments, bien qu’ils restent sous-explorés, sont un réservoir encore plus important que la colonne d’eau, avec des concentrations de 10
8
à 10
11
virus par gramme de sédiment [
9
]. Les abondances virales sur et sous la surface des sédiments sont donc 10 à 1 000 fois plus importantes que celles de la colonne d’eau.
Une analyse morphologique réalisée dans six régions océaniques, a montré que la majorité des virus (79 %) consistent en de petites particules icosaédriques non caudées (dépourvues de queue), suivi par des virus affiliés aux trois familles bien connues de bactériophage « tête – queue » appartenant à l’ordre des
Caudovirales
que l’on retrouve dans les milieux terrestres (
Myoviridae
[14 %],
Podoviridae
[6 %] et
Siphoviridae
[1 %]) [
10
] (
Figure 2
). Les virus marins ne sont donc pas, morphologiquement, différents de leurs congénères terrestres. L’essor des techniques de séquençage a toutefois ouvert la voie à des études systématiques et quantitatives (métagénomiques) des génomes viraux. Ces analyses indiquent que l’information génétique contenue dans les génomes de virus marins code des fonctions inconnues, certains de ces gènes ne sont d’ailleurs pas répertoriés dans les banques de données actuelles. L’expédition océanographique à bord de la goélette Tara
2
a permis la plus grande étude métagénomique (sur 145 échantillons) couvrant toutes les régions océaniques majeures, y compris les régions polaires [
11
]. Les auteurs de cette étude ont identifié environ 200 000 populations virales formant des assemblages distincts et définissant cinq grandes régions écologiques dans l’océan global. Parmi ces populations, 90 % n’ont pas pu être annotées taxonomiquement. Les
Caudovirales
, incluant les trois familles de bactériophages caudés, et
Algavirales (Nucleocytoviricota)
, incluant des virus à ADN double brin (ADNdb) infectant des microalgues, dominent les séquences connues. Alors que la recherche sur les virus dans l’océan s’est surtout concentrée sur les virus à ADN (et plus particulièrement des virus à ADNdb), en partie parce qu’on les pensait dominants, les virus à ARN marins sont récemment apparus comme d’autres membres importants des communautés virales. Comme les virus à ADN, les virus à ARN sont cosmopolites, dynamiques, et des prédictions
3
d’abondances suggèrent qu’ils représentent la moitié de la virosphère marine [
12
]. Il est probable que ces virus infectent majoritairement les protistes marins, c’est-à-dire les organismes eucaryotes unicellulaires, tels que les microalgues ou les champignons, mais qui comprennent aussi une grande diversité d’autres lignées [
13
]. L’ampleur de la diversité de ces petits virus a été révélée lors de l’expédition Tara Océans
2
avec près de 5 500 nouveaux génomes décrits [
14
].
 | Figure 2.
Photographies en microscopies optique et électronique de protistes non infectés et infectés, ainsi que des grands types de virus et bactériophages marins. (A)
Photo en microscopie optique d’une cellule de Phaeocystis (haptophyte) non infectée en culture (photo Roscoff Culture Collection).
(B)
Photo en microscopie électronique à transmission d’une coupe de
Phaeocystis
infectée par le virus à ADN PgV-I, avec une production importante des particules virales observable au sein de la cellule (flèches rouges).
(C)
Zoom sur les virus PgV-I de forme icosaédrique. (B et C sont des images modifiées de [
46
]).
(D)
Photo en microscopie optique de cellules de
Minidiscus
(diatomée [eucaryotes unicellulaires (de deux micromètres à un millimètre) présents dans tous les milieux aquatiques]) non infectées en culture.
(E)
Photo en microscopie électronique à transmission d’une coupe de
Minidiscus
infectée par des virus à ARN qui s’accumulent dans le cytoplasme (flèche rouge) avec une représentation zoomée des virions (F). (E et F sont des images modifiées de [
47
]).
(G, H et I)
Photographies en microscopie électronique à transmission de spécimens représentatifs de trois grandes familles de bactériophages marins avec des morphologies distinctes :
(G)
les Siphoviridae,
(H)
les Myoviridae et
(I)
les
Podoviridae
(G et H sont des images de la photothèque de la station biologique de Roscoff, par A.C. Baudoux ; I, photothèque de l’institut de biologie structurale, par G. Schoehn).
|
|
Un éventail métabolique unique pour exploiter les hôtes marins
Les virus ont tous la capacité d’acquérir des gènes du monde cellulaire et de les transmettre à une autre cellule par des événements de transduction. Ces transferts d’information génétique entre lignées non apparentées sont un puissant moteur d’innovation dans l’évolution microbienne. Dans l’océan, on estime que 10
24
gènes seraient ainsi véhiculés chaque année par des virus [
15
]. Les gènes d’origine cellulaire qui parviennent à se maintenir dans le monde viral codent souvent des protéines impliquées dans des métabolismes importants et limitants pour le cycle d’infection virale. Ils sont en effet exprimés au cours de l’infection pour augmenter ou compléter ceux supportés par l’hôte et optimiser le processus de réplication virale. Si la capacité des virus à acquérir des gènes à partir des hôtes qu’ils infectent est universelle, la panoplie de gènes retrouvée chez les virus marins est bien différente de celle de leurs congénères continentaux. Par exemple, chez les virus qui infectent les cyanobactéries, des bactéries photosynthétiques ultra-dominantes dans l’océan, une grande diversité de gènes impliqués dans le métabolisme du carbone, dans la synthèse et le métabolisme des acides nucléiques, ou dans la tolérance au stress, sont détectés [
16
]. Plus emblématique, une quinzaine de gènes impliqués dans différentes étapes de la photosynthèse cyanobactérienne (telles que la capture de la lumière, la synthèse de pigments, le transport des électrons photosynthétiques, ou le métabolisme du carbone) a été identifiée [
17
]. Un de ces gènes (
psbA
), retrouvé dans 80 % des génomes complets de cyanophage, code une protéine extrêmement labile, la protéine D1, qui constitue le cœur d’un des centres réactionnels de la photosynthèse : le photosystème II. Ce complexe protéique pigmenté permet de collecter l’énergie lumineuse et d’initier sa transformation,
via
une chaîne d’accepteurs d’électrons, en énergie sous la forme d’ATP et de NADPH (forme réduite du nicotinamide adénine dinucléotide phosphate). Durant le cycle d’infection, l’expression des protéines D1 virales permettrait de compenser la dégradation de cette protéine chez l’hôte, et donc de maintenir le fonctionnement et la stabilité du photosystème II.
Cette innovation génétique est encore plus stupéfiante chez les virus de protistes marins appartenant au phylum des
Nucleocytoviricota
. Ceux-ci comprennent une grande diversité de virus, qui infectent différents taxons au sein des haptophytes
4,
, des amibozoaires
5,
, des straménopiles
6,
et des archaeplastides
7
(
Figure 3
). Parmi les
Nucleocytoviricota
, les
Mimiviridae
constituent une famille remarquable en raison de la grande taille de leur capside et de leur génome, comparables à celles des petites bactéries. Il a d’ailleurs été proposé que ce groupe viral soit autant diversifié, voire plus, que les bactéries et les archées réunies [
18
]. Les
Nucleocytoviricota
dont les génomes ont été séquencés, montrent un incroyable éventail de potentiel métabolique avec la capacité de compléter, d’augmenter, ou d’apporter de nouvelles fonctions à l’hôte infecté. Il peut s’agir de gènes codant des protéines contribuant à l’acquisition de nutriments, tels que des transporteurs d’azote [
19
] et de phosphate [
20
], ainsi que des gènes dont les produits participent à la fermentation ou complémentent le métabolisme des glucides [
21
]. Une différence mal comprise entre les virus de cyanobactéries et les virus de protistes photosynthétiques marins, est l’absence de gènes impliqués dans la photosynthèse chez ces derniers. Cependant, les gènes des virus de protistes codent d’autres protéines qui utilisent la lumière du soleil, comme les rhodopsines [
22
,
23
]. La présence de ces rhodopsines microbiennes est indépendante du fait que l’hôte code ou non de telles protéines. Elles peuvent donc apporter une nouvelle fonction métabolique à l’hôte [
23
]. Chez certains génomes viraux, s’ajoutent également les protéines nécessaires à la biosynthèse du rétinal, le pigment dont les rhodopsines ont besoin pour fonctionner [
23
]. Ceci est remarquable, car les probables organismes hôtes ne semblent pas capables de synthétiser le bêta-carotène, précurseur du rétinal, et les virus doivent donc disposer de plusieurs gènes codant la machinerie pour le faire ; ces gènes seraient ensuite également exprimés par l’hôte infecté.
 | Figure 3.
(A)
Un arbre phylogénomique (maximum de vraisemblance) des
Nucleocytoviricota
fondé sur 10 protéines supposément héritées verticalement. Les
Nucleocytoviricota
infectent une variété d’hôtes eucaryotes, principalement des protistes, comme indiqué ici pour ceux isolés à partir d’hôtes en culture ou non (i.e., reconstruction métagénomique). Les supports statistiques sont indiqués lorsque la valeur de
bootstrap
(mesure de robustesse) dépasse 80 %. La barre d’échelle indique le nombre de substitutions par site. La couleur de chaque étiquette de virus indique la lignée d’hôtes de laquelle le virus est issu, ainsi que ceux dont les hôtes sont inconnus. Les étoiles noires indiquent les hôtes protistes. Il est probable que la contribution relative plus élevée des protistes photosynthétiques en tant qu’hôtes des
Nucleocytoviricota
résulte du fait qu’il y ait plus de protistes photosynthétiques en culture par rapport aux protistes hétérotrophes et/ou mixotrophes (figure modifiée de [
13
]).
(B)
Représentation phylogénétique des phages en utilisant l’outil informatique vConTACT2 (
Viral CONTigs Automatic Clustering and Taxonomy
) pour établir les relations entre phages. Ce réseau comprend 2 617 génomes de phages de référence RefSeq, chacun étant représenté par un noeud. Une arête représente une connexion entre deux noeuds (génomes), fondée sur le nombre de clusters de protéines partagés. Les arbres phylogénétiques traditionnels sont utilisés en supposant que les phages suivent une évolution linéaire. Ce type de phylogénie fondée sur une analyse de réseau semble améliorer la compréhension des relations évolutives des phages, car elle fournit des informations sur les transferts horizontaux de gènes, qui sont très fréquents chez les phages, et est donc plus représentative (figure modifiée de [
48
]).
|
Enfin, les virus influencent l’évolution de l’hôte en s’intégrant dans les génomes, un phénomène qui a été décrit pour le génome humain également [
24
] et dans les génomes des plantes [
25
]. De même, la capacité des virus à s’intégrer dans les génomes de protistes ou de bactéries a été observée dans des couples hôte-virus en culture [
26
,
27
]. Les conséquences de cette intégration ne sont pas claires, mais le matériel viral semble refléter des vestiges d’anciennes infections et n’est pas exprimé à la même fréquence que les autres gènes. Cela suggère que ces anciens gènes résiduels sont peut-être devenus non fonctionnels et n’influencent pas beaucoup l’hôte, ou ne sont exprimés que dans certaines conditions. Néanmoins, ces observations compliquent les études visant à décrire la diversité virale existante par le séquençage métagénomique et doivent être prises en compte lors de l’étude des génomes, notamment ceux des protistes.
|
Force de mortalité dans les océans
Alors que la biomasse totale des océans équivaut à entre 1 et 2 % de celle des systèmes terrestres (environ 6
versus
environ 470 milliards de tonnes de carbone), leur productivité est à peu près égale [
28
]. Cette observation surprenante s’explique par le fait que la biomasse océanique est principalement microbienne et qu’elle présente donc un renouvellement très rapide. Ces taux de renouvellement élevés de la biomasse microbienne dans les écosystèmes marins proviennent d’un fort « prélèvement » imposé par la prédation des maillons trophiques supérieurs (ou broutage) et par les infections virales (par des virus lytiques), ce qui entraîne des temps de renouvellement des microbes de l’ordre de quelques heures ou quelques jours. Mesurer de façon précise la mortalité (ou lyse) induite par les virus est toutefois un vrai défi et, à ce jour, une dizaine d’approches ont été développées. Bien que toutes différentes et imparfaites, elles indiquent néanmoins que les virus marins sont des agents de mortalité importants pour les communautés microbiennes, égalant la mortalité induite par le broutage [
1
]. On estime en effet que près d’un tiers des microbes serait infecté à chaque instant dans l’océan.
Les virus détruisent généralement entre 10 à 30 % de la production bactérienne journalière dans l’eau. L’infection des communautés bactériennes par les virus est un processus extrêmement dynamique. Elle varie au cours des saisons, le long du continuum côte-large, de la surface aux profondeurs océaniques, ou encore selon les populations bactériennes qui coexistent dans un même échantillon [
1
]. En surface, on estime, par exemple, que les virus éliminent chaque jour 20 à 40 % de la production bactérienne [
1
], avec des pics d’infection au cours de la journée possiblement synchronisés au cycle cellulaire des populations infectées [
29
]. Mais ce sont dans les profondeurs océaniques que l’impact des virus est le plus marqué puisqu’ils détruisent, en moyenne, 80 % de la production bactérienne [
30
]. Les virus marins sont également impliqués dans le déclin des efflorescences algales (ou
blooms
en anglais) qui se développent, souvent de façon spectaculaire, le long de nos côtes ou au large. Durant les
blooms
d’espèces phytoplanctoniques, telles que
Emiliania huxleyi
,
Phaeocystis globosa
ou
Heterosigma akashiwo
, des taux de mortalité par lyse virale considérables sont enregistrés (jusqu’à 100 % des cellules observées étant infectées) dès lors que la concentration des microalgues augmente dans l’environnement [
31
].
La régulation des
blooms
algaux par les virus illustre parfaitement la théorie de «
killing the winner
»
8
énoncée en 1997 [
32
], et devenue, depuis, un concept fondamental dans les études d’écologie microbienne. Ce modèle propose que les virus attaquent préférentiellement les espèces abondantes, considérées comme les plus compétitives pour acquérir les ressources nutritives. En effet, les virus ne sont pas mobiles, leur probabilité de rencontre avec un hôte est donc d’autant plus grande que la population hôte est abondante, comme lors des
blooms
. Le contrôle, voire l’élimination, du
winner
permet l’utilisation des ressources et le développement d’espèces moins compétitives. Par la suite, un virus, capable d’infecter l’espèce nouvellement dominante, se développera et le cycle continuera. Les virus, par la mortalité qu’ils imposent, agissent donc comme un moteur de la diversité des communautés microbiennes. Il existe toutefois un certain nombre de contre-exemples à la théorie «
killing the winner
». Par exemple, les populations de cyanobactéries marines, dominantes dans les eaux de surface, sont faiblement infectées [
33
]. Les raisons expliquant ces observations ne sont, à ce jour, pas élucidées et conduisent à revisiter les hypothèses de travail actuelles afin de mieux décrire les dynamiques plancton-virus et prédire leur évolution dans l’océan actuel et futur.
À l’échelle mondiale, l’importance de l’infection virale semble varier selon un gradient latitudinal, avec de plus fortes valeurs aux basses latitudes (subtropicales) comparées aux hautes latitudes (polaires) [
34
]. Les raisons expliquant ces variations restent mal comprises. Dans l’océan, l’infection virale est régulée par un grand nombre de facteurs, dont des facteurs abiotiques (concentration en nutriments, température, salinité, intensité lumineuse, radiation solaire), qui agissent sur l’état physiologique des hôtes et/ou sur l’infectiosité des virus, et des facteurs biotiques (capacité à développer des résistances, abondance des hôtes, ou broutage des cellules infectées) [
35
]. La variabilité environnementale influence également les stratégies de réplication virale, avec une plus forte proportion de virus tempérés (se répliquant par lysogénie
9,
) dans des environnements où l’abondance et l’activité bactérienne sont faibles, et, inversement, une majorité de virus virulents (se répliquant par cycle lytique) dans des eaux enrichies en nutriments et plus chaudes, et où la productivité est plus importante [
35
].
|
Agent de redistribution de la matière et effet sur le climat
Dans l’océan, les micro-organismes qui réalisent la photosynthèse oxygénique
10
(appelés producteurs primaires) utilisent la lumière, les nutriments, et le dioxyde de carbone pour produire de la biomasse vivante et du dioxygène, qui sera restitué à l’atmosphère (
Figure 4
) ; la vitesse à laquelle la biomasse est produite grâce à la photosynthèse est appelée
production primaire
. Le carbone fixé par le phytoplancton est ensuite consommé par le zooplancton et, enfin, les particules générées le long de ce réseau alimentaire (les pelotes fécales du zooplancton, les cellules mortes, les détritus) subissent une série de transformations : elles peuvent être recyclées par les bactéries hétérotrophes, ou exportées vers le fond océanique. On estime que, chaque année, près de 10 milliards de tonnes de carbone sont ainsi exportées à partir de la couche de surface. Une petite partie des particules (environ 2 %) atteint les plus grandes profondeurs et peut être séquestrée dans les sédiments pendant des millénaires. L’ensemble des processus qui participent à l’export de carbone de la surface vers les fonds océaniques se nomme
pompe à carbone biologique
. Cette pompe permet l’absorption et le stockage d’une part significative du CO
2
émis dans l’atmosphère et donc ralentit le réchauffement climatique lié à l’accumulation de ce gaz. Disséquer la mécanique de cette pompe à carbone biologique, et en particulier le rôle de chaque composante microbienne et les flux de carbone qu’elles transitent, est un enjeu majeur si l’on veut comprendre le fonctionnement de notre climat et prédire son évolution.
 | Figure 4.
Place des virus au sein du réseau trophique marin et impacts potentiels sur la pompe à carbone biologique (export de carbone)
via
le
shunt
et le
shuttle
viraux.
L’hypothèse du
shunt
viral (flèches noires pleines) postule qu’en tuant leurs hôtes microbiens par lyse cellulaire, les virus détournent la biomasse destinée aux échelons trophiques supérieurs (
i.e.
, les protistes hétérotrophes, le zooplancton et les animaux) et la redirige sous forme de matière organique dissoute vers le compartiment bactérien. Ce processus conduirait à ralentir la pompe à carbone biologique. L’hypothèse du
shuttle
viral (flèches noires en pointillé) propose, qu’au contraire, les virus pourraient augmenter l’efficacité de la pompe à carbone biologique
via
l’agrégation et la sédimentation de particules organiques ou de cellules infectées ou encore le relargage par lyse virale de micronutriments, limitant la production primaire.
|
L’infection virale modifie de façon incontestable le destin des micro-organismes qui forment le socle de la pompe à carbone biologique, mais l’impact net des virus sur ce processus est loin d’être élucidé. Deux hypothèses s’opposent. Celle qui a prévalu jusqu’à récemment, est que l’infection virale ralentit la pompe à carbone biologique (
Figure 4
). L’infection des micro-organismes, tels que les bactéries et le phytoplancton, conduit à leur mort par lyse cellulaire et donc à la libération de leur contenu cytoplasmique dans le milieu ambiant. En détruisant ces cellules, les virus dérobent la biomasse destinée aux prédateurs des maillons trophiques supérieurs et la transforment en matière organique dissoute, utilisable par le compartiment bactérien [
36
,
37
]. Cette redistribution de la matière organique (encore appelée
viral shunt
) résulterait en une diminution de la production des échelons trophiques supérieurs, et donc des particules générées le long du réseau alimentaire, au profit du réseau microbien. On estime que le
viral shunt
s’élèverait à 150 milliards de tonnes de carbone par an [
38
]. Inversement, il s’agit alors de l’hypothèse du
viral shuttle
, les virus pourraient accélérer la pompe à carbone biologique en induisant, par exemple, la libération au cours de la lyse, de micronutriments, tels que le fer, dont les faibles concentrations limitent la production primaire dans près de la moitié des océans [
39
]. L’infection et la lyse des microbes infectés pourraient également induire la formation de différents types de particules susceptibles de sédimenter, telles que des agrégats constitués des produits de la lyse virale [
40
], des spores de dormance [
41
], ou encore des cellules infectées qui perdent leur motilité [
42
] (
Figure 4
). Ces observations en laboratoire sont confortées par des modèles environnementaux qui indiquent que la présence de certains gènes bactériens et viraux prédit la variabilité de l’export de carbone vers les profondeurs océaniques [
43
].
Shunt
ou
Shuttle
? Il est en fait probable que la contribution relative de ces deux processus varie selon les populations infectées et les conditions environnementales, ce qui renforce la nécessité de quantifier l’infection virale
in situ
, de mieux comprendre le devenir des cellules infectées et d’évaluer comment la variabilité environnementale (naturelle et anthropique) régule ces processus.
Un autre potentiel effet des virus sur le climat est celui, plus insolite, de l’impact des infections virales sur la production d’aérosols qui jouent un rôle dans la formation des nuages, les précipitations et l’effet d’albédo
11
de la planète. En effet, les très nombreux aérosols marins sont majoritairement composés de minuscules éléments invisibles qui contribuent activement aux précipitations d’eau de pluie, en favorisant la formation de noyaux d’eau glacée dans les nuages. Des expérimentations en laboratoire ont montré que les coccolithes (les plaques de carbonate de calcium entourant les cellules) aérosolisés émis par
E. huxleyi
lors d’une infection virale, peuvent constituer une part importante des aérosols marins, d’un ordre de grandeur plus important que dans une population d’
E. huxleyi
non infectée [
44
]. La lyse virale conduit également à la production de diméthylsulfoniopropionate (DMSP), un osmolyte
12
d’origine algale précurseur d’un gaz actif sur le climat, le diméthylsulfure (DMS). Au contact de l’air, le DMS peut être converti en particules d’aérosol de sulfate, servant de noyaux de condensation pour la vapeur d’eau initiant la formation des nuages. Encore une fois, la lyse virale pourrait jouer un rôle, qu’il reste encore à élucider, sur l’augmentation ou la diminution de la libération de DMS, avec des effets directs sur le climat de la planète [
45
]. En fin de compte, les effets des interactions virales sur les processus de rétroaction à l’interface océan-atmosphère restent un terrain d’étude quasi-inexploré qui conduira sûrement à de surprenantes découvertes.
|
Après trois décennies d’exploration, il ne fait plus aucun doute que l’océan renferme une quantité et une diversité étonnantes de virus. Cette virosphère marine contribue de manière déterminante à l’écologie et à l’évolution des microbes marins, au maintien de la diversité, ainsi qu’aux cycles des nutriments, de la matière et de l’énergie dans l’océan. De nombreuses questions fondamentales restent toutefois sans réponse. Leur diversité est particulièrement mal caractérisée, avec 90 % des séquences environnementales sans information taxonomique et fonctionnelle. Quels sont les virus retrouvés dans cette « matière noire » ? Quels sont leurs hôtes ? Comment les infectent-ils ? L’océan est par ailleurs vaste, difficile d’accès et de nombreux environnements restent sous-échantillonnés, comme les régions tropicales, les abysses, les sédiments, les sources hydrothermales, ou les microbiotes associés. Une grande diversité de virus reste encore à découvrir. Enfin, si la contribution des virus marins à l’équilibre du climat est aujourd’hui sans équivoque, leur réponse aux conséquences du changement climatique (acidification des océans, élévation de la température, désoxygénation, stratification des eaux de surface, érosion de la diversité, phénomènes extrêmes, etc.) n’est que peu étudiée et controversée. En retour, l’impact potentiel des virus sur la formation des nuages,
via
la formation d’aérosols d’origine biologique, reste aujourd’hui très anecdotique. Compte tenu de leur importance écologique, il est indispensable de continuer à caractériser ce compartiment encore trop mal connu.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Nous remercions nos réseaux de collaborateurs français et étrangers pour les discussions sur le monde fascinant des virus marins ainsi que les deux relecteurs pour leurs commentaires sur la version originale de ce manuscrit. Nos remerciements vont également à l’ANR pour son soutien financier (ANR-20-CE02-0025-01 PHENOMAP, ANR-15-CE01-0009-01 CALYPSO).
|
Footnotes |
1.
Suttle
CA
.
Marine viruses — major players in the global ecosystem.
.
Nat Rev Microbiol.
2007;
;
5
:
:801.
–
812
.
2.
Mushegian
AR
Are There 1031 Virus Particles on Earth, or More, or Fewer?
.
J Bacteriol.
2020
;
:202.
.
3.
Hendrix
RW
,
Smith
MCM
,
Burns
RN
,
et al.
Evolutionary relationships among diverse bacteriophages and prophages: All the world’s a phage.
.
Proc Natl Acad Sci USA.
1999;
;
96
:
:2192.
–
2197
.
4.
Bergh
Ø
,
BØrsheim
KY
,
Bratbak
G
,
et al.
High abundance of viruses found in aquatic environments.
.
Nature.
1989;
;
340
:
:467.
–
468
.
5.
Noble
R
,
Fuhrman
J
.
Use of SYBR Green I for rapid epifluorescence counts of marine viruses and bacteria.
.
Aquat Microb Ecol.
1998;
;
14
:
:113.
–
118
.
6.
Marie
D
,
Brussaard
CPD
,
Thyrhaug
R
,
et al.
Enumeration of Marine Viruses in Culture and Natural Samples by Flow Cytometry.
.
Appl Environ Microbiol.
1999;
;
65
:
:45.
–
52
.
7.
Forterre
P
,
Soler
N
,
Krupovic
M
,
et al.
Fake virus particles generated by fluorescence microscopy.
.
Trends Microbiol.
2013;
;
21
:
:1.
–
5
.
8.
Wigington
CH
,
Sonderegger
D
,
Brussaard
CPD
,
et al.
Re-examination of the relationship between marine virus and microbial cell abundances.
.
Nat Microbiol.
2016;
;
1
:
:15024.
.
9.
Hewson
I
,
O’Neil
JM
,
Fuhrman
JA
,
et al.
Virus-like particle distribution and abundance in sediments and overlying waters along eutrophication gradients in two subtropical estuaries.
.
Limnol Oceanogr.
2001;
;
46
:
:1734.
–
1746
.
10.
Brum
JR
,
Schenck
RO
,
Sullivan
MB
.
Global morphological analysis of marine viruses shows minimal regional variation and dominance of non-tailed viruses.
.
ISME J.
2013;
;
7
:
:1738.
–
1751
.
11.
Gregory
AC
,
Zayed
AA
,
Conceição-Neto
N
,
et al.
Marine DNA Viral Macro – and Microdiversity from Pole to Pole.
.
Cell.
2019;
;
177
:
:1109.
–
1123
.
12.
Steward
GF
,
Culley
AI
,
Mueller
JA
,
et al.
Are we missing half of the viruses in the ocean?
.
ISME J.
2013;
;
7
:
:672.
–
679
.
13.
Bachy
C
,
Hehenberger
E
,
Ling
Y-C
,
et al.
Marine Protists: A Hitchhiker’s Guide to their Role in the Marine Microbiome.
. In:
Stal
LJ
,
Cretoiu
MS
(eds).
The Marine Microbiome.
.
Cham:
:
Springer International Publishing;
,
2022
: pp.
:159.
–
241
.
14.
Zayed
AA
,
Wainaina
JM
,
Dominguez-Huerta
G
,
et al.
Cryptic and abundant marine viruses at the evolutionary origins of Earth’s RNA virome.
.
Science.
2022;
;
376
:
:156.
–
62
.
15.
Jiang
SC
,
Paul
JH
.
Gene Transfer by Transduction in the Marine Environment.
.
Appl Environ Microbiol.
1998;
;
64
:
:2780.
–
2787
.
16.
Crummett
LT
,
Puxty
RJ
,
Weihe
C
,
et al.
The genomic content and context of auxiliary metabolic genes in marine cyanomyoviruses.
.
Virology.
2016;
;
499
:
:219.
–
229
.
17.
Puxty
RJ
,
Millard
AD
,
Evans
DJ
,
et al.
Shedding new light on viral photosynthesis.
.
Photosynth Res.
2015;
;
126
:
:71.
–
97
.
18.
Mihara
T
,
Koyano
H
,
Hingamp
P
,
et al.
Taxon Richness of “Megaviridae” Exceeds those of Bacteria and Archaea in the Ocean.
.
Microbes Environ.
2018;
;
33
:
:162.
–
171
.
19.
Monier
A
,
Chambouvet
A
,
Milner
DS
,
et al.
Host-derived viral transporter protein for nitrogen uptake in infected marine phytoplankton.
.
Proc Natl Acad Sci USA.
2017;
;
114
:
:E7489.
–
E7498
.
20.
Bachy
C
,
Charlesworth
CJ
,
Chan
AM
,
et al.
Transcriptional responses of the marine green alga Micromonas pusilla and an infecting prasinovirus under different phosphate conditions.
.
Environ Microbiol.
2018;
;
20
:
:2898.
–
2912
.
21.
Schvarcz
CR
,
Steward
GF
.
A giant virus infecting green algae encodes key fermentation genes.
.
Virology.
2018;
;
518
:
:423.
–
433
.
22.
Yutin
N
,
Koonin
EV
.
Proteorhodopsin genes in giant viruses.
.
Biol Direct.
2012;
;
7
:
:34.
.
23.
Needham
DM
,
Yoshizawa
S
,
Hosaka
T
,
et al.
A distinct lineage of giant viruses brings a rhodopsin photosystem to unicellular marine predators.
.
Proc Natl Acad Sci USA.
2019;
;
116
:
:20574.
–
20583
.
24.
Griffiths
DJ
.
Endogenous retroviruses in the human genome sequence.
.
Genome Biol.
2001;
;
2
:
:1.
–
5
.
25.
Maumus
F
,
Epert
A
,
Nogué
F
,
et al.
Plant genomes enclose footprints of past infections by giant virus relatives.
.
Nat Commun.
2014;
;
5
:
:4268.
.
26.
Filée
J.
.
Multiple occurrences of giant virus core genes acquired by eukaryotic genomes: The visible part of the iceberg?
.
Virology.
2014;
;
466–7
:
:53.
–
59
.
27.
Forterre
P
,
Prangishvili
D
.
The major role of viruses in cellular evolution: facts and hypotheses.
.
Curr Opin Virol.
2013;
;
3
:
:558.
–
565
.
28.
Bar-On
YM
,
Phillips
R
,
Milo
R
.
The biomass distribution on Earth.
.
Proc Natl Acad Sci USA.
2018;
;
115
:
:6506.
–
6511
.
29.
Aylward
FO
,
Boeuf
D
,
Mende
DR
,
et al.
Diel cycling and long-term persistence of viruses in the ocean’s euphotic zone.
.
Proc Natl Acad Sci USA.
2017;
;
114
:
:11446.
–
11451
.
30.
Danovaro
R
,
Dell’Anno
A
,
Corinaldesi
C
,
et al.
Major viral impact on the functioning of benthic deep-sea ecosystems.
.
Nature.
2008;
;
454
:
:1084.
–
1087
.
31.
Short
SM
.
The ecology of viruses that infect eukaryotic algae.
.
Environ Microbiol.
2012;
;
14
:
:2253.
–
2271
.
32.
Thingstad
T
,
Lignell
R
.
Theoretical models for the control of bacterial growth rate, abundance, diversity and carbon demand.
.
Aquat Microb Ecol.
1997;
;
13
:
:19.
–
27
.
33.
Mruwat
N
,
Carlson
MCG
,
Goldin
S
,
et al.
A single-cell polony method reveals low levels of infected Prochlorococcus in oligotrophic waters despite high cyanophage abundances.
.
ISME J.
2021;
;
15
:
:41.
–
54
.
34.
Mojica
KDA
,
Huisman
J
,
Wilhelm
SW
,
et al.
Latitudinal variation in virus-induced mortality of phytoplankton across the North Atlantic Ocean.
.
ISME J.
2016;
;
10
:
:500.
–
513
.
35.
Mojica
KDA
,
Brussaard
CPD
.
Factors affecting virus dynamics and microbial host – virus interactions in marine environments.
.
FEMS Microbiol Ecol.
2014;
;
89
:
:495.
–
515
.
36.
Wilhelm
SW
,
Suttle
CA
.
Viruses and Nutrient Cycles in the SeaViruses play critical roles in the structure and function of aquatic food webs.
.
Bioscience.
1999;
;
49
:
:781.
–
788
.
37.
Fuhrman
JA
.
Marine viruses and their biogeochemical and ecological effects.
.
Nature.
1999;
;
399
:
:541.
–
548
.
38.
Suttle
CA
.
Viruses in the sea.
.
Nature.
2005;
;
437
:
:356.
–
361
.
39.
Poorvin
L
,
Rinta-Kanto
JM
,
Hutchins
DA
,
et al.
Viral release of iron and its bioavailability to marine plankton.
.
Limnol Oceanogr.
2004;
;
49
:
:1734.
–
1741
.
40.
Yamada
Y
,
Tomaru
Y
,
Fukuda
H
,
et al.
Aggregate Formation During the Viral Lysis of a Marine Diatom.
.
Front Mar Sci.
2018;
;
5
:
:167.
.
41.
Pelusi
A
,
De Luca
P
,
Manfellotto
F
,
et al.
Virus-induced spore formation as a defense mechanism in marine diatoms.
.
New Phytol.
2021;
;
229
:
:2251.
–
9
.
42.
Zimmerman
AE
,
Howard-Varona
C
,
Needham
DM
,
et al.
Metabolic and biogeochemical consequences of viral infection in aquatic ecosystems.
.
Nat Rev Microbiol.
2020;
;
18
:
:21.
–
34
.
43.
Guidi
L
,
Chaffron
S
,
Bittner
L
,
et al.
Plankton networks driving carbon export in the oligotrophic ocean.
.
Nature.
2016;
;
532
:
:465.
–
470
.
44.
Trainic
M
,
Koren
I
,
Sharoni
S
,
et al.
Infection Dynamics of a Bloom-Forming Alga and Its Virus Determine Airborne Coccolith Emission from Seawater.
.
Iscience.
2018;
;
6
:
:327.
–
335
.
45.
Danovaro
R
,
Corinaldesi
C
,
Dell’anno
A
,
et al.
Marine viruses and global climate change.
.
FEMS Microbiol Rev.
2011;
;
35
:
:993.
–
1034
.
46.
Baudoux
A-C
,
Brussaard
CPD
.
Characterization of different viruses infecting the marine harmful algal bloom species Phaeocystis globosa.
.
Virology.
2005;
;
341
:
:80.
–
90
.
47.
Arsenieff
L
,
Gall
FL
,
Rigaut-Jalabert
F
,
et al.
Diversity and dynamics of relevant nanoplanktonic diatoms in the Western English Channel.
.
ISME J.
2020
;
:1.
–
16
.
48.
Dion
MB
,
Oechslin
F
,
Moineau
S
.
Phage diversity, genomics and phylogeny.
.
Nat Rev Microbiol.
2020;
;
18
:
:125.
–
38
.
|