La sénescence cellulaire est un processus multi-étapes qui entraîne un arrêt de la prolifération des cellules. Différents stimulus définissent différents types de sénescence, dont les liens sont discutés [ 1 – 3 ] ( → ).
(→) Voir les Synthèses de J.M. Brondello et al ., m/s n° 3, mars 2012, page 288, et Y. Tachikart et al ., m/s n° 6-7, juin-juillet 2018, page 547
Bien qu’il n’existe aucun marqueur à la fois universel et spécifique de la sénescence, elle implique souvent l’induction transcriptionnelle de la protéine P16 Ink4a (P16), et elle est couramment mise en évidence par l’augmentation de l’activité de la β-galactosidase (SA-βGal, senescence associated beta-galactosidase) [ 1 – 3 ]. La sénescence cellulaire joue un rôle dans le développement, la cicatrisation, la régénération, et la suppression tumorale [ 1 – 4 ]. En contrepartie de ces bénéfices à court terme, l’accumulation de cellules sénescentes dans un tissu ou un organe paraît conduire, directement ou indirectement, à son dysfonctionnement et contribuer à des maladies liées à l’âge [ 1 – 4 ]. Ce lien entre accumulation de cellules sénescentes et déclin fonctionnel motive des stratégies thérapeutiques ciblant les cellules sénescentes [ 2 – 4 ]. Pourtant, ce lien semble devoir parfois être nuancé.
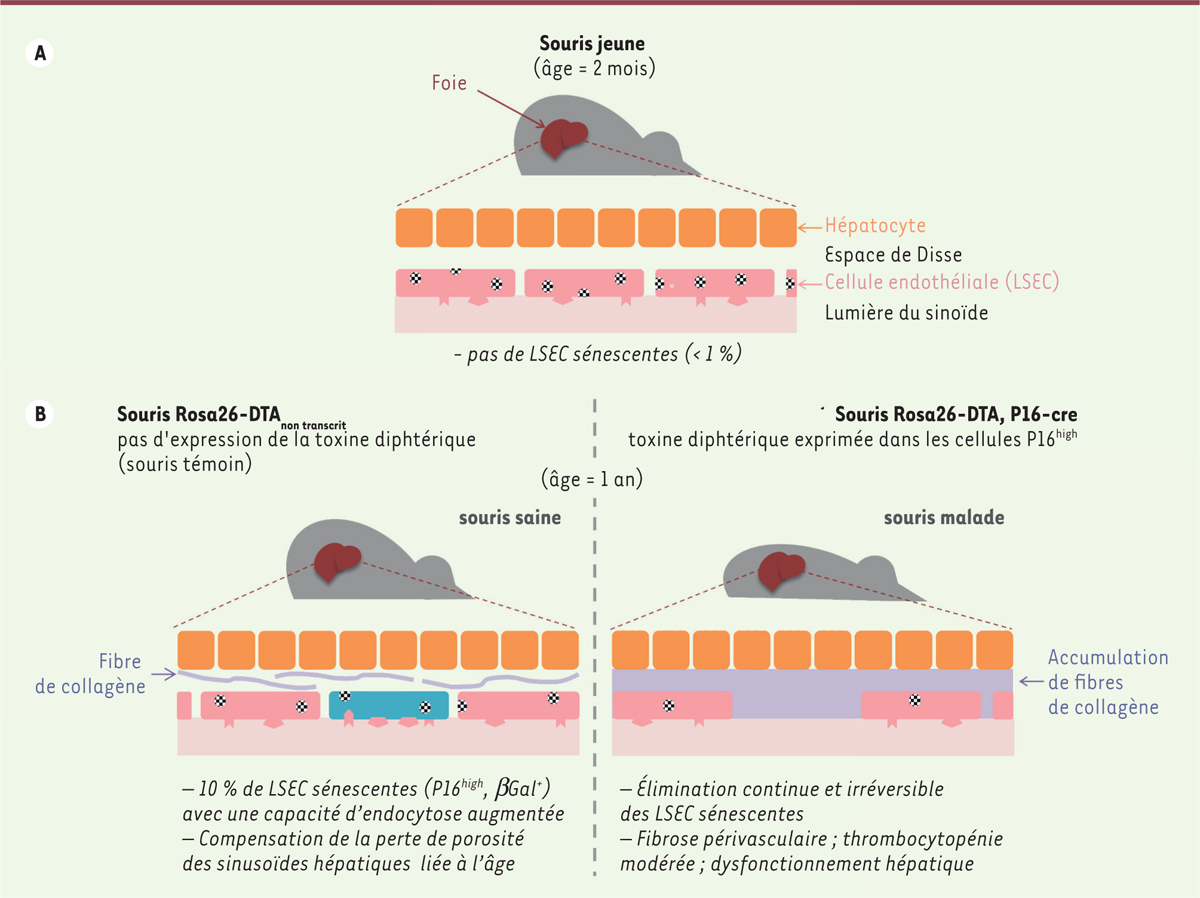
Une équipe de chercheurs a récemment produit des souris transgéniques permettant l’élimination sélective des cellules sénescentes (P16 high ) au fur et à mesure de leur apparition ( Figure 1 ) [ 5 ]. Alors que des travaux antérieurs pouvaient laisser supposer un effet bénéfique [ 3 , 5 ], les chercheurs ont constaté, au contraire, que la santé d’une partie de ces souris se dégrade vers un an [ 5 ]. Les souris malades souffrent de la perte de cellules endothéliales sénescentes, tout particulièrement de celles des sinusoïdes hépatiques ( liver sinusoidal endothelial cells , LSEC). Les LSEC jouent un rôle fondamental dans l’élimination de nombreux déchets, toxines ou agents infectieux présents dans le sang. Cette fonction repose sur des récepteurs membranaires spécialisés, qui confèrent aux LSEC une remarquable capacité d’endocytose, la plus forte parmi toutes les cellules de l’organisme [ 5 ]. Les auteurs montrent, chez les souris témoins, que les LSEC sénescentes s’accumulent progressivement au cours de la vie, passant de moins de 1 % des LSEC chez les souris âgées de deux mois, à 10 % à l’âge de un an et à plus de 50 % à l’âge de deux ans. Chez les souris âgées de un an, les LSEC sénescentes présentent une expression de nombreux récepteurs spécialisés dans l’endocytose et une capacité d’internalisation des LDL ( low-density lipoproteins ) oxydées (LDL-ox) ou acétylées supérieures à celles des LSEC non sénescentes [ 5 ] ( Figure 1 ). À cet âge, les LSEC sénescentes sont donc dotées d’une fonction détoxifiante accrue. Ce gain fonctionnel compense la diminution progressive de la porosité des sinusoïdes avec l’âge par pseudo-capillarisation (diminution du nombre des fenêtres entre les LSEC et formation d’une membrane basale), et la réduction corrélative de l’épuration du sang par les hépatocytes voisins [ 5 ]. Les auteurs montrent par ailleurs que la perte des LSEC sénescentes chez les souris transgéniques est irréversible : les LSEC éliminées ne sont pas remplacées par de nouvelles LSEC, mais par des dépôts de collagène. Cette perte conduit, chez les souris âgées de un an, à une fibrose périvasculaire dans le foie, et dans d’autres organes (cœur, poumon, rein) 1, , et à une détérioration du fonctionnement hépatique [ 5 ] ( Figure 1 ). Ces résultats montrent l’importance structurale et fonctionnelle du maintien des LSEC sénescentes.
| Figure 1.
Les cellules endothéliales des sinusoïdes du foie (LSEC) sénescentes sont indispensables au fonctionnement hépatique.
Ce modèle d’étude requiert l’utilisation de deux cassettes insérées chacune dans une des deux copies d’un locus spécifique (
knock-in
). La première, constituée de l’ADNc codant le fragment A de la toxine diphtérique (DTA), est insérée dans le gène murin d’expression ubiquitaire
Rosa26
(Rosa26-DTA
non transcrit
). L’ADN inséré comporte aussi un signal d’interruption de la transcription éliminable par la recombinase Cre et présent entre le promoteur de
Rosa26
et
DTA
: la transcription de
DTA
est donc conditionnée par l’expression de Cre. La seconde, constituée de l’ADNc codant la recombinase Cre, est insérée dans la partie 3’ du gène codant P16 (P16-cre). La production de Cre, et donc celle de DTA, sont ainsi restreintes aux cellules exprimant l’ARNm
P16
et la protéine P16 elle-même au-dessus d’un seuil critique (P16
high
). Notons que chez ces souris, la production de Cre n’est pas couplée à celle de P19
Arf
, l’autre produit majeur du gène codant P16 (gène
Cdkn2a
ou
Ink4a/Arf
) et que la version recombinée du gène code toujours une protéine P16 entière [
5
]. Les souris témoins ne portent que Rosa26-
DTA
non transcrit
. Jusqu’alors, les stratégies d’élimination sélective des cellules sénescentes utilisaient un transgène « non ciblé » (intégration au hasard dans le génome), contenant à la fois des régions régulatrices du gène codant P16 et un gène suicide codant une protéine dont l’activité toxique est inductible [
3
,
5
,
9
].
A.
Chez les souris âgées de deux mois, les LSEC sont densément fenestrées (disques pointillés), ce qui favorise les échanges avec les hépatocytes, et ne sont pas sénescentes (moins de 1 % de cellules SA-βGal
+
).
B..
La proportion de LSEC sénescentes (cellule bleue) augmente ensuite et atteint 10 % à l’âge de 12 mois (souris témoin Rosa26-DTA
non transcrit
, à gauche). À cet âge, les LSEC sénescentes ont une expression plus forte de nombreux récepteurs spécialisés dans l’endocytose (en rose, par exemple
scavenger
et
mannose-like receptors
) et une fonction détoxifiante accrue. Lorsque les LSEC P16
high
(sénescentes) sont sélectivement éliminées de façon continue (souris doublement transgéniques), 10 % à 20 % des souris âgées de un an sont malades (à droite). Les LSEC éliminées sont remplacées par des fibres de collagène, qui remplissent l’espace entre ces cellules et les hépatocytes (espace de Disse). Une fibrose périvasculaire s’installe dans le foie (et dans d’autres organes), associée à une thrombocytopénie modérée. Des cellules endothéliales P16
high
sont également éliminées dans d’autres organes que le foie, ce qui contribue vraisemblablement au phénotype de ces souris. Une élimination en une fois des cellules P16
high
chez des souris âgées de 18 mois grâce à une version inductible de Cre provoque des effets similaires, mais plus sévères : fibrose périvasculaire avec détérioration généralisée de la perméabilité vasculaire, thrombocytopénie plus marquée, et accumulation de LDL (
low-density lipoproteins
) oxydées dans le sang. Les auteurs utilisent aussi une variante de leur méthode dans laquelle la protéine fluorescente verte (
green fluorescent protein
, GFP) remplace DTA afin d’identifier, et non d’éliminer, les cellules P16
high
[
5
].
|
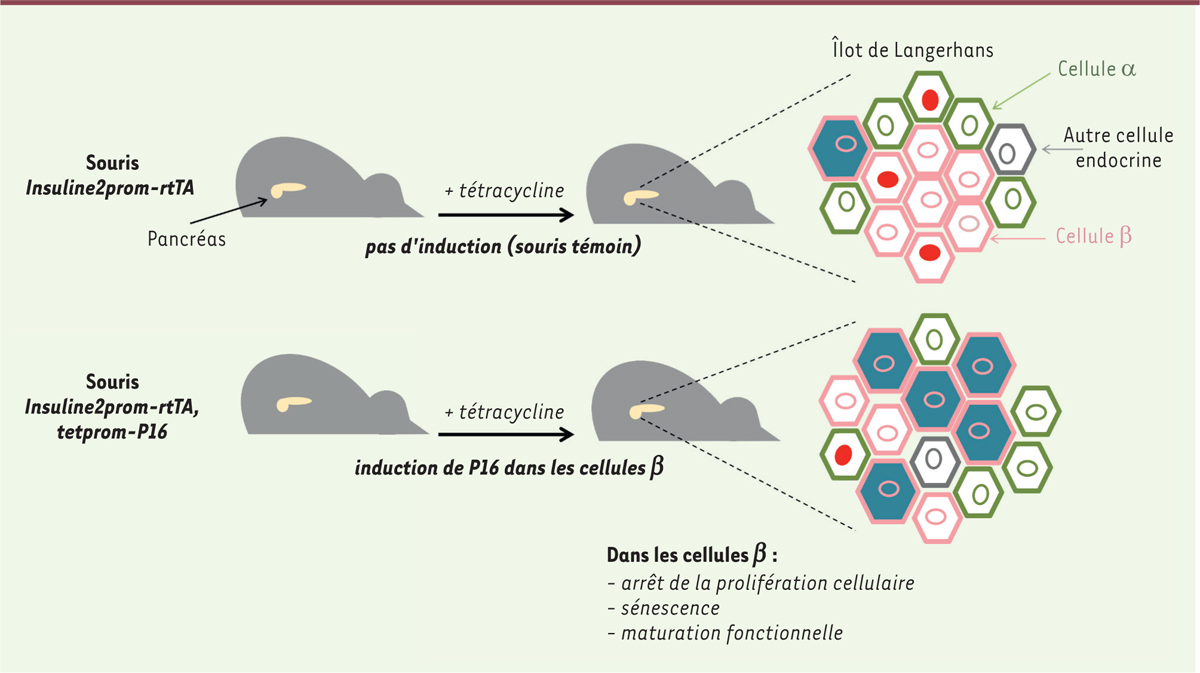
Le pancréas fournit aussi un exemple de corrélation positive entre accumulation de cellules sénescentes et fonctionnement d’un organe. Les cellules β du pancréas jouent un rôle essentiel dans le contrôle de la glycémie car elles sont les productrices exclusives de l’insuline, l’unique hormone hypoglycémiante. Afin d’étudier directement l’effet de la sénescence sur la fonction des cellules β du pancréas, une autre équipe de chercheurs y a induit sélectivement et temporairement (pendant dix jours) l’expression de P16, chez des souris âgées de trois à quatre semaines ( Figure 2 ). Comme escompté, cette induction arrête la prolifération des cellules β et déclenche leur sénescence, attestée par l’augmentation de l’expression de nombreux marqueurs, dont celle de SA-βGal et de l’ARNm Cdkn1a codant P21 [ 6 , 7 ]. Surtout, elle s’accompagne d’une amélioration fonctionnelle de ces cellules. En effet, leur taille, le nombre et l’activité de leurs mitochondries, leur absorption du glucose et leur contenu en insuline augmentent. Plus remarquable encore, l’induction de P16 augmente la sécrétion d’insuline par les cellules β en réponse à une concentration élevée de glucose ( glucose-stimulated insulin secretion , GSIS) sans augmenter la sécrétion basale de l’hormone, ce qui témoigne d’accroissement de leur maturité fonctionnelle [ 6 , 7 ]. Cet effet persiste après une induction durable de P16 (pendant 2 mois) [ 6 ]. En outre, la surexpression brève (15 jours) ou durable (2 mois) de P16 dans les cellules β améliore le contrôle de la glycémie d’un type de souris diabétiques 2, [ 6 ]. Réciproquement, le blocage de la fonction de P16 endogène perturbe la maturation fonctionnelle des cellules β murines in vivo et d’une lignée de cellules β humaines (EndoC-βH2) in vitro . Enfin, des cellules β sénescentes s’accumulent avec le temps chez la souris et chez l’homme et, au moins chez l’homme, ces cellules sont plus grandes et contiennent des mitochondries plus actives que les autres cellules β [ 6 , 7 ]. Chez les mammifères, la sénescence des cellules β peut donc être associée à leur maturation. Ce résultat corrobore des résultats plus anciens montrant une amélioration fonctionnelle des cellules β jusque tard (16 mois) dans la vie des souris [ 8 ], mais il reste cependant controversé. Par exemple, une autre étude rapporte que le profil transcriptomique des cellules β sénescentes (SA-bGal + ) de souris âgées de sept à huit mois est moins mature que celui des cellules β non sénescentes (SA-βGal - ), et que l’élimination des cellules β sénescentes, associées à l’âge ou à deux situations d’insulino-résistance, améliore le contrôle de la glycémie [ 9 ] 3, . Des stimulus différant par leur nature, leur intensité ou leur temporalité induisent probablement des sénescences distinctes, en particulier pour la composition du SASP ( senescence-associated secretory phenotype ) 4, , avec des conséquences fonctionnelles variables pour les cellules β du pancréas [ 9 , 10 ].
| Figure 2.
La surexpression de P16 induit la sénescence et accroît la maturité fonctionnelle des cellules
β
du pancréas.
Ce modèle d’étude requiert l’utilisation de deux transgènes. Le premier,
Insuline2prom-rtTA
, est constitué de l’ADNc codant le transactivateur transcriptionnel rtTA, activable par la tétracycline et placé sous le contrôle du promoteur du gène
insuline2
de rat (
Insuline2prom
) ; rtTA est donc produit exclusivement dans les cellules β du pancréas. Le second,
tetprom-P16
, est constitué de l’ADNc codant P16 (humain) sous le contrôle du promoteur tet (
tetprom
), reconnu et activé par rtTA uniquement en présence de tétracycline (système
Tet-on
). Chez les souris portant ces deux transgènes (en bas), P16 est donc exprimée exclusivement dans les cellules β et uniquement en présence de tétracycline. Les souris témoins (en haut) ne portent que le transgène
Insuline2prom-rtTA
. La tétracycline a été administrée à ces deux lignées de souris dans leur alimentation. Ce traitement induit P16 dans les cellules β (en rose) des souris doublement transgéniques (en bas), ce qui arrête leur prolifération (perte de Ki67, un marqueur de prolifération en rouge dans le noyau), augmente leur taille, accroît l’expression de nombreux marqueurs de sénescence, dont SA-βGal (cellules bleues), et amplifie certains traits caractéristiques de leur maturation fonctionnelle, en particulier la GSIS (
glucose-stimulated insulin secretion
). La proportion réelle de cellules β prolifératives (Ki67
+
) dans les conditions témoins est de 3,5 % (souris âgées de trois à quatre semaines). P16 (exogène) arrête la prolifération dans toutes les cellules β qui l’expriment, mais une petite proportion des cellules β demeurent prolifératives car l’expression de P16 n’est pas induite dans toutes les cellules b. Réciproquement, une petite proportion des cellules β sont sénescentes (SA-βGal
+
) chez les souris témoins. Les cellules α (en vert) et les cellules β (en rose) constituent la grande majorité (> 80 %) des cellules des îlots de Langerhans, mais d’autres types de cellules endocrines minoritaires existent, représentés ici par une cellule de couleur anthracite. Les résultats ont été obtenus après une induction de P16 pendant 10 jours chez des souris âgées de trois à quatre semaines, et corroborés par l’augmentation de la GSIS après une induction de P16 pendant 15 jours chez des souris âgées de cinq à six semaines. L’effet positif de P16 sur la GSIS se maintient après une induction de P16 pendant deux mois [
6
,
7
].
|
On considère généralement que la présence de cellules sénescentes peut être bénéfique lorsqu’elle est de courte durée, mais qu’elle devient néfaste si elle persiste [ 2 , 4 , 10 ]. Cette « règle » n’est pas toujours vérifiée : dans les deux situations présentées ici, une accumulation durable de cellules sénescentes maintient ou améliore le fonctionnement d’un organe 5, , et, dans les deux cas, les cellules sénescentes apparaissent plus « performantes » que les cellules non sénescentes du même type. La sénescence accompagne également la maturation ou la différenciation (terminale) 6, d’autres types cellulaires [ 3 , 4 , 11 , 12 ]. La concomitance de ces deux processus (sénescence d’une part, et différenciation/maturation d’autre part) dans quelques situations suggère qu’ils découlent parfois d’une même cause, ou bien qu’ils exercent un effet positif l’un sur l’autre. Ces deux hypothèses sont envisageables. En effet, des déclencheurs classiques de la sénescence cellulaire, par exemple des stress génotoxiques ou oxydants, ou un dysfonctionnement des télomères des chromosomes, peuvent induire la différenciation/maturation de certaines cellules [ 4 ]. De plus, dans les cellules β du pancréas, la triiodothyronine, hormone thyroïdienne, induit à la fois des marqueurs de sénescence et de maturation cellulaires [ 13 ]. Par ailleurs, l’effet de la surexpression de P16 dans les cellules β suggère que la sénescence favorise parfois la différenciation/maturation cellulaire [ 6 , 7 ]. Cela résulte vraisemblablement de l’existence de traits à la fois caractéristiques de la sénescence et importants pour la maturation des cellules β (et pour la différenciation/maturation d’autres cellules), tels que l’arrêt de la prolifération et l’augmentation de la taille des cellules et de la masse mitochondriale [ 1 – 4 , 6 , 7 , 14 ]. L’état sénescent pourrait en outre favoriser la mise en place ou la survie de certaines cellules différenciées/matures en augmentant leur résistance à l’apoptose [ 4 ]. Récipoquement, la différenciation/maturation peut promouvoir la sénescence en amplifiant certains stress, notamment le stress oxydant. Ainsi, pour les LSEC, l’augmentation de l’expression de récepteurs spécialisés dans l’endocytose accroît l’absorption des LDL-ox circulant dans le sang, ce qui promeut la sénescence de ces cellules [ 5 ]. En outre, il est possible que la différenciation/maturation accroisse également l’exposition des cellules à un stress oxydant d’origine interne. Par exemple, la respiration mitochondriale, une source majeure d’espèces réactives de l’oxygène dans la cellule [ 14 ], s’intensifie avec la maturation des cellules β (et avec la différenciation/maturation d’autres cellules) [ 6 , 7 ]. Ainsi, la connexion entre sénescence et maturation dans les cellules β du pancréas (entre autres) pourrait résulter de multiples mécanismes et dépendre notamment du niveau d’activité de protéines contrôlant la prolifération et la taille des cellules ou la quantité et la qualité de leurs mitochondries. Cette dernière hypothèse est en accord avec l’implication de RB ( Retinoblastoma ), un relais habituel de P16, de mTOR ( mammalian target of rapamycin ) et, probablement, de PGC-1α ( peroxisome proliferative-activated receptor γ coactivator 1 α), dans la maturation associée à la sénescence des cellules β humaines de la lignée EndoC-βH2 [ 6 , 7 , 15 ]. Plus généralement, en dehors des quelques cas évoqués ici, le rapport entre sénescence et différenciation/maturation reste encore à préciser [ 4 ].