Les cellules germinales mâles (spermatozoïdes) et femelles (ovocytes) se divisent par méiose, une étape-clé de la reproduction sexuée. Cette division spécialisée assure la formation de gamètes haploïdes, aptes à la fécondation et au développement embryonnaire, qui donneront naissance à un nouvel embryon après leur fusion. La méiose consiste en deux divisions successives sans nouvelle synthèse intermédiaire d’ADN, la méiose I puis la méiose II, au cours desquelles sont ségrégés les chromosomes homologues, puis les chromatides sœurs. Chez la femelle, la méiose s’arrête naturellement à deux étapes de sa progression. Dans les ovaires, l’ovocyte se bloque en prophase de méiose I pour accumuler les organites et nutriments nécessaires au développement. La méiose reprend au moment de l’ovulation et l’ovocyte se bloque en métaphase de la méiose II, chez les vertébrés, pour attendre la fécondation. Les erreurs de progression méiotique, comme un arrêt inopiné en métaphase I ou une absence d’arrêt en métaphase II, sont une cause d’infertilité chez la femme. Elles produisent des ovocytes non fécondables ou des embryons aneuploïdes, contenant un jeu supplémentaire de chromosomes ou sans génome paternel après parthénogenèse 1 . Il importe donc de déterminer comment l’ovocyte différencie deux divisions fonctionnellement distinctes et s’arrête au bon moment de la méiose, pour tenter de comprendre ces dysfonctionnements et proposer des solutions thérapeutiques. La progression en méiose est pilotée par les complexes Cdk1 ( cyclin-dependent kinase 1 )-cyclines. Une étude récente apportent un nouvel éclairage sur les mécanismes d’arrêt et de spécialisation ovocytaires, en élucidant le mode d’action de la cycline B3 pour empêcher la fécondation avant la métaphase II chez les vertébrés.
La division cellulaire est orchestrée par le turn-over des protéines et leur phosphorylation, catalysée principalement par la kinase Cdk1 associée aux cyclines, les complexes Cdk1-cyclines. Les vertébrés expriment deux cyclines A (A1, A2) et trois cyclines B (B1, B2, B3) [ 1 ]. Leur turn-over différentiel produit différentes activités Cdk1, responsables de la phosphorylation temporelle et ordonnée des substrats nécessaires pour la division. Les cyclines B1 et B2 sont considérées comme les cyclines majeures de la méiose ovocytaire dans toutes les espèces ( Figure 1 ) . Leur invalidation individuelle chez la souris a permis de préciser leurs fonctions partiellement redondantes [ 1 ]. Les ovocytes dépourvus de cycline B1 ne progressent pas en méiose II et entrent dans un état interphasique, alors que ceux dépourvus de la cycline B2 orchestrent la méiose I avec une activité Cdk1 réduite, ce qui entraîne des défauts du fuseau méiotique et un retard d’entrée en anaphase de méiose I [ 1 ]. La surexpression artificielle de la cycline B1 dans les ovocytes invalidés pour la cycline B2 ou de la cycline B2 dans ceux invalidés pour la cycline B1 rétablit la progression méiotique jusqu’en métaphase II : les complexes Cdk1-cyclines B1/B2 semblent donc phosphoryler des substrats communs pour piloter la méiose. Comme dans la mitose, le turn-over des cyclines B1 et B2 orchestre la division ovocytaire en contrôlant les seuils d’activité de Cdk1 requis pour la succession des deux divisions et l’arrêt en métaphase II ( Figure 1 ) . Ces cyclines participent à l’activation de Cdk1 pour organiser la prométaphase I [ 1 ]. En métaphase I, elles sont dégradées après leur ubiquitination par l’ubiquitine ligase APC ( anaphase-promoting complex ) pour inactiver Cdk1 et déclencher l’anaphase de méiose I. Une fois les chromosomes homologues ségrégés, l’expulsion du premier globule polaire marque la fin de la méiose I [ 1 ]. Les cyclines B1 et B2 sont alors de nouveau accumulées grâce à leur traduction et à l’inhibition progressive de l’APC, afin de réactiver Cdk1 pour l’entrée en méiose II sans interphase intercalaire [ 1 ]. Pendant l’arrêt en métaphase II, l’inhibition dynamique de l’APC stabilise les cyclines, ce qui maintient l’activité de Cdk1 jusqu’à la fécondation [ 1 ].
| Figure 1.
Méiose femelle et complexes Cdk1-cyclines B1/B2 chez les vertébrés. A.
Représentation schématique de la méiose femelle. Les ovocytes sont bloqués en prophase de méiose I et reprennent la division au moment de l’ovulation. Ils rompent l’enveloppe nucléaire (
germinal vesicle breakdown
, GVBD), progressent en métaphase de méiose I, puis sortent de la méiose I. La méiose II s’enchaîne alors rapidement. Chez les vertébrés, ils s’arrêtent une nouvelle fois en métaphase II pour attendre la fécondation. Ce n’est qu’avec la fécondation que l’ovocyte achève la méiose II.
B.
Contrôle de la ploïdie ovocytaire. La méiose I et la méiose II s’enchaînent sans duplication de l’ADN (phase S). Les chromosomes homologues se séparent au cours de la transition métaphase-anaphase de la méiose I. Ces deux processus réduisent de moitié le nombre de chromosomes dans l’ovocyte, assurant son passage d’un état diploïde à un état haploïde. La fécondation provoque la sortie de la méiose II, au cours de laquelle sont ségrégées les chromatides-sœurs.
C.
Contrôle de la méiose femelle par les complexes Cdk1-cyclines B1/B2. Cdk1 est la kinase majeure de la méiose femelle. Elle est activée en deux vagues pour orchestrer la méiose I puis la méiose II. Pour être active, Cdk1 est complexée aux cyclines B1 et B2, qui sont considérées comme les principales cyclines de la division ovocytaire et présentent des fonctions partiellement redondantes en phosphorylant des substrats communs. En prophase, les complexes Cdk1-cyclines B1/B2 sont inhibés par phosphorylation. Lors de la reprise de la méiose, ils sont déphosphorylés, puis activés pour organiser la métaphase I. Entre la méiose I et la méiose II, la dégradation des cyclines B1 et B2 inactive transitoirement Cdk1 pour sortir de la méiose I. Ces cyclines sont ensuite réaccumulées pour réactiver Cdk1 et organiser la progression en méiose II. Les cyclines B1 et B2 sont ensuite stabilisées et maintiennent une activité Cdk1 stable et forte, nécessaire à l’arrêt en métaphase II. Avec la fécondation, Cdk1 est inactivée par la dégradation des cyclines B1 et B2, afin que l’ovocyte achève la méiose II.
|
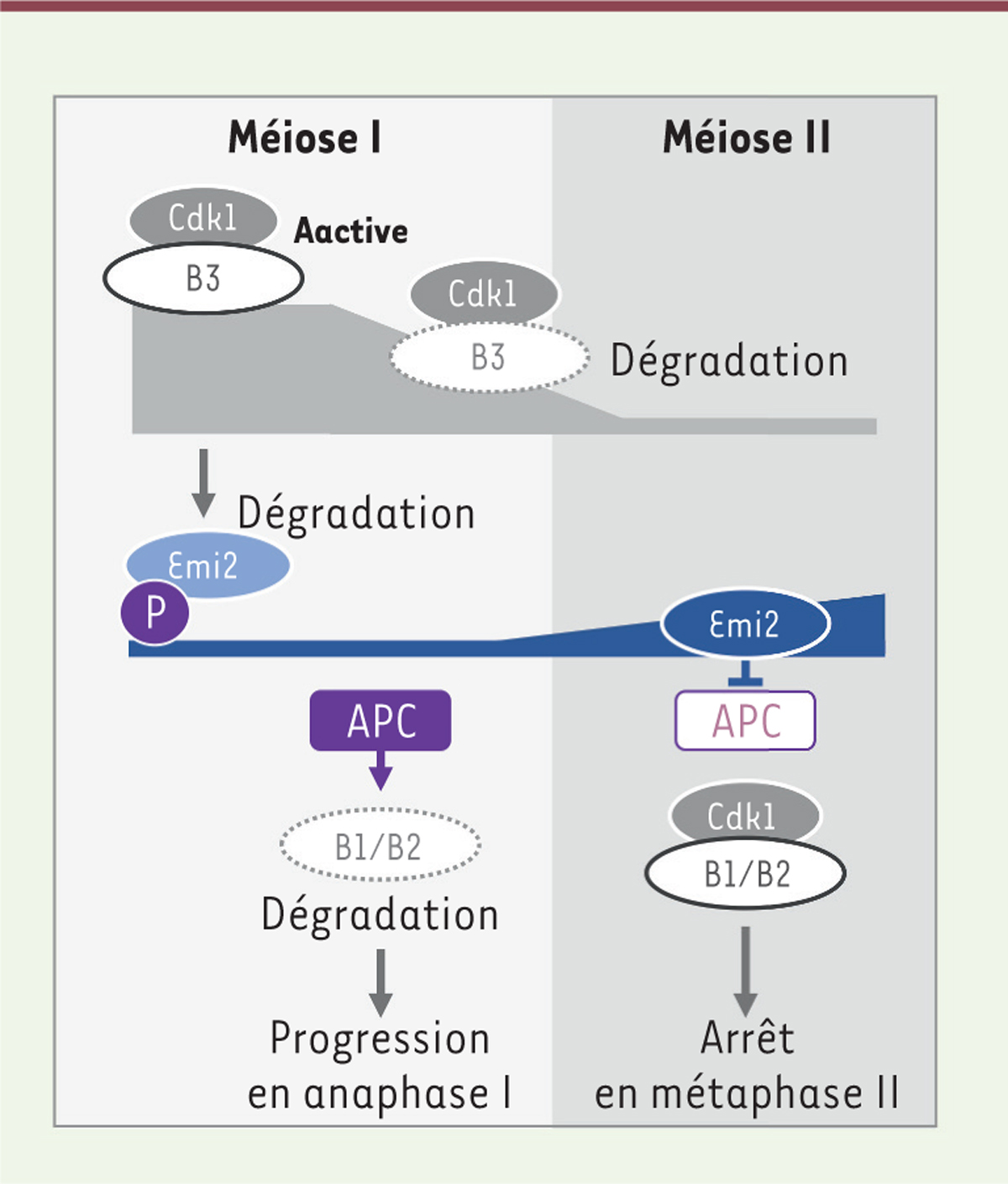
La cycline B3 est la cycline B ovocytaire « oubliée » chez les vertébrés, car elle a été considérée, à tort, comme absente des ovocytes de xénope [ 1 ]. Conservée chez les métazoaires, son expression varie selon le type cellulaire et l’espèce, et semble restreinte aux gamètes femelles chez les vertébrés [ 1 ]. L’étude de souris mutantes invalidées pour cette cycline (souris Ccnb3 -/- ) a récemment permis d’établir son rôle primordial pendant la méiose femelle ( Figure 2 ) . Ces souris sont viables et les mâles sont fertiles : cette cycline n’est donc essentielle ni à la mitose, ni à la méiose mâle [ 2 , 3 ]. Les femelles sont en revanche stériles en raison d’un arrêt prématuré des ovocytes en métaphase I, un phénotype associé à la stabilisation des substrats de l’APC, dont les cyclines B1 et B2 [ 2 , 4 ]. L’expression d’une cycline B3 capable d’activer Cdk1 lève cet arrêt ovocytaire, à l’inverse de celle de la cycline B1, qui est sans effet [ 2 ]. Ces résultats montrent que le complexe Cdk1-cycline B3 phosphoryle des substrats distincts de ceux phosphorylés par Cdk1-cycline B1/B2, et que cette spécificité fonctionnelle déclenche la sortie de méiose I.
| Figure 2.
L’expression de la cycline B3 en méiose I conditionne l’arrêt de l’ovocyte en métaphase II en attendant la fécondation.
La sortie de la méiose I est déclenchée par la dégradation protéolytique, sous le contrôle de l’ubiquitine ligase APC (
anaphase-promoting complex
), ciblant notamment les cyclines B1/B2. L’APC est ensuite progressivement inhibée grâce à l’accumulation de la protéine Emi2, son inhibiteur spécifique des ovocytes chez les vertébrés. Ce mécanisme permet la ré-accumulation des cyclines B1 et B2, puis leur stabilisation pour l’arrêt en métaphase II. La cycline B3 est présente tout au long de la méiose I, puis dégradée durant l’anaphase de la méiose I. En métaphase I, elle s’oppose à la mise en place d’un arrêt prématuré de la méiose en phosphorylant Emi2. Ce processus provoque la dégradation d’Emi2 et permet d’activer l’APC pour sortir de la méiose I. En méiose II, la cycline B3 ne s’accumule pas, contrairement aux cyclines B1 et B2. Sa dégradation permet l’accumulation d’Emi2 puis l’arrêt de l’ovocyte en métaphase II pour éviter une activation parthénogénétique des ovocytes conduisant à la formation d’embryons triploïdes. Le contrôle de la stabilité de la cycline B3 garantit ainsi que l’ovocyte ne soit fécondé qu’après avoir réduit sa ploïdie cellulaire.
|
De plus, la cycline B3 a un profil d’expression méiotique original ( Figure 2 ) . Elle est présente tout au long de la méiose I, puis dégradée après l’anaphase de méiose I par un mécanisme impliquant le motif d’ubiquitination par l’APC ( D-box ), commun aux cyclines B [ 2 , 5 ]. En revanche, elle ne s’accumule pas en méiose II [ 6 ]. Lorsqu’elle est exprimée artificiellement à contretemps dans les ovocytes de souris bloqués en métaphase II, la cycline B3 déclenche l’anaphase de méiose II sans fécondation [ 5 , 6 ]. La dérégulation de la cycline B3 a donc des effets biologiques divergents de ceux décrits pour les cyclines B1/B2, dont la surexpression bloque l’ovocyte en métaphase I et dont l’invalidation inhibe la progression en méiose II [ 1 ]. L’activité Cdk1-cycline B3 s’opposerait ainsi à celle de Cdk1-cyclines B1/B2 pour l’entrée en anaphase de méiose I, et aussi en anaphase de méiose II en cas d’expression artificielle à ce stade. La présence ou non de la cycline B3 déterminerait ainsi le stade méiotique d’attente de la fécondation chez les vertébrés.
Comment le complexe Cdk1-cycline B3 déclenche-t-il l’anaphase de méiose I ? Sachant que l’expression inappropriée de la cycline B3 en méiose II lève l’arrêt physiologique de la méiose précédant la fécondation, il restait à découvrir les cibles de ce complexe moléculaire. Par des approches in vitro et in vivo de surexpression et d’invalidation de la cycline B3 dans deux modèles méiotiques complémentaires chez la souris et le xénope, le substrat Emi2 vient d’être identifié [ 7 ]. Cette protéine, spécifique des vertébrés, inhibe l’APC par liaison directe. Elle est traduite en métaphase I, puis s’accumule entre les deux divisions cellulaires pour implémenter l’arrêt en métaphase II [ 7 ]. En métaphase I, son expression est restreinte pour ne pas bloquer l’activation de l’APC, requise pour achever la méiose I. En revanche, elle doit être présente en méiose II pour inhiber l’APC, permettant ainsi l’accumulation puis la stabilisation des cyclines B1 et B2 durant l’arrêt en métaphase II [ 7 ]. Emi2 est une protéine dont le turn-over et notamment la stabilité sont étroitement contrôlés par sa phosphorylation au cours de la méiose. En particulier, la voie kinasique Mos/MAPK, spécifique des ovocytes et active depuis la métaphase I jusqu’à la fécondation, stabilise Emi2 et stimule son activité inhibitrice de l’APC. En méiose II, elle s’opposerait aux effets déstabilisateurs du complexe Cdk1-cycline B1/B2 pour maintenir l’arrêt en métaphase II [ 7 ]. C’est la fécondation qui inactive le réseau moléculaire Mos/MAPK-Emi2-APC. Emi2 est dégradée par l’ubiquitine ligase SCF ( Skp-cullin-F-box complex ), ce qui lève l’inhibition de l’APC et entraîne la dégradation des cyclines B1/B2 et l’inactivation de Cdk1 [ 7 ]. L’ovocyte fécondé sépare alors les chromatides-sœurs et achève la méiose II en expulsant le second globule polaire.
L’arrêt de la méiose en métaphase II repose sur de multiples phosphorylations ciblant la stabilité et l’activité de Emi2, mais on ignorait jusqu’à récemment le mécanisme limitant son expression en métaphase I. Ce mécanisme vient d’être élucidé. In vitro , le complexe Cdk1-cycline B3 phosphoryle Emi2 sur un site très conservé entre espèces mais non ciblé par le complexe Cdk1-cycline B1, ce qui provoque sa dégradation [ 6 ]. La phosphorylation de ce site unique a des conséquences fonctionnelles majeures sur la progression méiotique in vivo . Les ovocytes des souris Ccnb3 -/- accumulent précocement Emi2 en métaphase I, ce qui inhibe l’APC et empêche la sortie de la méiose I [ 6 ]. De plus, l’expression d’un fragment d’Emi2, phosphorylable mais incapable d’inhiber l’APC, dans les ovocytes des souris témoins provoque un arrêt de la méiose en métaphase I. Ce fragment empêche la phosphorylation d’Emi2 endogène par le complexe Cdk1-cycline B3, et donc sa dégradation [ 6 ]. Étonnamment, les ovocytes Ccnb3 -/- peuvent néanmoins achever la méiose I si les mécanismes moléculaires d’arrêt en métaphase II, notamment la voie Mos/MAPK, sont inactivés [ 6 ]. L’ovocyte, encore diploïde, a donc le potentiel de s’arrêter en métaphase I en empruntant les voies de signalisation impliquées dans l’arrêt en métaphase II et peut se diviser si la fécondation survient à ce stade. Ces voies sont cependant inopérantes car l’activité de Cdk1-cycline B3 déstabilise Emi2 et entraîne la sortie de la méiose I. La dégradation de la cycline B3 et par conséquent l’inactivation du complexe Cdk1-cycline B3 permettent ensuite l’arrêt de la méiose en métaphase II, ce qui garantit que l’ovocyte ne soit fécondé qu’après avoir réduit sa ploïdie cellulaire.
Ces résultats fournissent ainsi une explication moléculaire au « choix » du stade d’arrêt de la méiose femelle précédant la fécondation chez les vertébrés. Des mutations du gène codant la cycline B3 chez la femme ont été associées à un arrêt prématuré des ovocytes en métaphase I conduisant à la formation d’embryons triploïdes et à des fausses couches récurrentes [ 8 – 10 ]. Ces résultats ouvrent des perspectives nouvelles pour notre compréhension de l’orchestration de la méiose femelle des vertébrés et pour celle d’anomalies ovocytaires qui pourraient résulter de la mutation du gène codant la cycline B3.