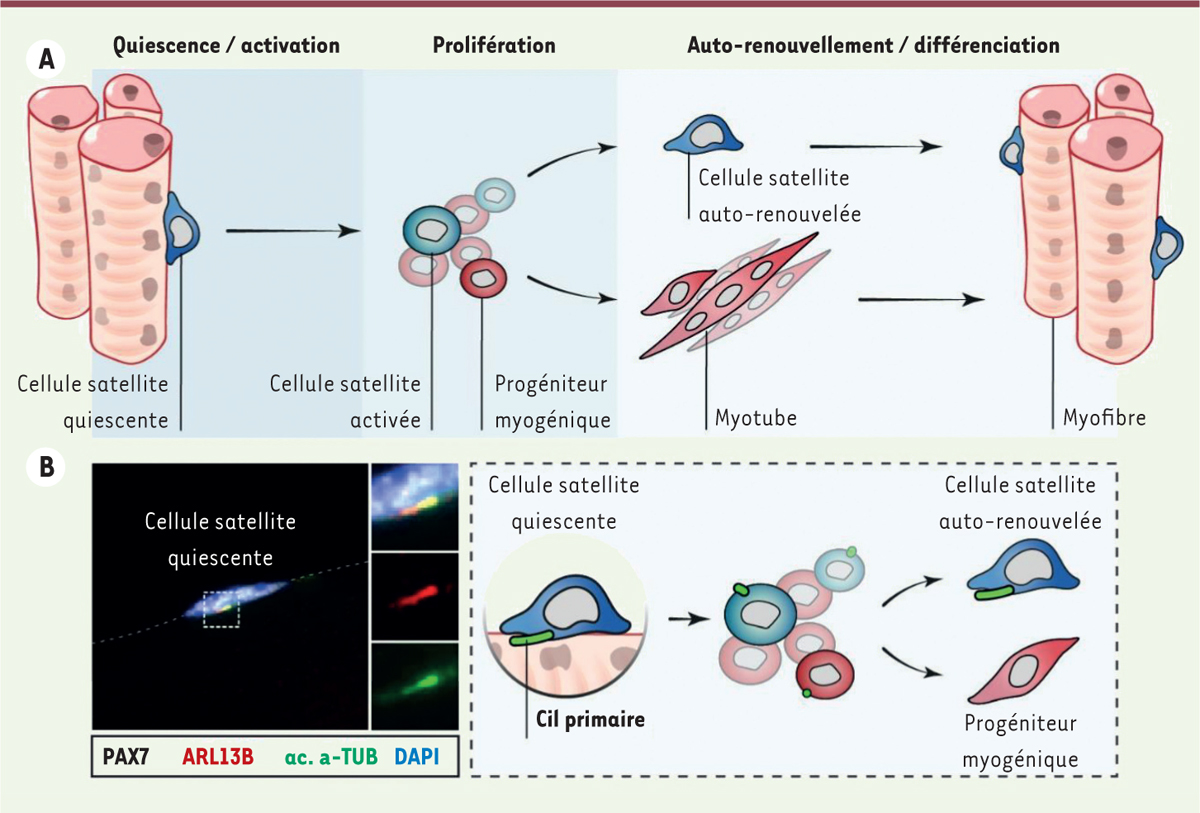
Les cellules satellites sont les cellules souches musculaires matures qui permettent la régénération du muscle squelettique après une lésion tissulaire [ 1 ]. Alors que les cellules satellites du muscle sain sont dans un état de dormance réversible ou quiescence, une blessure musculaire conduit à leur activation, c’est-à-dire à leur entrée dans le cycle cellulaire. Une fois activées, les cellules satellites prolifèrent rapidement. La grande majorité de ces cellules se différencient en progéniteurs myogéniques, ou myoblastes, qui fusionneront ensuite pour reformer des fibres musculaires. En parallèle, une petite proportion des cellules satellites activées s’auto-renouvellent et redeviennent quiescentes, ce qui maintient le stock des cellules souches ( Figure 1A ) . Lorsque les propriétés de quiescence, de prolifération, d’auto-renouvellement ou de différenciation des cellules satellites sont compromises, la régénération musculaire est altérée.
| Figure 1.
Dynamique du cil primaire dans la cellule souche musculaire. A.
La cellule souche musculaire, ou cellule satellite, est quiescente dans le muscle sain. En réponse à une blessure musculaire, elle s’active et prolifère pour générer un grand nombre de cellules progénitrices musculaires, qui se différencient et fusionnent entre elles pour former des myotubes, dont la maturation aboutit aux myofibres. En parallèle, une petite proportion de cellules satellites activées sortent du cycle cellulaire et retournent dans un état de quiescence, permettant ainsi l’auto-renouvellement du réservoir de cellules souches.
B.
Un immunomarquage de la protéine ciliaire ARL13B et de l’α-tubuline acétylée (ac. α-TUB) permet de détecter le cil primaire de la cellule satellite (marquée par l’expression du facteur de transcription PAX7). Ce marquage a permis de montrer que les cellules satellites quiescentes possèdent un cil primaire, qui est résorbé au moment de leur activation, et qui se reforme dans les cellules satellites, permettant leur auto-renouvellement. Coloration du noyau cellulaire par le DAPI.
|
Il existe deux phases de quiescence, appelées G 0 et G Alert , qui se distinguent par l’activation du complexe protéique mTORC1 ( mechanistic target of rapamycin complex 1 ) [ 2 ]. Les cellules satellites en phase G Alert ont une taille supérieure à celle des cellules en phase G 0 , ainsi qu’une légère augmentation de leur masse mitochondriale et de la synthèse d’ARN. Ces caractéristiques leur confèrent une meilleure capacité d’activation et permettent d’accélérer la régénération d’un muscle endommagé. Les cellules satellites quiescentes en phase G Alert sont observées à distance d’une lésion tissulaire à la suite de la libération de facteurs circulants par cette dernière. À ce jour, seuls quelques facteurs tels que HGFA ( hepatocyte growth factor activator ) [ 3 ] ou HMGB1 ( high mobility group box protein 1 ) [ 4 ], et certains polluants tels que la TCDD (2,3,7,8-tétrachlorodibenzo-p-dioxine) [ 5 ] ont démontré leur capacité à promouvoir la transition des cellules satellites vers l’état G Alert .
Les cellules satellites quiescentes possèdent un cil primaire, dont la présence est contrôlée de façon dynamique : après une lésion musculaire, le cil primaire est résorbé lors de l’activation de la cellule satellite, et il se reforme dans les cellules satellites vouées à l’auto-renouvellement ( Figure 1B ) [ 6 ]. La formation et la résorption du cil primaire, qui est présent à la surface de la plupart des cellules des vertébrés en phase G 0 , sont synchronisées avec le cycle cellulaire [ 7 ] ( → ).
(→) Voir la Synthèse de N. Delgehyr et N. Spassky, m/s n° 11, novembre 2014, page 976
Ce cil agit comme une antenne cellulaire permettant la transmission de signaux activant de nombreuses voies de signalisation contrôlant le destin cellulaire. En particulier, le cil primaire est le site privilégié de la transduction de la voie de signalisation impliquant Hedgehog (Hh), puisqu’il contrôle notamment l’activité transcriptionnelle du facteur GLI3 [ 8 ]. En effet, en l’absence de signal Hh extrinsèque, la protéine GLI3 subit des modifications post-traductionnelles dans le cil primaire, ce qui la transforme en un répresseur transcriptionnel de la voie Hh. Lorsque le cil primaire n’est plus présent, les modifications post-traductionnelles de GLI3 ne se produisent plus, et l’expression de la forme répressive de cette protéine diminue fortement.
Nous avons découvert que la régulation du facteur de transcription GLI3 par le cil primaire joue un rôle majeur dans le contrôle de la quiescence et de la prolifération des cellules souches musculaires [ 9 ]. Nous avons d’abord montré que la forme répressive de GLI3 (GLI3R) est abondante dans les cellules satellites quiescentes, qui possèdent un cil primaire, tandis que les progéniteurs myogéniques en train de proliférer, qui n’en possèdent que rarement, ne contiennent que de faibles quantités de GLI3R. Quant aux myofibres (cellules musculaires différenciées et fusionnées), elles ne contiennent pas de GLI3R. Nous avons alors fait l’hypothèse que GLI3R, dont la présence dépend de celle du cil primaire, pourrait contrôler la quiescence des cellules satellites.
Pour valider cette hypothèse, nous avons produit des souris mutantes chez lesquelles le gène Gli3 est inactivé spécifiquement dans les cellules satellites par une injection de tamoxifène. En absence de lésion musculaire et donc de facteurs extrinsèques, cette inactivation ciblée du gène Gli3 conduit à la transition des cellules satellites quiescentes de la phase G 0 vers la phase G Alert : les cellules satellites de ces souris sont de plus grande taille, synthétisent plus d’ARN et ont une masse mitochondriale plus grande que celles des cellules satellites de souris témoins. Cependant, elles demeurent quiescentes et conservent leur cil primaire. Enfin, en cas de lésion tissulaire, les cellules satellites mutées ( Gli3 Δ / Δ) entrent dans le cycle cellulaire plus rapidement que les cellules en phase G 0 . Bien que GLI3R soit faiblement exprimé dans les progéniteurs myogéniques, l’inactivation ciblée du gène Gli3 suffit à augmenter leur capacité de proliférer. Ainsi, la régénération du muscle squelettique induite par l’injection d’un agent myonécrotique, la cardiotoxine, est nettement améliorée chez les souris mutantes par rapport aux souris témoins : les cellules satellites Gli3 Δ / Δ s’activent plus rapidement et prolifèrent davantage, ce qui aboutit à la régénération d’un muscle squelettique dont le calibre des myofibres et le stock de cellules souches sont augmentés.
Nous avons ensuite analysé le transcriptome des cellules satellites Gli3 Δ / Δ quiescentes et activées, et avons montré que les gènes surexprimés en l’absence de GLI3 sont principalement associés à la réponse cellulaire au glucose, à la signalisation par l’insuline et à la phosphorylation oxydante, tous ces processus étant liés à l’activité du complexe protéique mTORC1, dont l’implication dans la transition des cellules satellites quiescentes vers l’état G Alert et dans la prolifération des cellules satellites activées était déjà connue [ 2 , 10 ]. En accord avec les résultats de cette analyse transcriptomique, les cellules satellites Gli3 Δ / Δ présentent une forte augmentation du taux de phosphorylation de la protéine ribosomique S6, qui reflète l’activité du complexe mTORC1. Ainsi, nous avons suggéré que, dans la cellule satellite quiescente, l’activation du répresseur transcriptionnel GLI3 par le cil primaire prévient l’activation de la voie mTORC1 et maintient la cellule en phase G 0 .
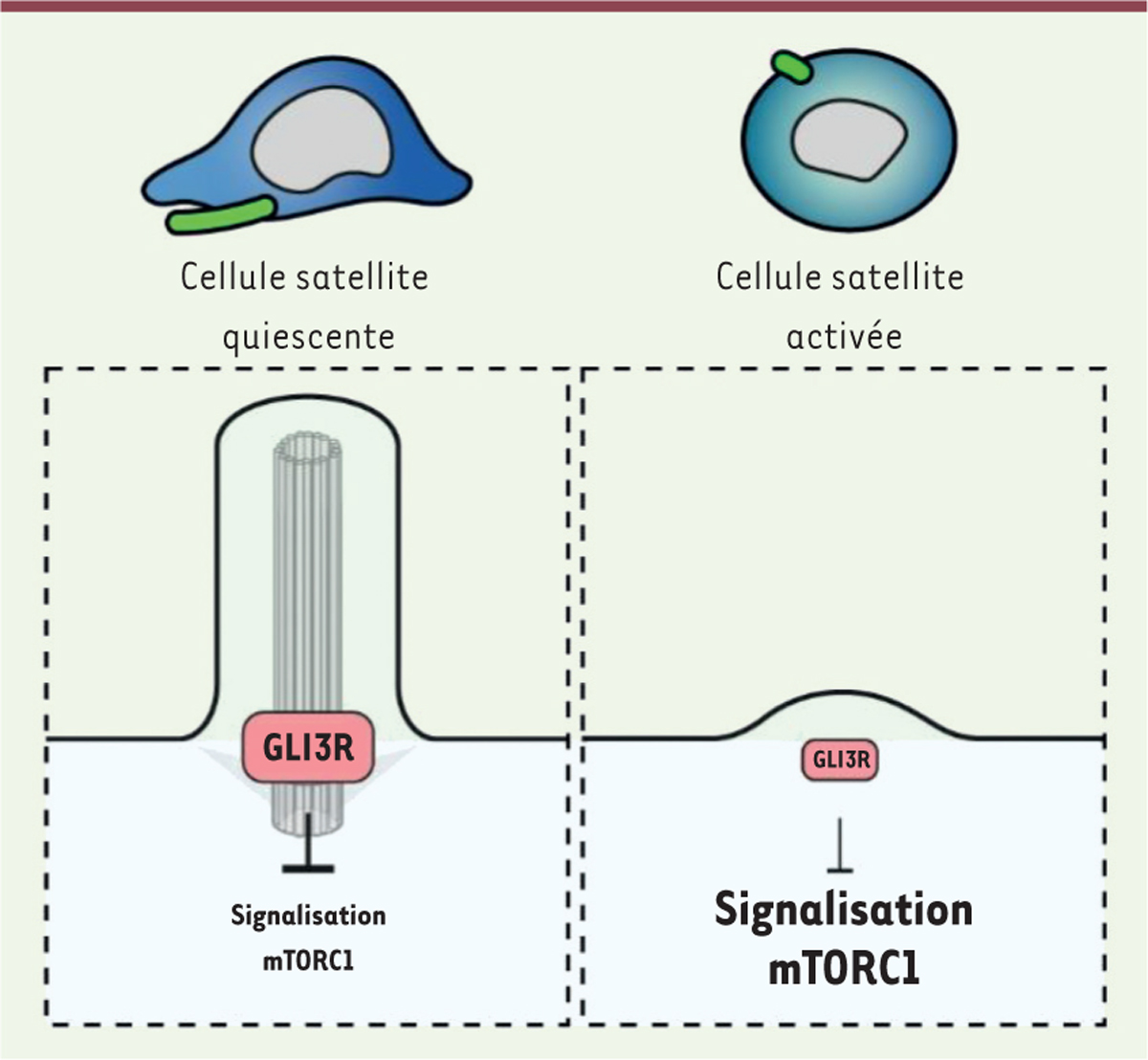
Pour tenter de valider cette hypothèse, nous avons traité les cellules satellites Gli3 Δ / Δ avec la rapamycine, un puissant inhibiteur de la voie mTORC1, et avons montré que ce traitement « réverse » le phénotype de type G Alert des cellules Gli3 Δ / Δ : la quantité d’ARN et la masse mitochondriale reviennent au niveau basal observé dans des cellules témoins en phase G 0 . Le traitement des cellules satellites Gli3 Δ / Δ par la rapamycine prévient l’entrée précoce dans la phase G 1 du cycle cellulaire et diminue leur capacité de proliférer. Ce résultat montre que la signalisation mTORC1 est liée au contrôle de l’activité du facteur GLI3R par le cil primaire et est nécessaire au maintien de la quiescence et à la prévention de la prolifération excessive des cellules souches musculaires ( Figure 2 ) .
| Figure 2.
GLI3 contrôle la signalisation mTORC1 dans les cellules satellites.
Dans la cellule satellite quiescente, différentes enzymes contenues dans le cil primaire permettent la modification post-traductionnelle de GLI3 et sa transformation en répresseur transcriptionnel (GLI3R). GLI3R inhibe la signalisation mTORC1, ce qui permet de maintenir la cellule dans un état quiescent. Au moment de l’activation de la cellule satellite, la résorption du cil primaire empêche la modification post-traductionnelle de GLI3, ce qui réduit considérablement l’expression de GLI3R. La signalisation mTORC1 est alors activée, et la cellule satellite sort de sa quiescence et prolifère.
|
L’ensemble de ces résultats indiquent que l’activité répressive de GLI3 dépendante de la présence du cil primaire contrôle la transition entre les phases de quiescence G 0 et G Alert des cellules satellites [ 9 ]. Puisque l’état G Alert a aussi été observé dans d’autres types de cellules souches matures [ 2 ], Gli3 pourrait contrôler également les phases de quiescence de ces cellules. Enfin, la capacité accrue des cellules satellites dépourvues de GLI3 à réparer le muscle squelettique fait de ce répresseur transcriptionnel une cible de choix pour le développement de stratégies thérapeutiques ciblant les cellules souches musculaires en médecine régénérative.