| |
| Med Sci (Paris). 39(4): 335–343. doi: 10.1051/medsci/2023008.Antagonistes du récepteur minéralocorticoïde Une nouvelle option thérapeutique dans la maladie rénale diabétique Sophie Girerd,1,2,3 Matthieu Soulie,4 Jonatan Barrera-Chimal,5 and Frédéric Jaisser2,3,4* 1Département de néphrologie, CHRU de Nancy
,
Nancy
,
France 2Centre d’investigation clinique-plurithématique (CIC-P) 1433, F-CRIN INI-CRCT - Essais cliniques cardiovasculaires et rénaux, CHRU de Nancy
,
Nancy
,
France 3Inserm U1116, université de Lorraine
,
France 4Inserm, UMRS 1138, centre de recherche des Cordeliers, Sorbonne Université, université Paris Cité
,
Paris
,
France 5Centre de recherche de l’hôpital Maisonneuve-Rosemont, faculté de médecine, Centre affilié à l’université de Montréal, Montréal
,
Québec
,
Canada |
Vignette (© iStock).
Le nombre de patients présentant un diabète est en augmentation constante sur les dernières décennies, et pourrait toucher plus de 700 millions de personnes dans le monde d’ici 20 ans. En France, comme dans les autres pays industrialisés, c’est actuellement une personne sur 10 qui en est atteinte [
1
]. Les patients diabétiques développent des complications chroniques qui affectent plusieurs organes et contribuent aux comorbidités diabétiques [
2
]. La maladie rénale diabétique est l’une des complications les plus courantes, affectant environ 40 % de ces patients [
3
].
La maladie rénale diabétique se développe généralement après une durée de diabète mal équilibré de dix ans, mais cette maladie peut être présente au moment du diagnostic chez les patients atteints d’un diabète de type 2 (DT2) [
3
]. Les facteurs de risque de la maladie rénale diabétique sont peu spécifiques : à l’hyperglycémie s’ajoutent, la plupart du temps, d’autres facteurs de risque cardiovasculaire (tabac, hypertension artérielle, dyslipidémie), une histoire familiale de diabète avec néphropathie, une influence ethnique (les sujets noirs, hispaniques ou asiatiques sont plus à risque).
La maladie rénale chronique est définie par des anomalies de la structure ou de la fonction rénale présentes depuis plus de trois mois et requiert l’un des deux critères suivants : un débit de filtration glomérulaire estimé (DFGe) inférieur à 60 ml/min/1,73 m
2
, ou une albuminurie persistante [
3
]. Le terme maladie rénale diabétique désigne la maladie rénale chronique qui est causée par un diabète. Cependant son diagnostic peut être difficile car les patients diabétiques peuvent présenter des symptômes cliniques et biologiques très hétérogènes : ainsi, 15 à 20 % des patients ne présentent, par exemple, pas d’albuminurie [
4
]. La maladie rénale diabétique peut conduire à une insuffisance rénale terminale qui nécessite une épuration extrarénale par dialyse ou une transplantation. Dans les pays industrialisés, cette maladie est la cause la plus fréquente de démarrage d’un traitement de suppléance de la fonction rénale (en Europe, plus de 20 % des patients dialysés sont diabétiques, aux États-Unis, ils sont plus de 30 %, et plus de 40 % en Asie). Diabète et maladie rénale diabétique sont également fortement associés aux maladies cardiovasculaires et à leurs complications [
2
,
5
].
Le traitement de l’hypertension artérielle, en particulier le blocage du système rénine-angiotensine, est la pierre angulaire du traitement de la maladie rénale diabétique. Cependant, malgré un contrôle tensionnel par les inhibiteurs de l’enzyme de conversion de l’angiotensine (IECA) et les bloqueurs des récepteurs de l’angiotensine (ARA), et un contrôle glycémique optimisé, un risque résiduel important de progression vers l’insuffisance rénale terminale persiste, de même que le risque de développement de maladies cardiovasculaires associées.
Des progrès dans la compréhension de la physiopathologie de la maladie rénale diabétique et l’identification de nouvelles cibles, au-delà du système rénine-angiotensine, ont ouvert de nouvelles possibilités de traitement. Les inhibiteurs du cotransporteur sodium-glucose de type 2 (SGLT-2) ont émergé comme une nouvelle classe thérapeutique, pouvant à la fois ralentir la progression de la maladie rénale diabétique et réduire les événements cardiovasculaires chez les patients présentant un DT2 [
6
]. Au cours des deux dernières décennies, les effets délétères de l’aldostérone dans la physiopathologie des maladies cardiorénales ont été mis en évidence, et le blocage du récepteur minéralocorticoïde (RM) par des antagonistes (ARM) s’est révélé être une nouvelle approche thérapeutique dans la MRD [
7
–
9
]. Deux études cliniques majeures récemment publiées ont démontré pour la première fois le bénéfice apporté par la finerénone, un nouvel ARM non stéroïdien ayant un index thérapeutique favorable, pour le traitement de patients présentant une maladie rénale diabétique. Nous discuterons dans cette synthèse les avantages potentiels de cette nouvelle approche thérapeutique de la maladie rénale diabétique ainsi que le positionnement de ce traitement par rapport aux inhibiteurs du SGLT-2, récemment disponibles.
|
Physiopathologie de la maladie rénale diabétique
L’hyperglycémie chronique est un facteur de risque majeur pour le développement et la progression de la maladie rénale diabétique [
10
]. Les concentrations sanguines de glucose élevées affectent en effet diverses cellules résidentes du rein, telles que les cellules endothéliales et les cellules des tubules rénaux, qui sont particulièrement sensibles à la toxicité induite par le glucose [
10
]. Au niveau intracellulaire, ces fortes concentrations activent de multiples voies métaboliques et inflammatoires et conduisent à la génération d’intermédiaires toxiques : produits avancées de glycation (AGE, pour
advanced glycation end products
), espèces réactives de l’oxygène, cytokines inflammatoires et facteurs de croissance et pro-fibrosants [
10
]. Une exposition prolongée à un tel environnement toxique exerce finalement des effets délétères sur la fonction et la morphologie rénales. Dans le tubule proximal, l’hypertrophie induite et la charge filtrée de glucose élevée conduit à une réabsorption accrue de glucose et de sodium par le SGLT-2, entraînant une diminution de l’apport de sodium aux cellules de la
macula densa
de l’appareil juxtaglomérulaire
1
qui est à l’origine d’une activation intrarénale de la cascade rénine-angiotensine-aldostérone ce qui conduit à une vasoconstriction de l’artériole efférente, à une augmentation de la pression intraglomérulaire et à une hyperfiltration glomérulaire [
11
]. Au fil du temps, l’hyperfiltration et l’augmentation de la pression intraglomérulaire est à l’origine d’un stress mécanique et augmente la demande en oxygène, entraînant une atteinte glomérulaire et la progression de la maladie rénale diabétique. La stimulation intrarénale du système rénine-angiotensine-aldostérone active, par ailleurs, une multitude de voies pro-inflammatoires et pro-fibrosantes [
12
]. Une contribution d’altérations épigénétiques intervenant au cours des premières phases de la maladie rénale diabétique, qui entraînent potentiellement des modifications dans la transcription des gènes codant des protéines impliquées dans plusieurs voies de signalisation, a également été proposée [
13
].
|
Rôle délétère de l’activation du récepteur minéralocorticoïde dans la maladie rénale diabétique et bénéfices de ses antagonistes Mécanisme d’action du récepteur minéralocorticoïde
Le récepteur minéralocorticoïde (RM) est un membre de la famille des récepteurs des hormones stéroïdiennes. Il agit comme un facteur de transcription dépendant d’un ligand [
14
]. La liaison du ligand au RM favorise des modifications conformationnelles qui permettent sa translocation du cytoplasme vers le noyau, dans lequel il se lie à des éléments spécifiques de la réponse hormonale, et recrute des cofacteurs transcriptionnels, ce qui permet la transcription ou la répression de ses gènes cibles [
14
]. Le RM relaie l’activité physiologique de l’aldostérone, l’hormone stéroïde surrénalienne [
14
]. Il est surtout connu pour son rôle dans le contrôle de l’homéostasie du sodium et du potassium, ainsi que du volume extracellulaire et de la pression artérielle, du fait de son expression par les cellules épithéliales rénales sensibles à l’aldostérone dans le néphron distal [
14
]. Ces cellules expriment l’enzyme 11β-hydroxystéroïde déshydrogénase de type 2 (11β-HSD2). Cette enzyme transforme le cortisol en cortisone, incapable de se lier au RM et de l’activer. Ainsi, bien que le RM lie l’aldostérone et le cortisol avec une affinité identique, l’activité de la 11β-HSD2 dans ces cellules épithéliales rénales confère au RM une spécificité pour l’aldostérone [
14
].
Le rôle physiologique de l’aldostérone est d’augmenter la réabsorption de sodium (Na
+
) et l’excrétion de potassium (K
+
) par la formation du complexe RM-aldostérone. Ce complexe active, par différentes voies de régulation, le canal sodique épithélial apical (ENaC) et la Na
+
/K
+
ATPase basolatérale. Dans les cellules intercalaires
2,
, le complexe RM-aldostérone augmente les niveaux de pendrine
3,
, ce qui favorise la réabsorption de chlorure (Cl
-
) et réduit la sécrétion de K
+
dans le néphron distal. Dans les cellules du tube contourné distal, le complexe favorise en revanche la réabsorption de Na
+
et de Cl
-
, en augmentant l’activité du cotransporteur sodium-chlore [
14
].
Le profil d’expression du RM dans le rein, ou dans d’autres organes, est plus large qu’on ne le pensait initialement
(
Figure 1
)
. Il est en effet exprimé dans des cellules non épithéliales, comme les cardiomyocytes, les adipocytes, les podocytes, les cellules immunitaires inflammatoires, les cellules endothéliales et les cellules musculaires lisses vasculaires, par exemple. Ces cellules n’expriment pas ou peu la 11β-HSD2, ce qui suggère une activation potentielle du RM par le cortisol plutôt que par l’aldostérone [
14
]
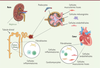 | Figure 1.
Profil d’expression du récepteur minéralocorticoïde dans le rein et le cœur.
|
Les antagonistes du RM (ARM) sont classés en composés stéroïdiens et non stéroïdiens. Les ARM stéroïdiens, comme la spironolactone et l’éplérénone, ont d’abord été développés et utilisés pour le traitement de l’hyperaldostéronisme primaire, de l’hypertension artérielle et, plus récemment, de l’insuffisance cardiaque. Afin d’améliorer la tolérance des ARM, plusieurs antagonistes non stéroïdiens ont été récemment développés. Il s’agit notamment de la finerénone, de l’esaxerénone, de l’apararénone, du KBP-5074 et de l’AZD9977, tous à différents stades de développement allant des essais précliniques aux essais cliniques de phase III. Certains sont déjà commercialisés comme l’esaxerénone et la finerénone, par exemple [
15
]. Lors de leur liaison avec le RM, les ARM induisent un changement conformationnel du récepteur qui inhibe la liaison de l’aldostérone et d’autres ligands. Cela diminue l’accumulation nucléaire de RM et inhibe le recrutement des cofacteurs transcriptionnels et donc la signalisation qui y est associée.
La fibrose rénale corticale et médullaire est un point commun à l’ensemble des néphropathies, indépendamment de leur étiologie. La suractivation du RM, qui contribue à l’inflammation et à la fibrose, est bien documentée dans les maladies cardiovasculaires et est maintenant reconnue comme une cible thérapeutique potentielle pour ralentir la progression de la maladie rénale chronique, qu’elle qu’en soit la cause. L’aldostérone stimule en effet la synthèse de collagène dans les cellules mésangiales
in vivo
et
in vitro
. Elle favorise les lésions des podocytes, provoque une dysfonction endothéliale et augmente le stress oxydant dans le système vasculaire. L’inhibition du RM réduit ainsi les dommages aux podocytes, retarde la glomérulosclérose, et diminue la protéinurie, la fibrose et l’inflammation du parenchyme rénal [
9
,
13
]
(
Figure 2
)
. Au niveau cardiaque, l’aldostérone favorise l’apoptose des cardiomyocytes et la fibrose myocardique, conduisant à un remodelage de la matrice extracellulaire cardiaque et à une altération de la contractilité [
7
,
16
]
(
Figure 2
)
. Chez des rats et des souris diabétiques, le blocage du RM par la spironolactone ou l’éplérénone, réduit les dépôts de collagène dans les zones glomérulaires, tubulo-interstitielles et périvasculaires, et diminue l’albuminurie [
9
,
13
]. Des résultats similaires ont été rapportés avec la finerénone [
15
]. En effet, la finerénone inhibe les voies pro-fibrosantes et pro-inflammatoires, diminue la protéinurie et bloque la fibrose interstitielle rénale sans modification de la pression artérielle [
15
]. Elle inhibe l’expression des gènes pro-fibrosants et pro-inflammatoires au niveau cardiaque, prévient la fibrose myocardique, et améliore la fonction cardiaque à des doses non hypotensives [
15
]. De nombreuses études précliniques indiquent que les effets protecteurs rénaux et cardiovasculaires de la finerénone, et d’autres ARM, reposent sur leurs propriétés anti-inflammatoires, anti-fibrosantes et anti-oxydantes
(
Figure 2
)
.
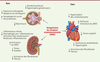 | Figure 2.
Effets protecteurs rénaux et cardiovasculaires des antagonistes du récepteur minéralocorticoïde (ARM) (études précliniques).
Les flèches présentent une augmentation (↑) ou une diminution (↓). eNOS : NO synthase endothéliale.
|
Comparaison entre antagonistes du récepteur minéralocorticoïde
Les antagonistes non stéroïdiens du RM ont un profil pharmacologique différent des antagonistes stéroïdiens [
15
], ce qui participe à leur meilleur tolérance. La finerénone a en effet une plus grande sélectivité pour le RM que la spironolactone, et une affinité de liaison au récepteur plus élevée que la spironolactone et l’éplérénone [
15
]. La liaison de la finerénone induit ainsi un recrutement de cofacteurs différents de ceux recrutés par l’éplérénone, entraînant une modulation de profils d’expression génique différents [
17
]. La spironolactone est moins sélective que l’éplérénone et la finerénone. Elle peut antagoniser les récepteurs des androgènes et activer ceux de la progestérone, conduisant ainsi à des effets secondaires anti-androgéniques et progestatifs (gynécomastie et impuissance chez l’homme, irrégularités menstruelles chez la femme) aux conséquences possiblement importantes pour l’observance du traitement [
15
].
|
Traitement de la maladie rénale diabétique
Un diagnostic précoce de la maladie rénale diabétique est essentiel pour introduire des mesures pour ralentir ou stopper la progression de la maladie et ses complications, en particulier cardiovasculaires [
5
]. La combinaison de multiples stratégies thérapeutiques est en fait nécessaire. Elle comprend les contrôles glycémiques et de la pression artérielle (avec pour objectif des valeurs de la pression systolique inférieure à 130 mmHg et de la pression diastolique inférieure à 80 mmHg), la prise en charge des dyslipidémies, ainsi qu’une optimisation des règles hygiéno-diététiques, en particulier une majoration de l’exercice physique [
3
]. Les inhibiteurs du système rénine-angiotensine, les inhibiteurs de l’enzyme de conversion de l’angiotensine (IECA) et les antagonistes des récepteurs de l’angiotensine (ARA), qui réduisent la pression artérielle, l’hypertension intraglomérulaire et l’albuminurie, sont recommandés en première intention dans le cadre de la maladie rénale chronique, en raison de leurs effets bénéfiques sur la fonction rénale et leur effet protecteur au niveau cardiovasculaire. Néanmoins, les IECA et les ARA ralentissent mais n’arrêtent pas la progression de la maladie rénale diabétique. Chez près de 50 % des patients, après un an de blocage du système rénine-angiotensine-aldostérone, un échappement de la synthèse d’angiotensine et/ou de l’aldostérone peut être observé [
18
] et l’augmentation de l’aldostérone a été associée à un déclin accéléré du débit de filtration glomérulaire estimé chez les patients présentant une maladie rénale diabétique.
L’optimisation du contrôle glycémique, obtenu précocement dans l’évolution du diabète, a un effet bénéfique bien établi pour la prévention de la maladie rénale diabétique [
19
]. Les inhibiteurs de cotransporteur sodium-glucose de type 2 (SGLT-2) montrent des bénéfices thérapeutiques qui vont au-delà du contrôle de la glycémie [
20
]. Chez les patients présentant un DT2, ces inhibiteurs se sont révélés protecteurs sur la fonction rénale, que ce soit dans les études ayant ce critère de jugement comme critère principal (essai clinique CREDENCE avec la canaglifozine chez les patients présentant un DT2 avec une maladie rénale diabétique), ou dans les études évaluant l’évolution de la fonction rénale comme critère de jugement secondaire, dans des essais portant sur la protection cardiovasculaire (essai clinique EMPAREG OUTCOME avec la empaglifozine ; essai CANVAS avec la canaglifozine ; essai DECLARE-TIMI avec la dapaglifozine ; essai VERTIS-CV avec la ertuglifozine ; essai SCORED avec la sotaglifozine). Cet effet protecteur rénal a également été démontré chez les patients présentant une maladie rénale chronique protéinurique, qu’elle soit ou non associée à un DT2 (essai DAPA-CKD avec la dapaglifozine). Chez les patients présentant un DT2 ayant des antécédents ou plusieurs facteurs de risque cardiovasculaire, l’utilisation des glifozines est par ailleurs associée à une réduction des événements cardiovasculaires majeurs (essai clinique EMPAREG-OUTCOME et CANVAS). C’est également le cas pour les patients de l’essai clinique CREDENCE.
Des essais cliniques évaluant les agonistes des récepteurs du
glucagon-like peptide-1
(AR GLP-1) ont également montré des effets bénéfiques sur les paramètres cardiovasculaires, en particulier chez les patients présentant un DT2 et des maladies cardiovasculaires, ou qui sont à haut risque de maladies cardiovasculaires. Cependant, leurs mécanismes rénoprotecteurs sont moins bien établis [
21
].
|
La finerénone, un nouvel antagoniste non stéroïdien du récepteur minéralocorticoïde
En complément des bloqueurs du système rénine-angiotensine et des inhibiteurs du cotransporteur sodium-glucose de type 2, les antagonistes non stéroïdiens du RM sont désormais disponibles pour le traitement de la maladie rénale diabétique. Les antagonistes du RM (ARM) stéroïdiens, comme la spironolactone ou l’éplérénone, apportent un bénéfice clinique important chez les patients souffrant d’hypertension et d’insuffisance cardiaque à fraction d’éjection réduite [
22
,
23
]. L’effet bénéfique de ces ARM stéroïdiens sur la protéinurie ou l’albuminurie chez les patients traités par les inhibiteurs du système rénine-angiotensine a également été démontré dans des essais cliniques à petite échelle [
7
]. L’utilisation plus large de la spironolactone et de l’éplérénone chez les patients présentant une maladie rénale chronique a été limitée, en raison des complications intrinsèquement associées à ces traitements, telles que les effets secondaires anti-androgéniques (lié à la mauvaise spécificité de la spironolactone), le risque hyperkaliémique et l’aggravation de la fonction rénale, en particulier chez les patients dont la fonction rénale est altérée. Le programme clinique ARTS (
aldosterone receptor antagonist tolerability study
) de phase II (ARTS, ARTS-HF [
heart failure
] et ARTS-DN [
diabetic nephropathy
]) a permis d’étudier les effet de la finérénone chez les patients présentant un DT2 et une maladie rénale diabétique [
24
–
26
]. Ces études ont montré que ce traitement réduisait l’albuminurie et diminuait les taux de peptide natriurétique de type B, avec un risque d’hyperkaliémie modéré par rapport à celui observé avec les ARM stéroïdiens.
Récemment, la finerénone a été approuvée aux États-Unis et en Europe pour limiter la progression de l’insuffisance rénale, réduire les décès liés à des accidents cardiovasculaires et l’hospitalisation pour insuffisance cardiaque, chez les patients présentant une maladie rénale chronique et un DT2. La finerénone est le seul ARM disponible pour cette indication. Les essais initiaux l’impliquant comprenaient deux essais de phase III ayant des protocoles complémentaires, avec plus de 13 000 patients présentant une maladie rénale diabétique : FIDELIO-DKD (
finerenone in reducing kidney failure and disease progression in diabetic kidney disease
) incluant 5 734 patients [
27
] et FIGARO-DKD (
finerenone in reducing cardiovascular mortality and morbidity in diabetic kidney disease
) incluant 7 437 patients [
28
]. Ces deux essais cliniques indépendants mais de conception similaire, étaient randomisés, en double aveugle, et contrôlés par placebo. FIDELIO-DKD a étudié l’efficacité et la sécurité de la finerénone pour ralentir la progression de la maladie chez les patients présentant une maladie rénale diabétique avancée, alors que FIGARO-DKD évaluait l’innocuité de la finerénone, son efficacité dans la réduction de la morbidité cardiovasculaire, et la mortalité aux stades précoces de la maladie rénale chronique. Ce programme comprenait en outre une analyse prédéfinie FIDELITY, combinant les 13 026 patients des deux essais [
29
]. Les critères de jugement principaux de FIDELITY ont été définis comme les paramètres cardiovasculaires et rénaux, avec, en particulier, le doublement du taux de créatinine sérique et le temps de survenue d’une insuffisance rénale terminale [
29
]. La
Figure 3
présente les résultats majeurs obtenus dans ces études.
 | Figure 3.
Essais cliniques réalisés pour l’évaluation de l’efficacité de la finerénone pour la protection rénale et cardiovasculaire de patients diabétiques de type 2 présentant une maladie rénale chronique.
UACR : ratio albuminurie/créatininurie (selon [
24
,
26
–
31
]).
|
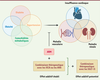 | Figure 4.
Association des antagonistes du récepteur minéralocorticoïde et des autres thérapeutiques ayant un bénéfice établi sur la protection rénale et cardiovasculaire des patients diabétiques de type 2.
Un effet additif sur l’action des antagonistes du récepteur minéralocorticoïde (ARM) est avéré avec les IECA (inhibiteurs de l’enzyme de conversion de l’angiotensine) ou les ARA (bloqueurs des récepteurs de l’angiotensine), et un effet additif est potentiel avec les inhibiteurs de SGLT-2 (cotransporteur sodium-glucose de type 2) (SGLT-2i) ou les antagonistes du récepteur de GLP-1 (
glucagon-like peptide-1
).
|
L’incidence totale des événements indésirables liés au traitement était similaire entre les groupes finerénone et placebo dans les deux essais [
28
,
29
]. Les événements indésirables liés à l’hyperkaliémie étaient deux fois plus fréquents avec la finerénone qu’avec le placebo dans FIDELIO-DKD (18,3 % contre 9,0 %) et FIGARO-DKD (10,8 % contre 5,3 %) [
31
], avec toutefois une augmentation très modeste des taux sériques de potassium (0,23 mmol/L), qui sont restés stables tout au long de l’étude [
29
]. L’analyse groupée FIDELITY a, quant à elle, indiqué que l’hyperkaliémie entraînait des arrêts de traitement plus fréquents chez les patients recevant la finerénone (1,7 %) par rapport à ceux traités par le placebo (0,6 %). En dehors de l’hyperkaliémie, aucun effet secondaire cliniquement significatif n’a été observé avec la finerénone dans les deux essais, y compris la gynécomastie, l’impuissance et les irrégularités menstruelles [
29
].
|
Maladie cardiovasculaire et maladie rénale chronique
Les patients présentant une maladie rénale chronique, qu’ils soient diabétiques ou non, ont un risque élevé de complications cardiovasculaires [
2
]. Chez les personnes atteintes de diabète, la maladie rénale chronique augmente considérablement ce risque, et la principale cause de décès chez ces patients est liée aux maladies cardiovasculaires, plus qu’à leur insuffisance rénale [
2
,
32
]. Néanmoins, les maladies cardiovasculaires restent souvent sous-diagnostiquées et sous-traitées chez les patients présentant une maladie rénale chronique [
33
]. La maladie rénale chronique provoque un état pro-inflammatoire global et chronique, contribuant aux processus de remodelages vasculaire et myocardique qui vont entraîner une athérosclérose accélérée, une calcification vasculaire, ainsi qu’une fibrose myocardique, et la calcification des valves cardiaques [
5
].
Des thérapies visant à réduire le risque de maladies cardiovasculaires dans la maladie rénale chronique ont été proposées, laissant espérer que le risque cardiovasculaire chez les patients présentant une insuffisance rénale chronique peut être réduit à l’avenir [
3
]. Les essais cliniques avec les SGLT-2i ou les GLP-1 RA montrent systématiquement des avantages chez les patients présentant un DT2 à haut risque de maladies cardiovasculaires [
21
,
34
]. L’essai FIDELIO-DKD a montré que la finerénone, en combinaison avec un blocage optimisé du système rénine-angiotensine, peut prévenir les événements cardiovasculaires chez les patients présentant un DT2 et une maladie rénale chronique [
27
]. L’essai FIGARO-DKD montre, quant à lui, que l’ajout de finérénone au traitement standard réduit considérablement les risques de mortalité et d’évènements cardiovasculaires chez les patients présentant une insuffisance rénale chronique et un DT2 [
28
].
|
La finerénone : combinaison thérapeutique et effets additifs (
Figure 4
).
Inhibiteurs de l’enzyme de conversion de l’angiotensine/bloqueurs du récepteur de l’angiotensine
Les agents antihypertenseurs, tels que les IECA et les ARA, sont recommandés comme médicaments de première intention dans la prise en charge de la maladie rénale chronique, quelle que soit son origine [
3
]. Les inhibiteurs du système rénine-angiotensine sont efficaces à tous les stades de la maladie et sont recommandés pour les patients présentant soit une hypertension et une maladie rénale chronique protéinurique, soit un DFGe réduit (inférieur à 60 ml/min/1,73 m
2
) et une albuminurie supérieure à 300 mg/g [
3
]. Un traitement combinant IECA et ARA est associé à un risque accru d’événements indésirables graves, en particulier une hyperkaliémie. Chez les patients présentant une maladie rénale chronique et un DT2, l’association d’antagonistes ARM et d’inhibiteurs du système rénine-angiotensine réduit l’albuminurie et le risque de progression de la maladie rénale, indépendamment du contrôle de la pression artérielle. Les résultats des essais FIDELIO-DKD et FIGARO-DKD obtenus chez des patients présentant un DT2 et une maladie rénale chronique, a confirmé que la finerénone, sur fond de blocage maximal du système rénine-angiotensine, réduit l’albuminurie et ralentit la progression du déclin du DFGe [
27
,
28
]. Si une hyperkaliémie se développe pendant le traitement par ARM en association avec des bloqueurs du système rénine-angiotensine, plusieurs options sont disponibles : une diminution de l’apport alimentaire en potassium ; la correction de l’acidose avec du bicarbonate et l’utilisation de diurétiques ou des chélateurs de potassium, tels que le patiromer et le zirconium de sodium cyclosilicate [
35
,
36
].
Inhibiteurs du co-transporteur de sodium
SGLT-2 (cotransporteur sodium-glucose de type 2) est un transporteur de grande capacité et de faible affinité, présent presque exclusivement dans le segment initial du tubule proximal. Il est responsable de la majorité de la résorption du glucose [
20
]. Le principal mécanisme d’action des inhibiteurs de ce transporteur repose sur le blocage de la réabsorption du glucose, ce qui provoque une glycosurie et une natriurèse. L’activation du rétrocontrôle tubulo-glomérulaire conduit à une vasoconstriction artériolaire et à une vasodilatation artériolaire efférente. Il en résulte une diminution de la pression intraglomérulaire, une réduction de l’hyperfiltration glomérulaire, de l’albuminurie et du déclin du débit de filtration glomérulaire. L’augmentation de la natriurèse tend alors, par divers mécanismes, à augmenter la kaliurèse. Les patients traités par des inhibiteurs de ce transporteur (SGLT-2i) présentent ainsi moins de risque d’hyperkaliémie ou utilisent moins de chélateurs de potassium [
37
]. Une méta-analyse des essais cliniques portant sur l’impact cardio-rénal de ces inhibiteurs a montré que ceux-ci réduisaient légèrement les taux de potassium sériques et le risque d’hyperkaliémie chez les patients traités par rapport aux contrôles [
38
]. Une analyse de l’essai FIDELIO-DKD révèle en outre que l’hyperkaliémie survient moins fréquemment chez les patients qui utilisent la finerénone en association avec des SGLT-2i, par rapport à ceux qui n’ont pas utilisé d’inhibiteurs du SGLT-2 [
31
]. La combinaison de SGLT-2i et d’ARM apparaît donc comme une option de traitement intéressante du point de vue de la sécurité d’utilisation, en particulier chez les patients à risque d’hyperkaliémie (traités par inhibiteur du système rénine-angiotensine ou par ARM, ou présentant une fonction rénale réduite, par exemple). Les SGLT-2i exercent de multiples autres effets rénoprotecteurs, en limitant l’ischémie relative intrarénale, le stress oxydant et, indirectement, l’inflammation et le remodelage de la matrice extracellulaire. Les inhibiteurs de SGLT-2 améliorent les paramètres cardio-rénaux chez les patients, qu’ils soient diabétiques ou pas [
34
,
39
]. Lorsqu’ils sont utilisés en association avec des bloqueurs du système rénine-angiotensine chez les patients présentant une maladie rénale diabétique modérée, ils réduisent la progression de l’insuffisance rénale et les évènements cardiovasculaires, quel que soit le contrôle glycémique [
34
].
L’association de finerénone et d’inhibiteurs de SGLT-2 pourrait donc offrir une protection rénale et cardiovasculaire accrue. Dans l’étude FIDELIO-DKD, 4,6 % des patients ont reçu un SGLT2i. Une hyperkaliémie est survenue moins fréquemment chez ces patients traités par la finerénone et recevant un SGLT2i [
27
]. Dans l’étude ROTATE-3 (une étude en
cross over
4
intégrant 46 patients, avec un traitement de quatre semaines), un effet additif bénéfique de la dapaglifozine et de l’éplerénone sur la diminution de l’albuminurie a été mis en évidence [
40
]. Dans cette étude, la différence de kaliémie, par rapport à la valeur mesurée avant traitement, s’est révélée moindre lorsque les patients avaient reçu le traitement combiné (0,23 % pour la combinaison dapaglifozine-éplerénone, contre 0,03 % pour la dapaglifozine seule et 0,36 % pour éplerénone seule) [
40
]. Ces résultats, prometteurs, suggèrent qu’une association entre SGLT2i et ARM apporterait un bénéfice supérieur à celui de l’utilisation de ces molécules utilisées séparément, tout en réduisant le risque hyperkaliémique chez les patients présentant une maladie rénale diabétique. Une étude de phase II, CONFIDENCE (
combination effect of finerenone and empagliflozin
), combinant, ou pas, l’empaglifozine et la finerénone, avec comme critère primaire la réduction de l’albuminurie au bout de quatre mois de traitement, est actuellement en cours [
41
].
|
La maladie rénale diabétique touche une grande partie de la population mondiale. C’est une maladie chronique évolutive dont la physiopathologie complexe n’est pas entièrement comprise. L’identification de nouveaux mécanismes a révélé des cibles médicamenteuses potentielles et a conduit au développement de nouvelles approches thérapeutiques. Les données concernant l’utilisation des SGLT-2i et leur association avec les inhibiteurs du système rénine-angiotensine ont déjà un impact sur les pratiques de soins et les recommandations. L’efficacité d’utilisation et la sécurité d’emploi de la finerénone soutiennent son utilisation clinique aux côtés des thérapies déjà validées. Dans un avenir proche, les résultats d’essais cliniques réalisés avec les antagonistes du récepteur du GLP-1 permettront de préciser s’ils représentent une autre classe thérapeutique apportant un bénéfice rénal. Après 20 ans de pénurie de traitement de la maladie rénale diabétique, les SGLT-2i et l’ARM non stéroïdien finerénone, seuls ou peut-être en combinaison, sont maintenant disponibles pour ralentir la progression de la maladie rénale chronique due au diabète, et diminuer le risque résiduel malgré les thérapies actuelles. |
F.J. a reçu des bourses de recherche de la part de Astrazeneca and Bayer SAS, ainsi que des honoraires de la part de Astrazeneca, Bayer SAS et KBP Biosciences.
S.G., M.S. et J.B.C. déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Jager
KJ
,
Kovesdy
C
,
Langham
R
,
et al.
A single number for advocacy and communication-worldwide more than 850 million individuals have kidney diseases.
.
Kidney Int.
2019;
;
96
:
:1048.
–
1050
.
2.
Fried
LF
,
Folkerts
K
,
Smeta
B
,
et al
.
Targeted literature review of the burden of illness in patients with chronic kidney disease and type 2 diabetes.
.
Am J Manag Care.
2021;
;
27
:
:S168.
–
77
.
3.
Kidney Disease: Improving Global Outcomes (KDIGO) Diabetes Work Group. KDIGO 2020 Clinical Practice Guideline for Diabetes Management in Chronic Kidney Disease.
.
Kidney Int.
2020;
;
98
:
:S1.
–
115
.
4.
Chang
TI
,
Li
S
,
Chen
S-C
,
et al.
Risk factors for ESRD in individuals with preserved estimated GFR with and without albuminuria: results from the Kidney Early Evaluation Program (KEEP).
.
Am J Kidney Dis.
2013;
;
61
:
:S4.
–
11
.
5.
Jankowski
J
,
Floege
J
,
Fliser
D
,
et al
.
Cardiovascular Disease in Chronic Kidney Disease: Pathophysiological Insights and Therapeutic Options.
.
Circulation.
2021;
;
143
:
:1157.
–
72
.
6.
Fang
M
,
Wang
D
,
Coresh
J
,
et al
.
Trends in Diabetes Treatment and Control in U.S. Adults, 1999–2018.
.
N Engl J Med.
2021;
;
384
:
:2219.
–
28
.
7.
Barrera-Chimal
J
,
Bonnard
B
,
Jaisser
F
.
Roles of Mineralocorticoid Receptors in Cardiovascular and Cardiorenal Diseases.
.
Annu Rev Physiol.
2022;
;
84
:
:585.
–
610
.
8.
Agarwal
R
,
Kolkhof
P
,
Bakris
G
,
et al
.
Steroidal and non-steroidal mineralocorticoid receptor antagonists in cardiorenal medicine.
.
Eur Heart J.
2021;
;
42
:
:152.
–
61
.
9.
Barrera-Chimal
J
,
Lima-Posada
I
,
Bakris
GL
,
et al
.
Mineralocorticoid receptor antagonists in diabetic kidney disease - mechanistic and therapeutic effects.
.
Nat Rev Nephrol.
2022;
;
18
:
:56.
–
70
.
10.
Thomas
MC
,
Brownlee
M
,
Susztak
K
,
et al.
Diabetic kidney disease.
.
Nat Rev Dis Primer.
2015;
;
1
:
:15018.
.
11.
DeFronzo
RA
,
Reeves
WB
,
Awad
AS
.
Pathophysiology of diabetic kidney disease: impact of SGLT2 inhibitors.
.
Nat Rev Nephrol.
2021;
;
17
:
:319.
–
34
.
12.
Ruggenenti
P
,
Cravedi
P
,
Remuzzi
G
.
The RAAS in the pathogenesis and treatment of diabetic nephropathy.
.
Nat Rev Nephrol.
2010;
;
6
:
:319.
–
330
.
13.
Barrera-Chimal
J
,
Jaisser
F
.
Pathophysiologic mechanisms in diabetic kidney disease: A focus on current and future therapeutic targets.
.
Diabetes Obes Metab.
2020;
;
22
(Suppl 1)
:
:16.
–
31
.
14.
Jaisser
F
,
Farman
N
.
Emerging Roles of the Mineralocorticoid Receptor in Pathology: Toward New Paradigms in Clinical Pharmacology.
.
Pharmacol Rev.
2016;
;
68
:
:49.
–
75
.
15.
Kintscher
U
,
Bakris
GL
,
Kolkhof
P
.
Novel non-steroidal mineralocorticoid receptor antagonists in cardiorenal disease.
.
Br J Pharmacol.
2022;
;
179
:
:3220.
–
34
.
16.
Bauersachs
J
,
Lother
A
.
Mineralocorticoid receptor activation and antagonism in cardiovascular disease: cellular and molecular mechanisms.
.
Kidney Int Suppl.
2022;
;
12
:
:19.
–
26
.
17.
Grune
J
,
Beyhoff
N
,
Smeir
E
,
et al.
Selective Mineralocorticoid Receptor Cofactor Modulation as Molecular Basis for Finerenone’s Antifibrotic Activity.
.
Hypertens Dallas Tex.
1979;
;
2018
:
(71)
:
:599.
–
608
.
18.
Bomback
AS
,
Klemmer
PJ
.
The incidence and implications of aldosterone breakthrough.
.
Nat Clin Pract Nephrol.
2007;
;
3
:
:486.
–
492
.
19.
Holman
RR
,
Paul
SK
,
Bethel
MA
,
et al.
Long-term follow-up after tight control of blood pressure in type 2 diabetes.
.
N Engl J Med.
2008;
;
359
:
:1565.
–
1576
.
20.
Kakar
F
,
Weiss
NS
,
Strite
SA
.
Non-contraceptive estrogen use and the risk of gallstone disease in women.
.
Am J Public Health.
1988;
;
78
:
:564.
–
566
.
21.
Sattar
N
,
Lee
MMY
,
Kristensen
SL
,
et al
.
Cardiovascular, mortality, and kidney outcomes with GLP-1 receptor agonists in patients with type 2 diabetes: a systematic review and meta-analysis of randomised trials.
.
Lancet Diabetes Endocrinol.
2021;
;
9
:
:653.
–
62
.
22.
Pitt
B
,
Zannad
F
,
Remme
WJ
,
et al.
The effect of spironolactone on morbidity and mortality in patients with severe heart failure. Randomized Aldactone Evaluation Study Investigators.
.
N Engl J Med.
1999;
;
341
:
:709.
–
717
.
23.
Pitt
B
,
Remme
W
,
Zannad
F
,
et al.
Eplerenone, a selective aldosterone blocker, in patients with left ventricular dysfunction after myocardial infarction.
.
N Engl J Med.
2003;
;
348
:
:1309.
–
1321
.
24.
Pitt
B
,
Kober
L
,
Ponikowski
P
,
et al.
Safety and tolerability of the novel non-steroidal mineralocorticoid receptor antagonist BAY 94–8862 in patients with chronic heart failure and mild or moderate chronic kidney disease: a randomized, double-blind trial.
.
Eur Heart J.
2013;
;
34
:
:2453.
–
2463
.
25.
Bakris
GL
,
Agarwal
R
,
Chan
JC
,
et al.
Effect of Finerenone on Albuminuria in Patients With Diabetic Nephropathy: A Randomized Clinical Trial.
.
JAMA.
2015;
;
314
:
:884.
–
894
.
26.
Filippatos
G
,
Anker
SD
,
Böhm
M
,
et al.
A randomized controlled study of finerenone vs. eplerenone in patients with worsening chronic heart failure and diabetes mellitus and/or chronic kidney disease.
.
Eur Heart J.
2016;
;
37
:
:2105.
–
2114
.
27.
Bakris
GL
,
Agarwal
R
,
Anker
SD
,
et al
.
Effect of Finerenone on Chronic Kidney Disease Outcomes in Type 2 Diabetes.
.
N Engl J Med.
2020;
;
383
:
:2219.
–
29
.
28.
Pitt
B
,
Filippatos
G
,
Agarwal
R
,
et al
.
Cardiovascular Events with Finerenone in Kidney Disease and Type 2 Diabetes.
.
N Engl J Med.
2021;
;
385
:
:2252.
–
63
.
29.
Agarwal
R
,
Filippatos
G
,
Pitt
B
,
et al
.
Cardiovascular and kidney outcomes with finerenone in patients with type 2 diabetes and chronic kidney disease: the FIDELITY pooled analysis.
.
Eur Heart J.
2022;
;
43
:
:474.
–
84
.
30.
Agarwal
R
,
Anker
SD
,
Filippatos
G
,
et al
.
Effects of canagliflozin versus finerenone on cardiorenal outcomes: exploratory post hoc analyses from FIDELIO-DKD compared to reported CREDENCE results.
.
Nephrol Dial Transplant.
2022;
;
37
:
:1261.
–
9
.
31.
Agarwal
R
,
Joseph
A
,
Anker
SD
,
et al
.
Hyperkalemia Risk with Finerenone: Results from the FIDELIO-DKD Trial.
.
J Am Soc Nephrol.
2022;
;
33
:
:225.
–
37
.
32.
Thompson
S
,
James
M
,
Wiebe
N
,
et al.
Cause of Death in Patients with Reduced Kidney Function.
.
J Am Soc Nephrol.
2015;
;
26
:
:2504.
–
2511
.
33.
Tuttle
KR
,
Alicic
RZ
,
Duru
OK
,
et al.
Clinical Characteristics of and Risk Factors for Chronic Kidney Disease Among Adults and Children: An Analysis of the CURE-CKD Registry.
.
JAMA Netw Open.
2019;
;
2
:
:e1918169.
.
34.
McGuire
DK
,
Shih
WJ
,
Cosentino
F
,
et al
.
Association of SGLT2 Inhibitors With Cardiovascular and Kidney Outcomes in Patients With Type 2 Diabetes: A Meta-analysis.
.
JAMA Cardiol.
2021;
;
6
:
:148.
–
58
.
35.
Packham
DK
,
Rasmussen
HS
,
Lavin
PT
,
et al.
Sodium zirconium cyclosilicate in hyperkalemia.
.
N Engl J Med.
2015;
;
372
:
:222.
–
231
.
36.
Weir
MR
,
Bakris
GL
,
Bushinsky
DA
,
et al.
Patiromer in patients with kidney disease and hyperkalemia receiving RAAS inhibitors.
.
N Engl J Med.
2015;
;
372
:
:211.
–
221
.
37.
Barrera-Chimal
J
,
Gerarduzzi
C
,
Rossignol
P
,
et al
.
The non-steroidal mineralocorticoid receptor antagonist finerenone is a novel therapeutic option for patients with Type 2 diabetes and chronic kidney disease.
.
Clin Sci.
2022;
;
136
:
:1005.
–
17
.
38.
Neuen
BL
,
Oshima
M
,
Agarwal
R
,
et al
.
Sodium-Glucose Cotransporter 2 Inhibitors and Risk of Hyperkalemia in People With Type 2 Diabetes: A Meta-Analysis of Individual Participant Data From Randomized, Controlled Trials.
.
Circulation.
2022;
;
145
:
:1460.
–
70
.
39.
van der Beek
AB
,
Boer
RA
,
Heerspink
HJL
.
Kidney and heart failure outcomes associated with SGLT2 inhibitor use.
.
Nat Rev Nephrol.
2022;
;
18
:
:294.
–
306
.
40.
Provenzano
M
,
Puchades
MJ
,
Garofalo
C
,
et al
.
Albuminuria-Lowering Effect of Dapagliflozin, Eplerenone, and Their Combination in Patients with Chronic Kidney Disease: A Randomized Crossover Clinical Trial.
.
J Am Soc Nephrol.
2022;
;
33
:
:1569.
–
80
.
41.
Green
JB
,
Mottl
AK
,
Bakris
G
,
et al
.
Design of the COmbinatioN effect of FInerenone anD EmpaglifloziN in participants with chronic kidney disease and type 2 diabetes using an UACR Endpoint study (CONFIDENCE).
.
Nephrol Dial Transplant.
2022
;
:gfac198.
.
|