| |
| Med Sci (Paris). 39(4): 359–369. doi: 10.1051/medsci/2023053.Physiopathologie et traitements de l’hypertension artérielle pulmonaire Frédéric Perros,1,2,3* Étienne-Marie Jutant,4 Laurent Savale,1,2,3 Peter Dorfmüller,5 Marc Humbert,1,2,3 and David Montani1,2,3** 1Université Paris-Saclay, faculté de médecine
,
94270Le Kremlin-Bicêtre
,
France 2Inserm UMR-S 999, groupe hospitalier Saint Joseph – Hôpital Marie Lannelongue
,
92350Le Plessis-Robinson
,
France 3Service de pneumologie et soins intensifs respiratoires, Centre de référence de l’hypertension pulmonaire, Hôpital Bicêtre, AP-HP
,
78 rue du Général Leclerc
,
94270Le Kremlin-Bicêtre
,
France 4Université de Poitiers, CHU de Poitiers, service de pneumologie, Inserm CIC 1402 Axe IS-ALIVE
,
Poitiers
,
France 5Institut für Pathologie, Universitätsklinikum Giessen/Marburg and Deutsches Zentrum für Lungenforschung (DZL)
,
Allemagne |
Vignette (© Marc Humbert).
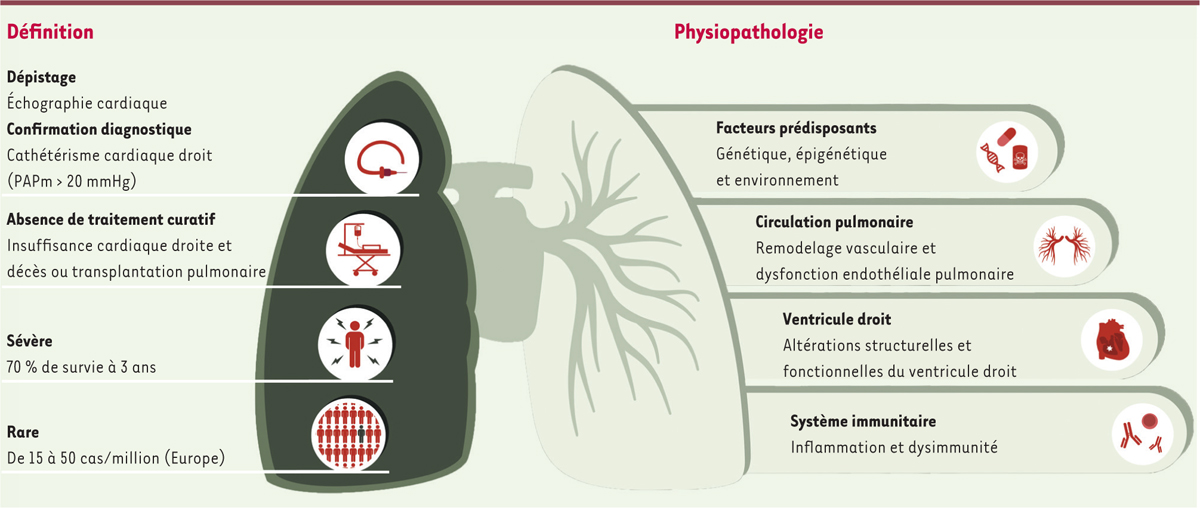
L’hypertension artérielle pulmonaire (HTAP) est une maladie rare dont l’évolution critique et l’issue fatale sont inévitables en l’absence de traitement. La maladie est causée par un remodelage obstructif des petites artères pulmonaires et est caractérisée par une augmentation progressive des résistances vasculaires pulmonaires (RVP) qui conduit à une insuffisance ventriculaire droite [
1
,
2
]. Le diagnostic repose principalement sur le cathétérisme cardiaque droit et l’exclusion d’autres formes d’hypertension pulmonaire (HTP) (telle que l’HTP associée aux maladies cardiaques gauches, aux maladies respiratoires chroniques ou à une obstruction chronique des artères pulmonaires) [
1
,
2
].
1
Les symptômes initiaux sont peu spécifiques. Ils incluent un essoufflement, d’abord à l’effort puis au repos, des malaises, et des syncopes. Selon les recommandations de 2022 des Sociétés européennes de cardiologie (ESC) et de pneumologie (ERS), l’HTAP est une HTP précapillaire, définie par une augmentation de la pression artérielle pulmonaire moyenne (PAPm) supérieure à 20 mm Hg, une pression artérielle pulmonaire d’occlusion (PAPO) normale (inférieure ou égale à 15 mm Hg) et une augmentation des résistances vasculaires pulmonaires (RVP) supérieure à 2 unités Wood (UW)
2,
[
1
,
2
]. L’HTP était auparavant définie par un seuil de PAPm supérieur ou égal à 25 mm Hg. Cependant, des patients présentant des PAPm comprises entre 21 et 24 mm Hg pouvaient présenter de véritables maladies vasculaires pulmonaires chroniques, avec un pronostic défavorable et un risque accru de décès [
3
]. De même, le seuil de RVP était précédemment de 3 UW, mais des données récentes [
4
] ont confirmé que des RVP supérieures à 2 UW correspondaient déjà à un état pathologique, justifiant également un abaissement du seuil des RVP à 2 UW.
La pathogenèse de l’HTAP est complexe et multifactorielle. Elle repose sur de nombreux piliers, tels que des prédispositions génétiques, un déséquilibre entre les médiateurs vasodilatateurs et les médiateurs vasoconstricteurs, ainsi qu’une dysimmunité et une inflammation, qui conduisent finalement à une dysfonction endothéliale, à la prolifération des cellules musculaires lisses, à l’activation des fibroblastes et au dépôt de collagène sur les parois remodelées des vaisseaux. Les altérations vasculaires pulmonaires sont à l’origine d’un remodelage myocardique hypertrophique et d’un dysfonctionnement ventriculaire droit [
5
]
(
Figure 1
)
.
 | Figure 1.
L’HTAP, définition et origine.
|
|
Les HTP ont été classées en groupes selon leur présentation clinique et les mécanismes physiopathologiques impliqués. La classification comprend actuellement cinq grands groupes d’HTP [
1
,
2
] permettant de définir des stratégies thérapeutiques spécifiques à chaque groupe
(
Figure 2
)
. L’HTAP correspond au groupe 1. Elle constitue une forme rare d’HTP, caractérisée par une altération des vaisseaux pulmonaires de petits calibres. Les groupes 2 à 5 correspondent à des formes d’HTP plus fréquentes et secondaires à d’autres maladies. Le groupe 2 correspond aux HTP associées aux cardiopathies gauches, le groupe 3 aux HTP associées aux maladies respiratoires chroniques et/ou à l’hypoxie, et le groupe 4 aux HTP secondaires à des obstructions artérielles pulmonaires chroniques, principalement l’HTP thrombo-embolique chronique. Le groupe 5 réunit les HTP de mécanismes multifactoriels et/ou inconnus.
 | Figure 2.
Classification des HTP.
|
L’HTAP peut être héritable ou secondaire à des expositions médicamenteuses ou toxiques. Elle peut également être associée à différentes maladies, comme les connectivites (principalement la sclérodermie systémique et le lupus érythémateux disséminé), l’infection par le virus de l’immunodéficience humaine (VIH), l’hypertension portale, les cardiopathies congénitales, la bilharziose. Ces HTAP sont caractérisées par un remodelage artériel pulmonaire prédominant. Après l’exclusion d’une HTP d’un autre groupe ou d’une HTAP de cause déterminée, une HTAP sera alors dite « idiopathique ».
L’HTAP idiopathique est la forme la plus fréquente (50 à 60 % des cas), suivie des HTAP associées aux connectivites, aux cardiopathies congénitales et à l’hypertension portale [
6
]. La nouvelle classification des HTP [
1
,
2
] distingue deux sous-groupes d’HTAP idiopathique, selon la réponse au test de vasoréactivité en aigu
3
. Ce test prédit la réponse à long terme aux inhibiteurs calciques des patients présentant une HTAP idiopathique, héritable ou induite par les médicaments. Dans les autres situations, ce test n’a pas de valeur diagnostique ou pronostique.
Le terme « héritable » définit des HTAP associées à des mutations des gènes de susceptibilité ou survenant dans un contexte familial, sans que des mutations aient été identifiées. La prise d’anorexigènes (aminorex, dexfenfluramine, fenfluramine, benfluorex), de dasatinib (inhibiteur de tyrosine kinase) et de métamphétamine est considérée comme étant une cause prouvée d’HTAP [
7
–
9
]. D’autres associations médicamenteuses dites « possibles » sont dues à des médicaments pour lesquels il existe une suspicion de causalité (données épidémiologiques, pharmacologiques ou expérimentales) qui n’est pas encore définitivement établie. La prise de ces médicaments justifient donc une surveillance particulière.
Il existe des formes plus rares d’HTAP, associant un remodelage veinulaire et capillaire pulmonaire. Dans la nouvelle classification, ces HTAP sont regroupées en « HTAP avec signes d’atteinte veinulaire et/ou capillaire (maladie veino-occlusive et/ou hémangiomatose capillaire pulmonaire) ». Cette forme d’HTAP est caractérisée par une présentation clinique particulière (dyspnée majeure, hypoxémie sévère, diminution de la diffusion pulmonaire du monoxyde de carbone et anomalies radiologiques), des facteurs de risque spécifiques (exposition aux agents alkylants, aux solvants organiques) et l’existence d’une forme génétique de transmission autosomique récessive liée à des mutations bialléliques du gène
EIF2AK4
(
eukaryotic translation initiation factor 2 alpha kinase 4
) codant la protéine GCN2 (
General Control Non derepressible 2
) [
10
,
11
].
|
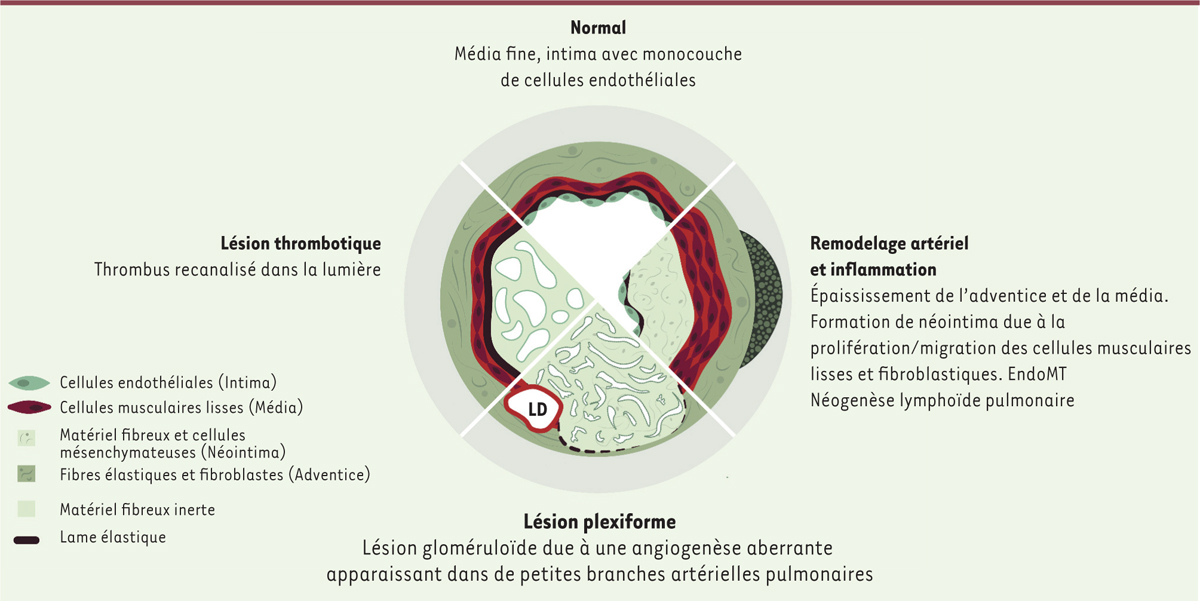
Bien que de causes variables, les différentes formes d’HTAP présentent un aspect histologique similaire avec un remodelage caractéristique des artérioles pulmonaires
(
Figure 3
)
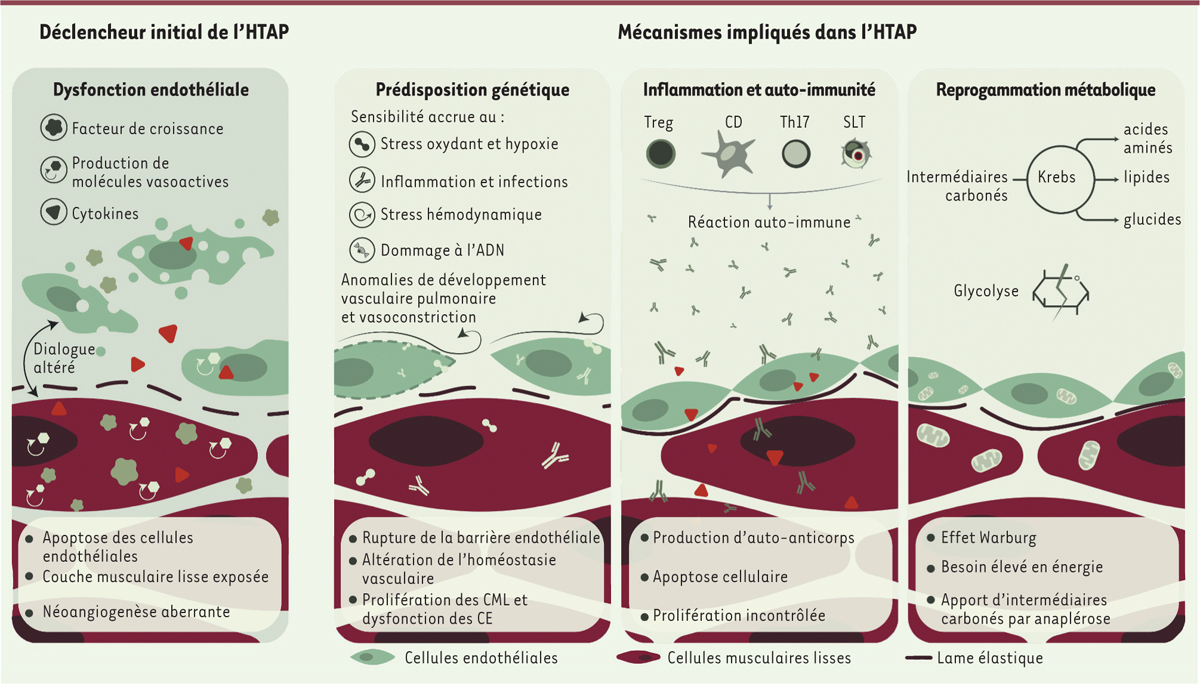
. Les mécanismes qui sont à l’origine de ces transformations ne sont pas entièrement élucidés. Plusieurs processus physiopathologiques sont impliqués
(
Figure 4
)
, tels que la dysfonction endothéliale, la migration et la prolifération de cellules musculaires lisses et de cellules endothéliales des artères pulmonaires, la transition endothélio-mésenchymateuse, la prolifération, la migration et la différenciation accrues des fibroblastes adventitiels de l’artère pulmonaire, l’inflammation, l’hypoxie, les dommages à l’ADN, et le stress oxydant [
5
,
12
,
13
].
 | Figure 3.
Histopathologie schématique de l’HTAP.
LD : lésion de dilatation ; EndoMT : transition endothélio-mésenchymateuse.
|
 | Figure 4.
Physiopathologie de l’HTAP : déclencheur et mécanismes.
Treg : Lymphocytes T régulateurs ; CD : cellules dendritiques ; Th17 : lymphocytes Th17 ; SLT : structures lymphoïdes tertiaires ; CE : cellule endothéliale ; CML : cellule musculaire lisse.
|
Prédispositions génétiques
Des mutations génétiques ont été identifiées dans certaines formes d’HTAP. Leur mode de transmission est le plus souvent autosomique dominant à pénétrance incomplète. Ces mutations concernent des gènes régulant l’homéostasie endothéliale (
BMPR2
,
ACVRL1
,
Endogline
,
GDF2
,
SMAD9
,
CAV1
)
4,
, des gènes codant des canaux ioniques (
KCNK3
,
AQP1
,
ATP13A3
,
ABCC8
)
4
ou des gènes impliqués dans le développement pulmonaire ou vasculaire pulmonaire (
TBX4
,
KDR
,
SOX17
)
4
[
2
]. Ces altérations favorisent une rupture de la barrière endothéliale, un remodelage vasculaire pulmonaire exagéré, une vasoconstriction – en particulier pour les mutations affectant des canaux potassiques, tels que
KCNK3
– et une raréfaction et des malformations vasculaires. Les voies de signalisation qui dépendent de ces gènes sont fréquemment dérégulées dans l’HTAP idiopathique ou dans les autres formes d’HTAP, mais aussi dans les modèles animaux de la maladie, indiquant que ces gènes constituent des éléments clés de l’homéostasie vasculaire pulmonaire. La diminution d’expression des protéines codées par ces gènes sensibilise le lit vasculaire pulmonaire au stress hémodynamique, à l’hypoxie, aux inducteurs de dommages à l’ADN, aux infections, et à l’inflammation.
À ce jour, des mutations inactivatrices délétères bi-alléliques dans le gène
EIF2AK4
sont la seule cause génétique prouvée de la maladie veino-occlusive héritable [
11
]. Les chimiothérapies, en particulier l’utilisation d’agents alkylants, ou l’exposition professionnelle à des solvants organiques, constituent les principaux facteurs de risque des formes sporadiques de la maladie [
14
–
16
]. Cependant, l’expression pulmonaire de
GCN2
est également diminuée dans les formes non héritables de maladie veino-occlusive pulmonaire [
17
,
18
]. GCN2 appartient à une famille de quatre kinases sensibles au stress. Ces kinases phosphorylent eIF2α (a
-subunit of eukaryotic initiation factor 2
), qui protège alors les cellules en réduisant la synthèse des protéines et en régulant l’expression des gènes impliqués dans la réponse au stress (ou réponse intégrée au stress, ISR pour
integrated stress response
) [
19
]. GCN2 induit des changements dans l’expression de gènes en réponse à la privation d’acides aminés ; cependant, elle est également impliquée dans la réponse à d’autres inducteurs, notamment les infections virales, l’hypoxie ou le stress oxydant. eIF2α est le seul substrat de GCN2 identifié à ce jour. Il existe néanmoins des preuves que les effets de l’activation de GCN2 pourraient se produire sans phosphorylation d’eIF2α, ce qui suggère l’implication d’autres voies de signalisation qui seraient également contrôlées par GCN2. Le rôle et l’expression de GCN2 dans le système vasculaire pulmonaire restent inconnus. On peut cependant envisager qu’une réduction de l’activité de GCN2, en raison d’une réponse intégrée au stress alors défectueuse, puisse conduire à une augmentation de la vulnérabilité au stress oxydant et à une inflammation. Des travaux récents ont montré que GCN2 pourrait moduler l’activité de la voie dépendante de BMPR-II (
bone morphogenetic protein receptor type 2
), une voie de signalisation fortement impliquée dans la pathogenèse de l’HTAP [
18
].
Dysfonction endothéliale
Les facteurs initiaux déclencheurs de l’HTAP sont encore mal connus, mais ils auraient pour cible privilégiée la cellule endothéliale. Ces cellules sont directement exposées aux modifications de flux sanguin, d’oxygénation et de facteurs circulants, comme les cytokines, les hormones, ou les médicaments. Il est probable que les premiers effets sur ces cellules incluent une augmentation de leur apoptose entraînant une perturbation de la couche endothéliale et l’exposition de la couche musculaire lisse sous-jacente aux facteurs de croissance solubles et aux cytokines circulants [
5
]. Des modifications phénotypiques et épigénétiques dans la couche endothéliale entraînent également la libération, dans l’environnement vasculaire, de médiateurs qui peuvent favoriser la survie des cellules endothéliales environnantes, entraînant une prolifération déréglée et une néo-angiogenèse aberrante. On observe ainsi des modifications affectant la production de molécules vasoactives, telles que le NO, la prostacycline, l’endothéline-1 (ET-1) et la sérotonine, qui contribuent à la dysfonction endothéliale et à la vasoconstriction [
5
]. Les médiateurs libérés par les cellules endothéliales affectent également la membrane basale sous-jacente et la matrice extracellulaire environnante. Les altérations de composition et de quantités de matrice extracellulaire contribuent ainsi également à l’environnement local anormal dans les vaisseaux pulmonaires remodelés des patients présentant une HTAP.
Reprogrammation métabolique Dans cet environnement hyperprolifératif, on observe une reprogrammation métabolique qui favorise la croissance et la prolifération des cellules vasculaires. Les cellules musculaires lisses, isolées de vaisseaux pulmonaires de patients présentant une HTAP, ont en effet une glycolyse accrue en condition aérobie (ou effet Warburg). Cependant, cette augmentation de glycolyse ne suffit pas à répondre à l’ensemble des besoins métaboliques des cellules en train de proliférer. Ces cellules subissent donc une reprogrammation métabolique afin de répondre à leurs besoins élevés en énergie et en éléments constitutifs.
Le cycle de Krebs offre une source importante de substrats pour la biosynthèse des acides aminés, des glucides et des lipides. Dans les cellules en train de proliférer, l’activité soutenue du cycle de Krebs nécessite l’apport d’intermédiaires carbonés. L’anaplérose
5
permet de reconstituer les intermédiaires carbonés, par la carboxylation du pyruvate en oxaloacétate par la pyruvate carboxylase, et par la glutaminolyse (désamidation de la glutamine par la glutaminase) [
20
]. La pyruvate carboxylase joue un rôle majeur dans l’anaplérose et donc dans la régulation de la croissance et de la viabilité des cellules en train de proliférer dont le métabolisme a été modifié, de la phosphorylation oxydante à la glycolyse. Chez le rat, son inhibition empêche la reprogrammation métabolique des cellules et atténue le remodelage vasculaire pulmonaire dans l’HTP expérimentale [
20
].
Inflammation et auto-immunité
Bien que la présence de cellules inflammatoires périvasculaires et de structures lymphoïdes tertiaires (SLT ou TLS, pour
tertiary lymphoid structures
), génératrices d’auto-anticorps, à proximité des artères pulmonaires ait été décrite, et que l’augmentation de cytokines, de chimiokines pro-inflammatoires, et d’auto-anticorps dans le sang périphérique ait été signalée à plusieurs reprises, l’interprétation du rôle, la pertinence physiopathologique et l’importance mécanistique de ces caractéristiques inflammatoires et dysimmunitaires font encore l’objet de discussions enflammées [
12
]. Néanmoins, les mutations les plus importantes qui ont été associées à l’HTAP touchent des gènes qui jouent un rôle critique dans les mécanismes de régulation de la réponse immunitaire, en plus de leur importance dans l’homéostasie et dans la fonction vasculaires [
12
]. L’HTAP est associée à des troubles auto-immuns et immunitaires primaires, comme dans l’HTAP associée aux connectivites, au cours de laquelle l’HTP se développe dans un contexte pro-inflammatoire. Il apparaît ainsi, au moins dans ce contexte, qu’une thérapie anti-inflammatoire et/ou immunomodulatrice puisse réduire l’augmentation des pressions artérielles pulmonaires [
21
] (
→
).
(→) Voir la Synthèse de F. Perros
et al.
,
m/s
n° 6-7, juin-juillet 2013, page 607
Qu’elle soit d’origine infectieuse, auto-immune ou sans cause retrouvée, la présence d’une inflammation périvasculaire plus ou moins marquée est une constante des lésions pulmonaires caractéristiques de l’HTAP. Dans l’HTP sévère induite chez le rat par l’exposition à la monocrotaline, et dans les lésions d’HTAP chez l’homme, on observe, dans la paroi des artères pulmonaires affectées, un recrutement intense de cellules dendritiques, des cellules du système immunitaire inné en charge de programmer les lymphocytes T pour induire une réponse immunitaire adaptative [
22
]. Chez le rat, l’accumulation des cellules dendritiques dans les artères précède les altérations vasculaires et hémodynamiques, suggérant un rôle initiateur de ces cellules dans l’histoire de la maladie.
Dans de nombreuses maladies auto-immunes, le nombre de cellules dendritiques et leur degré de capacité à activer des lymphocytes T auto-réactifs sont accrus. Dans l’HTAP idiopathique, les cellules dendritiques, dérivées de monocytes, induisent une plus importante activation/prolifération des lymphocytes T CD4
+
, associée à leur polarisation en lymphocytes de type Th17 [
23
], une réponse immunitaire qui joue un rôle central dans la pathogenèse de nombreuses maladies inflammatoires à médiation auto-immune. On constate également une déplétion spécifique des lymphocytes T CD4
+
circulants, ce qui pourrait résulter de leur recrutement dans les structures lymphoïdes tertiaires pulmonaires où sont produits les auto-anticorps, comme cela a été décrit dans l’HTAP expérimentale mais aussi chez l’homme [
24
]. Dans l’HTAP idiopathique, les lymphocytes CD4
+
circulants produisent de fortes quantités d’IL-17 après activation [
23
]. Ces observations renforcent la suspicion d’une réponse de type Th17 pathologique dans l’HTAP, possiblement contrôlée par les cellules dendritiques. L’activation de la voie NF-κB (
nuclear factor-kappa beta
), une voie centrale de l’inflammation, de la réponse au stress, de la différenciation et de la prolifération des cellules dendritiques, par délétion de la protéine régulatrice de NF-κB, A20 (ou
TNF alpha-induced protein 3
), est suffisante pour induire chez la souris une HTP accompagnée d’une inflammation pulmonaire dépendante de l’IL(interleukine)-6 [
25
]. Cette découverte récente vient ainsi étayer le rôle central de l’activation des cellules dendritiques dans le processus de développement de l’HTAP. Une accumulation de différentes cellules immunitaires, y compris de cellules dendritiques, dans le cœur et, en particulier, dans le ventricule droit [
26
], est également observée dans ce modèle de la maladie, mais on ignore encore leur rôle dans le remodelage et la fonction cardiaques.
Dysfonctionnement ventriculaire droit
L’augmentation des RVP, due à l’obstruction artérielle pulmonaire, conduit à une surcharge du ventricule droit et, finalement, à une insuffisance ventriculaire droite qui constitue la principale cause de mortalité et de morbidité de l’HTAP. Le ventricule droit sain est une structure compliante, à paroi mince, dont la dilatation est rapide en présence d’une augmentation brutale de sa post-charge. L’HTP aboutit à l’hypertrophie ventriculaire droite, mais le délai d’apparition de l’insuffisance cardiaque droite est variable. Les mécanismes de constitution et de développement de la défaillance ventriculaire droite restent cependant à préciser. Chez le rat, les mutations du gène
BMPR2
compromettent la vascularisation pulmonaire, mais aussi la fonction et la structure cardiaques [
27
]. Un effet délétère de cette mutation est donc suspecté dans l’inadaptation du ventricule droit chez les porteurs développant la maladie. La réponse de ces patients aux traitements conventionnels reste également une question non résolue.
|
La classification en cinq groupes permet de regrouper les HTP ayant des mécanismes communs et une pris en charge similaire. La prise en charge de l’HTAP (groupe 1) repose sur des mesures générales et des traitements spécifiques, avec une stratégie thérapeutique dont l’objectif est de maintenir les patients avec un faible risque de mortalité à un an [
2
].
Les mesures générales La prise en charge de l’HTAP est complexe. Elle nécessite une approche multidisciplinaire. Les mesures générales font partie intégrante des soins donnés au patient. Elles comprennent de nombreuses composantes, incluant l’activité physique et la réhabilitation supervisées, la prise en charge de la rétention hydrosodée par un régime hyposodé et l’usage en combinaison des trois classes de diurétiques (diurétiques de l’anse, thiazidiques et antagonistes de l’aldostérone), l’oxygénothérapie en cas d’insuffisance respiratoire chronique sévère, la supplémentation en fer en cas d’anémie par carence martiale, la mise à jour des vaccinations (contre la grippe, l’infection par le pneumocoque et la Covid 19 [coronavirus disease 2019]) et une prise en charge psychosociale. Les traitements spécifiques de l’HTAP
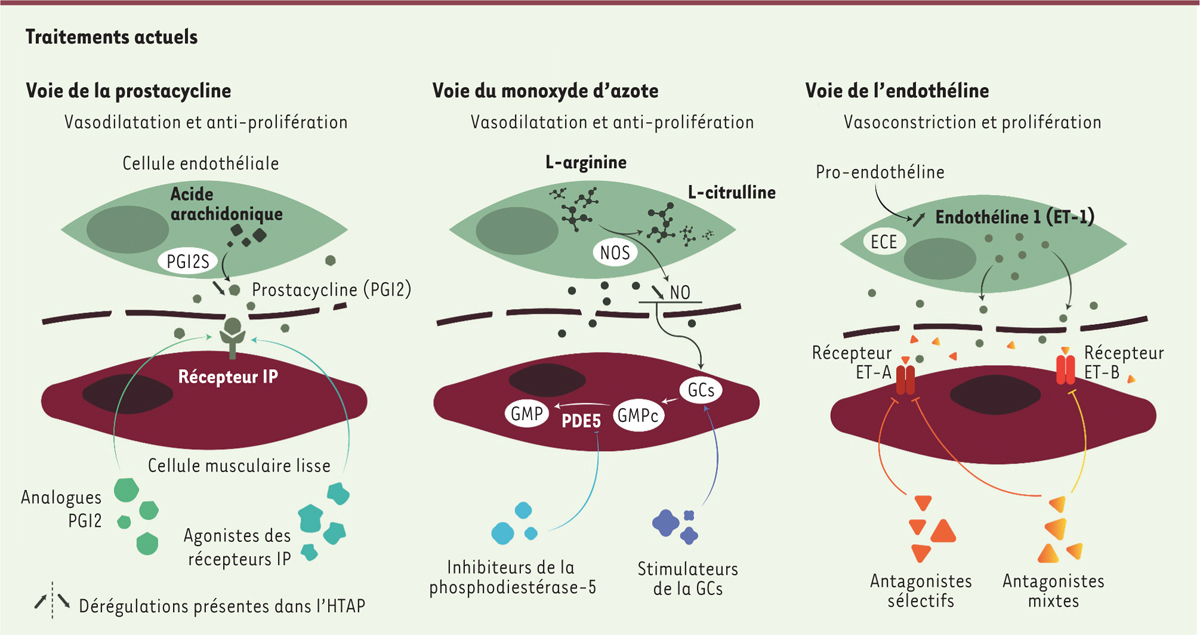
Les traitements médicamenteux de l’HTAP regroupent les antagonistes calciques (à fortes doses) réservés à certaines formes d’HTAP avec réponse au test de vasoréactivité aiguë, et des traitements « spécifiques » visant trois grandes voies de la dysfonction endothéliale
(
Figure 5
)
.
 | Figure 5.
Traitements spécifiques de l’HTAP.
PGI2S : synthase de la prostacycline (PGI2) ; IP : récepteur de la prostacycline ; NOS : synthase du monoxyde d’azote (NO) ; GCs : guanylate cyclase soluble ; GMP : guanosine monophosphate ; GMPc : guanosine monophosphate cyclique ; ECE : enzyme de conversion de l’endothéline ; ETA, ETB : récepteurs de types A et B de l’endothéline 1 (ET-1).
|
Les inhibiteurs calciques
Les inhibiteurs calciques à fortes doses sont réservés aux patients présentant une HTAP idiopathique, héritable ou induite par les médicaments, et ayant une réponse positive au test de vasoréactivité aiguë lors du cathétérisme cardiaque droit (soit moins de 10 % des formes d’HTAP idiopathique). La réponse positive au test prédit une réponse favorable à long terme aux inhibiteurs calciques dans ces formes d’HTAP et est associée à un pronostic favorable [
28
]. La réponse au test ne permet par contre pas de prédire une réponse aux inhibiteurs calciques dans les autres formes d’HTAP et les autres groupes d’HTP [
29
]. Les inhibiteurs calciques les plus utilisés sont la nifédipine, le diltiazem et l’amlodipine.
Les antagonistes des récepteurs de l’endothéline
L’endothéline 1 favorise la vasoconstriction et la prolifération des cellules musculaires lisses artérielles pulmonaires. Elle se fixe aux récepteurs A et B de l’endothéline (ETA et ETB) exprimés par les cellules musculaires lisses. La liaison de l’endothéline 1 à l’ETB, exprimé principalement à la surface des cellules endothéliales artérielles pulmonaires, entraîne une vasodilatation, par production accrue de prostacyclines. Le blocage sélectif des récepteurs ETA, ou non sélectif des deux récepteurs ETA et ETB, a montré une efficacité globalement similaire dans l’HTAP sur la classe fonctionnelle de la
New-York heart association
(NYHA), sur les capacités fonctionnelles à l’effort et sur le délai d’aggravation clinique [
30
]. Les antagonistes des récepteurs de l’endothéline (ARE) utilisés dans l’HTAP sont l’ambrisentan, antagoniste oral qui bloque préférentiellement les récepteurs ETA, le bosentan, un antagoniste des récepteurs ETA et ETB, et le macitentan, également un double antagoniste (indisponible en France).
Les inhibiteurs de la phosphodiestérase de type 5 et les stimulateurs de la guanylate cyclase
La stimulation de la guanylate cyclase soluble (GCs) par le NO entraîne la production de guanosine monophosphate cyclique (GMPc), qui agit comme un second messager intracellulaire. Le GMPc a un puissant effet vasodilatateur sur les artérioles pulmonaires. Sa production est contrôlée par une boucle de rétroaction négative entraînant sa dégradation
via
différentes phosphodiestérases, dont la phosphodiestérase de type 5 (PDE5) qui est présente dans la circulation artérielle pulmonaire. Les inhibiteurs de la phosphodiestérase 5 (ou IPDE5) et les stimulateurs de GCs agissent différemment sur la production de GMPc. Ils ne doivent donc pas être associés. Des essais randomisés ont montré l’efficacité des IPDE5 (sildénafil ou tadalafil) sur les symptômes, la capacité à l’effort et l’hémodynamique [
31
,
32
]. Les stimulateurs de GCs (comme le riociguat), initialement développés dans l’HTP thromboembolique chronique, ont aussi montré leur efficacité sur la capacité à l’exercice, l’hémodynamique et le délai d’aggravation clinique chez des patients ayant une HTAP déjà traitée par des antagonistes de récepteurs de l’endothéline ou par la prostacycline [
33
].
Les analogues de la prostacycline et les agonistes des récepteurs de la prostacycline
Dans l’HTAP, la voie de la prostacycline est dérégulée. La synthèse de prostacycline dans les artères pulmonaires est en effet diminuée, entraînant une réduction de la synthèse d’AMP cyclique, un second messager vasodilatateur. Les analogues de la prostacycline et les agonistes de son récepteur sont vasodilatateurs, antiagrégants plaquettaires et antiprolifératifs. L’utilisation de ces analogues est le traitement le plus efficace actuellement disponible dans l’HTAP. Leur courte demi-vie reste toutefois limitante et nécessite une administration par voie parentérale continue. L’époprosténol est administré par voie intra-veineuse, de façon continue
via
un cathéter central tunnelisé. Son efficacité a été montrée dans plusieurs essais randomisés contrôlés, avec un effet sur les symptômes, la capacité à l’exercice, l’hémodynamique et sur la mortalité des patients [
34
]. L’iloprost est, quant à lui, administré par voie inhalée sous la forme d’aérosols. Son efficacité clinique a été démontrée, même si cette forme d’administration reste moins efficace que celles par voies intraveineuse ou sous-cutanée continues [
35
]. Le tréprostinil est disponible en Europe et est injecté par voie sous-cutanée en continu. Il améliore la capacité à l’exercice, l’hémodynamique et les symptômes de la maladie [
36
]. La douleur au site de perfusion reste l’effet indésirable le plus fréquemment rapporté. Le selexipag est un agoniste sélectif du récepteur de la prostacycline. Il est disponible pour un traitement par voie orale et a conduit à une amélioration hémodynamique chez les patients non encore traités ou déjà traités par ARE [
37
].
Stratégie de prise en charge de l’HTAP L’HTAP doit être prise en charge par des centres experts, de façon multidisciplinaire. En cas d’HTAP idiopathique, héritable, associée aux toxiques ou aux connectivites, la décision de traitement dépend de la présence ou non de comorbidités cardiopulmonaires et de la stratification selon le risque de mortalité à un an (celle-ci reposant sur des critères cliniques, fonctionnels, d’imagerie et hémodynamiques). Dans les nouvelles recommandations, il est proposé une stratification en trois strates de risques au diagnostic et en quatre strates de risques à la réévaluation, en distinguant le risque intermédiaire en risque intermédiaire-bas et en risque intermédiaire-élevé, en raison de la différence de pronostic entre ces deux strates de risques. Les patients sans comorbidités cardiopulmonaires et à risque faible ou intermédiaire doivent donc être traités par une bithérapie orale, associant un ARE et un inhibiteur de PDE5. Chez les patients présentant un risque élevé, une trithérapie initiale, incluant un traitement par analogue de prostacycline par voie intra-veineuse ou sous-cutanée, est recommandée. Chez les patients présentant des comorbidités cardiorespiratoires, une monothérapie peut être proposée en première intention. Les patients nécessitent ensuite un suivi régulier, avec une stratification du risque et, avec, pour objectif, le maintien d’un faible risque de mortalité à un an. En cas de maladie veino-occlusive pulmonaire, les patients ont une moins bonne réponse aux traitements spécifiques de l’HTAP (avec un risque d’œdème pulmonaire) et un pronostic réservé en l’absence de transplantation pulmonaire. Le traitement est en général commencé par monothérapie orale, le patient devant être évalué précocement pour discuter la possibilité d’une transplantation pulmonaire. La transplantation pulmonaire
La transplantation pulmonaire est à envisager en cas d’HTAP réfractaire à un traitement médical optimal, ou en cas d’HTAP de mauvais pronostic, comme la maladie veino-occlusive pulmonaire. Actuellement, la plupart des patients reçoivent une transplantation bipulmonaire. La transplantation cœur-poumon est privilégiée en cas de maladie cardiaque associée non corrigible (en particulier les HTAP associées aux cardiopathies congénitales). Les résultats à long terme restent corrects, avec une survie médiane de 10 ans [
38
].
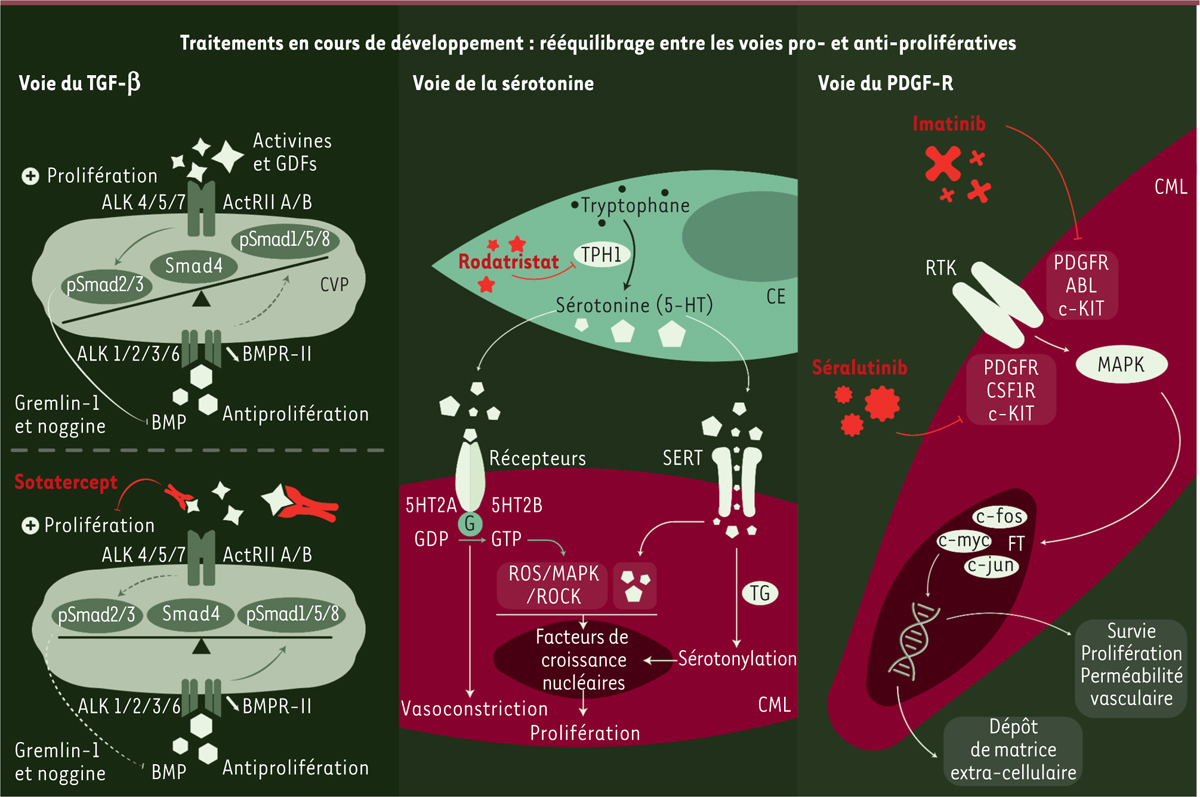
Les nouveaux traitements
Malgré l’amélioration du pronostic grâce aux traitements visant les trois voies de la dysfonction endothéliale, l’HTAP reste une maladie incurable, avec un taux de mortalité élevé. De nouveaux traitements sont en cours de développement avec l’objectif de cibler des mécanismes de la maladie différents en modulant préférentiellement le remodelage vasculaire pulmonaire. Les traitements les plus prometteurs visent les voies de signalisation associées aux récepteurs de la superfamille du TGF-β (
transforming growth factor beta
) ou les voies de la sérotonine et du PDGF (
platelet-derived growth factor
)
(
Figure 6
)
.
 | Figure 6.
Les nouveaux traitements de l’HTAP en développement clinique.
Les trois voies ciblées : TGF-b (
transforming growth factor beta
), sérotonine et PDGF-R (
platelet-derived growth factor receptor
). CVP : cellule vasculaire pulmonaire ; CE : cellule endothéliale ; CML : cellule musculaire lisse ; GDF :
growth-differentiating factor
; BMP :
bone morphogenetic proteins
; TPH1 : tryptophane hydroxylase 1 ; 5HT2A, 5HT2B : récepteurs de la sérotonine couplés aux protéines G (G) ; SERT : transporteur de la sérotonine ; TG : transglutaminase ; RTK : récepteur à activité tyrosine kinase ; récepteur du PDGF (PDGFR) ; CSF1R : récepteur du CSF-1 (
colony-stimulating factor 1
) ; c-KIT :
mast/stem cell growth factor receptor kit
; ABL : tyrosine kinase Abelson ; FT : facteurs de transcription ; MAPK :
mitogen-activated protein kinases
; ROS :
reactive oxygen species
; ROCK :
Rho-associated protein kinase
; ALK :
anaplastic lymphoma kinase.
|
Stratégie thérapeutique ciblant la superfamille du TGF-β
Les mutations du gène
BMPR2,
codant le récepteur BMPR-II (
bone morphogenetic protein receptor type II
), sont à l’origine de formes familiales ou sporadiques d’HTAP. BMPR-II est un récepteur de type II de la superfamille du TGF-β qui active les protéines Smad 1/5/8, ce qui limite la prolifération cellulaire dans les parois artérielles pulmonaires [
39
,
40
]. La perte de signalisation qui suit l’engagement du BMPR-II est partagée par l’ensemble des formes d’HTAP. Les tentatives de rétablir directement cette signalisation n’ont néanmoins pas conduit à un traitement efficace. Une stratégie alternative a été de bloquer la voie dépendant de l’activine, une glycoprotéine faisant partie de la famille du TGF-β, pour rétablir la voie de signalisation impliquant BMPR-II. Le sotatercept agit comme un piège, séquestrant les ligands de forte affinité du récepteur de type IIA de l’activine (ACTRIIA) [
41
,
42
] (
→
).
(→) Voir la Nouvelle de M. Humbert
et al.
,
m/s
n° 10, octobre 2021, page 839
Dans l’HTAP, une activation anormale de la voie de l’activine est très souvent associée à la perte de signalisation impliquant BMPR-II, ce qui favorise la prolifération cellulaire par l’activation des protéines Smad 2/3. Le sotatercept rétablit le frein à cette prolifération cellulaire et limite ainsi l’accumulation des cellules vasculaires dans les parois des petites artères pulmonaires
(
Figure 6
)
. Dans l’essai clinique de phase II PULSAR (NCT03496207), randomisé, en double aveugle, réalisé chez des patients présentant une HTAP en classe fonctionnelle NYHA II ou II et déjà traités [
43
], une baisse significative des RVP à 24 semaines (ce qui représentait le critère de jugement principal de l’étude) a été observée dans le groupe traité par sotatercept, de même qu’une amélioration du test de marche de six minutes, et qu’une diminution du NT-proBNP
6
. Les effets indésirables les plus fréquents ont été une thrombocytopénie et une polyglobulie, pouvant nécessiter une adaptation des doses de médicament administrées. Les résultats de la phase ouverte de l’étude PULSAR (NCT03496207) ont confirmé les données de sécurité et démontré une efficacité clinique persistante, fonctionnelle, biologique et hémodynamique [
44
]. Un essai clinique de phase III, l’étude STELLAR (NCT04576988), a confirmé l’efficacité et la tolérance du traitement, en association avec les traitements habituels. D’autres essais de phase III, en cours, visent à évaluer l’efficacité du sotatercept dans différentes indications d’HTAP et des formes d’HTP (étude ZENITH, NCT04896008 ; étude HYPERION, NCT04811092 ; étude CADENCE, NCT04945460) [
45
]. Les prochaines étapes permettront de préciser la place du sotatercept dans l’algorithme thérapeutique actuel, d’évaluer son efficacité dans des formes spécifiques d’HTAP non incluses dans les premiers essais cliniques, et d’identifier des biomarqueurs prédictifs de réponse au traitement, ce qui permettra de s’orienter vers une médecine de précision.
Stratégie thérapeutique ciblant la voie de la sérotonine
Les données concernant les HTAP secondaires à des expositions médicamenteuses et drogues associées à des dérivés de la sérotonine (ou 5-hydroxytryptamine, 5-HT), et les observations obtenues dans les modèles animaux, ont conduit à la réalisation d’essais thérapeutiques utilisant des inhibiteurs de recapture de la 5-HT, sans toutefois démontrer leur efficacité thérapeutique. Une approche différente a donc été proposée. Celle-ci visait à limiter la production de 5-HT en inhibant la tryptophane hydroxylase-1 (TPH-1), l’enzyme limitante de la synthèse de 5-HT
7
, par le rodatristat (administré par voie inhalée). L’essai ELEVATE 2 (NCT04712669), en cours de recrutement, examine l’effet du rodatristat sur les résistances vasculaires pulmonaires à six mois dans une étude randomisée, multicentrique de phase II, en double aveugle, chez des patients souffrant d’HTAP traités par mono-, bi- ou tri-thérapie.
Stratégie thérapeutique ciblant la voie du PDGF
L’inhibition de la voie de signalisation du PDGF (
platelet-derived growth factor
) par des inhibiteurs de son récepteur tyrosine kinase, comme l’imatinib, avait suscité de l’espoir pour le traitement de l’HTAP il y a une quinzaine d’années. Néanmoins, l’essai IMPRES (essai randomisé en double aveugle contre placebo) avait montré en 2013 un rapport bénéfice-risque défavorable pour ces molécules [
46
]. Afin de limiter les risques d’effets secondaires systémiques, de nouvelles études ont été initiées pour examiner l’efficacité d’une administration par inhalation de ces inhibiteurs. Un essai clinique de phase II (étude TORREY, NCT04456998), visant à évaluer l’efficacité et la tolérance du séralutinib inhalé (inhibiteur de tyrosine kinase ciblant plus spécifiquement le récepteur du PDGF, le récepteur du CSF-1 [
colony-stimulating factor 1
] et c-kit) a été débuté en 2022. Il révèle que le séralutinib pourrait également augmenter l’expression de BMPR-II [
47
]. Les résultats, en cours de publication, viennent d’être rendus publics. Ils montrent une diminution statistiquement significative des résistances vasculaires pulmonaires dans le groupe traité (critère de jugement principal), mais sans amélioration du test de marche de 6 minutes. Un essai clinique de phase IIb/III est également en cours (IMPAHCT, NCT05036135). Il vise à évaluer l’efficacité de l’imatinib inhalé sur les résistances vasculaires pulmonaires (phase IIb), et sur le test de marche (phase III).
|
L’HTAP est une maladie rare et sévère pour laquelle sont néanmoins disponibles des thérapies spécifiques qui améliorent la qualité de vie des patients, les symptômes et le pronostic de la maladie. Ces thérapies ciblent la dysfonction endothéliale caractéristique de la maladie et ont une action essentiellement vasodilatatrice. En cas d’échec de ces traitements, une transplantation pulmonaire est envisagée. Mettant à profit les connaissances sur la génétique de l’HTAP, et sur les bases cellulaires et moléculaires du remodelage vasculaire à l’origine de la maladie, de nouveaux traitements sont en développement avec pour but de rééquilibrer la balance entre les voies pro- et anti-prolifératives. Des recommandations internationales, mises à jour régulièrement, aident à la prise en charge de ces patients. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Humbert
M
,
Kovacs
G
,
Hoeper
MM
,
et al
.
2022 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension.
.
Eur Heart J.
2022
;
:ehac237.
.
2.
Humbert
M
,
Kovacs
G
,
Hoeper
MM
,
et al
.
2022 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension.
.
Eur Respir J.
2022
;
:2200879.
.
3.
Hoeper
MM
,
Humbert
M
.
The new haemodynamic definition of pulmonary hypertension: evidence prevails, finally!
.
Eur Respir J.
2019;
;
53
:
:1900038.
.
4.
Maron
BA
,
Brittain
EL
,
Hess
E
,
et al
.
Pulmonary vascular resistance and clinical outcomes in patients with pulmonary hypertension: a retrospective cohort study.
.
Lancet Respir Med.
2020;
;
8
:
:873.
–
84
.
5.
Humbert
M
,
Guignabert
C
,
Bonnet
S
,
et al.
Pathology and pathobiology of pulmonary hypertension: state of the art and research perspectives.
.
Eur Respir J.
2019;
;
53
:
:1801887.
.
6.
Lau
EMT
,
Giannoulatou
E
,
Celermajer
DS
,
et al.
Epidemiology and treatment of pulmonary arterial hypertension.
.
Nat Rev Cardiol.
2017;
;
14
:
:603.
–
614
.
7.
Weatherald
J
,
Chaumais
M-C
,
Savale
L
,
et al.
Long-term outcomes of dasatinib-induced pulmonary arterial hypertension: a population-based study.
.
Eur Respir J.
2017;
;
50
:
:1700217.
.
8.
Savale
L
,
Chaumais
M-C
,
Cottin
V
,
et al.
Pulmonary hypertension associated with benfluorex exposure.
.
Eur Respir J.
2012;
;
40
:
:1164.
–
1172
.
9.
Abenhaim
L
,
Moride
Y
,
Brenot
F
,
et al.
Appetite-suppressant drugs and the risk of primary pulmonary hypertension. International Primary Pulmonary Hypertension Study Group.
.
N Engl J Med.
1996;
;
335
:
:609.
–
616
.
10.
Montani
D
,
Lau
EM
,
Descatha
A
,
et al.
Occupational exposure to organic solvents: a risk factor for pulmonary veno-occlusive disease.
.
Eur Respir J.
2015;
;
46
:
:1721.
–
1731
.
11.
Montani
D
,
Lau
EM
,
Dorfmüller
P
,
et al.
Pulmonary veno-occlusive disease.
.
Eur Respir J.
2016;
;
47
:
:1518.
–
1534
.
12.
Perros
F
,
Humbert
M
,
Dorfmüller
P
.
Smouldering fire or conflagration? An illustrated update on the concept of inflammation in pulmonary arterial hypertension.
.
Eur Respir Rev.
2021;
;
30
:
:210161.
.
13.
Ranchoux
B
,
Antigny
F
,
Rucker-Martin
C
,
et al.
Endothelial-to-mesenchymal transition in pulmonary hypertension.
.
Circulation.
2015;
;
131
:
:1006.
–
1018
.
14.
Ranchoux
B
,
Günther
S
,
Quarck
R
,
et al.
Chemotherapy-induced pulmonary hypertension: role of alkylating agents.
.
Am J Pathol.
2015;
;
185
:
:356.
–
371
.
15.
Perros
F
,
Günther
S
,
Ranchoux
B
,
et al.
Mitomycin-Induced Pulmonary Veno-Occlusive Disease: Evidence From Human Disease and Animal Models.
.
Circulation.
2015;
;
132
:
:834.
–
847
.
16.
Caliez
J
,
Riou
M
,
Manaud
G
,
et al
.
Trichloroethylene increases pulmonary endothelial permeability: implication for pulmonary veno-occlusive disease.
.
Pulm Circ.
2020;
;
10
:
:2045894020907884.
.
17.
Nossent
EJ
,
Antigny
F
,
Montani
D
,
et al.
Pulmonary vascular remodeling patterns and expression of general control nonderepressible 2 (GCN2) in pulmonary veno-occlusive disease.
.
J Heart Lung Transplant.
2018;
;
37
:
:647.
–
655
.
18.
Manaud
G
,
Nossent
EJ
,
Lambert
M
,
et al
.
Comparison of Human and Experimental Pulmonary Veno-Occlusive Disease.
.
Am J Respir Cell Mol Biol.
2020;
;
63
:
:118.
–
31
.
19.
Santos-Ribeiro
D
,
Godinas
L
,
Pilette
C
,
et al.
The integrated stress response system in cardiovascular disease.
.
Drug Discov Today.
2018;
;
23
:
:920.
–
929
.
20.
Valuparampil Varghese
M
,
James
J
,
Eccles
CA
,
et al
.
Inhibition of Anaplerosis Attenuated Vascular Proliferation in Pulmonary Arterial Hypertension.
.
J Clin Med.
2020;
;
9
:
:E443.
.
21.
Perros
F
,
Humbert
M
,
Cohen-Kaminsky
S
Hypertension artérielle pulmonaire.
.
Un parfum d’auto-immunité. Med Sci (Paris).
2013;
;
29
:
:607.
–
616
.
22.
Perros
F
,
Dorfmüller
P
,
Souza
R
,
et al.
Dendritic cell recruitment in lesions of human and experimental pulmonary hypertension.
.
Eur Respir J.
2007;
;
29
:
:462.
–
468
.
23.
Hautefort
A
,
Girerd
B
,
Montani
D
,
et al.
T-helper 17 cell polarization in pulmonary arterial hypertension.
.
Chest.
2015;
;
147
:
:1610.
–
1620
.
24.
Perros
F
,
Dorfmüller
P
,
Montani
D
,
et al.
Pulmonary lymphoid neogenesis in idiopathic pulmonary arterial hypertension.
.
Am J Respir Crit Care Med.
2012;
;
185
:
:311.
–
321
.
25.
Koudstaal
T
,
van Hulst
JAC
,
Das
T
,
et al
.
DNGR1-Cre-mediated Deletion of Tnfaip3/A20 in Conventional Dendritic Cells Induces Pulmonary Hypertension in Mice.
.
Am J Respir Cell Mol Biol.
2020;
;
63
:
:665.
–
80
.
26.
van Uden
D
,
Koudstaal
T
,
van Hulst
JAC
,
et al
.
Central Role of Dendritic Cells in Pulmonary Arterial Hypertension in Human and Mice.
.
Int J Mol Sci.
2021;
;
22
:
:1756.
.
27.
Hautefort
A
,
Mendes-Ferreira
P
,
Sabourin
J
,
et al.
Bmpr2 Mutant Rats Develop Pulmonary and Cardiac Characteristics of Pulmonary Arterial Hypertension.
.
Circulation.
2019;
;
139
:
:932.
–
948
.
28.
Sitbon
O
,
Humbert
M
,
Jaïs
X
,
et al.
Long-term response to calcium channel blockers in idiopathic pulmonary arterial hypertension.
.
Circulation.
2005;
;
111
:
:3105.
–
3111
.
29.
Montani
D
,
Savale
L
,
Natali
D
,
et al.
Long-term response to calcium-channel blockers in non-idiopathic pulmonary arterial hypertension.
.
Eur Heart J.
2010;
;
31
:
:1898.
–
1907
.
30.
Clozel
M
,
Maresta
A
,
Humbert
M
.
Endothelin receptor antagonists.
.
Handb Exp Pharmacol.
2013;
;
218
:
:199.
–
227
.
31.
Galiè
N
,
Ghofrani
HA
,
Torbicki
A
,
et al.
Sildenafil citrate therapy for pulmonary arterial hypertension.
.
N Engl J Med.
2005;
;
353
:
:2148.
–
2157
.
32.
Galiè
N
,
Brundage
BH
,
Ghofrani
HA
,
et al.
Tadalafil therapy for pulmonary arterial hypertension.
.
Circulation.
2009;
;
119
:
:2894.
–
2903
.
33.
Ghofrani
H-A
,
Galiè
N
,
Grimminger
F
,
et al.
Riociguat for the treatment of pulmonary arterial hypertension.
.
N Engl J Med.
2013;
;
369
:
:330.
–
340
.
34.
Rubin
LJ
,
Mendoza
J
,
Hood
M
,
et al.
Treatment of primary pulmonary hypertension with continuous intravenous prostacyclin (epoprostenol). Results of a randomized trial.
.
Ann Intern Med.
1990;
;
112
:
:485.
–
491
.
35.
Olschewski
H
,
Simonneau
G
,
Galiè
N
,
et al.
Inhaled iloprost for severe pulmonary hypertension.
.
N Engl J Med.
2002;
;
347
:
:322.
–
329
.
36.
Simonneau
G
,
Barst
RJ
,
Galie
N
,
et al.
Continuous subcutaneous infusion of treprostinil, a prostacyclin analogue, in patients with pulmonary arterial hypertension: a double-blind, randomized, placebo-controlled trial.
.
Am J Respir Crit Care Med.
2002;
;
165
:
:800.
–
804
.
37.
Simonneau
G
,
Torbicki
A
,
Hoeper
MM
,
et al.
Selexipag: an oral, selective prostacyclin receptor agonist for the treatment of pulmonary arterial hypertension.
.
Eur Respir J.
2012;
;
40
:
:874.
–
880
.
38.
Yusen
RD
,
Edwards
LB
,
Kucheryavaya
AY
,
et al.
The Registry of the International Society for Heart and Lung Transplantation: Thirty-second Official Adult Lung and Heart-Lung Transplantation Report–2015; Focus Theme: Early Graft Failure.
.
J Heart Lung Transplant.
2015;
;
34
:
:1264.
–
1277
.
39.
Long
L
,
Ormiston
ML
,
Yang
X
,
et al.
Selective enhancement of endothelial BMPR-II with BMP9 reverses pulmonary arterial hypertension.
.
Nat Med.
2015;
;
21
:
:777.
–
785
.
40.
Morrell
NW
,
Aldred
MA
,
Chung
WK
,
et al.
Genetics and genomics of pulmonary arterial hypertension.
.
Eur Respir J.
2019;
;
53
:
:1801899.
.
41.
Humbert
M
,
Montani
D
,
Savale
L
,
et al
.
Cibler les ligands du récepteur de l’activine de type IIA pour traiter l’hypertension artérielle pulmonaire.
.
Med Sci (Paris).
2021;
;
37
:
:839.
–
43
.
42.
Guignabert
C
,
Humbert
M
.
Targeting transforming growth factor-β receptors in pulmonary hypertension.
.
Eur Respir J.
2021;
;
57
:
:2002341.
.
43.
Humbert
M
,
McLaughlin
V
,
Gibbs
JSR
,
et al
.
Sotatercept for the Treatment of Pulmonary Arterial Hypertension.
.
N Engl J Med.
2021;
;
384
:
:1204.
–
15
.
44.
Humbert
M
,
McLaughlin
V
,
Gibbs
JSR
,
et al
.
Sotatercept for the treatment of pulmonary arterial hypertension: PULSAR open-label extension.
.
Eur Respir J.
2023;
;
61
:
:2201347.
.
45.
Hoeper
MM
,
Badesch
DB
,
Ghofrani
HA
,
et al
.
Phase 3 Trial of sotatercept for treatment of pulmonary arterial hypertension.
.
N Engl J Med.
2023
Mar 6;
. doi:
10.1056/NEJMoa2213558
.
46.
Hoeper
MM
,
Barst
RJ
,
Bourge
RC
,
et al.
Imatinib mesylate as add-on therapy for pulmonary arterial hypertension: results of the randomized IMPRES study.
.
Circulation.
2013;
;
127
:
:1128.
–
1138
.
47.
Galkin
A
,
Sitapara
R
,
Clemons
B
,
et al
.
Inhaled seralutinib exhibits potent efficacy in models of pulmonary arterial hypertension.
.
Eur Respir J.
2022;
;
60
:
:2102356.
.
|