| |
| Med Sci (Paris). 39(4): 395–397. doi: 10.1051/medsci/2023047.Les virus à ARN Nipah et de la rougeole activent une voie alternative de signalisation : cGAS-STING Marlène Chemarin,1,2* Antonin Chenel,3** and Albane Knoche3,4*** 1École normale supérieure de Lyon, département de biologie, Master Biosciences Santé
,
Lyon
,
France 2Université Claude Bernard Lyon 1, faculté de médecine Lyon Est
,
Lyon
,
France 3École normale supérieure de Lyon, département de biologie, Master Biosciences
,
Lyon
,
France 4École polytechnique fédérale de Lausanne, faculté des sciences de la vie, Master Ingénierie des sciences du vivant
,
Lausanne
,
Suisse MeSH keywords: Humains, Virus de la rougeole, Transduction du signal, Nucleotidyltransferases, Rougeole, Immunité innée |
Le virus Nipah est un virus zoonotique enveloppé à ARN simple brin appartenant à la famille des
Paramyxoviridae
. Ce virus, découvert à la fin des années 1990 est responsable d’épidémies mortelles en Asie du Sud et du Sud-Est [
1
]. Sa transmission peut se faire directement de la chauve-souris, son réservoir, à l’homme (
via
l’ingestion de fruits contaminés) ou indirectement, par l’infection d’hôtes intermédiaires tels que les porcs ou les chevaux [
2
]. La transmission interhumaine est également possible [
2
]. L’infection de l’homme par le virus Nipah se manifeste en premier lieu par des symptômes grippaux. Puis, de par son tropisme pour les cellules endothéliales, il entraîne des affections respiratoires (souche NiV-B au Bangladesh et en Inde) ou neurologiques de type encéphalites (souche NiV-M en Malaisie) [
1
]. Au cours des épidémies, la mortalité est extrêmement élevée (entre 40 et 100 %), principalement en raison de l’absence de vaccin et de traitements efficaces [
2
]. Ainsi, l’Organisation mondiale de la santé catégorise le virus Nipah comme un « pathogène de priorité » (
priority pathogen
).
Les cellules humaines possèdent différents moyens de défenses intracellulaires pour lutter contre les infections virales. En premier lieu, les virus à ARN sont reconnus par des récepteurs de reconnaissance de motifs (
pattern recognition receptors
). Ceux-ci activent trois principales voies de signalisation, la voie de MAVS
(mitochondrial antiviral-signaling protein
) induite par la reconnaissance cytosolique de l’ARN viral, et celles de TRIF (
TIR domain-containing adaptor-inducing interferon-
β) et de MyD88 (
myeloid differentiation primary response 88
), toutes deux découlant de la reconnaissance endosomale de l’ARN viral [
3
].
In fine
, ces trois voies induisent l’activation de deux facteurs de transcription (NF-kB et IRF) permettant, entre autres, la production d’interféron (IFN) de type I [
4
]. Ce dernier agit localement, par effets autocrine et paracrine, en se liant à son récepteur IFNAR (
type 1 IFN alpha/beta receptor
) [
5
], ce qui déclenche la voie JAK-STAT. L’activation canonique de cette dernière conduit au contrôle viral et à la résolution de l’infection. Néanmoins, la synergie des trois voies de signalisation MAVS, TRIF et MyD88 ne suffit pas à une activation optimale [
6
].
Récemment, une nouvelle voie de signalisation en réponse aux virus à ARN a été découverte, il s’agit de la voie cGAS-STING [
7
]. Initialement connue pour induire une réponse interféron suite à la détection d’ADN cytosolique (provenant entre autres du noyau, des mitochondries, ou de virus à ADN) [
8
], il a été démontré que cette voie est activée par certains virus à ARN, comme c’est le cas de celui de la dengue [
7
].
Iampietro
et al.
ont identifié la voie cGAS-STING comme composant essentiel de la réponse antivirale suite à l’infection par les virus Nipah ou de la rougeole [
9
]. Dans cette étude, le virus de la rougeole, qui appartient à la même famille que le virus Nipah et qui possède les mêmes mécanismes d’adhérence cellulaire que celui-ci [
1
] a été utilisé comme modèle en complément du virus Nipah, car sa manipulation ne nécessite pas des conditions de confinement aussi strictes que pour le virus Nipah (niveau de sécurité biologique 2 pour le virus de la rougeole contre 4 pour le virus Nipah).
|
La synergie des voies MyD88, TRIF, MAVS et cGAS-STING protège contre l’infection par le virus Nipah
in vivo
chez la souris
Afin d’identifier les voies de signalisation anti-virales du virus Nipah, les auteurs ont généré des souris déficientes par
knock-out
(KO) pour une ou plusieurs de ces voies de signalisation, ainsi que des souris déficientes pour le récepteur de l’interféron IFNAR, comme contrôle positif de l’absence de réponse à l’infection virale. Après infection par le virus Nipah, ils ont observé que les souris ne disposent plus des voies MyD88, TRIF et MAVS (triple KO) ont une mortalité de 40 % après 20 jours d’infection. Remarquablement, les souris dépourvues des voies MyD88, TRIF, MAVS et cGAS-STING (quadruple KO) ont une mortalité de 100 % seulement après 11 jours d’infection, ce qui suggère un rôle synergique et non redondant de STING avec les autres voies dans le contrôle de l’infection par le virus Nipah. Par analyse immunohistochimique et analyse des lysats cellulaires des tissus cérébraux de souris, ils ont montré par ailleurs que les souris triple KO, quadruple KO et
Ifnar-1
KO ont la même quantité de nucléoprotéines et d’ARN codant ces nucléoprotéines. Cependant, les auteurs mettent en évidence un taux plus élevé de virus dans la rate des souris quadruple KO contrairement aux souris triple KO, ce qui suggère un éventuel rôle de cGAS-STING dans la clairance virale.
|
La voie cGAS-STING participe à l’élaboration de la réponse interféron suite à l’infection par
un paramyxovirus
Les auteurs se sont ensuite intéressés au rôle de la voie cGAS-STING dans l’expression et la libération d’IFN en réponse à l’infection par le virus Nipah. Pour ce faire, ils ont infecté des cellules primaires de souris, les fibroblastes embryonnaires primaires (pMEF), ainsi que les cellules d’une lignée cellulaire monocytaire humaine, les cellules THP-1, toutes ayant une déficience en un ou plusieurs gènes des quatre voies de signalisation. L’abolition de STING par KO au sein des pMEF induit une nette diminution de l’expression des IFN de type I (IFN-α et IFN-β), ainsi qu’une augmentation de charge virale caractérisée par une augmentation de l’ARN viral dans les lysats cellulaires. De même, dans les cellules THP-1, l’abolition de cGAS ou de STING par KO ou par des molécules inhibitrices, diminue l’expression d’IFN-α et d’IFN-β dans les cellules, ainsi que leur capacité à contrôler l’infection par le virus Nipah ou par celui de la rougeole. Ainsi, lors d’une infection par un
paramyxovirus
, l’activation de la voie cGAS-STING et la production d’IFN participeraient au contrôle de l’infection virale.
|
Le virus Nipah active la voie cGAS-STING de manière conventionnelle
Les auteurs ont étudié les marqueurs classiques de l’activation de la voie cGAS-STING, la phosphorylation de STING au niveau de la sérine 366 (S366) et l’ubiquitination de la lysine 63 (K63). Dans un premier temps, ils ont montré en utilisant les cellules de deux lignées cellulaires humaines, des cellules endothéliales microvasculaires pulmonaires et les cellules THP-1, que la phosphorylation S366 et l’ubiquitination K63 de STING ont lieu uniquement en présence de cGAS. Puis, ils ont démontré que l’invalidation des gènes
MYD88
,
TICAM1
(codant TRIF) ou
MAVS
n’impacte pas l’activation de STING. Cela signifie que, lors d’une infection par le virus Nipah, cGAS, pourtant senseur d’ADN cytosolique, serait le seul activateur de STING.
|
Dans leur étude, Iampietro
et al.
ont démontré l’activation de la voie cGAS-STING au cours d’une infection par un
paramyxovirus
, ainsi que l’importance de son activation dans la lutte contre cette infection
via
l’activation de la voie interféron. Le caractère non redondant de cGAS-STING souligne son importance dans le contrôle des infections par les virus à ARN par rapport aux voies déjà connues (MyD88, MAVS, TRIF)
(
Figure 1
)
.
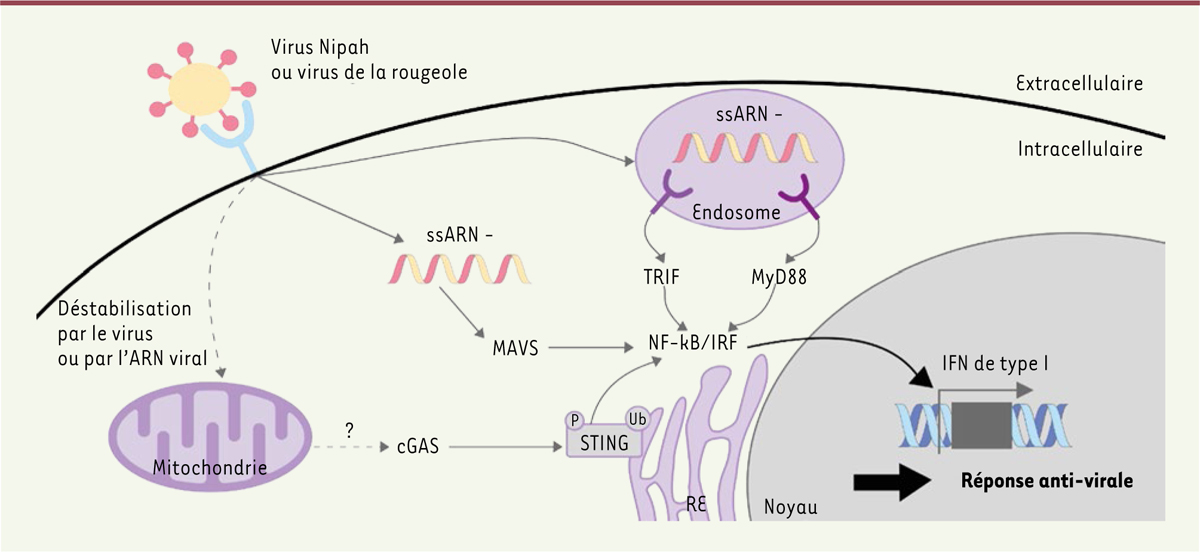
 | Figure 1.
Schéma récapitulatif de l’induction de la réponse interféron de type I par les virus à ARN Nipah et de la rougeole.
L’expression de l’interféron de type I, cytokine connue pour son rôle antiviral, passe par trois voies de signalisation classiques de la réponse aux virus à ARN : TRIF, MAVS et MyD88. A ces trois voies s’ajouterait la voie cGAS-STING, connue pour être activée par de l’ADN cytoplasmique. Les pointillés représentent une hypothèse de stimulation du senseur cGAS par déstabilisation des mitochondries.
IFN : Interferon, IRF : Interferon Regulatory Factors, NF-
κ
B : Nuclear Factor-
κ
B, MAVS : Mitochondrial Antiviral-Signaling protein, MyD88 : Myeloid Differentiation primary response 88, P : Phosphorylation, RE : Réticulum Endoplasmique, STING : Stimulator of Interferon Genes, TRIF : TIR domain-containing adaptor-inducing interferon-
β
, Ub : ubiquitination ; cGAS : cyclic GMP-AMP synthase.
|
Des recherches sont en cours afin d’élucider les mécanismes d’activation de la voie cGAS-STING lors de l’infection par les
paramyxovirus
tels que le virus Nipah et le virus de la rougeole. En effet, cGAS était connu jusqu’ici comme étant un senseur de l’ADN cytosolique grâce à son interaction avec le sucre-phosphate du squelette d’un double brin d’ADN [
8
]. Une hypothèse possible serait donc que l’infection par les
paramyxovirus
conduise à une détection de l’ADN mitochondrial dans le cytosol après une perte de stabilité des mitochondries faisant suite à l’infection [
10
]
(
Figure 1
)
.
L’identification de tous les acteurs conduisant à la libération d’IFN de type I, dont le rôle antiviral est avéré dans l’infection par le virus Nipah, peut conduire à l’élaboration ou au repositionnement de thérapeutiques existantes. Avec un objectif de stimulation de la voie de l’IFN, des analogues d’ARN double brin ont été testés dans un modèle de hamsters infectés par le virus Nipah ; ils améliorent nettement leur survie [
11
]. La récente découverte du rôle de la voie cGAS-STING dans la réponse IFN suite à une infection par le virus Nipah ouvre la voie au développement d’analogues de STING dans la lutte contre ce pathogène.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Hauser
N
,
Gushiken
AC
,
Narayanan
S
,
et al
.
Evolution of Nipah Virus Infection: Past, Present, and Future Considerations.
.
Trop Med Infect Dis.
2021;
;
6
:
:24.
.
2.
Ang
BSP
,
Lim
TCC
,
Wang
L
.
Nipah Virus Infection.
.
J Clin Microbiol.
2018;
;
56
:
:e01875.
–
e01817
.
3.
Thompson
MR
,
Kaminski
JJ
,
Kurt-Jones
EA
,
et al.
Pattern recognition receptors and the innate immune response to viral infection.
.
Viruses.
2011;
;
3
:
:920.
–
940
.
4.
Isaacs
A
,
Lindenmann
J
.
Virus interference. I. The interferon.
.
Proc R Soc Lond B Biol Sci.
1957;
;
147
:
:258.
–
267
.
5.
Theofilopoulos
AN
,
Baccala
R
,
Beutler
B
,
et al.
Type I interferons (alpha/beta) in immunity and autoimmunity.
.
Annu Rev Immunol.
2005;
;
23
:
:307.
–
336
.
6.
Iampietro
M
,
Aurine
N
,
Dhondt
KP
,
et al
.
Control of Nipah Virus Infection in Mice by the Host Adaptors Mitochondrial Antiviral Signaling Protein (MAVS) and Myeloid Differentiation Primary Response 88 (MyD88).
.
J Infect Dis.
2020;
;
221
:
:S401.
–
6
.
7.
Aguirre
S
,
Luthra
P
,
Sanchez-Aparicio
MT
,
et al.
Dengue virus NS2B protein targets cGAS for degradation and prevents mitochondrial DNA sensing during infection.
.
Nat Microbiol.
2017;
;
2
:
:17037.
.
8.
Sun
L
,
Wu
J
,
Du
F
,
et al.
Cyclic GMP-AMP Synthase Is a Cytosolic DNA Sensor That Activates the Type I Interferon Pathway.
.
Science.
2013;
;
339
:
:786.
–
791
.
9.
Iampietro
M
,
Dumont
C
,
Mathieu
C
,
et al
.
Activation of cGAS/STING pathway upon paramyxovirus infection.
.
iScience.
2021;
;
24
:
:102519.
.
10.
Aarreberg
LD
,
Esser-Nobis
K
,
Driscoll
C
,
et al.
Interleukin-1β Induces mtDNA Release to Activate Innate Immune Signaling via cGAS-STING.
.
Mol Cell.
2019;
;
74
:
:801.
–
815
.
11.
Georges-Courbot
MC
,
Contamin
H
,
Faure
C
,
et al.
Poly(I)-Poly(C12U) but Not Ribavirin Prevents Death in a Hamster Model of Nipah Virus Infection.
.
Antimicrob Agents Chemother.
2006;
;
50
:
:1768.
–
1772
.
|