| |
| Med Sci (Paris). 39(4): 397–399. doi: 10.1051/medsci/2023048.Les IFITM de mammifères face au VIH : comment mieux comprendre leurs mécanismes antiviraux Amandine Chantharath,1* Alicia Demonti,1** and Amélie Maurel1*** 1École normale supérieure de Lyon, département de biologie, Master Biosciences
,
Lyon
,
France MeSH keywords: Animaux, Humains, Antiviraux, Cellules HeLa, Protéines membranaires, Mammifères, Infections à VIH, Antigènes de différenciation, Pénétration virale |
Les facteurs de restriction sont des protéines cellulaires capables de freiner la réplication et la propagation d’un virus en interagissant directement avec des protéines virales. Différentes étapes du cycle viral peuvent être affectées par les facteurs de restriction : l’entrée dans la cellule, la décapsidation, la transcription, la traduction, l’assemblage, ainsi que la sortie du virus [
1
].
La famille de protéines IFITM (
interferon-induced transmembrane proteins
) est composée de facteurs de restriction agissant sur un large spectre de virus, dont le virus de l’immunodéficience humaine (VIH). Exprimés de manière basale dans la plupart des cellules humaines, la surexpression des IFITM est stimulée par les interférons lors de la réponse immunitaire antivirale [
2
]. Les IFITM sont principalement localisés au niveau des membranes plasmiques et lysosomales, qu’ils rigidifient et stabilisent [
3
,
4
].
Via
leur insertion dans les membranes cellulaires, certains IFITM peuvent empêcher la fusion avec l’enveloppe virale et ainsi bloquer l’entrée du virus dans la cellule hôte. Par ailleurs, en s’insérant au niveau de l’enveloppe virale, lors du bourgeonnement des virions, certains IFITM diminuent l’infectiosité de ces particules virales en réduisant leur capacité à fusionner avec d’autres cellules cibles [
5
].
Les IFITM sont présents dans de nombreuses espèces, y compris chez l’homme, les souris et les poissons. Cependant, le nombre de gènes
IFITM
varie d’une espèce à l’autre. Ce nombre est influencé par les processus de duplication et de perte de gènes au cours de l’évolution. Certaines espèces peuvent avoir perdu des gènes
IFITM
au fil du temps, tandis que d’autres peuvent en avoir gagné de nouveaux par duplication de gènes existants. Chez l’homme, on retrouve les IFITM 1, 2 et 3 dont les mécanismes antiviraux sont distincts [
6
,
7
]. Une étude récente de Marziali
et al.
analyse la diversité naturelle d’IFITM de mammifères afin d’identifier des déterminants moléculaires importants dans leur activité anti-VIH [
8
]. Pour cela, les auteurs ont testé les fonctions antivirales de 21 IFITM de mammifères dans un même modèle expérimental. Les fonctions qui ont été étudiées concernent la capacité des IFITM à bloquer l’entrée virale à diminuer l’infectiosité des virions, en utilisant le VIH comme virus modèle. Ils ont analysé en parallèle les homologies de séquence de ces IFITM, pour comprendre les bases moléculaires de leurs mécanismes antiviraux.
Cette étude a permis de montrer l’hétérogénéité des propriétés antivirales des IFITM de mammifères et l’importance des interactions entre leurs domaines protéiques. |
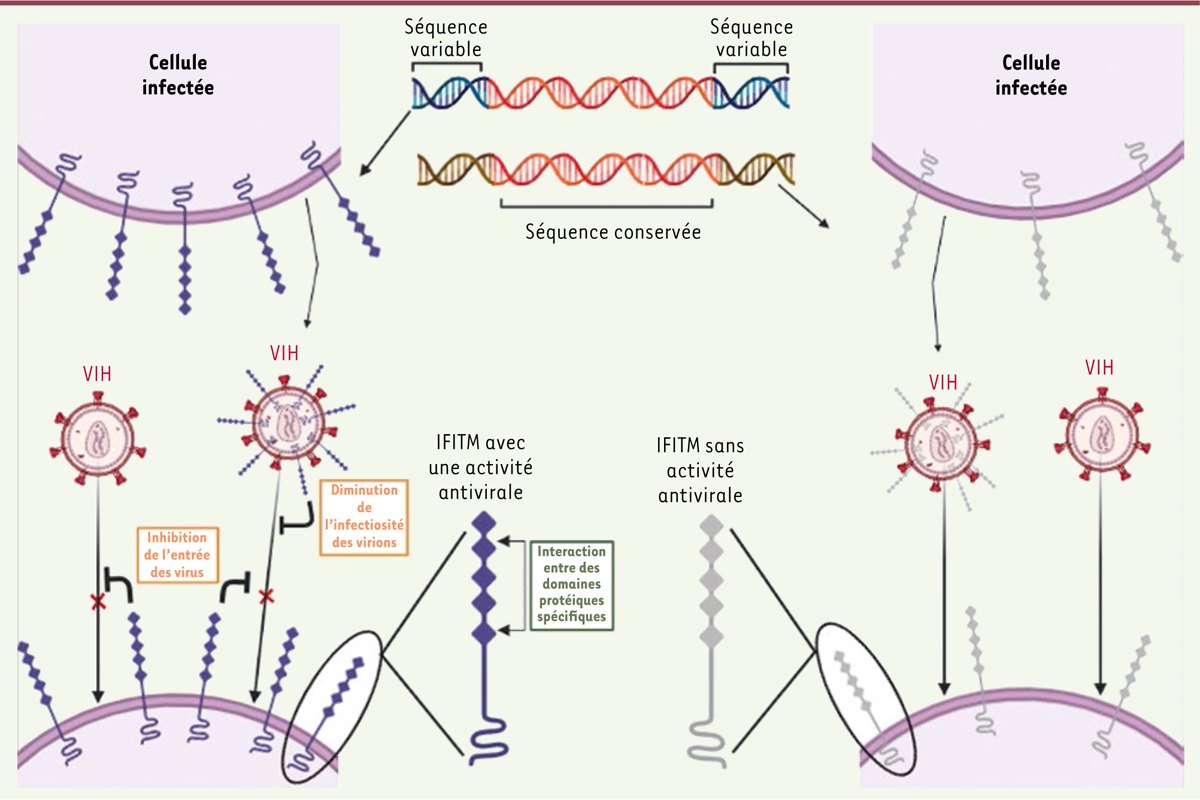
Les IFITM de mammifères présentent une relative homologie de séquence mais une hétérogénéité fonctionnelle antivirale
Marziali
et al.
ont choisi 21 IFITM afin d’étudier un large panel de protéines représentatif de leur diversité chez les mammifères. Ils ont montré que les gènes codant les IFITM sont très conservés entre les espèces, ce qui souligne leur importance du point de vue évolutif. La variabilité observée entre les différents IFITM se concentre au niveau des domaines C-terminal et N-terminal, ce dernier étant déjà connu pour réguler l’activité antivirale des IFITM2 et IFITM3 humains. [
9
,
10
]. Les auteurs ont évalué les différences de capacité antivirale des IFITM en comparant tout d’abord leur capacité à bloquer l’entrée du VIH-1
in vitro
. Pour cela, des cellules humaines exprimant les IFITM de différents mammifères ont été infectées avec des pseudo-particules virales du VIH exprimant la GFP (
green fluorescent protein
) afin de mesurer le taux d’infection par cytométrie en flux. Parallèlement, la capacité des IFITM à diminuer l’infectiosité des virions a été évaluée. Pour cela, des pseudo-particules virales du VIH-1 ont été produites à partir de cellules exprimant les différents IFITM et mises en contact avec d’autres cellules n’en exprimant pas. Le taux d’infection de ces cellules cibles a également été mesuré par cytométrie en flux. Malgré les homologies de séquences entre les IFITM étudiés, les auteurs ont observé des fonctions antivirales différentes. Tous les IFITM ne bloquent pas l’entrée du VIH dans les cellules cibles, et il existe des différences dans l’efficacité des différents IFITM à inhiber la fusion membranaire entre le virus et la cellule hôte ou à diminuer l’infectiosité des virions. Globalement, les IFITM bloquant l’entrée du virus réduisent également l’infectiosité des virions produits. Se pose alors la question du paradoxe entre l’hétérogénéité fonctionnelle des IFITM et leur homogénéité de séquence.
|
L’hétérogénéité de l’activité antivirale des IFITM est en partie expliquée par des différences de quantité protéique dans le modèle utilisé La première hypothèse pour expliquer les différences d’activité antivirale observées entre les IFITM est que leur taux d’expression est variable dans le modèle expérimental utilisé, après transfection. Les auteurs ont ainsi montré une corrélation positive entre la quantité d’IFITM dans les cellules et leur capacité à bloquer l’entrée virale et la diminution de l’infectiosité des virions. Ainsi, plus la quantité d’IFITM dans la cellule est importante, plus son efficacité antivirale est importante. Cependant, les auteurs ont également observé qu’augmenter expérimentalement la concentration protéique d’IFITM n’ayant aucune activité ne permet pas systématiquement d’induire des propriétés antivirales. Ces résultats suggèrent donc qu’il existe d’autres paramètres, distincts du niveau protéique, responsables du caractère antiviral ou non des IFITM. |
Les interactions entre les domaines des IFITM jouent un rôle déterminant dans l’activité antivirale
Les IFITM sont composés de cinq domaines protéiques. Bien que les propriétés physico-chimiques de chacun de ces domaines soient conservées entre les IFITM, les auteurs se sont demandé si des variations de séquence au sein de ces domaines pouvaient expliquer les différences de propriétés antivirales. Ils ont cependant observé que les domaines connus pour leur importance dans l’activité antivirale ont une séquence conservée chez tous les IFITM de mammifères [
9
]. Afin de vérifier l’implication de ces domaines dans l’activité antivirale des IFITM, ils ont produit des protéines chimères. Les auteurs ont montré que l’insertion de domaines isolés d’IFITM à activité antivirale dans des IFITM sans activité antivirale ne procure pas à ces derniers des propriétés antivirales. Ainsi, l’hétérogénéité des capacités antivirales des IFITM ne peut être expliquée par la présence ou l’absence d’un unique domaine. Cependant, les propriétés antivirales sont rétablies chez les chimères présentant des combinaisons spécifiques de deux domaines issus d’IFITM antiviraux. Ces résultats soulignent l’importance d’interactions entre domaines dans l’activité antivirale des IFITM.
|
Dans cette étude, Marziali
et al.
tirent avantage de la diversité naturelle des IFITM de mammifères pour identifier les facteurs à l’origine de leur activité anti-VIH. Ils mettent en évidence l’hétérogénéité des capacités antivirales des IFITM qui peut en partie être expliquée par des différences d’interactions entre domaines protéiques
(
Figure 1
)
. Dans les protéines chimères produites à partir de différents IFITM mammifères, des combinaisons particulières de domaines procurent une activité antivirale. Cela suggère que les interactions entre domaines protéiques des IFITM peuvent varier d’un IFITM à l’autre, et que ces variations sont le résultat d’adaptations spécifiques à chaque espèce de mammifère. Ces adaptations peuvent être liées aux différents virus auxquels ont été confrontés chaque espèce au cours de son évolution. Cela souligne l’importance des interactions hôte-virus dans le façonnage du système immunitaire inné chez les mammifères.
 | Figure 1.
Les différences d’activité antivirale entre les IFITM de mammifères peuvent en partie être expliquées par des interactions variées entre domaines protéiques.
VIH : virus de l’immunodéficience humaine ; IFITM :
Interferon-Induced Transmembrane Protein
.
|
|
Les auteures déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Jia
X
,
Zhao
Q
,
Xiong
Y
.
HIV Suppression by Host Restriction Factors and Viral Immune Evasion.
.
Curr Opin Struct Biol.
2015;
;
31
:
:106.
–
114
.
2.
Friedman
RL
,
Manly
SP
,
McMahon
M
,
et al.
Transcriptional and posttranscriptional regulation of interferon-induced gene expression in human cells.
.
Cell.
1984;
;
38
:
:745.
–
755
.
3.
Liao
Y
,
Goraya
MU
,
Yuan
X
,
et al.
Functional Involvement of Interferon-Inducible Transmembrane Proteins in Antiviral Immunity.
.
Front Microbiol.
2019;
;
10
:
:1097.
.
4.
Yánez
DC
,
Ross
S
,
Crompton
T
.
The IFITM protein family in adaptive immunity.
.
Immunology.
2020;
;
159
:
:365.
–
72
.
5.
Marziali
F
,
Cimarelli
A
.
Membrane Interference Against HIV-1 by Intrinsic Antiviral Factors: The Case of IFITM.
.
Cells.
2021;
;
10
:
:1171.
.
6.
Spence
JS
,
He
R
,
Hoffmann
HH
,
et al.
IFITM3 directly engages and shuttles incoming virus particles to lysosomes.
.
Nat Chem Biol.
2019;
;
15
:
:259.
–
268
.
7.
Sun
F
,
Xia
Z
,
Han
Y
,
et al
.
Topology, Antiviral Functional Residues and Mechanism of IFITM1.
.
Viruses.
2020;
;
12
:
:295.
.
8.
Marziali
F
,
Delpeuch
M
,
Kumar
A
,
et al
.
Functional Heterogeneity of Mammalian IFITM Proteins against HIV-1.
.
J Virol.
2021;
;
95
:
:e0043921.
.
9.
Chesarino
NM
,
McMichael
TM
,
Hach
JC
,
et al.
Phosphorylation of the antiviral protein interferon-inducible transmembrane protein 3 (IFITM3) dually regulates its endocytosis and ubiquitination.
.
J Biol Chem.
2014;
;
289
:
:11986.
–
11992
.
10.
Chesarino
NM
,
McMichael
TM
,
Yount
JS
.
E3 Ubiquitin Ligase NEDD4 Promotes Influenza Virus Infection by Decreasing Levels of the Antiviral Protein IFITM3.
.
PLoS Pathog.
2015;
;
11
:
:e1005095.
.
|