| |
| Med Sci (Paris). 39(5): 415–417. doi: 10.1051/medsci/2023056.Ruptures mécaniques de l’enveloppe du noyau des cellules et cancer du sein Alice Williart,1,2 Henri Popard,1,2 and Matthieu Piel1,2* 1Institut Pierre Gilles de Gennes, université Paris Sciences & Lettres
,
Paris
,
France 2Institut Curie, université Paris Sciences et Lettres, CNRS, UMR 144
,
Paris
,
France MeSH keywords: Humains, Femelle, Enveloppe nucléaire, Tumeurs du sein, Protéines nucléaires, anatomopathologie |
Dans l’organisme, les cellules sont soumises à des contraintes mécaniques dans différents contextes, physiologiques, comme lors de la migration des cellules immunitaires dans les capillaires ou dans les tissus, ou pathologiques, par exemple au sein de tumeurs solides denses confinées par les tissus environnants, comme c’est le cas pour le carcinome mammaire au stade
in situ
. En réponse à ces contraintes, les cellules se déforment et modifient leur comportement. Le noyau cellulaire, qui est l’organite le plus volumineux, est lui aussi déformé. Des résultats récents indiquent que le noyau peut produire des signaux en réponse aux déformations et qu’il pourrait jouer le rôle d’un senseur mécanique.
|
Réponse du noyau aux déformations mécaniques
Le noyau des cellules eucaryotes est entouré de l’enveloppe nucléaire, une double membrane dont les deux bicouches phospholipidiques (externe et interne) fusionnent au niveau des pores nucléaires, des complexes protéiques impliqués dans la sélectivité du transport nucléo-cytoplasmique. Cette enveloppe est soutenue par la
lamina
, un réseau de protéines - les lamines - qui lui confère ses propriétés mécaniques et constitue le nucléosquelette. Lorsque les cellules sont rondes, en l’absence de toute contrainte mécanique externe, l’enveloppe nucléaire a une apparence « fripée » et contient de nombreux replis, qui constituent un réservoir de surface. Dans le cas de contraintes faibles ou modérées, le noyau peut encaisser les déformations en dépliant et en tendant progressivement son enveloppe.
Le dépliement et la tension progressive de l’enveloppe nucléaire ont des conséquences sur le fonctionnement du noyau et de la cellule entière. En effet, des résultats expérimentaux suggèrent l’existence d’une modulation de l’ouverture des pores nucléaires en réponse à l’augmentation de la tension de l’enveloppe, conduisant à une augmentation de l’importation de certaines protéines, en particulier de coactivateurs de la transcription des gènes, comme YAP (
yes-associated protein
) et TAZ (taffazine) [
1
]. La tension de l’enveloppe est également détectée par une enzyme, la phospholipase A2 cytosolique (cPLA2) qui, après sa translocation à la membrane interne du noyau, catalyse la synthèse de l’acide arachidonique, à l’origine de plusieurs voies de signalisation (par exemple, celles impliquant la synthèse de prostaglandines) [
2
–
4
], en particulier dans les cellules immunitaires [
5
]. Ces résultats indiquent un rôle clef du noyau dans la perception des contraintes mécaniques exercées par l’environnement et dans l’adaptation des cellules à ces contraintes.
Au-delà d’un certain degré de déformation du noyau, lorsque tous les réservoirs de son enveloppe sont dépliés, la tension de celle-ci s’accroît et induit une augmentation de la pression intra-nucléaire. Cette pression, qui s’exerce sur les membranes, les détache de la
lamina
et induit la formation de
blebs
(
Figures 1A, 1B
), des bulles de la double membrane nucléaire, associées ou non à une rupture de la
lamina
. Pour des raisons encore mal comprises, ces
blebs
des membranes nucléaires sont instables : elles gonflent jusqu’à éclater, aboutissant à une rupture de l’enveloppe, qui est ensuite réparée [
6
,
7
].
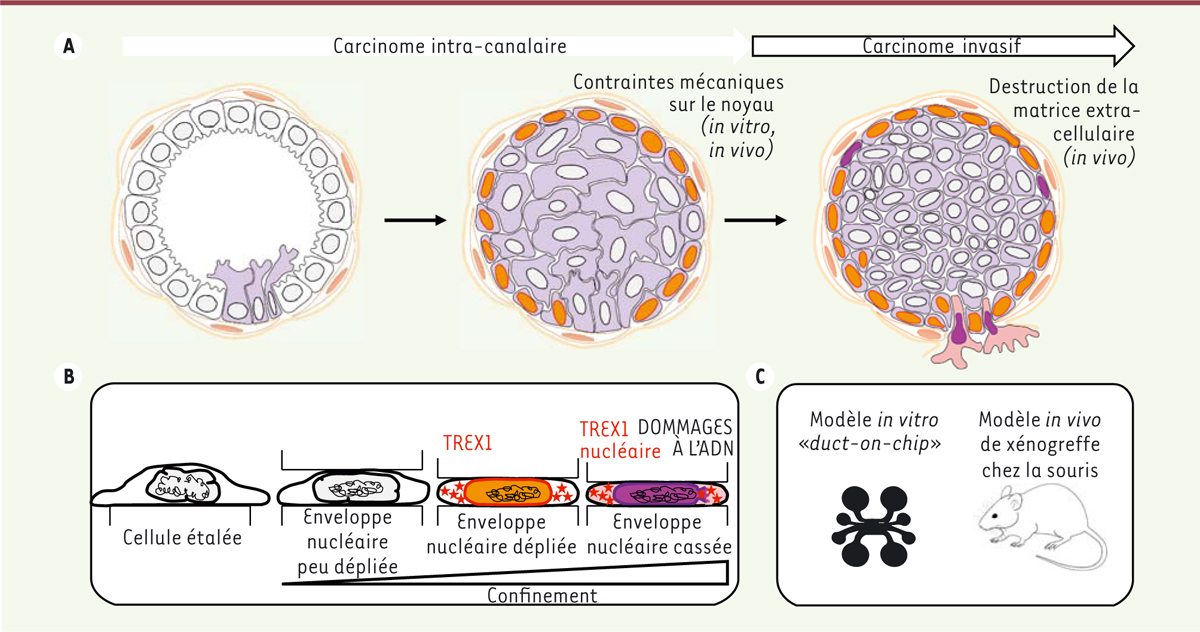
 | Figure 1.
La perte d’intégrité de l’enveloppe nucléaire provoque des dommages à l’ADN induits par l’exonucléase TREX1 et favorise la formation de métastases dans le cas du cancer du sein.
Au stade de carcinome intra-canalaire
in situ
, les cellules cancéreuses prolifèrent dans la lumière du canal et mettent sous pression les cellules tumorales périphériques, qui subissent alors des compressions de leur noyau (en rouge). Puis, au stade de carcinome invasif, les cellules confinées subissent une transition épithélio-mésenchymateuse, dégradent la matrice extra-cellulaire, et commencent à envahir les tissus environnants
(A)
, d’après les modèles
in vivo
(C)
. Sous l’effet du confineur
in vitro
, la cellule se déforme jusqu’à entraîner la rupture de l’enveloppe nucléaire, ce qui permet l’entrée de l’exonucléase TREX1 dans le noyau et provoque les dommages à l’ADN
(B)
.
|
Les ruptures de l’enveloppe conduisent à un mélange incontrôlé des contenus nucléaire et cytoplasmique, qui sont normalement séparés. L’ADN nucléaire se trouve alors exposé aux activités des enzymes cytoplasmiques, dont certaines ont pour fonction de détecter l’ADN viral, comme la
cyclic GMP-AMP synthase
(cGAS) [
8
], et de détruire cet ADN, comme la nucléase TREX1 (
3-repair exonuclease 1
). Les ruptures de l’enveloppe nucléaire sont donc également associées à des dommages à l’ADN [
6
], qui peuvent être dus à l’activité de TREX1 [
9
] ou à d’autres mécanismes, comme la dilution des facteurs de réparation de l’ADN [
10
].
Ces phénomènes ont été décrits
in vitro
dans des cellules migrant dans des microcanaux, des gels de collagène ou des explants de tissu [
6
,
7
], mais aussi dans des modèles de laminopathies associées à des mutations de la lamine A/C, comme la dystrophie musculaire d’Emery-Dreyfus [
11
].
|
Les ruptures de l’enveloppe nucléaire favorisent le processus métastatique dans le carcinome mammaire
Dans un article de Nader
et al.
, publié en 2021, les auteurs ont mis en lumière l’importance des contraintes mécaniques dans les tumeurs solides qui grossissent dans un environnement confiné [
9
]. Dans le cas du carcinome mammaire intracanalaire, la prolifération des cellules tumorales est contrainte par la membrane basale rigide du canal lactifère, ce qui impose de fortes déformations aux cellules de la périphérie de la tumeur. Ces auteurs ont alors proposé un mécanisme établissant le lien entre ruptures de l’enveloppe nucléaire et dommages à l’ADN, et étudient les conséquences à long terme sur le phénotype des cellules cancéreuses. La combinaison de systèmes microfabriqués permettant d’appliquer des contraintes mécaniques à l’échelle cellulaire et d’études
in vivo
dans un modèle murin leur a permis de décrire le scénario depuis les déformations des cellules tumorales jusqu’au déclenchement de la métastase, lorsque la tumeur perce la paroi du canal lactifère.
L’observation de coupes de carcinomes mammaires humains « naturels » ou implantés dans des modèles de souris (xénogreffe) révèle la présence de cellules présentant des dommages à l’ADN en périphérie de la tumeur, en particulier à des emplacements où la membrane basale du canal lactifère est déformée ou déjà percée. Ces dommages à l’ADN sont associés à des noyaux cellulaires très déformés, ce qui suggère un effet de la déformation mécanique des cellules qui sont prises entre la pression de la tumeur qui prolifère et la paroi rigide du conduit lactifère. En utilisant un système microfabriqué de « canal sur puce » (
duct-on-chip
), qui reproduit
in vitro
la structure du canal lactifère, les auteurs ont alors confirmé que la compression exercée par une masse de cellules à forte densité peut causer des ruptures de l’enveloppe nucléaire et des dommages à l’ADN.
L’application de déformations contrôlées grâce à un confineur microfabriqué permet également de valider les conséquences cellulaires des déformations. Le fort confinement des cellules peut induire une rupture de l’enveloppe nucléaire, à l’origine de dommages à l’ADN (
Figure 1B
). On peut noter que dans ces cellules, la rupture de l’enveloppe nucléaire est nécessaire à l’apparition des dommages à l’ADN : la déformation seule, sans rupture, ne suffit pas, ce qui suggère l’importance de la mise en contact du contenu nucléaire avec le cytoplasme.
Les nucléases cytoplasmiques constituent des candidats possibles pour les dommages observés. Les mêmes auteurs ont ainsi montré ainsi que lors de ruptures de l’enveloppe nucléaire sous confinement, l’exonucléase TREX1 est relocalisée du réticulum endoplasmique vers des membranes intranucléaires. En son absence, les cellules confinées subissent des ruptures de l’enveloppe nucléaire mais pas de dommages à l’ADN. Les auteurs ont ensuite exploré les conséquences des ruptures de l’enveloppe nucléaire et des dommages associés. Dans des cellules non transformées, les dommages à l’ADN induits par les ruptures de l’enveloppe nucléaire conduisent à l’entrée de la cellule en sénescence et à l’arrêt des mitoses. En revanche, dans le modèle de cellule mammaire cancéreuse, les dommages entraînent l’expression de marqueurs de la transition épithélio-mésenchymateuse, ainsi que la capacité à dégrader la matrice extracellulaire. Ces conséquences cellulaires requièrent la présence de TREX1 et peuvent être reproduites, en dehors de tout confinement, par l’induction de dommages à l’ADN. Ces résultats montrent donc que la réponse aux dommages à l’ADN peut profondément affecter le fonctionnement cellulaire et, dans le cas de cellules tumorales, favoriser l’apparition des caractéristiques mésenchymateuses associées à l’apparition de la métastase.
Ces résultats, obtenus
in vitro
dans des systèmes microfabriqués (confineur et
duct-on-chip
), ont ensuite été validés dans un modèle de xénogreffe de carcinome humain chez la souris (
Figure 1C
). La greffe de cellules tumorales « témoins » est associée à des ruptures de l’enveloppe nucléaire et à des dommages à l’ADN, tandis que la greffe de tumeurs dans lesquelles TREX1 est inactivé provoque des ruptures de l’enveloppe sans dommages à l’ADN. Tandis que la tumeur témoin devient rapidement invasive chez la souris, la tumeur dépourvue d’activité TREX1 ne dépasse pas le stade
in situ
(
i.e.
elle reste cantonnée au canal lactifère), ce qui souligne l’importance de cette enzyme dans la progression tumorale (
Figure 1A
). Ces résultats sont corroborés par des données cliniques dans les cancers du sein, montrant qu’une forte expression de TREX1 est associée à un mauvais pronostic.
|
L’article de Nader
et al.
présente donc un mécanisme par lequel des cellules tumorales peuvent acquérir des capacités invasives dans des situations de contraintes mécaniques. Les déformations du noyau cellulaire peuvent conduire à des ruptures de l’enveloppe nucléaire, qui mettent en contact les contenus cytoplasmique et nucléaire, à l’origine de dommages à l’ADN nécessitant l’activité de l’exonucléase cytoplasmique TREX1. Ces résultats ont d’abord été obtenus
in vitro
dans des systèmes expérimentaux microfabriqués reproduisant des environnements confinés, puis ils ont été validés
in vivo
en évaluant le caractère invasif de tumeurs humaines implantées chez la souris. Le mécanisme décrit par les auteurs de l’article permet d’expliquer pourquoi une forte expression de TREX1 est associée, dans certains cancers, à un mauvais pronostic. Plus généralement, ces résultats montrent la contribution du contexte mécanique au fonctionnement des tissus et au développement des tumeurs. Les déformations peuvent être suffisantes pour perturber l’intégrité du noyau cellulaire et affecter profondément le fonctionnement des cellules. Les résultats d’autres études montrent qu’en fonction du type cellulaire considéré, la déformation seule, en l’absence de ruptures de l’enveloppe nucléaire, peut être suffisante pour produire des dommages de l’ADN [
12
]. En dehors du contexte des tumeurs solides, les considérations mécaniques sont également à prendre en compte dans le contexte de la migration cellulaire, qui impose des déformations importantes aux cellules et à leur noyau. La microfluidique et la microfabrication proposent des outils permettant d’étudier ces phénomènes
in vitro
dans des systèmes contrôlés, et d’en découvrir les mécanismes physiques et moléculaires associés.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Andreu
I
,
Granero-Moya
I
,
Chahare
NR
,
et al.
Mechanical force application to the nucleus regulates nucleocytoplasmic transport.
.
Nat Cell Biol.
2022;
;
24
:
:896.
–
905
.
2.
Enyedi
B
,
Jelcic
M
,
Niethammer
P
.
The cell nucleus serves as a mechanotransducer of tissue damage-induced inflammation.
.
Cell.
2016;
;
165
:
:12.
.
3.
Venturini
V
,
Pezzano
F
,
Català Castro
F
,
et al.
The nucleus measures shape changes for cellular proprioception to control dynamic cell behavior.
.
Science.
2020;
;
370
:
:eaba2644.
.
4.
Lomakin
AJ
,
Cattin
CJ
,
Cuvelier
D
,
et al
.
The nucleus acts as a ruler tailoring cell responses to spatial constraints.
.
Science.
2020;
;
370
:
:eaba2894.
.
5.
Alraies
Z
,
Rivera
CA
,
Delgado
M-G
,
et al
.
Mechanical stimulation shapes the immunoregulatory properties of dendritic cells.
.
bioRxiv.
2022
.
6.
Raab
M
,
Gentili
M
,
de Belly
H
,
et al.
ESCRT III repairs nuclear envelope ruptures during cell migration to limit DNA damage and cell death.
.
Science.
2016;
;
352
:
:359.
–
362
.
7.
Denais
CM
,
Gilbert
RM
,
Isermann
P
,
et al.
Nuclear envelope rupture and repair during cancer cell migration.
.
Science.
2016;
;
352
:
:353.
–
358
.
8.
Guey
B
,
Wischnewski
M
,
Decout
A
,
et al
.
BAF restricts cGAS on nuclear DNA to prevent innate immune activation.
.
Science.
2020;
;
7
:
:823.
–
8
.
9.
Nader
GPF
,
Agüera-Gonzalez
S
,
Routet
F
,
et al
.
Compromised nuclear envelope integrity drives TREX1-dependent DNA damage and tumor cell invasion.
.
Cell.
2021;
;
184
:
:5230.
–
46.e22
.
10.
Irianto
J
,
Xia
Y
,
Pfeifer
CR
,
et al.
DNA Damage follows repair factor depletion and portends genome variation in cancer cells after pore migration.
.
Curr Biol.
2017;
;
27
:
:210.
–
223
.
11.
Earle
AJ
,
Kirby
TJ
,
Fedorchak
GR
,
et al
.
Mutant lamins cause nuclear envelope rupture and DNA damage in skeletal muscle cells.
.
Nat Mater.
2020;
;
19
:
:464.
–
73
.
12.
Shah
P
,
Hobson
CM
,
Cheng
S
,
et al
.
Nuclear deformation causes DNA damage by increasing replication stress.
.
Curr Biol.
2021;
;
31
:
:753.
–
65.e6
.
|