Si la flexibilité d’un individu facilite ses liens sociaux, qu’en est-il pour les protéines à l’échelle cellulaire ? La protéine VAP-A (
VAMP-associated protein A
) est une protéine intégrale de la membrane du réticulum endoplasmique impliquée dans les divers sites de contact membranaire avec d’autres organelles. VAP-A possède trois domaines structurés : un domaine
major sperm protein
(MSP) N-terminal, un domaine
coiled-coil
central de dimérisation, et un domaine transmembranaire C-terminal. Par son domaine MSP, VAP-A interagit avec des centaines de protéines dont la séquence d’acides aminés contient un motif FFAT, constitué de deux résidus phénylalanine (FF) dans un segment riche en résidus acides [
2
] (
Figure 1
). Par exemple, VAP-A interagit avec la protéine de liaison à l’oxystérol (OSBP) aux sites de contact membranaire entre le réticulum endoplasmique et le réseau trans-golgien : le complexe moléculaire OSBP-VAP-A assure le pontage membranaire et l’échange cholestérol/phosphatidylinositol-4-phosphate (PI4P) entre ces organelles [
3
]. Aux sites de contact membranaire entre réticulum endoplasmique et mitochondrie, VAP-A interagit avec VPS13A (
vacuolar protein sorting-associated protein 13A
) et PTPIP51 (
protein tyrosine phosphatase-interacting protein 51
), deux protéines qui contribuent au transfert d’acide phosphatidique du réticulum endoplasmique vers les mitochondries [
4
,
5
] : l’acide phosphatidique est un précurseur de la cardiolipine, un lipide crucial pour la dynamique mitochondriale. VAP-A joue donc le rôle d’un « opérateur central » répondant aux demandes de multiples interlocuteurs.
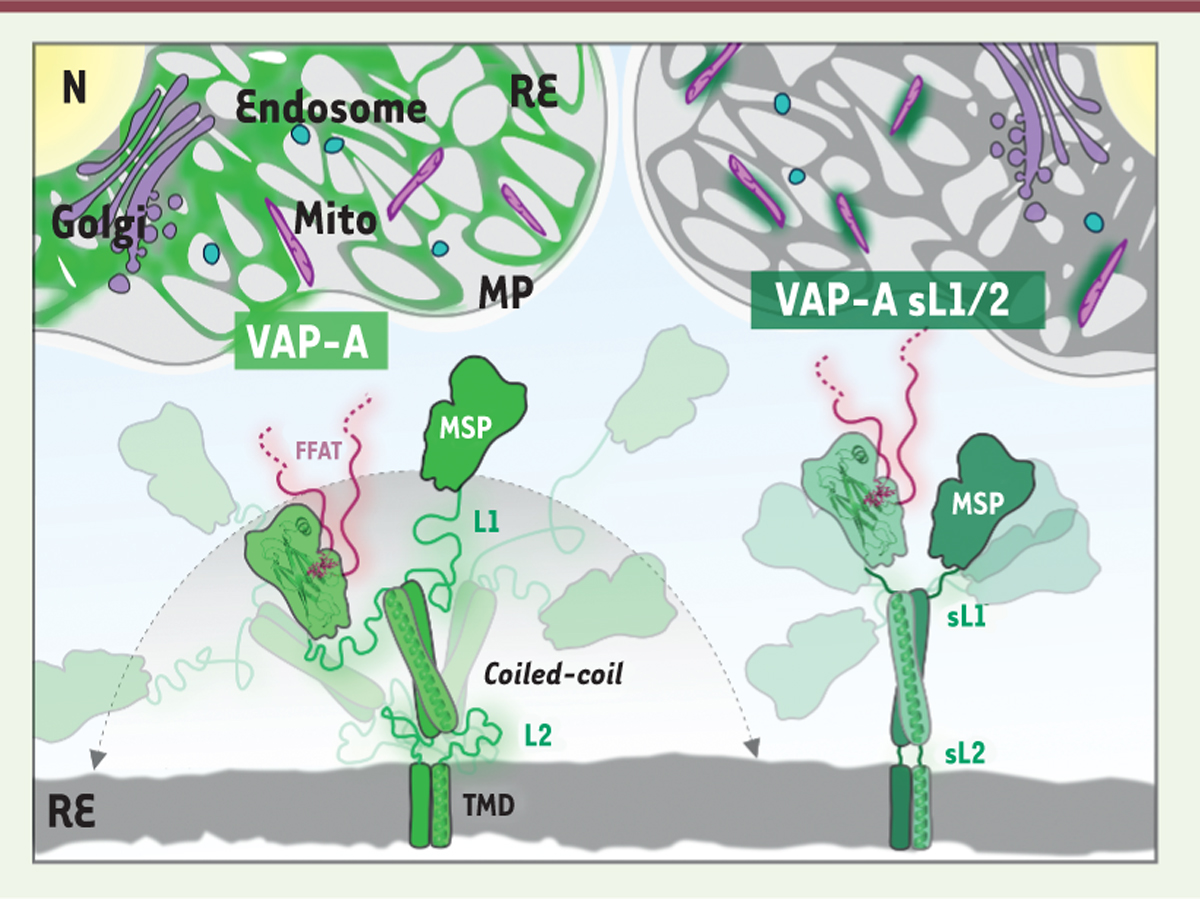
 | Figure 1.
Modèle moléculaire de la protéine VAP-A endogène et d’une protéine VAP-A rigidifiée par mutation de ses deux domaines linker (VAP-A sL1/2).
Les
linkers
flexibles L1 et L2 de la protéine VAP-A endogène lui permettent d’explorer un espace conformationnel plus large pour capturer des partenaires de liaison et adapter ainsi sa fonction à divers sites de contact membranaire entre organelles, y compris les sites de contact membranaire entre réticulum endoplasmique et réseau trans-golgien, qui sont éphémères, alors que le mutant rigidifié de la protéine, VAP-A sL1/2, a une distribution limitée aux sites de contact membranaire entre réticulum endoplasmique et mitochondrie, qui sont plus stables. N : Noyau ; Mito : mitochondrie ; RE : réticulum endoplasmique ; MP : membrane plasmique ; TMD : domaine trans-membranaire ; MSP : domaine
major sperm protein
; FFAT : motif de séquence protéique contenant deux résidus phénylalanine (FF) entourés de résidus acides, aspartate (D) ou glutamate (E).
|
Bien que l’interaction entre les domaines MSP et FFAT ait été caractérisée, il n’existait pas encore de modèle pour rendre compte, aux divers sites de contact membranaire, de l’interaction de VAP-A avec des partenaires de liaison aussi hétérogènes. Toutefois, on savait que VAP-A est capable de s’orienter et de s’allonger sur des distances variables depuis la membrane [
6
]. Par ailleurs, des programmes de prédiction de structure secondaire indiquaient que cette protéine possède deux régions non structurées (
linkers
L1 et L2) flanquant son domaine
coiled-coil
. Aussi avons-nous fait l’hypothèse que VAP-A, grâce à la flexibilité de ses
linkers
, peut recruter différents partenaires de liaison dans différents contextes de sites de contact membranaire, ce dont une molécule rigide serait incapable. Ces caractéristiques moléculaires pourraient également avoir une incidence sur la dynamique et la fonction de VAP-A aux sites de contact membranaire.
Quand nous utilisons le téléphone pour joindre un ami, VAP-A, quant à elle, utilise ses
linkers
pour entrer en contact avec ses partenaires de liaison. Grâce à des analyses biochimiques et des simulations de dynamique moléculaire, nous avons découvert que les deux
linkers
de VAP-A sont des régions intrinsèquement désordonnées [
7
]. Ces régions, sans structure tridimensionnelle définie, contiennent un grand nombre d’acides aminés polaires et chargés (notamment, Glu, Lys, Gln, et Ser) ainsi que les acides aminés Pro et Gly, qui tolèrent le contact avec le solvant aqueux, et peu de résidus hydrophobes (tels que Ile, Phe, Trp et Tyr). Les régions intrinsèquement désordonnées, qui se comportent comme des fils flexibles nageant dans le cytosol, augmentent la liberté conformationnelle des protéines, ce qui favorise les mouvements interdomaines, ou l’interaction avec des partenaires de liaison éloignés ou mobiles. En remplaçant par mutagenèse les
linkers
L1 et L2 de VAP-A (constitués respectivement de 32 et de 24 résidus) par des
linkers
synthétiques plus courts (sL1 et sL2, de séquences GGSGGSGG et GSG), nous avons observé, par cryomicroscopie électronique, que cette forme mutée de la protéine, VAP-A sL1/2, purifiée et reconstituée dans des protéoliposomes, est beaucoup moins flexible que la protéine non mutée, bien qu’elle conserve sa capacité d’interagir avec des protéines contenant un motif FFAT [
7
].
Pour étudier l’impact des régions intrinsèquement désordonnées de VAP-A dans un contexte cellulaire, nous avons utilisé une lignée de cellules épithéliales pigmentaires de la rétine humaine (cellules RPE1) immortalisées par expression de la protéine hTERT (
human telomerase reverse transcriptase
). Cette lignée cellulaire, dont le caryotype est stable, est couramment utilisée pour étudier le trafic membranaire. Nous avons établi des lignées hTERT-RPE1 génétiquement dépourvues de VAP-A par la technique CRISPR/Cas9, afin de réaliser des expériences de réexpression de VAP-A ou de VAP-A sL1/2 par transfection en évitant toute dimérisation avec la protéine VAP-A endogène. Nous avons constaté que la présence de la mutation sL1/2 dans la protéine VAP-A réexprimée entraîne son déplacement complet vers les sites de contact membranaire entre réticulum endoplasmique et mitochondrie, au détriment de ceux entre réticulum endoplasmique et réseau trans-golgien, ce qui perturbe l’activité de transfert de lipides de ses différents partenaires de liaison (tels que la protéine OSBP) à ces sites de contact. Étonnamment, nous montrons qu’aux sites de contact membranaire entre réticulum endoplasmique et mitochondrie, la réexpression de VAP-A sL1/2 mime les fonctions de la protéine endogène (non mutée) : elle restaure le métabolisme de la cardiolipine et la capacité de fusion mitochondriale (fonctions perdues en l’absence de VAP-A) grâce aux interactions de VAP-A sL1/2 avec PTPIP51 et VPS13A. Notons aussi qu’une autre construction rigide, obtenue en allongeant artificiellement le domaine
coiled-coil
de VAP-A, se comporte comme le mutant VAP-A sL1/2. En revanche, d’autres constructions flexibles dans lesquelles les
linkers
de VAP-A ont été remplacés par des peptides de même longueur, mais dont la séquence d’acides aminés est différente (séquence inversée, ou riche en résidus Gly et Ser), ont une localisation et une fonction similaires à celles de la protéine VAP-A endogène [
7
]. Cela montre que ce n’est pas la séquence d’acides aminés précise, mais bien la nature non structurée et flexible des régions intrinsèquement désordonnées de la protéine VAP-A qui lui permet de s’engager fonctionnellement dans les divers sites de contact membranaire.