| |
| Med Sci (Paris). 39(10): 703–706. doi: 10.1051/medsci/2023115.Détournement d’une bactérie commensale pour la vaccination anti-tumorale Nesrine Mabrouk,1 Fanny Mejean,1 Corinne Tanchot,1 and Éric Tartour1,2* 1Université Paris Cité, Inserm U970, PARCC
,
Paris
,
France 2Département d’immunologie, hôpital européen Georges Pompidou-hôpital Necker, AP-HP
,
Paris
,
France MeSH keywords: Humains, Vaccins anticancéreux, Symbiose, Microbiote |
Staphylococcus epidermidis
: une bactérie commensale capable d’induire des lymphocytes T CD8
+
Les millions de bactéries, virus et champignons présents à la surface de notre épiderme constituent la flore commensale de la peau.
Staphylococcus epidermidis
est une bactérie extracellulaire non pathogène chez les individus non immunodéprimés. Elle est présente notamment sur la peau, où elle joue un rôle contre la dissémination de certains microorganismes pathogènes. Les travaux de recherche du groupe dirigé par Yasmina Belkaid ont montré que cette bactérie appliquée directement sur la peau, chez la souris et chez un primate non humain, pouvait induire une réponse de lymphocytes T CD8
+
[
1
,
2
]. Ce résultat était inattendu car on considère généralement que les bactéries extracellulaires induisent plutôt une réponse immunitaire humorale. Dans la continuité de ces travaux, et en raison du rôle connu des lymphocytes T CD8
+
dans la vaccination anti-tumorale, le même groupe de chercheurs a modifié cette bactérie pour qu’elle exprime des antigènes tumoraux [
3
].
|
La bactérie
S. epidermidis
modifiée pour lui faire synthétiser des antigènes tumoraux protège contre le développement de tumeurs
En modifiant génétiquement
S. epidermidis
pour qu’elle exprime l’ovalbumine ou des antigènes mutés dérivés de mélanomes ou de cancers de la prostate, les auteurs ont montré que l’application cutanée de cette bactérie ainsi modifiée protégeait les animaux contre le développement de tumeurs primaires (mélanomes et cancers de la prostate), mais aussi métastatiques dans les poumons (dans ce cas, l’effet était observé après une application prophylactique ou thérapeutique de la bactérie modifiée). Les animaux préalablement colonisés et protégés par la bactérie modifiée étaient également résistants à une nouvelle greffe tumorale, ce qui témoignait de l’induction d’une réponse mémoire par la vaccination. Ce mode de vaccination peut agir en synergie avec l’administration d’anticorps anti-PD-1 ou anti-CTLA-4, des immunothérapies utilisées en cancérologie humaine, ce qui laisse entrevoir la possibilité de nouvelles combinaisons thérapeutiques. Différents essais cliniques récents de phase II chez des patients présentant un mélanome ou un cancer du col de l’utérus associé aux papillomavirus ont également montré l’existence d’une synergie entre une vaccination par des acides nucléiques (ARN ou ADN) ciblant des antigènes mutés ou des protéines virales, et l’administration de l’anticorps anti-PD-1 [
4
,
5
].
|
Les lymphocytes T CD8
+
sont impliqués dans l’effet antitumoral de la vaccination par la bactérie
S. epidermidis
modifiée
Afin de documenter le mécanisme à l’origine du succès de cette vaccination, les auteurs ont montré, à l’aide d’un antigène modèle, l’ovalbumine, que l’application cutanée de
S. epidermidis
exprimant l’ovalbumine ou des peptides immunodominants CD4 ou CD8 dérivés de l’ovalbumine induisait une réponse lymphocytaire T CD8
+
spécifique de cet antigène. Contrairement à d’autres modes de vaccination, cette réponse lymphocytaire n’était accompagnée d’aucune inflammation, infection, ou rupture de la barrière épithéliale, ce qui confère à l’utilisation de cette bactérie un profil de sécurité rassurant. Après l’application cutanée de la bactérie modifiée, ces lymphocytes T CD8
+
sont retrouvés dans les ganglions lymphatiques drainant la zone d’application, ainsi qu’à distance, et l’élimination de ces lymphocytes supprime l’effet anti-tumoral.
Cependant, par rapport à d’autres modes de vaccination, notamment la vaccination par injection d’un ARN, seule ou combinée à l’injection d’un vecteur viral recombinant selon un protocole « première immunisation-rappel hétérologue » (
prime-boost
), il semble que l’intensité de la réponse lymphocytaire induite par l’application cutanée de
S. epidermidis
soit moindre, car mesurée le plus souvent à moins de 1 % de tétramères positifs en cytométrie de flux
1
[
6
]. Par comparaison avec une vaccination par l’ovalbumine mélangée à l’adjuvant complet de Freund
2
, l’induction de lymphocytes T CD8
+
dans la rate par l’application cutanée de
S. epidermidis
exprimant l’ovalbumine semble aussi moins importante. On peut regretter que les auteurs n’aient analysé que la réponse des lymphocytes T CD8
+
dirigée contre l’ovalbumine et pas celle contre les néo-antigènes (produits de gènes mutés), qui représentent aujourd’hui les antigènes tumoraux les plus utilisés pour la vaccination antitumorale chez l’homme [
7
].
Les auteurs ont montré que l’immunisation par une bactérie modifiée produisait une réponse de lymphocytes T CD8
+
de type effecteurs-mémoire. Cela pourrait expliquer l’efficacité de cette vaccination, car ces lymphocytes ont généralement une capacité cytotoxique contre la tumeur plus importante que les lymphocytes de type mémoire centrale (présents principalement dans les organes lymphoïdes), qui sont induits de façon naturelle lorsque l’on greffe une tumeur exprimant l’ovalbumine à une souris, sans vaccination associée. Une autre sous-population de lymphocytes T CD8
+
, appelés lymphocytes T résidents à mémoire (T
RM
), définie par l’expression de CD103, CD69 et CD49a, joue un rôle que l’on considère de plus en plus important dans l’efficacité de la vaccination anti-tumorale, particulièrement lorsque celle-ci cible des muqueuses, comme c’est le cas notamment dans le cancer du poumon [
8
]. Il aurait été intéressant de montrer que les lymphocytes T CD8
+
induits avaient un profil de type T
RM
dans ces modèles tumoraux, ce que ces auteurs et d’autres avaient d’ailleurs montré dans des études précédentes [
1
].
|
Autres mécanismes d’action de cette vaccination anti-tumorale reposant sur
S. epidermidis
modifiée
Même si les auteurs ont mis en évidence le rôle des lymphocytes T CD8
+
dans l’efficacité anti-tumorale de cette vaccination, il semble que d’autres mécanismes soient requis pour provoquer la régression des tumeurs. En effet, si l’antigène tumoral est présent dans le cytosol des bactéries modifiées et pas dans leur membrane, l’induction de lymphocytes T CD8
+
ne s’accompagne plus d’une protection tumorale. Par ailleurs, si les bactéries modifiées n’expriment qu’un seul épitope CD8 ou CD4 de l’ovalbumine, on n’observe pas non plus d’effet anti-tumoral. Ces expériences indiquent donc la nécessité d’une coopération entre ces deux populations de lymphocytes T, CD8
+
et CD4
+
, pour l’inhibition de la croissance tumorale. Enfin, pour que la bactérie modifiée ait une action anti-tumorale, elle doit être inoculée vivante : une colonisation active du tissu est donc nécessaire [
3
].
Les auteurs ont également apporté la preuve que la colonisation de la peau par
S. epidermidis
sans expression de l’antigène tumoral ne suffit pas à empêcher la croissance de la tumeur, ce qui ne corrobore pas les résultats d’autres travaux de recherche dans lesquels la colonisation par des bactéries de génotype « sauvage » issues du microbiote intestinal suffisait à induire des lymphocytes T CD8
+
et à améliorer l’efficacité de l’immunothérapie [
9
,
10
]. Dans d’autres cas, un mimétisme moléculaire entre des antigènes tumoraux et la bactérie de génotype « sauvage » a été rapporté pour expliquer le rôle du microbiote dans l’amélioration de l’efficacité de la vaccination et de l’immunothérapie anti-tumorales [
11
]. Les résultats de précédents travaux de recherche avaient montré que
S. epidermidis
induisait une réponse de lymphocytes T CD8
+
avec un profil de type Tc1 car produisant de l’interféron γ, et de type Tc17 car produisant de l’interleukine-17 [
1
]. Une réponse de type Tc17 est d’ailleurs retrouvée avec de nombreuses bactéries commensales de la peau, et a été impliquée dans l’inhibition de la croissance tumorale.
S. epidermidis
était également capable d’induire des lymphocytes T CD8
+
restreints par des molécules HLA de classe I non polymorphe (MHC1b) de type H2-M3 chez la souris [
2
]. Enfin,
S. epidermidis
augmente l’expression des alarmines S100A8 et S100A9, qui sont impliquées dans le recrutement des granulocytes neutrophiles, capables de moduler la croissance tumorale [
12
]. Il est donc surprenant qu’aucun de ces différents effecteurs anti-tumoraux n’ait été retrouvé après la vaccination par
S. epidermidis
modifiée, d’autant plus que la même souche de
S. epidermidis
(NIHLM087) semble avoir été utilisée pour les travaux de recherche précédents, ce qui élimine une explication possible. Il se peut que l’expression d’antigènes exogènes par la bactérie modifie le profil de la réponse immunitaire induite, par rapport à la bactérie non modifiée.
|
Originalité et avantages de ce mode de vaccination
Le principal avantage de cette stratégie de vaccination anti-tumorale reposant sur l’utilisation d’une bactérie commensale est sa relative innocuité puisqu’elle ne déclenche pas de réaction inflammatoire. Néanmoins, en raison du risque d’infection nosocomiale chez les sujets immunodéprimés, elle est contre-indiquée pour cette population d’individus. Des microorganismes pathogènes recombinants, comme des virus ou des bactéries intracellulaires (
Listeria
), avaient précédemment été utilisés pour vectoriser l’antigène tumoral dans l’élaboration de vaccins anti-tumoraux, mais l’utilisation de bactéries commensales pour cette application n’avait encore jamais été rapportée. L’application cutanée de la bactérie commensale modifiée est plus simple que l’injection intramusculaire ou intraveineuse des précédents vecteurs dérivés de microorganismes pathogènes, lesquels déclenchent en outre une réaction inflammatoire. De plus, ils risquent d’induire la production d’anticorps dirigés contre le vecteur, qui le neutraliseront lors d’injections ultérieures. Comme les bactéries commensales semblent résider durablement dans la peau, il ne semble pas qu’elles soient éliminées par la réponse humorale. Néanmoins, il conviendra de le vérifier aussi pour ces bactéries commensales modifiées pour exprimer des antigènes exogènes.
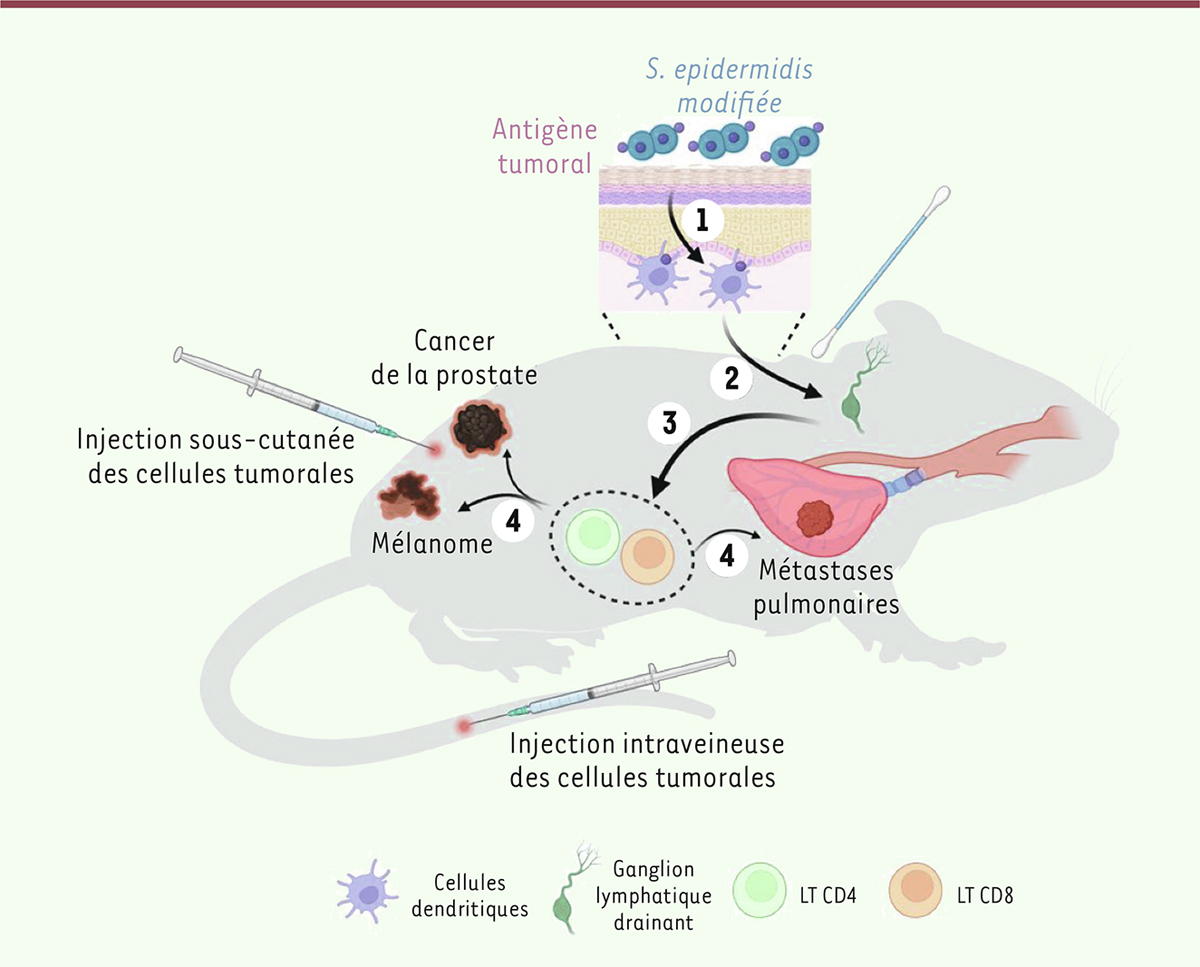
 | Figure 1.
Induction de lymphocytes T à activité anti-tumorale par application cutanée de bactéries modifiées exprimant des antigènes tumoraux.
La souche de Staphylococcus epidermidis modifiée pour lui faire exprimer des antigènes tumoraux (ovalbumine, néoantigènes) a été appliquée sur la peau de la souris. Ces antigènes sont donc pris en charge par des cellules dendritiques, qui migrent vers les ganglions drainants et induisent une activation des lymphocytes T (LT) CD8
+
et CD4
+
. Ces derniers sont capables d’éliminer différentes tumeurs primaires greffées sous la peau de l’animal (mélanome B16-F10, cancer de la prostate non orthotopique Tramp-C2), ou des métastases pulmonaires induites après injection intraveineuses des cellules cancéreuses. Cette efficacité anti-tumorale existe après une vaccination prophylactique ou une vaccination thérapeutique. Elle entraîne une réponse mémoire protégeant les animaux guéris en cas de nouvelle greffe tumorale (figure réalisée à l’aide du logiciel Biorender).
|
|
Même si
S. epidermidis
est présente sur la peau et dans le tube digestif chez l’homme, et malgré la mise en évidence d’une réponse immunitaire induite par l’application de la bactérie modifiée chez le macaque, on ne peut pas encore savoir si l’utilisation de cette bactérie est optimale pour induire une réponse immunitaire anti-tumorale chez l’homme. La flore commensale digestive de l’individu semble influencer la réponse immunitaire aux vaccins prophylactiques anti-infectieux et aux vaccins thérapeutiques anti-tumoraux contre des néo-antigènes ou des virus associés aux tumeurs [
13
], et elle pourrait donc également interférer avec ce nouveau type de vaccin anti-tumoral par voie cutanée. On peut aussi craindre une compétition entre la flore cutanée endogène et la bactérie commensale modifiée utilisée pour la vaccination.
La réponse immunitaire varie considérablement entre les différentes bactéries commensales, et même pour une même souche bactérienne. Outre la réponse lymphocytaire T effectrice décrite ci-dessus, d’autres bactéries commensales, comme certaines espèces de
Clostridium,
peuvent induire des lymphocytes T régulateurs [
14
], ce qui permet d’envisager d’utiliser également certaines de ces bactéries pour traiter des maladies auto-immunes.
Enfin cette stratégie originale de vaccination anti-tumorale s’inscrit dans un renouveau de l’immunothérapie anti-tumorale reposant sur le développement de la plateforme vaccinale ARNm, l’utilisation de néo-antigènes dérivés de la tumeur plus immunogènes, et l’association de ces vaccins anti-tumoraux avec l’administration d’anticorps dirigés contre des molécules impliquées dans les points de contrôle immunitaire [
4
,
5
,
7
]. La société Moderna a d’ailleurs fait une première demande d’enregistrement par la
Food and drug administration
(FDA) américaine pour un vaccin à ARN ciblant des néo-antigènes tumoraux, utilisé en association avec l’injection d’un anticorps anti-PD-1 chez des patients présentant des mélanomes à haut risque de récidive après leur exérèse chirurgicale.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Naik
S
,
Bouladoux
N
,
Linehan
JL
,
et al.
Commensal-dendritic-cell interaction specifies a unique protective skin immune signature.
.
Nature.
2015;
;
520
:
:104.
–
108
.
2.
Linehan
JL
,
Harrison
OJ
,
Han
SJ
,
et al
.
Non-classical immunity controls microbiota impact on skin immunity and tissue repair.
.
Cell.
2018;
;
172
:
:784.
–
96 e718
.
3.
Chen
YE
,
Bousbaine
D
,
Veinbachs
A
,
et al
.
Engineered skin bacteria induce antitumor T cell responses against melanoma.
.
Science.
2023;
;
380
:
:203.
–
10
.
4.
Sahin
U
,
Oehm
P
,
Derhovanessian
E
,
et al
.
An RNA vaccine drives immunity in checkpoint-inhibitor-treated melanoma.
.
Nature.
2020;
;
585
:
:107.
–
12
.
5.
Youn
JW
,
Hur
SY
,
Woo
JW
,
et al
.
Pembrolizumab plus GX-188E therapeutic DNA vaccine in patients with HPV-16-positive or HPV-18-positive advanced cervical cancer: interim results of a single-arm, phase 2 trial.
.
Lancet Oncol.
2020;
;
21
:
:1653.
–
60
.
6.
Palmer
CD
,
Rappaport
AR
,
Davis
MJ
,
et al
.
Individualized, heterologous chimpanzee adenovirus and self-amplifying mRNA neoantigen vaccine for advanced metastatic solid tumors: phase 1 trial interim results.
.
Nat Med.
2022;
;
28
:
:1619.
–
29
.
7.
Rojas
LA
,
Sethna
Z
,
Soares
KC
,
et al
.
Personalized RNA neoantigen vaccines stimulate T cells in pancreatic cancer.
.
Nature.
2023
:
:1.
–
7
.
8.
Karaki
S
,
Blanc
C
,
Tran
T
,
et al
.
CXCR6 deficiency impairs cancer vaccine efficacy and CD8
+
resident memory T-cell recruitment in head and neck and lung tumors
.
.
J Immunother Cancer.
2021;
;
9
:
:e001948.
.
9.
Tanoue
T
,
Morita
S
,
Plichta
DR
,
et al.
A defined commensal consortium elicits CD8 T cells and anti-cancer immunity.
.
Nature.
2019;
;
565
:
:600.
–
605
.
10.
Derosa
L
,
Routy
B
,
Desilets
A
et al
.
Microbiota-centered interventions: The next breakthrough in immuno-oncology?
Cancer Discov.
2021;
;
10
:
:2396.
–
412
.
11.
Tagliamonte
M
,
Cavalluzzo
B
,
Mauriello
A
,
et al
.
Molecular mimicry and cancer vaccine development.
.
Mol Cancer.
2023;
;
22
:
:75.
.
12.
Gebhardt
C
,
Nemeth
J
,
Angel
P
,
et al.
S100A8 and S100A9 in inflammation and cancer.
.
Biochem Pharmacol.
2006;
;
72
:
:1622.
–
1631
.
13.
Lynn
DJ
,
Benson
SC
,
Lynn
MA
,
et al
.
Modulation of immune responses to vaccination by the microbiota: implications and potential mechanisms.
.
Nat Rev Immunol.
2022;
;
22
:
:33.
–
46
.
14.
Atarashi
K
,
Tanoue
T
,
Shima
T
,
et al.
Induction of colonic regulatory T cells by indigenous
Clostridium
species
.
.
Science.
2011;
;
331
:
:337.
–
341
.
|