| |
| Med Sci (Paris). 39(10): 744–753. doi: 10.1051/medsci/2023124.Les stress pendant les 1 000 premiers jours de la vie quand tout commence Catherine Verney1,3* and Tania Vitalis1,2* 1Université de Paris, NeuroDiderot
,
Paris
,
France 2Inserm, Paris, U1141, hôpital Robert-Debré
,
48 boulevard Sérurier
,
75019Paris
,
France 3Association Ensemble pour l’éducation de la petite enfance
,
37 allée du Forum
,
92100Boulogne-Billancourt
,
France |
Vignette Léonard de Vinci, vers 1510).
Le bon déroulement de l’enfance est au cœur des politiques de santé publique. De nombreuses recherches récentes étayent la théorie de l’origine développementale de la santé et des maladies (DOHaD, pour
developmental origin of health and disease
) physiques, psychiques ou comportementales. Les bases biologiques de la DOHaD incluent des modifications épigénétiques induites par les aléas de l’environnement, particulièrement au cours du développement pré- et postnatal humain [
1
–
3
] (
→
).
(→) Voir les Synthèses de C. Junien
et al
., et L. Storme
et al
.,
m/s
n° 1, janvier 2016, pages 27 et 74
Le récent rapport de septembre 2020 de la commission des 1 000 premiers jours
1
, présidée par le neuropsychiatre Boris Cyrulnik, résume la situation de la petite enfance en France [
4
]. Il énonce des préconisations pour mieux prendre en charge le développement émotionnel et cognitif de l’enfant. Les adversités, dont les stress des 1 000 premiers jours, sont abordées par leurs possibles impacts sur les vulnérabilités spécifiques au développement physique, émotionnel et cognitif de l’enfant, associées à un risque de maladie à long terme [
5
]. Les individus exposés à des stress précoces intenses ont deux fois plus de probabilité de développer des difficultés à réguler leurs émotions associées ou non à des troubles psychiatriques [
6
]. Chez l’homme adulte, comme chez l’ensemble des mammifères
,
les stress se présentent dans l’environnement sous un spectre large allant du stress positif au stress toxique. Ces stress mobilisent des réseaux corps-cerveau ancestraux essentiels à la vie et la survie [
7
] (
→
).
(→) Voir la Synthèse de C. Verney et al.,
m/s
n° 11, novembre 2021, page 1002
Le
Center on the Developing Child
de l’université d’Harvard (États-Unis) a défini trois types de stress identifiables à tous les stades de la vie [
8
] : 1) le stress positif, essentiel au bon fonctionnement des fonctions végétatives, hormonales, immunitaires et émotionnelles ; 2) le stress tolérable/supportable d’adaptation à l’environnement physiologique, pour la gestion des émotions, comme la peur ; et 3) le stress toxique/traumatique, sévère et/ou prolongé, avec des effets à plus ou moins long terme sur la santé, le psychisme et le comportement de l’individu.
Les conséquences des stress environnementaux sur la biologie et le psychisme des bébés pendant les 1 000 premiers jours
2,
sont extrêmement plastiques et durent toute l’enfance. Les stress toxiques/traumatiques nécessitent d’être détectés et « réparés » ou prévenus précocement afin d’induire des résiliences
3
avant que l’enfant atteigne l’âge adulte. Face à l’extrême vulnérabilité du très jeune enfant, il est impératif de définir les meilleures prises en charge possibles pour l’enfant et pour les couples mère, parents, soignants et enfant.
|
1 Le développement cérébral humain
La morphogenèse cérébrale est l’expression d’une programmation génique, une suite d’événements géniques, moléculaires et cellulaires qui s’induisent et/ou s’inhibent dans des séquences spatio-temporelles strictes. Pendant la période embryonnaire (jusqu’à huit semaines de gestation [SG] chez l’homme), la neurogenèse des régions sous-corticales du cerveau (tronc cérébral, mésencéphale, diencéphale (hypothalamus, thalamus), amygdale) est globalement achevée. Les neurones du cortex cérébral sont en très grande partie générés entre la septième et la seizième SG. Les aires corticales sensori-motrices et associatives sont activées dans la perception-action autour de la naissance. La voie motrice pyramidale est présente dès le deuxième trimestre de gestation chez l’homme, alors que les régulations motrices non pyramidales maturent avec la marche vers un an jusqu’à la maitrise de l’écriture vers sept-huit ans. Le toucher, le goût, la proprioception sont présents autour du troisième mois de grossesse, l’ouïe vers le sixième mois alors que la vision s’active à la naissance. En fin de gestation et autour de la naissance, la morphogenèse programmée est achevée. La rencontre du fœtus et du nouveau-né avec son environnement stimule et stabilise les synapses et connexions qui formeront plus tard le socle du connectome singulier à chacun. Ce sont les expériences sensorielles, motrices et émotionnelles qui sélectionnent des synapses et des arborisations axonales fonctionnelles, éliminent et élaguent les axones et synapses non stimulés (
pruning
) [
11
–
13
]. Ces séquences de stabilisations progressives correspondent à des périodes sensibles ou critiques développementales plus ou moins longues, spécifiques de chaque fonction cérébrale. Les connexions végétatives, sensori-motrices, associatives pariétales, temporales puis préfrontales, se structurent progressivement jusqu’à l’âge adulte (
Figure 1A
). La qualité de l’environnement durant ces périodes sensibles de sculpture du connectome propre à chaque individu est essentiel à son bon développement [
14
]. Le connectome humain sollicite trois réseaux principaux, le réseau par défaut, le réseau du contrôle exécutif et le réseau de saillance [
15
] (
Figure 1B
). Dans le mode par défaut, le cerveau n’est engagé dans aucune tâche nécessitant de l’attention ou le traitement d’un stimulus extérieur (en éveil calme ou sommeil) à l’opposé du contrôle exécutif nécessitant la mobilisation de l’attention et la mémoire de travail dans l’adaptation de comportements vers une tâche donnée. Le réseau de saillance, singulier à chacun, s’active grâce à la perception et l’intégration de stimulus sensoriels et émotionnels en mobilisant les réseaux limbiques dont le circuit de récompense (plaisir/motivation) [
5
]. Le réseau de saillance permettrait le passage d’un fonctionnement « d’un mode par défaut » au contrôle exécutif nécessaire à l’adaptation des comportements.
|
|
Développement précoce des structures cérébrales liées au stress
Les différents systèmes cérébraux gérant les stress [
7
,
10
] (
→
) comme le système nerveux autonome, l’axe corticotrope, les réseaux monoaminergiques et les réseaux cortico-limbiques, s’installent pendant la période prénatale, suivant des séquences de développement que nous présentons dans l’
Encadré 1
[
11
–
15
] (
→
) et la
Figure 1A
[
5
,
13
]. L’ébauche des nerfs crâniens et du noyau du tractus solitaire du rhombencéphale sont en phase de différenciation vers la cinquième semaine de gestation (SG) (Verney C, observation personnelle). Les noyaux du nerf vague (le nerf crânien de la X
e
paire, pneumogastrique ou X) sont associés aux nerfs V, VII, IX, XI qui réguleront, plus tard, les fonctions sensori-motrices de la face (
Encadré 2
) [
16
–
18
]. Le lent démarrage de l’inhibition vagale, qui contrebalance l’excitation sympathique, s’effectue d’abord par la différenciation du noyau moteur dorsal du nerf vague vers la vingt-cinquième SG. La différenciation du noyau ambigu ventral, dans le bulbe (
Figure 4
), est largement dépendante de la myélinisation des efférences qui commence vers la vingt-quatrième SG et se poursuit durant la première année post-natale [
5
]. L’axe neuronal corticotrope (hypothalamo-hypophysaire-surrénalien) s’élabore pendant la période embryonnaire (jusqu’à la huitième SG) avec une différenciation s’étalant jusqu’au troisième trimestre de gestation [
5
]. La fonctionnalité des hormones du stress – dont le cortisol avant la naissance – n’est pas encore clairement établie chez le fœtus, difficilement séparable de la part maternelle. La genèse neuronale des noyaux cérébraux monoaminergiques (noradrénaline/adrénaline, dopamine, sérotonine) s’effectue entre la cinquième et la septième SG, avec l’émission d’axones ascendants et/ou descendants pendant la période fœtale [
19
–
21
]. Les efférences noradrénergique et dopaminergique corticales sont présentes selon une distribution corticale adulte, vers la fin du second trimestre de gestation [
19
]. Les différents noyaux du complexe amygdalien sont identifiables autour de la quinzième SG et sont différenciés à la naissance [
5
]. Le thalamus, fortement relié à l’amygdale, est un relai sensoriel et limbique essentiel dans l’activation corticale due au stress. Ses différents noyaux sensoriels, limbiques, moteurs et cognitifs sont identifiables vers la vingt-sixième SG. Les connexions thalamo-corticales débutent vers la dix-septième SG et se déploient jusqu’à la naissance [
5
,
13
]. Le développement des connexions corticales suit un gradient médio-latéral et postéro-antérieur [
22
]. Les connectomes des aires médianes, comme les cortex cingulaires (antérieur et postérieur), et des aires préfrontales médianes (orbito-frontal et ventro-médian) participent aux proto-réseaux de saillance
4,
et de mode par défaut
5,
(
Figure 1B
). Les données d’imagerie suggèrent que ces proto-réseaux sont actifs autour de la naissance, avant le déploiement des réseaux des fonctions exécutives (cortex préfrontal dorso-latéral) et de l’attention (réseaux pariéto-frontaux) [
13
,
23
,
24
]. À la naissance, les réseaux de l’acquisition du langage sont proches de leur aspect adulte, comme les connexions du gyrus fusiforme (responsable de la reconnaissance du visage) [
25
,
26
].
(→) Voir la Synthèse de M..P. Moisan et M. Le Moal,
m/s
n° 6-7, juin-juillet 2012, page 612
(→) Voir la Synthèse de J.P. Bourgeois,
m/s
n° 4, avril 2005, page 428
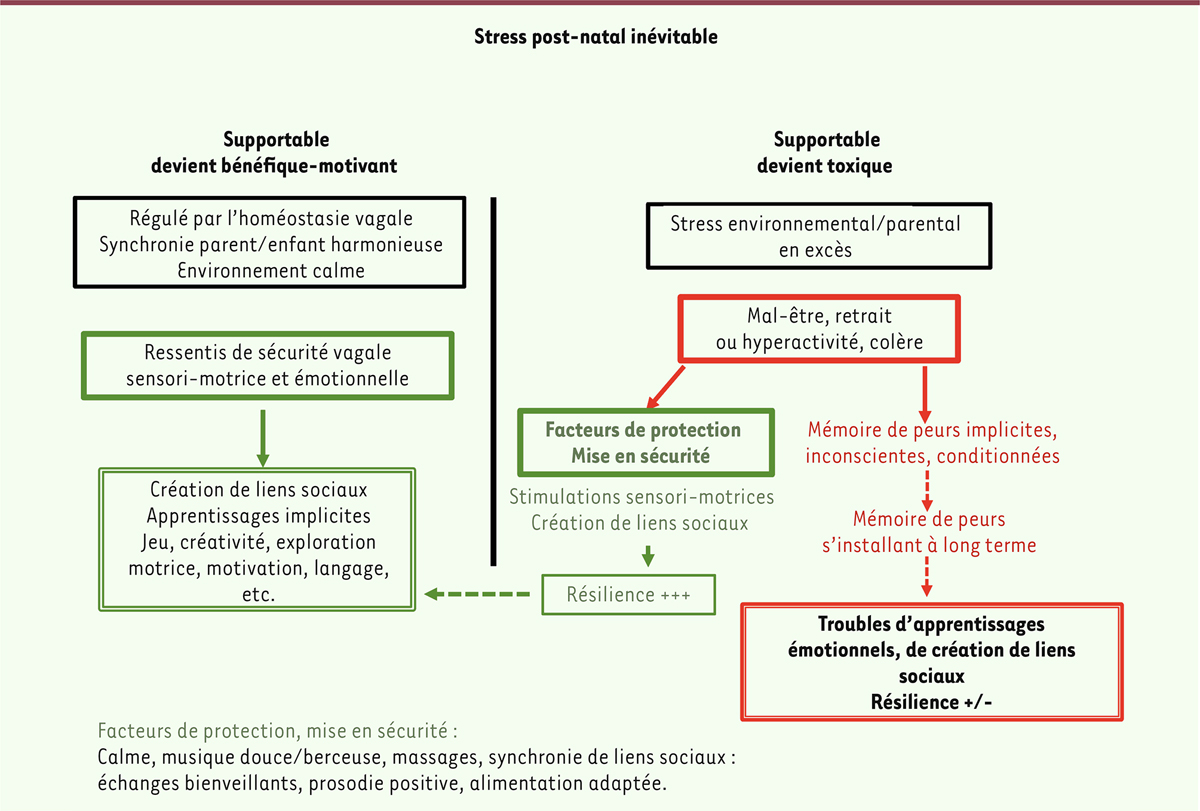
 | Figure 1.
A. Séquences de développement des systèmes cérébraux liés au stress.
Les connections du cortex cérébral (bleu azur) et la synaptogenèse corticale (bleu cobalt) s’installent vers 18 semaines de gestation (SG) et augmentent jusqu’à atteindre un pic dans les systèmes sensori-moteurs autour de la naissance. Ces évènements débutent plus tardivement, vers 15 mois postnatal, pour les cortex associatifs pariétal et temporal suivis par le cortex préfrontal. Les noyaux sous-corticaux limbiques incluent le thalamus, l’amygdale et l’hippocampe (rose). Les structures impliquées dans la régulation du stress, système nerveux autonome et axe corticotrope (hypothalamo-hypophysaire-surrénalien), apparaissent en jaune. Les cycles de myélinisation (vert) de différents réseaux du connectome débutent vers le troisième trimestre de gestation et se terminent vers l’âge de 20 ans (adapté de [
5
,
12
]) L’intensité de chaque couleur représente le degré de maturation/fonction de chaque système.
B. Les trois principaux réseaux cérébraux actifs autour de la naissance
(voir
encadré 1
). Le réseau du mode par défaut s’active lors du sommeil et de l’éveil calme (intéroception) et se désactive lors du traitement d’un stimulus extérieur par le réseau des fonctions exécutives nécessitant de l’attention dirigée vers l’exécution d’une tâche (cortex préfrontal dorso-latéral [cPFdl], gyrus angulaire [gA], précuneus [PrCu]). Ce dernier réseau va se renforcer séquentiellement avec les apprentissages. À la naissance, deux réseaux sont fortement interconnectés : 1) le réseau du mode par défaut, incluant le cortex préfrontal médian (cPFm), le cortex cingulaire postérieur (cCp), le lobule pariétal inférieur (lPi) et le gyrus temporal médian (gTm), et 2) le réseau de saillance, incluant le cortex préfrontal médian (cPFm), le cortex orbito-frontal (cOF), le cortex cingulaire antérieur (cCa), l’insula (Ins) et l’amygdale (Amy). Le réseau de saillance est activé dans la perception et l’intégration de stimulus émotionnels et sensoriels. Il fait la transition entre le réseau de mode par défaut (
control
«
top-down
») et les fonctions exécutives (processus de référence du moi) nécessaires pour l’adaptation des comportements à son environnement (adapté de [
14
]).
|
 | Figure 4.
Coupe frontale du bulbe schématisant le système polyvagal et ses différentes fonctions
(figure adaptée de Neuroclub, université de Genève).
|
Le stress chronique subit par les très grands prématurés induit une hyperactivation du proto-réseau de saillance, au détriment de l’activation du proto-réseau du mode par défaut [
24
]. Mais la confirmation d’un possible effet du stress à long terme sur ces connectomes est loin d’être établie, du fait de la variabilité inter-individuelle et de la remarquable plasticité observée dans ces réseaux synaptiques au cours du développement.
|
Conséquences des stress sur le développement biologique, psychique et social durant les 1 000 premiers jours du bébé en devenir |
Les modifications épigénétiques dépendantes de la temporalité et de l’intensité du stress
L’adversité environnementale, dont le stress périnatal sous des formes très variées, peut induire chez la mère, en particulier au niveau du placenta, chez le fœtus et chez le nouveau-né, des modifications épigénétiques ayant un effet sur les régulations de l’axe corticotrope (cortisol), de l’inflammation, des systèmes monoaminergiques, des neuropeptides et sur le microbiote intestinal [
3
]. Les mécanismes peuvent impliquer un changement de l’état de méthylation de l’ADN, l’acétylation ou la phosphorylation des histones ou des ARN non codants [
1
]. Chez l’adulte sain, l’exposition au stress induit l’expression d’un ensemble de gènes codant des médiateurs de l’inflammation, la réponse CTRA (
conserved transcriptional response to adversity
) [
27
]. Durant le troisième trimestre de la grossesse, l’exposition à un stress intense entraîne une libération accrue de cytokines pro-inflammatoires, IL(interleukine)-1, IL-6 et TNF-α (
tumor necrosis factor alpha
), et de CRP (protéine C-réactive), qui peuvent conduire
in fine
à une parturition prématurée. Chez la mère, le stress induit également une augmentation de la libération du cortisol circulant. Le cortisol sera néanmoins inactivé en grande partie en cortisone par le placenta (
via
l’action de la HSD11B2 [
corticosteroid 11-beta-dehydrogenase 2
]). Parallèlement, les méthylations du gène
HSD11B
, qui code l’HSD11B, mais aussi du gène
NR3C1
(
nuclear receptor subfamily 3 group C member 1
), qui code le récepteur des glucocorticoïdes, sont augmentées, réduisant leur expression [
28
]. L’arrivée massive de cortisol module l’expression de différents gènes, dont
FKBP5 (FK506-binding protein 51)
qui code une protéine qui réduit l’affinité entre le cortisol et ses récepteurs. Le stress maternel pendant la grossesse a été corrélé à l’augmentation de la méthylation de
FKBP5
chez le nouveau-né, réduisant sa capacité à lier le cortisol, ce qui le prédispose à développer une forte agitation à la naissance [
29
] (
Figure 2
). Le stress gestationnel dérégule les taux de monoamines
6
circulantes et des taux élevés d’adrénaline et de noradrénaline entraînent une vasoconstriction et une réduction des flux sanguins fœtaux et placentaires, pouvant mener à des retards de croissance [
2
]. D’autres altérations épigénétiques sont observées à la suite d’un stress précoce, comme la modification persistante du gène
BDNF
(
brain-derived neurotrophic factor
), qui code une neurotrophine essentielle à la plasticité cérébrale. Le dosage sanguin du BDNF permettrait de déceler une vulnérabilité comportementale qui aura été induite par l’exposition à un stress environnemental [
30
]. Les stress vécus par les jeunes enfants induisent, à terme, et « par compensation », une moins bonne réactivité de l’axe corticotrope et une hyperméthylation persistante (durant 8 à 16 ans) du gène
SLC6A4
(
solute carrier family 6 member 4
) qui code le transporteur de la sérotonine (SERT
). SLC6A4
apparaît important pour la réponse au stress et différents polymorphismes ont été décrits, associés soit à une prédisposition à la résilience, soit à une hypersensibilité. Ces modifications ont ainsi été associées, chez les jeunes enfants, à une moins bonne capacité à réguler l’humeur et à de l’hyperactivité [
31
]. Parmi les neuropeptides ou neurohormones, l’ocytocine joue un rôle important. Elle régule le déclenchement de l’accouchement et de l’allaitement, et favorise les relations d’attachement entre mère et enfant. Or, le cortisol et l’hyperactivation du système sympathique inhibent la libération d’ocytocine par l’hypophyse [
31
].
 | Figure 2.
Chez un prématuré et/ou un nouveau-né à terme subissant diverses adversités/stress chroniques
, les différentes régulations biologiques amenant vers la résilience sont celles : 1) de l’axe corticotrope (hypothalamo-hypophysaire-surrénalien), conduisant vers une homéostasie des hormones du stress (ACTH [
adreno-corticotropic hormone
], CRF [
corticotropin-releasing factor
]) et du cortisol ; 2) du système polyvagal du système ventral (NA : noyau ambigu) ; 3) de la régulation de l’expression de certains gènes :
NR3C1
,
HSD11B
,
FKBP5…
(épigénome) ; 4) des réseaux cérébraux de gestion des émotions, en particulier ceux induisant l’inhibition amygdalienne (rouge foncé : cortex limbique, vert ; cortex associatif). Les dérégulations de ces systèmes peuvent altérer l’homéostasie cérébrale lorsqu’elles surviennent lors de périodes développementales critiques (végétatives, sensorielles, sensori-motrices, limbiques) et être à l’origine de la résilience ou d’une vulnérabilité ultérieure.
|
|
2 Les multiples fonctions du nerf vague - La théorie polyvagale (d’après
[
16
,
17
,
47
]) (
Figure 4
)
Autour de la naissance, le tonus vagal maintient l’homéostasie physiologique des différents organes, en particulier des rythmes cardio-respiratoires. Il agit comme un frein en inhibant l’activation sympathique, ce qui permet de maintenir une fréquence cardiaque basse et d’ajuster le débit sanguin au métabolisme. Le noyau moteur dorsal du vague, végétatif et qui é met des terminaisons non myélinisées, régule plutôt les adaptations cardiaques fines. En complément, le noyau ambigu, source ventrale du nerf vague myélinisé, garantit une adaptation cardiaque et métabolique rapide en toutes circonstances. Le noyau ambigu a de multiples connexions avec les noyaux des nerfs crâniens contrôlant les muscles de la face et de la tête (mimiques, vocalises, é coute, vision), l’amygdale, l’hypothalamus (axe corticotrope), les aires corticales temporales et pariétales. Ces connexions créent une synergie entre les é tats viscéraux et les comportements sociaux spontanés par des voies rétroactives (
feedback
). Le système vagal myélinisé commence à être fonctionnel vers le troisième trimestre de la gestation, intégrant progressivement durant la première année de vie les régulations corticales matures. Le système polyvagal ventral active les voies sensori-motrices faciales du bébé associées à la neuroception. Il permet la détection d’indices indiquant si l’environnement est dangereux ou pas, si les personnes sont dignes de confiance, ce qui désactive les mécanismes de défense et contribue à l’engagement social et à l’attachement [
16
-
18
]. Stephen Porges souligne le rôle capital du système nerveux autonome dans la régulation de l’affect, des é motions et du comportement. «
La psychophysiologie polyvagale est une tentative d’unifier la notion corps-esprit dans un continuum d’action-réaction reliant le monde extérieur au monde intérieur
» [
16
,
47
].
|
|
La théorie polyvagale, attachement et liens psycho-sociaux
La théorie polyvagale développe le concept de l’homéostasie vagale des différents organes et des liens psycho-sociaux dès la fin de la gestation et autour de la naissance [
16
,
17
]. Comme nous l’avons indiqué (
Encadré 2
et
Figure 2
,
4
), le système vagal myélinisé est impliqué dans les capacités d’harmonisation physiques et rythmiques précoces des bébés, en miroir avec leurs figures parentales, comme l’expression faciale, l’hypersensibilité auditive et la prosodie
7
. Les synchronies vagales entre la mère et l’enfant s’évaluent par la conductance de la peau, la fréquence cardiaque et l’arythmie sinusale respiratoire (ASR) (index du tonus vagal ventral) [
33
]. Dès la naissance, le tempérament de certains nouveau-nés s’exprime fortement, par des mimiques nombreuses et expressives, en miroir à des stimulus positifs (proposés par les parents ou les soignants). Pour d’autres, ces mimiques restent peu expressives [
34
]. Les nouveau-nés expressifs présentent une arythmie sinusale élevée différente de celle observée chez les nouveau-nés peu expressifs. Les mères anxieuses, dépressives et même en colère, présentent une faible activité vagale. Ces dernières présentent par ailleurs des taux de cortisol élevés, associés à des faibles niveaux de dopamine et de sérotonine.
Les synchronies comportementales d’expressions positives et négatives, entre le nouveau-né et sa mère, ont été classées par Thomas Berry Brazelton
8
en trois catégories selon les expressions faciales : heureuses, tristes ou surprises. Elles sont extrêmement rapides et réversibles, comme le montre le test de « face à face impassible » (
still face
) développé par Brazelton et Edward Tronick [
35
].
Chez le nouveau-né, l’attachement est lié intimement aux échanges par imitation avec les figures d’attachement. C’est donc une bonne gestion des émotions de la personne prenant en charge le nouveau-né (parents ou autres personnes) qui initiera, en miroir, des synchronisations harmonieuses d’attachement du bébé [
18
]. Dans le cas d’un stress toxique dû à l’environnement du bébé, des évaluations cliniques quantifiables seront essentielles afin de poser un diagnostic/pronostic et agir le plus tôt possible afin de le protéger.
|
Adaptations du connectome limbique et stress pendant les 1 000 premiers jours
Le proto-réseau saillant impliqué dans la gestion des émotions et les réactions au stress est présent dès le troisième trimestre de gestation (
Figure 1B
). Le stress d’une naissance extrêmement prématurée (avant la vingt-neuvième SG) induit chez le nouveau-né une réduction significative du volume du noyau de l’amygdale, en comparaison avec celui de bébés nés à terme [
36
], chez lesquels le complexe amygdalien atteint un fonctionnement proche de celui observé chez l’adulte. Suite à un stress intense et prolongé, le complexe amygdalien peut s’hypertrophier [
37
,
38
]. Entre l’amygdale et le cortex préfrontal médian, des boucles rétroactives fonctionnelles (
feedback
) ont été identifiées dès quatre jours après la naissance. Les sensations de peur, dues à un stress toxique, activent ces boucles rétroactives, principalement à partir de l’amygdale (de « bas en haut » ou
bottom-up
). Ces boucles stimulées induisent une suractivité des synapses excitatrices, à l’origine d’une augmentation des arborisations axonales et du volume de l’amygdale, par la plasticité cérébrale. L’inhibition amygdalienne, sensée gérer cet excès d’excitation provoquée par la peur [
7
], est altérée dans son installation, en pleine période critique de développement (
Encadré 1
et
Figure 2
), ce qui peut entraver les régulations au niveau limbique et préfrontal à long terme [
37
,
38
]. Des stress intenses/chroniques, durant les 1 000 premiers jours, peuvent modeler anormalement les circuits des « mémoires de peur implicites et inconscientes » ancrées dans le striatum limbique, comme des réflexes conditionnés positifs ou négatifs, avant que les mémoires explicites conscientes hippocampiques, le « je me souviens », s’établissent chez l’enfant à partir de deux-trois ans. Si les adversités sont répétées, les mémoires de peur se consolident en mémoire à long terme, associées à l’installation de modifications morphologiques et épigénétiques que nous avons présentées (
Figure 3
). La remarquable plasticité et la résilience développementales observées chez un enfant sain [
4
] peuvent être entravées par des altérations épigénétiques dont celles du gène
BDNF
pendant les périodes critiques/sensibles (
Encadré 1
).
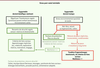 | Figure 3.
Trop de stress, non gérable par les plasticités cérébrales et émotionnelles singulières à chacun, installe la peur, la crainte de séparation, et un mal être [
17
]. Dans un environnement non sécurisé, le nouveau-né cesse d’explorer et devient mutique, ou il manifeste sa détresse par des pleurs, de la colère et une hyperactivité excessive avec toutes les nuances pouvant s’exprimer entre ces deux états. Ces comportements observés par des tiers et/ou évalués dans des services hospitaliers dédiés [
5
] donnent l’alerte sur la souffrance du bébé et orientent vers une mise en sécurité avec des facteurs de protection et de soutien à la parentalité [
4
].
|
Les données concernant les épigénomes montrent combien ces épigénomes sont spécifiques à chaque individu, dans son héritage transgénérationnel singulier, évoluant constamment au contact de l’environnement, de l’adversité à la résilience. Ces évolutions épigénétiques semblent participer au développement ultérieur de troubles physiques, psychiques et comportementaux [
2
,
3
,
39
] (
→
).
(→) Voir la Synthèse de C. Junien
et al
.,
m/s
n° 1, janvier 2016, page 35
Comme cela a été noté par Boris Cyrulnik, «
dès avant la naissance apparaît une mémoire sans souvenir que précèdent les traces de ce dont nous sommes issus. Ces traces de vie nous submergent ou nous manquent, nous enchantent ou nous hantent, nous subliment ou nous sidèrent lorsqu’elles sont liées à l’innommable
» [
40
].
|
Comment soutenir l’adaptation au stress du bébé vulnérable et en devenir pendant les 1 000 premiers jours
Le risque d’être exposé à un stress sévère pendant l’enfance reste élevé, quel que soit le lieu où vit l’enfant, et peut atteindre une prévalence de 50 % dans des quartiers qui sont sous l’influence de la violence et de la criminalité [
38
,
41
]. Dans ces quartiers, certains enfants présentent des lésions cortico-limbiques qui peuvent être objectivées par imagerie cérébrale, avec des anomalies déjà détectées en prénatal chez des mères enceintes. L’adversité correspond aux maltraitances et aux violences domestiques et environnementales, mais aussi à des risques biologiques, de malnutrition, d’un environnement toxique, avec des risques d’infections [
42
]. Il est donc nécessaire de développer des politiques de prévention, avec un soutien précoce à la parentalité, afin d’éviter l’installation de dérégulations durables dans le corps et le cerveau du nouveau-né. La plupart des nouveau-nés intègrent ces stress comme des stress tolérables, et développent de la résilience, démontrant plus de motivation pour les affronter plus tard (
Figure 3
). D’autres enfants, plus vulnérables, seront plus ou moins traumatisés, avec des conséquences variées sur la régulation de leurs émotions et leur santé. Dans les services de néonatologie, les grands prématurés sont traités systématiquement par des corticoïdes afin de soutenir leur système corticotrope et leurs fonctions cardio-respiratoires [
42
]. Le stress omniprésent est perçu par le prématuré. Il a d’ailleurs des conséquences sur son microbiote intestinal [
5
,
43
] ensemencé naturellement par la flore intestinale de la mère lors d’un accouchement par voie basse ou par les germes ambiants après une césarienne. Le rôle du microbiote intestinal dans l’homéostasie du nouveau-né est de plus en plus documenté et l’allaitement est préconisé comme un facteur positif pour un meilleur développement [
13
]. Les enfants prématurés hospitalisés, qui subissent ces conditions en plus de la séparation d’avec leur mère, voient leur stress augmenter avec l’abondance des sons, de lumière, d’odeurs, de douleurs qu’ils rencontrent dans ce milieu [
5
]. Des protocoles de protection sensorielle, comme le système NIDCAP (
newborn individualized developmental care and assessment program
) [
5
,
44
] ont été élaborés afin de minimiser ces différentes agressions sensorielles. Plus tard, les stimulations sensorielles passives comme celles induites par les écrans sont inadaptées au nouveau-né. Les enfants prématurés, comme les autres enfants, ont des compétences [
4
]. Il a en effet été montré que la lecture de contes, par exemple, améliorait la capacité de vocabulaire de ces enfants, plus tard au cours de leur développement. Néanmoins, la séparation du bébé d’avec sa mère perturbe son auto-régulation vagale et les synchronies essentielles au déploiement de son attachement et de ses liens sociaux. Dans certains services, des
family rooms
permettent de les rapprocher de leurs parents. La méthode « Kangourou », mise en place en Colombie à Bogota il y a plus de 35 ans en réponse aux prises en charge désastreuses de très grands prématurés (des enfants nés à la vingt-sixième SG et pesant 600 g) palie cet éloignement [
45
]. Cette méthode de « peau à peau » d’un des parents avec son bébé né prématuré ou à terme s’avère très bénéfique. Elle rétablit la synchronie vagale cardio-respiratoire, l’homéostasie thermique, l’organisation d’un sommeil paisible, et renforce les comportements d’attachements entre le bébé et ses parents. Associés à une diminution d’activation de l’axe corticotrope, les systèmes ocytocinergiques (ocytocine circulante et réseaux neuronaux centraux) sont stimulés chez la mère et le nouveau-né [
45
,
46
]. Une concentration élevée d’ocytocine chez la mère, en interaction avec le système de plaisir (récompense) dopaminergique, contribue à l’émergence de satisfaction, d’émotions positives envers son bébé et envers elle-même. Le ressenti de bien-être/de sécurité du bébé découle de l’interprétation subjective d’un état de calme autonome, régulé par les réseaux vagaux myélinisés, en miroir et en synchronie avec ceux de sa mère ou de la personne qui le prend en charge [
18
]. Le nouveau-né se développe, apprend et est stimulé, en expérimentant et en imitant son entourage. Tout ressenti de distance, de stress, d’anxiété, même inconsciente, chez la personne le prenant en charge (parent ou soignant) induit des interprétations négatives [
4
,
35
,
47
]. Dans la vie quotidienne, des stress occasionnels, souvent intéroceptifs (comme des troubles digestifs) mais aussi environnementaux, sont inévitables et peuvent perturber la relation entre la mère, l’enfant et les soignants, avec des colères et des incompréhensions réciproques (
Figure 3
).
Les bercements, les échanges positifs de mimiques et de babillages, des massages, de la musique douce et autres pratiques, permettent le retour au calme et au ressenti de sécurité par le bébé. Ces pratiques mènent à une homéostasie limbique positive des réseaux de saillance et du mode par défaut, ouvrant la voie aux apprentissages implicites par analogie avec les premières fonctions exécutives associées au raffinement des réseaux sensori-moteurs et de l’attention. Dès sa naissance, le nouveau-né dispose de nombreuses compétences [
4
]. Il reconnait sa mère par ses perceptions sensorielles et, rapidement, les personnes de son environnement. Il apprend, en expérimentant. Il est plus intéressé par ce qu’il ne connaît pas que par ce qu’il connait déjà. Naturellement, il est altruiste. Il expérimente par ses sens et sa motricité et par tous les jeux qui se présentent à lui.
En condition de stress, ce bébé sera perturbé, distrait, mais lorsque la tranquillité reviendra, il retrouvera rapidement un ressenti de calme. Aussi, s’il ressent sa mère/un parent ou un soignant comme stressé, il est conseillé de déléguer sa prise en charge à une autre personne [
47
]. Il est donc important d’élargir le cercle d’adultes susceptibles de le prendre en charge [
4
]. Comme le mentionne le psychiatre David Gourion dans son manuel anti-stress [
48
] : «
La plupart des personnes qui se sentent heureuses depuis l’enfance ne souffrent pas de stress. Elles gèrent leur stress naturellement
».
Le ressenti de bien-être et de sécurité permet au bébé d’intégrer les stress adaptatifs auxquels il est soumis, tout en développant ses capacités d’apprentissages implicites, de créativité, avec curiosité et motivation. Toutes les préconisations de prises en charges des bébés, développées dans le rapport des 1 000 premiers jours [
4
], ont pour but le bon déroulement de cette période critique de vulnérabilité, si importante pour le devenir physique et psychique de l’enfant.
|
Les auteures déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Tania Vitalis remercie la Fondation de France (Eng 00089602) et la Fondation pour la recherche sur le cerveau – programme « Adaptation du cerveau à son environnement » – pour leurs subventions. Daniel Verney est remercié pour sa lecture critique de l’article.
|
Footnotes |
1.
Junien
C
,
Panchenko
P
,
Pirola
L
,
et al.
Le nouveau paradigme de l’origine de la santé et des maladies (DOHaD). Épigénétique, environnement : preuves et chaînons manquants.
.
Med Sci (Paris).
2016;
;
32
:
:27.
–
34
.
2.
Storme
L
,
Luton
D
,
Abdennebi-Najar
L
,
et al.
DOHaD : conséquences à long terme de la pathologie périnatale. Retard de croissance intra-utérin et prématurité.
.
Med Sci (Paris).
2016;
;
32
:
:74.
–
80
.
3.
Nobile
,
S
,
Di Sipio Morgia
,
C
,
Vento
,
G
.
Perinatal Origins of Adult Disease and Opportunities for Health Promotion: A Narrative Review.
.
J Pers Med.
2022;
;
12
:
:157.
.
5.
Lammertink
F
,
Vinkers
CH
,
Tataranno
ML
,
et al.
Premature Birth and Developmental Programming: Mechanisms of Resilience and Vulnerability.
.
Front Psychiatry.
2021;
;
11
:
:531571.
.
6.
Andersen
SL
.
Exposure to early adversity: Points of cross-species translation that can lead to improved understanding of depression.
.
Dev Psychopathol.
2015;
;
27
:
:477.
–
491
.
7.
Verney
C
,
Gressens
P
,
Vitalis
T
.
anatomie et physiologie du stress traumatique.
.
Med Sci (Paris).
2021;
;
37
:
:1002.
–
10
.
8.
National Scientific Council on the Developing Child.
.
Excessive stress disrupts the architecture of the developing brain: Working paper No. 3.
. (
2005
/2014).
www.developingchild.harvard.edu
.
9.
Cyrulnik
B
.
Un merveilleux malheur.
.
Paris:
:
Ed. Odile Jacob;
,
1999
:
:237.
p.
10.
Moisan
MP
,
Le Moal
M
.
Le stress dans tous ses états.
.
Med Sci (Paris).
2012;
;
28
:
:612.
–
617
.
11.
Huttenlocher
PR
,
Dabholkar
AS
.
Regional differences in synaptogenesis in human cerebral cortex.
.
J Comp Neurol.
1997;
;
387
:
:167.
–
178
.
12.
Bourgeois
JP
.
Synaptogenèses et épigenèses cérébrales.
.
Med Sci (Paris).
2005;
;
21
:
:428.
–
433
.
13.
Ouyang
M
,
Dubois
J
,
Yu
Q
,
et al.
Delineation of early brain development from fetuses to infants with diffusion MRI and beyond.
.
Neuroimage.
2019;
;
15
:
:836.
–
850
.
14.
Nelson
CA
,
Gabard-Durnam
L
.
Early adversity and critical Periods: Neurodevelopmental consequences of violating the expectable environment.
Trends Neurosci.
2020;
;
43
:
:133.
–
43
.
15.
Bressler
SL
,
Menon
V
.
Large-scale brain networks in cognition: emerging methods and principles Trends.
.
Cogn Sci.
2010;
;
14
:
:277.
–
290
.
16.
Porges
SW
.
La théorie polyvagale. Fondements neurophysiologiques des émotions, de l’attachement, de la communication et de l’autorégulation.
.
Paris:
:
ecp Sciences;
,
2021
:
:373.
p.
17.
Porges
SW
.
Polyvagal Theory: A Science of Safety.
.
Front Integr Neurosci.
2022;
;
16
:
:871227.
.
18.
Pierrehumbert
B
.
Le premier lien. Théorie de l’attachement.
.
Paris:
:
Odile Jacob;
,
2003
:
:416.
p.
19.
Verney
C.
.
Distribution of the Catecholaminergic neurons in the Central Nervous System of human embryos and fetuses.
.
Microsc Res and Tech.
1999;
;
46
:
:24.
–
47
.
20.
Verney
C
,
Lebrand
C
,
Gaspar
P
.
Changing distribution of monoaminergic markers in the developing human cerebral cortex with special emphasis on the serotonin transporter. anat.
.
Record.
2002;
;
267
:
:87.
–
93
.
21.
Kinney
HC
,
Broadbelt
KG
,
Haynes
RL
,
et al.
The serotonergic anatomy of the developing human medulla oblongata: implications for pediatric disorders of homeostasis.
.
J Chem Neuroanat.
2011;
;
41
:
:182.
–
199
.
22.
van den Heuvel
MI
,
Thomason
ME
.
Functional connectivity of the human brain in utero.
.
Trends Cogn Sci.
2016;
;
20
:
:931.
–
939
.
23.
Menon
V.
.
Large-scale brain networks and psychopathology: a unifying triple network model Trends.
.
Cogn Sci.
2011;
;
15
:
:10.
.
24.
Lammertink
F
,
van den Heuvel
MP
,
Hermans
EJ
,
et al.
Early-life stress exposure and large-scale covariance brain networks in extremely preterm-born infants.
.
Translational Psychiatry.
2022;
;
12
:
:256.
.
25.
van den Heuvel
MI
,
Turk
E
,
Manning
JH
.
Hubs in the human fetal brain network.
.
Dev Cog Neurosci.
2018;
;
30
:
:108.
–
115
.
26.
Dubois
J
,
Poupon
C
,
Thirion
B
,
et al.
Exploring the Early Organization and Maturation of Linguistic Pathways in the Human Infant Brain.
.
Cerebral Cortex.
2016;
;
26
:
:2283.
–
2298
.
27.
Ross
KM
,
Cole
SW
,
Carroll
JE
,
et al.
Elevated pro-inflammatory gene expression in the third trimester of pregnancy in mothers who experienced stressful life events.
.
Brain Behav Immun.
2019;
;
76
:
:97.
–
103
.
28.
Capron
LE
,
Ramchandani
PG
,
Glover
V
.
Maternal prenatal stress and placental gene expression of NR3C1 and HSD11B2: The effects of maternal ethnicity.
.
Psychoneuroendocrinology.
2018;
;
87
:
:166.
–
172
.
29.
Monk
C
,
Feng
T
,
Lee
S
,
et al.
Distress during pregnancy: Epigenetic regulation of placenta glucocorticoid-related genes and fetal neurobehavior.
.
Am J Psychiatry.
2016;
;
173
:
:705.
–
713
.
30.
Kundakovic
M
,
Gudsnuk
K
,
Herbstman
JB
,
et al.
DNA methylation of BDNF as a biomarker of early-life adversity.
.
Proc Natl Acad Sci U S A.
2015;
;
112
:
:6807.
–
6813
.
31.
Timothy
A
,
Benegal
V
,
Shankarappa
B
,
et al.
Influence of early adversity on cortisol reactivity, SLC6A4 methylation and externalizing behavior in children of alcoholics.
.
Prog Neuropsychopharmacol Biol Psychiatry.
2019;
;
94
:
:109649.
.
32.
Walter
MH
,
Abele
H
,
Plappert
CF
.
The Role of Oxytocin and the Effect of Stress During Childbirth: Neurobiological Basics and Implications for Mother and Child.
.
Front Endocrinol.
2021;
;
12
:
:742236.
.
33.
Busuito
A
,
Quigley
KM
,
Moore
GA
,
et al.
In sync: Physiological correlates of behavioral synchrony in infants and mothers.
.
Dev Psychol.
2019;
;
55
:
:1034.
–
1045
.
34.
Field
T
,
Diego
M
,
Hernandez-Reif
M
.
Prematurity and potential predictors.
.
Int J Neurosci.
2008;
;
118
:
:277.
–
289
.
35.
Tronick
E
,
Als
H
,
Adamson
L
,
et al.
The infant’s response to entrapment between contradictory messages in face-to-face interaction.
.
J Am Acad Child Psychiatry.
1978;
;
17
:
:1.
–
13
.
36.
Cismaru
AL
,
Gui
L
,
Vasung
L
,
et al.
Altered amygdala development and fear processing in prematurely born infants.
.
Front Neuroanatomy.
2016;
;
10
:
:55.
.
37.
Humphreys
KL
,
Camacho
MC
,
Roth
MC
,
et al.
Prenatal stress exposure and multimodal assessment of amygdala-medial prefrontal cortex connectivity in infants.
.
Dev Cogn Neurosci.
2020;
;
46
:
:100877.
.
38.
Brady
RG
,
Rogers
CE
,
Prochaska
T
,
et al.
The Effects of Prenatal Exposure to Neighborhood Crime on Neonatal Functional Connectivity.
.
Biol Psychiatry.
2022;
;
92
:
:139.
–
48
.
39.
Junien
C
,
Panchenko
P
,
Fneich
S
,
et al.
Épigénétique et réponses transgénérationnelles aux impacts de l’environnement.
.
Des faits aux lacunes. Med Sci (Paris).
2016;
;
32
:
:35.
–
44
.
40.
Cynulnik
B
.
Des âmes et des saisons.
.
Paris:
:
Odile Jacob;
,
2021
:
:297.
p.
41.
Kaiser
RH
,
Clegg
R
,
Goer
F
.
Childhood Stress, Grown-up Brain Networks: Corticolimbic Correlates of Threat-related Early Life Stress and Adult Stress.
.
Response Psychol Med.
2018;
;
48
:
:1157.
–
1166
.
42.
Ramaswamy
VV
,
Bandyopadhyay
T
,
Nanda
D
,
et al.
Assessment of postnatal corticosteroids for the prevention of bronchopulmonary dysplasia in preterm neonates: A systematic review and network meta-analysis.
.
et al.
JAMA Pediatr.
2021;
;
1
:
:175.
.
43.
Indrio
F
,
Martini
S
,
Francavilla
R
,
et al.
Epigenetic Matters: The Link between Early Nutrition, Microbiome, and Long-term Health Development.
.
Front Pediatr.
2017;
;
5
:
:178.
.
44.
Aita
M
,
De Clifford Faugère
G
,
Lavallée
A
,
et al.
Effectiveness of interventions on early neurodevelopment of preterm infants: a systematic review and meta-analysis.
.
BMC Pediatrics.
2021;
;
21
:
:210.
.
45.
Jefferies
AL
.
Société canadienne de pédiatrie, Comité d’étude du foetus et du nouveau-né. La méthode kangourou pour le nourrisson prématuré et sa famille.
.
Paediatrics & Child Health.
2012;
;
17
:
:144.
–
146
.
46.
Moberg
KU
,
Handlin
L
,
Petersson
M
.
Neuroendocrine mechanisms involved in the physiological effects caused by skin-to-skin contact – With a particular focus on the oxytocinergic system.
.
Infant Behav and Dev.
2020;
;
61
:
:101482.
.
47.
der Kolk
BV
.
Le corps n’oublie rien; Le cerveau, l’esprit et le corps dans la guérison du traumatisme.
.
Paris:
:
Albin Michel;
,
2018
:
:590.
p
48.
Gourion
D
.
Méthode anti-stress.
.
Paris:
:
Ed. Marabout;
,
2022
:
:224.
p.
|