| |
| Med Sci (Paris). 39(11): 809–813. doi: 10.1051/medsci/2023148.La phosphoprotéine P du virus de la rage inhibe la protéine kinase TBK1 et interfère avec des condensats liés à l’immunité innée Damien Glon,1 Nathalie Scrima,1 Quentin Nevers,1 Cécile Lagaudrière-Gesbert,1* and Yves Gaudin1** 1Institut de biologie intégrative de la cellule (I2BC), CEA, CNRS, université Paris-Saclay
,
Gif-sur-Yvette
,
France MeSH keywords: Humains, Rage (maladie), Immunité innée, Protein-Serine-Threonine Kinases, Phosphorylation |
Voies d’induction des interférons
La synthèse et la secrétion des interférons (IFN) sont déclenchées par la reconnaissance de motifs moléculaires spécifiques, portés par les agents infectieux pathogènes (
pathogen-associated molecular patterns,
PAMP), par des protéines cellulaires appelées PRR (
pattern recognition receptors
). La liaison des IFN à leurs récepteurs, présents à la surface de toutes les cellules, déclenche une cascade de signalisation qui augmente l’expression de centaines de gènes (les ISG pour
interferon-stimulated genes
). Lors d’une infection, les produits des ISG permettent d’établir un état antiviral qui va limiter la réplication et la propagation du virus. Deux familles de PRR, ceux de type Toll (
Toll-like receptors
, TLR) et ceux de type RIG-I (
Rig-I-like receptors
, RLR), sont impliquées dans la reconnaissance des virus à ARN [
1
].
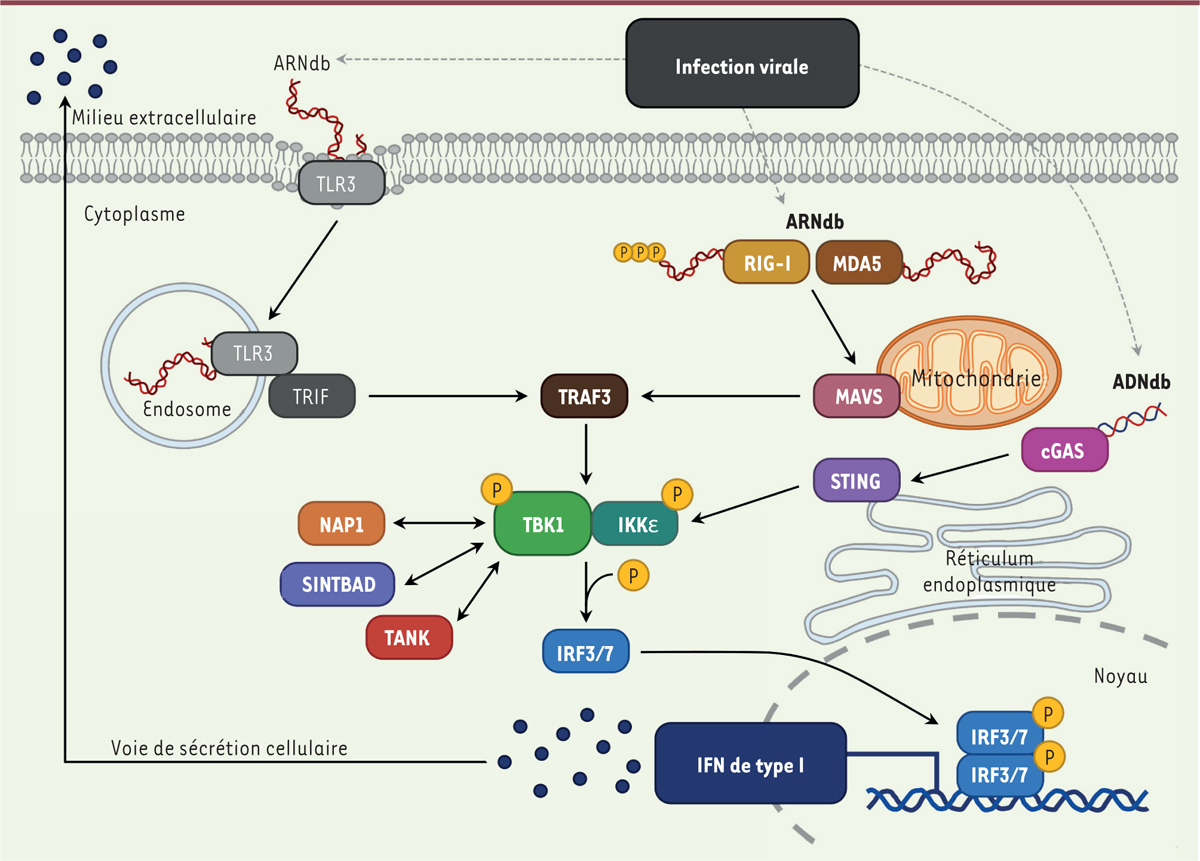
Les TLR sont des protéines transmembranaires présentes à la surface de la cellule ou dans ses compartiments endosomiques. TLR3, qui reconnaît des ARN double brin (ARNdb), est un acteur essentiel de la détection des virus à ARN. La liaison de TLR3 aux ARNdb déclenche une cascade de signalisation qui conduit à la phosphorylation de la protéine kinase TBK1 (
TANK-binding kinase 1
) qui, ainsi activée, phosphoryle à son tour les facteurs de transcription IRF3 ou IRF7, entraînant leur homo- ou hétéro-dimérisation. Ces dimères d’IRF3 et d’IRF7 induisent la transcription des gènes codant les IFN de type I (IFN-I) [
2
] (
Figure 1
).
 | Figure 1.
TBK1 est au carrefour des voies d’induction de l’interféron.
La détection d’une infection virale par les différentes familles de PRR (TLR, RLR et senseurs d’ADN cytosolique) conduit à l’activation de la protéine kinase TBK1. Cette dernière assure la phosphorylation des facteurs IRF3 et IRF7, ce qui active la transcription des gènes codant les interférons de type I (IFN-I). Par ailleurs, TBK1 forme aussi des complexes avec des protéines adaptatrices, dont la fonction est mal connue.
|
RIG-I et MDA-5 (
melanoma differentiation-associated protein 5
) sont des RLR reconnaissant les ARN étrangers dans le cytoplasme de la cellule. RIG-I est activé par de courtes séquences d’ARNdb ayant des extrémités 5’ di- ou tri-phosphorylées. MDA-5 est activée par de plus longues séquences d’ARNdb, indépendamment de l’état de phosphorylation de leurs extrémités 5’. Ces récepteurs sont des hélicases qui contiennent deux domaines d’activation et de recrutement des caspases (les domaines CARD) à leur extrémité N-terminale. La liaison à l’ARNdb déclenche un changement de conformation des RLR exposant les domaines CARD, ce qui permet leur association avec un domaine de même nature de la protéine MAVS (
mitochondrial antiviral-signaling protein
), présente à la membrane externe de la mitochondrie. Cette interaction induit une oligomérisation de MAVS et un assemblage de complexes qui activent TBK1. Comme dans la voie des TLR, cela induit l’activation de IRF3 ou de IRF7, et
in fine
, l’expression des IFN-I
(
Figure 1
)
[
3
].
De nombreuses protéines cellulaires sont associées à la voie d’induction de l’IFN. Parmi elles, les protéines dites adaptatrices, NAP1 (
NAK-associated protein 1
), SINTBAD (
similar to NAP1 TBK1 adaptor
) et TANK (
TRAF-family member associated NF-
κ
B activator
), qui s’associent à TBK1
(
Figure 1
)
. Ces protéines contribueraient à activer la voie d’induction de l’IFN par l’assemblage de complexes activateurs, mais les mécanismes de leur recrutement et leurs fonctions restent débattus [
4
].
Les interférons constituent donc une première ligne de défense cellulaire que les virus doivent franchir pour établir une infection productive. Ces derniers ont donc développé des stratégies qui contrecarrent l’induction de l’IFN, la signalisation par l’IFN et l’activité des ISG [
5
].
|
Ce virus neurotrope cause une encéphalite fatale chez les mammifères, et tue encore plus de 50 000 personnes chaque année dans le monde [
6
]. Son génome est constitué d’un ARN simple brin de polarité négative. La transcription et la réplication du génome viral ont lieu dans les corps de Negri, qui sont des inclusions cytoplasmiques de quelques micromètres de diamètre possédant des propriétés d’organites liquides [
7
]. Ils concentrent en particulier la nucléoprotéine virale (N, étroitement associée au génome viral), l’ARN polymérase virale (L) et son cofacteur, la phosphoprotéine (P). Cette dernière joue un rôle majeur dans la défense du virus contre la réponse IFN. En particulier, il a été montré que la phosphoprotéine P de la souche SAD du virus de la rage (P
SAD
) bloque la phosphorylation d’IRF3, et ainsi la production d’IFN par la cellule infectée, par un mécanisme qui n’était pas élucidé [
8
].
|
La phosphoprotéine P se lie à TBK1
Afin de comprendre les bases moléculaires de l’inhibition de la production d’IFN par la phosphoprotéine P, nous avons tiré parti de la différence de deux souches rabiques (SAD et CVS) quant à leur capacité à inhiber l’induction de l’IFN, ce que seule P
SAD
est capable de faire. Une unique substitution de résidu d’acide aminé en position 179 (sérine pour SAD, proline pour CVS) est responsable de cette différence entre les deux souches. Par conséquent, un virus recombinant SAD-S179P (dans lequel le gène codant P
SAD
est remplacé par sa version mutée Ser179Pro) présente un défaut de croissance dans des cellules qui produisent l’IFN, mais se comporte comme la souche SAD de génotype « sauvage » dans des cellules incapables d’en produire [
9
].
Nous avons immunoprécipité les protéines P
SAD
, P
CVS
, P
SAD
-S179P et P
CVS
-P179S exprimées dans des cellules humaines après transfection par des plasmides contenant les gènes correspondants, afin de caractériser l’ensemble de leurs partenaires de liaison (
i.e.
, leur interactome). Nous avons ainsi identifié TBK1 comme la seule protéine interagissant préférentiellement avec les formes inhibitrices de la protéine P (P
SAD
et P
CVS-
P179S). Il s’agit d’une interaction directe qui nécessite la présence des sites de phosphorylation de TBK1 (S172 et Y179), ce qui suggère que la protéine P se lie à la forme phosphorylée (donc activée) de la kinase. Dans certaines lignées cellulaires murines, cette interaction induit la séquestration de TBK1 dans les corps de Negri [
9
].
Le ciblage de TBK1 est une stratégie particulièrement efficace pour inhiber la production d’IFN puisque cette kinase est située au point de convergence de plusieurs voies de signalisation : celles déclenchées par TLR3, RIG-I et MDA-5, mais aussi la voie cGAS-STING (
stimulator of interferon genes
), qui est induite par la présence d’ADNdb dans le cytoplasme (
Figure 1
).
|
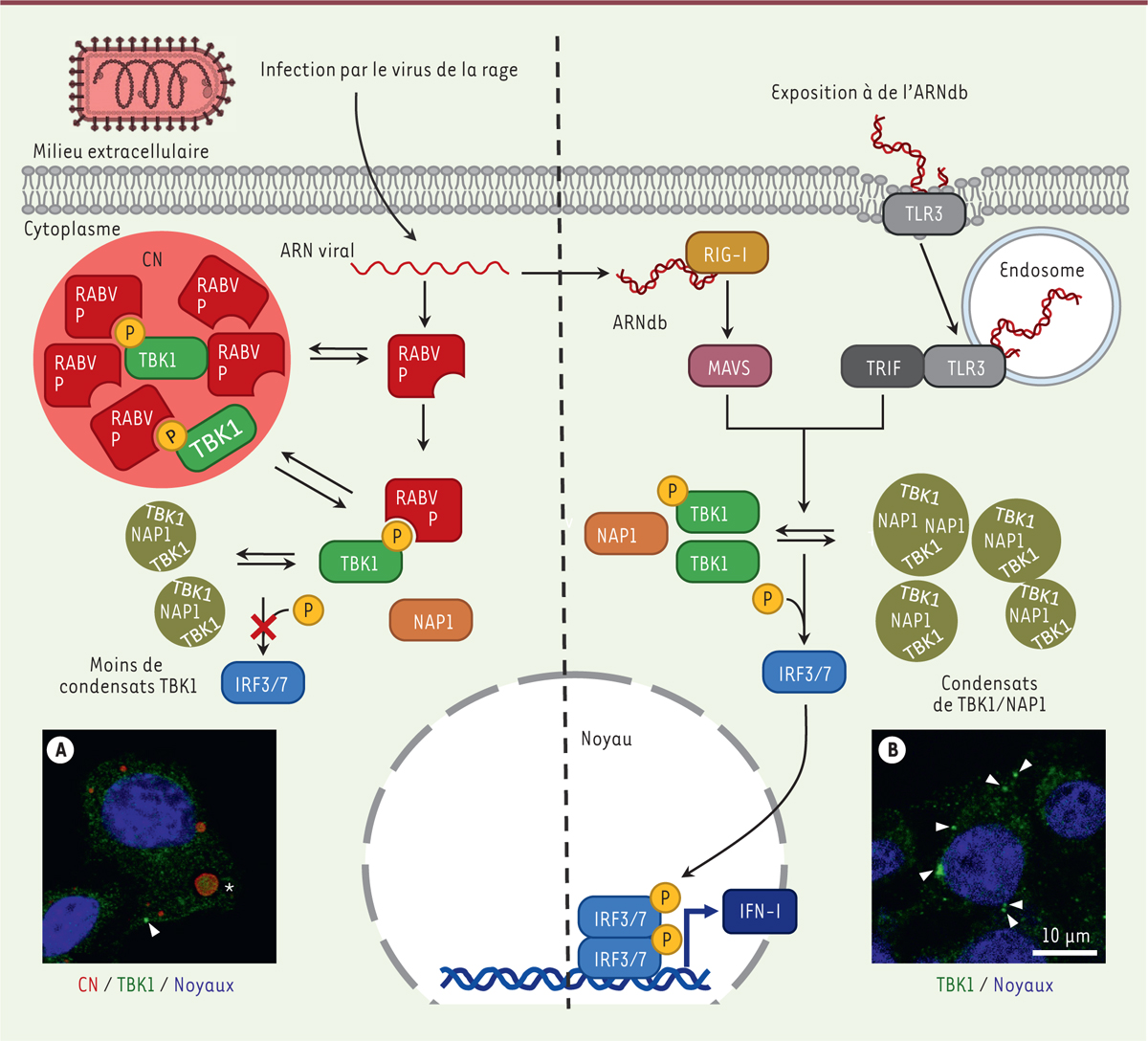
TBK1, NAP1 et SINTBAD forment des condensats liquides en présence de signaux de danger
Nous avons constaté que dans les cellules infectées par le virus de la rage (que ce soit par la souche CVS ou par la souche SAD), la kinase TBK1 formait des condensats de forme sphérique, dans lesquels se trouvaient aussi les protéines adaptatrices NAP1 et SINTBAD. Nous avons montré que la présence d’ARNdb introduit dans le milieu de culture de la cellule, ou dans le cytoplasme par transfection, induisait également la formation de ces condensats (par la voie des TLR dans le premier cas, ou par la voie des RLR dans le second)
(
Figure 2
)
[
9
]. Par imagerie sur cellules vivantes exprimant des chimères fluorescentes de ces protéines, nous avons caractérisé la dynamique des condensats, qui peuvent se déplacer dans le cytoplasme le long de trajectoires plutôt rectilignes de plusieurs micromètres, ou s’associer pour former localement des structures en anneau. Par ailleurs, nous avons montré que ces condensats disparaissent temporairement après un choc hypotonique, avant de se reformer. Enfin, des expériences de recouvrement de fluorescence après photoblanchiment ont révélé que les protéines TBK1 et NAP1 font la navette entre le cytosol et les condensats [
9
].
 | Figure 2.
La phosphoprotéine P du virus de la rage interfère avec les condensats formés lors de l’induction de l’immunité innée.
Partie droite : l’exposition de cellules à de l’ARNdb active la production d’IFN par les voies des TLR et des RLR. L’activation de ces voies induit la formation de condensats cytosoliques de TBK1 (indiqués par des flèches sur l’image de microscopie confocale), ainsi que de NAP1 et de SINTBAD (non représenté sur le schéma). Partie gauche : lors de l’infection de cellules par le virus de la rage, la forme phosphorylée de TBK1 est ciblée par la phosphoprotéine P, conduisant à son accumulation dans les corps de Negri (CN) (étoile sur l’image de microscopie confocale) et à une formation réduite de condensats cytoplasmiques de TBK1 (tête de flèche). L’interaction entre les protéines P et TBK1 empêche la phosphorylation de IRF3 et, en conséquence, la production des IFN de type I (IFN-I).
|
|
Certaines protéines de la voie de signalisation conduisant à la production d’IFN sont donc capables, lors de l’exposition de la cellule à un signal de danger, de former transitoirement des condensats ayant des propriétés physiques comparables à celles des liquides. Ces condensats constituent une nouvelle catégorie d’« organites liquides » dépourvus de membrane. Ce type de condensats avait précédemment été décrit pour d’autres protéines susceptibles d’induire la synthèse d’IFN. Ainsi, la protéine cGAS, un senseur de la présence d’ADNdb cytosolique, forme des condensats liquides avec l’ADN, ce qui stimule sa capacité à synthétiser un dinucléotide cyclique, le cGAMP, qui, en se liant à la protéine STING, active une autre voie de signalisation conduisant, elle aussi, à l’activation de TBK1 et à l’induction de l’IFN [
10
].
Cela souligne l’importance de la formation de ce type de condensats dans les cascades de signalisation de l’immunité innée (et peut-être aussi dans d’autres voies de signalisation) [
10
]. Il est tentant de spéculer sur les raisons qui ont conduit à la sélection de tels mécanismes au cours de l’évolution. Premièrement, en concentrant les protéines, la formation de telles plateformes facilite l’auto-activation des enzymes impliquées. Deuxièmement, la vitesse de formation et de disparition des condensats liquides et leur sensibilité à leur environnement assurent une réponse rapide au stimulus (et son arrêt tout aussi rapide). Troisièmement, la séparation de phase liquide permet une réponse de type seuil, avec une réaction « en tout ou rien » au signal de danger. Sinon, dans l’hypothèse où la forme cytosolique de TBK1 serait la forme active, la formation de condensats pourrait tamponner la concentration de TBK1 libre dans le cytosol et ainsi limiter les réponses excessives. Quoi qu’il en soit, la formation de condensats vient s’ajouter aux modifications post-traductionnelles des protéines pour contrôler la voie de production de l’IFN.
Un dérèglement de ces condensats, résultant par exemple de la présence de mutations réduisant, ou au contraire favorisant, leur formation, pourrait conduire à des maladies auto-immunes ou entraîner une réponse inefficace de l’organisme aux infections. La conception de molécules stabilisant ou déstabilisant ces organites liquides pourrait donc avoir un intérêt thérapeutique. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Teijaro
JR
.
Type I interferons in viral control and immune regulation.
.
Curr Opin Virol
.
2016;
;
16
:
:31.
–
40
.
2.
Fitzgerald
KA
,
Kagan
JC
.
Toll-like receptors and the control of immunity.
.
Cell
.
2020;
;
180
:
:1044.
–
66
.
3.
Yoo
JS
,
Kato
H
,
Fujita
T
.
Sensing viral invasion by RIG-I like receptors.
.
Curr Opin Microbiol
.
2014;
;
20
:
:131.
–
138
.
4.
Goncalves
A
,
Bürckstümmer
T
,
Dixit
E
,
et al.
Functional dissection of the TBK1 molecular network.
.
PLoS One
.
2011;
;
6
:
:e23971.
.
5.
Ten
Garcia-Sastre A.
strategies of interferon evasion by viruses.
.
Cell Host Microbe
.
2017;
;
22
:
:176.
–
184
.
6.
Ribadeau-Dumas
F
,
Dacheux
L
,
Bourhy
H
.
La rage. Med Sci (Paris)
.
2013;
;
29
:
:47.
–
55
.
7.
Nikolic
J
,
Le Bars
R
,
Lama
Z
,
et al.
Negri bodies are viral factories with properties of liquid organelles.
.
Nat Commun
.
2017;
;
8
:
:58.
.
8.
Brzozka
K
,
Finke
S
,
Conzelmann
KK
.
Identification of the rabies virus α/β interferon antagonist: phosphoprotein P interferes with phosphorylation of interferon regulatory factor 3.
.
J Virol
.
2005;
;
79
:
:7673.
–
7681
.
9.
Scrima
N
,
Le Bars
R
,
Nevers
Q
,
et al
.
Rabies virus P protein binds to TBK1 and interferes with the formation of innate immunity-related liquid condensates.
.
Cell Rep
.
2023;
;
42
:
:111949.
.
10.
Boccaccio
GL
,
Thomas
MG
,
García
CC
.
Membraneless organelles and condensates orchestrate innate immunity against viruses.
.
J Mol Biol
.
2023;
;
23
:
:167976.
.
|