Malgré les progrès des thérapies anti-cancéreuses, le cancer du sein métastatique représente la première cause de décès par cancer chez la femme en France. En effet, bien que les femmes diagnostiquées au stade métastatique du cancer soient traitées par chimiothérapie, il est fréquent de constater une chimiorésistance des métastases, dont les causes restent mal connues. Le microenvironnement tumoral module la réponse au traitement antitumoral [ 1 ], en particulier parce qu’une partie des cellules dont il est constitué, appelées cellules stromales, sécrètent divers facteurs de croissance, des cytokines et des protéines de la matrice extracellulaire réduisant l’efficacité des traitements [ 2 ] ( → )
(→) Voir la Synthèse de J. Albrengues et al., m/s n° 4, avril 2014, page 391
Alors que les cellules inflammatoires (monocytes, macrophages, et granulocytes neutrophiles) sont désormais reconnues comme étant d’importants acteurs du contrôle de la progression tumorale, leur rôle dans l’efficacité des chimiothérapies reste à élucider [ 3 ]. Les chimiothérapies conventionnelles entraînent fréquemment une inflammation locale et générale [ 4 ], qui peut constituer un obstacle à leur efficacité. Nous avons tenté d’en comprendre la raison.
Bien que les granulocytes neutrophiles soient parmi les premières cellules à arriver sur le site de l’inflammation, leur rôle dans le cancer n’a attiré l’attention des chercheurs que récemment [ 5 ]. Lors d’une réponse physiologique à des agents pathogènes, les granulocytes neutrophiles les éliminent par trois principaux mécanismes : 1) la phagocytose, 2) la dégranulation libérant enzymes et protéases cytotoxiques, et 3) la formation de pièges extracellulaires ( neutrophil extracellular traps , NET). Les NET sont des filaments d’ADN associés à diverses enzymes et protéases relâchés dans le milieu extracellulaire [ 6 ] ( → )
(→) Voir la Nouvelle de M.A. Gougerot-Pocidalo et al. , m/s n° 5, mai 2007, page 464
Ils sont produits après citrullination 1 des histones par l’enzyme protein arginine deiminase 4 (PAD4), et sont libérés dans le milieu extracellulaire après la décondensation de la chromatine, la désintégration de la membrane nucléaire et la rupture de la membrane plasmique [ 7 ]. Nos travaux de recherche ainsi que ceux d’autres laboratoires ont permis de montrer que les NET ont des propriétés pro-métastatiques [ 8 , 9 ]. Cependant, le rôle des granulocytes neutrophiles, des NET, et plus généralement de l’inflammation dans la chimiorésistance reste mal connu.
Pour tenter de comprendre comment la chimiothérapie modifie le microenvironnement inflammatoire métastatique, nous avons utilisé un modèle murin de métastases pulmonaires issues de carcinomes mammaires [ 10 ]. Nous avons injecté des cellules murines provenant de métastases de cancer du sein dans la veine caudale de souris de la même lignée (syngéniques). Les souris porteuses de métastases pulmonaires ont ensuite été traitées par l’une ou l’autre de deux chimiothérapies (cisplatine ou association d’adriamycine et de cyclophosphamide) utilisées dans le traitement du cancer du sein métastatique. Une analyse des métastases pulmonaires par cytométrie en flux après cette chimiothérapie a montré l’infiltration des métastases par des granulocytes neutrophiles. Nous avons découvert qu’en réponse à la chimiothérapie, les cellules métastatiques sécrètent CXCL1 et CXCL5, des chimiokines à motif Cys-X-Cys (où X désigne un acide aminé quelconque) induisant ainsi le recrutement des granulocytes neutrophiles en se liant au récepteur CXCR2 ( C-X-C motif receptor 2 ) présent à leur surface. Nous avons montré le rôle fondamental de ces cellules dans l’inefficacité des chimiothérapies contre les métastases pulmonaires du cancer du sein. En effet, la déplétion des granulocytes neutrophiles par un anticorps ou l’inhibition pharmacologique du recrutement de ces cellules dans les poumons métastatiques améliore la sensibilité des cellules cancéreuses métastatiques aux chimiothérapies [ 10 ].
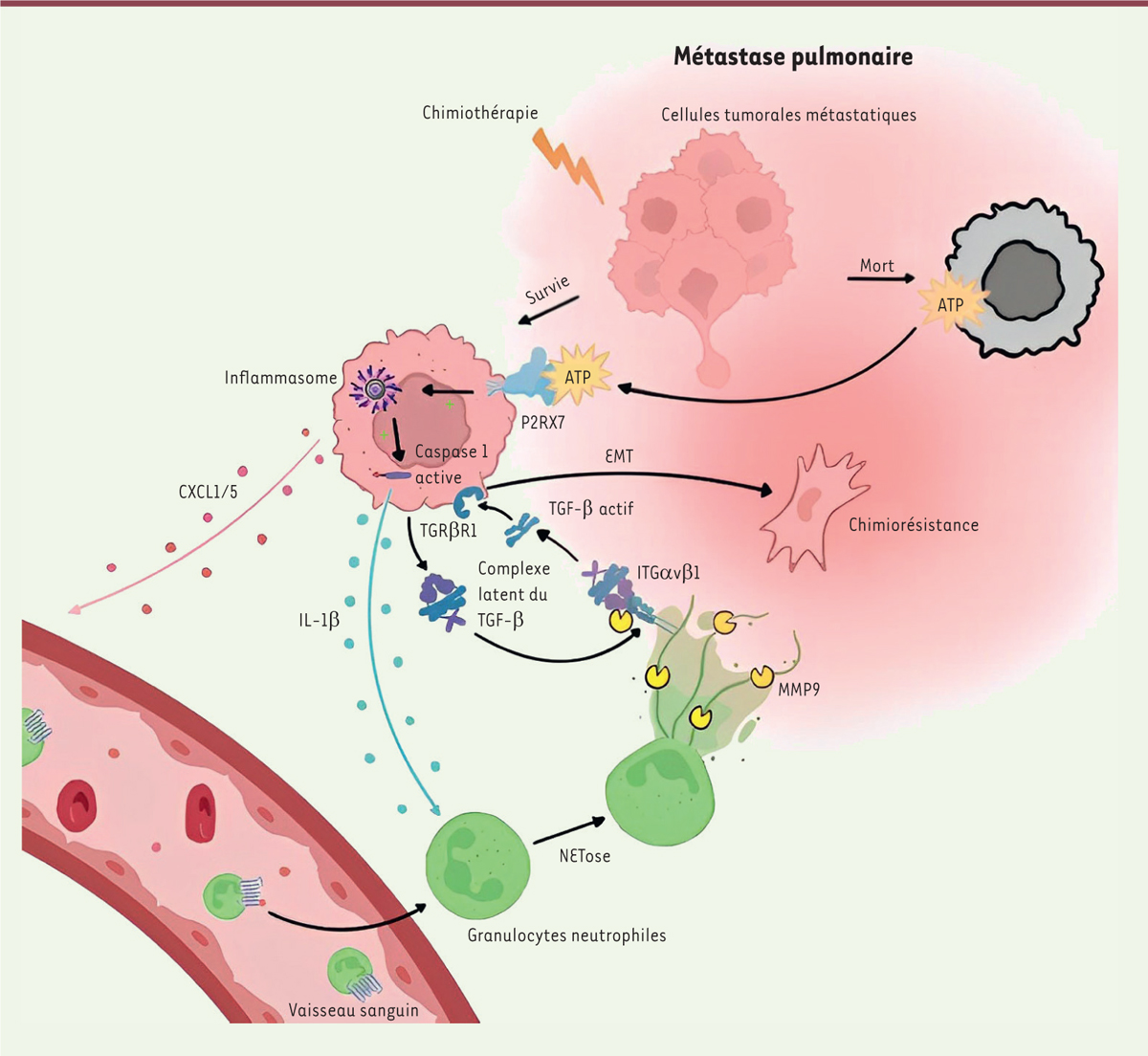
Nous avons ensuite montré, par immunofluorescence, que les granulocytes neutrophiles recrutés dans les niches métastatiques pulmonaires forment des NET, dont nous avons découvert le rôle dans la chimiorésistance de ces métastases. En effet, l’inhibition de la formation des NET par ajout d’un inhibiteur de l’enzyme PAD4, ou leur dégradation par la DNase I, améliore la chimiosensibilité des métastases. Par des expériences in vitro , nous avons ensuite montré que l’interleukine (IL)-1β, sécrétée par les cellules tumorales traitées par chimiothérapie, est responsable de la formation des NET. Seules certaines cellules tumorales meurent en réponse à la chimiothérapie. En mourant, ces cellules libèrent de l’ATP (adénosine triphosphate), qui active le récepteur P2RX7 ( P2X purinoceptor 7 ) à la surface des cellules tumorales qui n’ont pas été tuées par la chimiothérapie, entraînant l’activation de l’inflammasome NLRP3 ( NOD-like receptor family, pyrin domain containing 3 ) dans ces cellules. L’activation de NLRP3 entraîne à son tour celle de l’IL-1β et sa sécrétion dans le microenvironnement tumoral ( Figure 1 ) . Ainsi, l’administration d’un anticorps bloquant cette interleukine ou d’un inhibiteur pharmacologique de NLRP3 chez la souris empêche la formation des NET induite par la chimiothérapie, et augmente son efficacité contre les métastases pulmonaires [ 10 ].
| Figure 1.
Les pièges extracellulaires des granulocytes neutrophiles entraînent la chimiorésistance des métastases pulmonaires de cancer du sein.
En réponse à la chimiothérapie, les granulocytes neutrophiles infiltrent les métastases pulmonaires du cancer du sein, où ils forment des « pièges extracellulaires » (
neutrophil extracellular traps,
NET). Certaines cellules métastatiques tuées par la chimiothérapie sécrètent de l’ATP, ce qui active le récepteur purinergique P2RX7 sur les cellules métastatiques voisines, entraînant l’activation de l’inflammasome NLRP3 et ainsi, la sécrétion de l’interleukine-1β (IL-1β) par ces cellules. Cette interleukine est alors responsable de la formation des NET. Deux protéines associées aux NET sont nécessaires pour induire la chimiorésistance : l’intégrine-αvβ1 (ITGαvβ1), qui piège le TGF-β latent sécrété par les cellules métastatiques, et la métalloprotéinase matricielle 9 (MMP9), qui clive et active le TGF-β latent piégé. L’activation du TGF-β provoque la transition épithélio-mésenchymateuse des cellules cancéreuses et leur chimiorésistance.
|
Une analyse du transcriptome des cellules tumorales métastatiques nous a permis de comprendre les mécanismes moléculaires de la chimiorésistance induite par les NET. Nous avons découvert que les NET entraînent l’activation de la voie de signalisation du TGF-β ( transforming growth factor β) dans les cellules tumorales, ainsi que l’augmentation de l’expression des gènes de la transition épithélio-mésenchymateuse. Or, cette transition promeut la chimiorésistance dans plusieurs types de cancers [ 11 ]. Nous avons ainsi montré que l’inhibition du récepteur du TGF-β (TGF-βR1) contrecarre la transition épithélio-mésenchymateuse induite par les NET et augmente l’efficacité de la chimiothérapie [ 10 ].
Le TGF-β est un facteur de croissance synthétisé et sécrété sous la forme d’un complexe protéique latent, qui doit être clivé pour être activé. Nous avons montré que les NET ne contiennent pas de TGF-β actif ou latent, et que les cellules tumorales sécrètent principalement, en grande quantité, la petite forme latente du TGF-β, dans laquelle la molécule active de TGF-β est associée à la protéine LAP ( latency-associated peptide ). Ce TGF-β latent est activé par la dégradation protéolytique de la LAP par la métalloprotéinase 9 (MMP9) associée aux NET. Alors que la destruction des NET par la DNase I améliore l’effet de la chimiothérapie in vivo , cette destruction n’a aucun effet sur l’activité enzymatique de la MMP9 [ 8 ], et nous avons donc émis l’hypothèse que la structure tridimensionnelle de l’ADN des NET est nécessaire pour induire la chimiorésistance par activation du TGF-β latent. Dans ce contexte, nous avons identifié la présence, dans les NET, de l’intégrine αvβ1, qui piège le TGF-β latent dans les « filets d’ADN » des NET en se liant au motif Arg-Gly-Asp (RGD) de la protéine LAP. L’enzyme MMP9 peut alors cliver et activer le TGF-β, dont la signalisation induit une transition épithélio-mésenchymateuse des cellules cancéreuses et leur chimiorésistance. Ainsi, l’inhibition pharmacologique de MMP9 et de l’intégrine αvβ1 augmente-elle l’efficacité des chimiothérapies contre les métastases pulmonaires du cancer du sein [ 10 ].
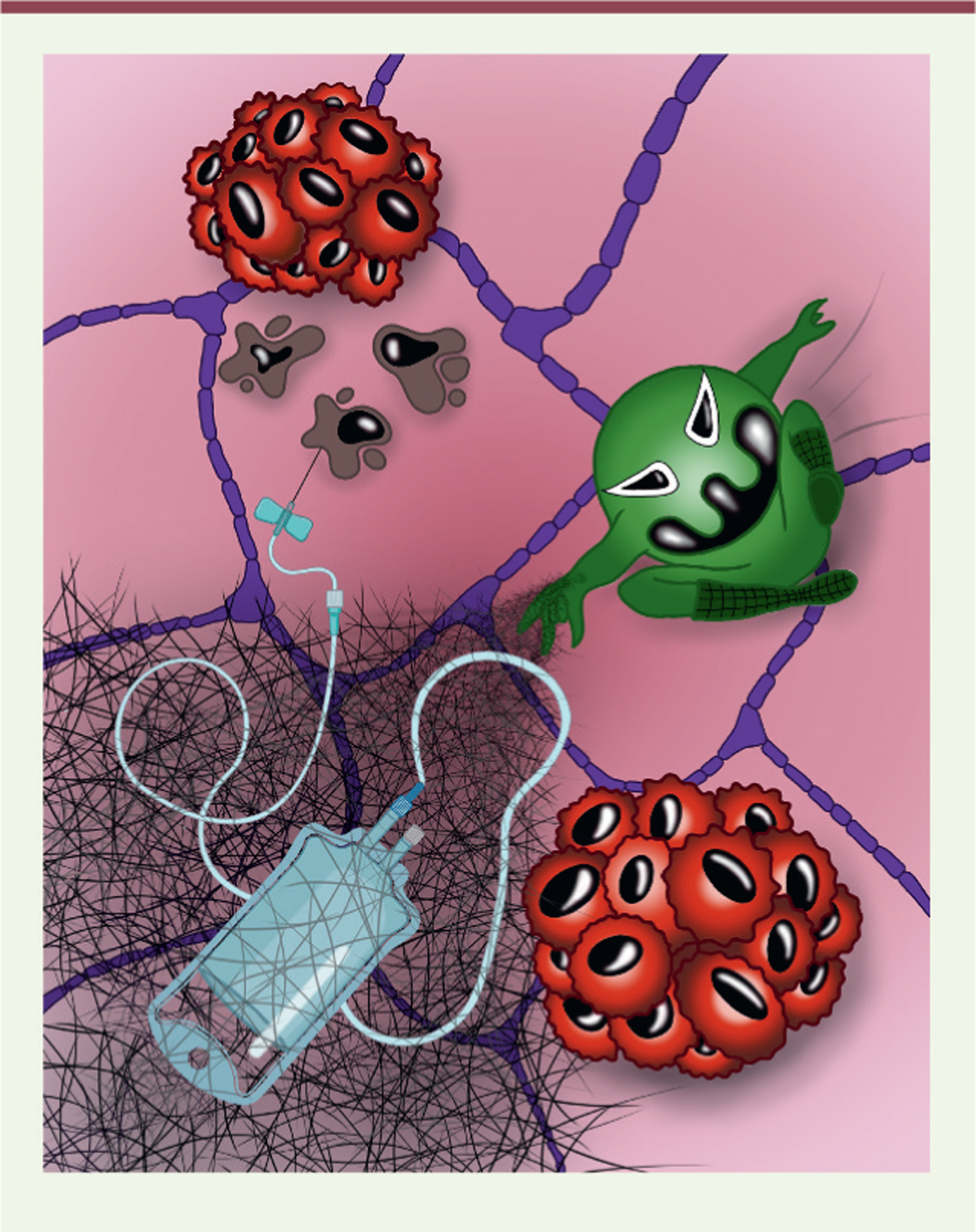
Nous avons donc montré que les NET formés en réponse à la chimiothérapie favorisent la chimiorésistance des métastases pulmonaires du cancer du sein chez la souris. Les NET pourraient ainsi constituer une cible thérapeutique chez les patientes présentant un cancer du sein métastatique ( Figure 2 ) . En effet, une analyse de la présence de NET dans le plasma sanguin de patientes en cours de chimiothérapie a permis de montrer que les NET augmentent après ce traitement, spécifiquement chez les patientes qui ne répondent pas ou qui répondent peu à la chimiothérapie. Cela suggère que le dosage des NET dans le sang pourrait être utilisé comme biomarqueur pour identifier les patientes chez qui la chimiothérapie sera peu efficace et pourrait être rendue plus efficace en ciblant la voie de signalisation intégrine αvβ1/MMP9/TGF-β que nous avons identifiée dans les NET.
| Figure 2.
Illustration du rôle des pièges extracellulaires des granulocytes neutrophiles dans la chimiorésistance.
Un granulocyte neutrophile «
spiderman
» (en vert) libère son « filet » sur un fond représentant l’épithélium pulmonaire (en violet), ce qui bloque l’efficacité de la chimiothérapie et permet aux métastases pulmonaires de continuer à se développer. Les cellules tumorales mourantes sont colorées en marron, et les cellules tumorales qui survivent en rouge.
|
Bien que les cellules cancéreuses soient la principale source de TGF-β latent, il est possible que certaines cellules stromales du microenvironnement tumoral métastatique en libèrent également. Le TGF-β agit sur de nombreux types de cellules, avec des effets à la fois physiologiques et pathologiques. La formation des NET pourrait donc être impliquée plus largement dans la progression de la maladie cancéreuse. Par exemple, la signalisation par le TGF-β peut activer les fibroblastes en myofibroblastes, qui sont les principaux responsables de la fibrose tumorale favorisant la formation d’une niche métastatique pouvant être chimiorésistante [ 2 ]. De plus, le TGF-β peut inhiber les lymphocytes T anti-tumoraux, favorisant ainsi la création d’une niche immunosuppressive. Ainsi, l’activation du TGF-β dans le microenvironnement métastatique par les NET après une chimiothérapie pourrait entraîner un remodelage profond de ce microenvironnement, favorisant la création d’une niche chimiorésistante.