| |
| Med Sci (Paris). 39(11): 830–832. doi: 10.1051/medsci/2023157.Les astrocytes, fournisseurs de glutamine pour l’activité physiologique des synapses glutamatergiques et la mémoire Julien Moulard1* and Nathalie Rouach1** 1Interactions neurogliales dans la physiologie et les pathologies cérébrales, Centre interdisciplinaire de recherche en biologie, Collège de France, CNRS, Inserm, Labex Memolife, Université Paris sciences & lettres
,
Paris
,
France MeSH keywords: Humains, Glutamine, Astrocytes, Neurones, Acide glutamique |
Le cycle glutamate-glutamine : quel rôle dans le fonctionnement des synapses excitatrices ?
Le réapprovisionnement des neurones en neurotransmetteurs, après leur libération à la synapse par les vésicules synaptiques, est crucial pour le fonctionnement neuronal. Bien que des neurotransmetteurs puissent être recaptés par les neurones par divers mécanismes, le glutamate
1
synaptique est principalement capturé par les astrocytes périsynaptiques
via
des transporteurs spécifiques [
1
]. Cela non seulement contribue à prévenir l’excitotoxicité
2
, mais aussi agit comme un mécanisme local de recyclage du glutamate synaptique. En effet, sans ce réapprovisionnement du neurone en neurotransmetteurs, le pool de glutamate présynaptique serait épuisé en moins d’une minute d’activité synaptique basale [
2
]. Il a donc été postulé l’existence d’un cycle glutamate-glutamine, où les astrocytes, après capture et transformation du glutamate synaptique en glutamine, la libèreraient dans l’espace extracellulaire afin que les neurones la récupèrent et la convertissent en glutamate [
3
]. Un tel mécanisme jouerait un rôle important
in vivo
car la synthèse
de novo
de la glutamine ne se produit pas dans les terminaisons nerveuses [
2
]. Bien que ce cycle soit reconnu comme impliqué dans l’épilepsie, un état pathologique d’hyper-activité neuronale synchrone dans lequel la libération de glutamate est fortement augmentée [
4
], sa pertinence physiologique est débattue. Ainsi, l’apport de nouveaux outils permettant de détecter le transfert de la glutamine astrocytaire aux neurones serait une avancée majeure pour prouver l’existence et clarifier le rôle de ce transfert.
|
Une avancée dans la visualisation de la coopération glioneuronale Une molécule de glutamine étiquetée avec la rhodamine (rhodamine-glutamine, RhGln) a été conçue pour visualiser directement la glutamine dans les cellules vivantes des tissus cérébraux. Cette molécule de petite taille (640 Da) possède plusieurs caractéristiques d’intérêt. Elle est soluble dans l’eau et fluorescente, avec une absorption et une émission lumineuses à des longueurs d’onde respectives de 580 nm et 601 nm. La rhodamine étant électriquement chargée positivement, elle laisse la glutamine intacte pour assurer ses fonctions biologiques. Enfin, l’étiquette fluorescente a été conjuguée à la chaîne latérale amide de la glutamine afin d’empêcher son hydrolyse en glutamate par la glutaminase, et de visualiser ainsi uniquement la glutamine, et non ses métabolites. Ce nouvel outil, combiné à l’imagerie de haute résolution, a permis la visualisation directe de la glutamine et l’exploration des mécanismes de sa redistribution. En effet, après injection intracellulaire de RhGln dans des astrocytes d’une tranche d’hippocampe de souris, cette molécule diffuse dans des cellules adjacentes. On la retrouve dans le corps cellulaire ainsi que dans les prolongements principaux et fins des astrocytes voisins, et sa diffusion dans le réseau astrocytaire s’est avérée dépendante des jonctions communicantes entre ces cellules.
Grâce à la combinaison de la microscopie de fluorescence de type STED (
stimulated emission depletion
) et d’une technique d’électrophysiologie
in situ
, nous avons montré que la glutamine astrocytaire est cruciale pour la fonction en condition physiologique. En stimulant les synapses de neurones glutamatergiques de l’hippocampe à une fréquence physiologique de 10 Hz, impliquée dans certaines formes d’apprentissage ou dans le sommeil [
5
] et connue pour mobiliser les réserves présynaptiques de glutamate [
6
], nous avons montré que le transfert de la glutamine dans le réseau astrocytaire est dépendant de la transmission synaptique excitatrice. De plus, nous avons pu confirmer l’existence d’un transfert directionnel de glutamine fluorescente (RhGln) des astrocytes vers les structures neuronales présynaptiques. Cette expérience a donc apporté une preuve visuelle directe de la mobilisation activité-dépendante de la glutamine astrocytaire vers le compartiment présynaptique.
|
Le transfert de glutamine nécessaire à l’activité synaptique des neurones glutamatergiques implique la connexine 43 astrocytaire
Afin de préciser le support moléculaire de l’approvisionnement activité-dépendant des neurones en glutamine par les astrocytes, nous nous sommes concentrés sur les connexines (Cx) astrocytaires, dont l’assemblage constitue des canaux jonctionnels intercellulaires et des hémicanaux (connexons)
3
permettant le transfert de petites molécules (moins de 1 500 Da) respectivement à l’intérieur et à l’extérieur du réseau astrocytaire [
7
]. Nous avons montré que cette organisation permet la redistribution de la glutamine du réseau astrocytaire vers les compartiments périsynaptiques, puis vers les synapses. Bien que les astrocytes expriment abondamment les Cx30 et Cx43, les résultats d’une précédente étude indiquaient que seule la Cx43 est impliquée dans l’activité synaptique physiologique par l’intermédiaire des hémicanaux qu’elle constitue [
7
]. Pour en apporter la preuve, il était nécessaire de montrer la présence de Cx43 à proximité des synapses et l’existence d’un contrôle « activité-dépendant » des hémicanaux qu’elle forme. Des immunomarquages de Cx43 dans l’hippocampe ont effectivement révélé sa présence dans les prolongements fins distaux d’astrocytes à proximité d’éléments présynaptiques glutamatergiques. Cette localisation périsynaptique de Cx43 astrocytaire a été confirmée par microscopie électronique, ainsi que par sa détection dans les synaptogliosomes, des structures issues d’un fractionnement du tissu cérébral, constituées par les synaptosomes
4
et les prolongements astrocytaires périsynaptiques. De plus, nous avons montré que l’activation des hémicanaux contenant Cx43, détectée par le test de capture du bromure d’éthidium, dépend de l’activité synaptique excitatrice induite par une stimulation physiologique (à la fréquence de 10 Hz) des afférences neuronales. Enfin,
in vivo
, la réintroduction de Cx43 dans les astrocytes de souris mutantes dépourvues de Cx43 permet de rétablir le transfert, dépendant de l’activité neuronale, de RhGln à la présynapse, confirmant ainsi l’implication des hémicanaux dans ce mécanisme. Afin d’élucider le mécanisme de l’ouverture activité-dépendante des hémicanaux impliqués dans la libération de glutamine, nous avons testé l’hypothèse de l’implication du glutamate et des ions potassium (K
+
), dont la libération est dépendante de l’activité synaptique excitatrice [
8
]. En utilisant des techniques d’imagerie et de pharmacologie, nous avons montré que tous deux contribuent effectivement à l’ouverture activité-dépendante des hémicanaux astrocytaires contenant la Cx43
via
l’activation des récepteurs ionotropiques du glutamate neuronaux et des canaux potassiques Kir4.1 (KCNJ10) astrogliaux, respectivement. Afin d’évaluer leurs contributions respectives, nous avons analysé l’activation des hémicanaux contenant Cx43 lors d’une application exogène soit de glutamate, soit d’ions K
+
, sur des tranches d’hippocampe de souris mutantes dépourvues des canaux astrocytaires Kir4.1. Les résultats de ces expériences indiquent que l’effet du glutamate sur l’ouverture des hémicanaux contenant la Cx43 nécessite l’activation des canaux Kir4.1 astrocytaires par l’ion K
+
. Ainsi, l’ensemble de ces données suggèrent que l’augmentation, par l’activité synaptique, de la perméabilité des hémicanaux astrocytaires situés à proximité des synapses glutamatergiques implique l’augmentation de la concentration extracellulaire des ions K
+
, qui activent les canaux Kir4.1 astrogliaux.
|
Pertinence physiologique du cycle glutamate-glutamine
Ici, nous avons montré que la glutamine astrogliale, libérée par les hémicanaux de Cx43, joue un rôle important dans la transmission synaptique excitatrice en conditions physiologiques. En effet, la glutamine astrogliale est essentielle, non seulement pour la facilitation initiale de la transmission synaptique excitatrice, mais aussi pour son maintien grâce à la reconstitution du contenu présynaptique de glutamate. La transmission synaptique basale en réponse à une stimulation unique des collatérales de Schaffer
5
est également dépendante de la libération de glutamine par les hémicanaux astrogliaux contenant la Cx43, ce qui confirme le rôle physiologique de la glutamine dans la transmission synaptique glutamatergique.
In vivo
, le glutamate présynaptique est mobilisé dans certains types de mémoire, incluant la mémoire de reconnaissance [
9
]. Nous avons donc évalué les performances des souris lors d’une tâche comportementale faisant appel à la mémoire de reconnaissance tout en inhibant, dans l’hippocampe, les hémicanaux contenant la Cx43 par le peptide Gap26. Nous avons ainsi mis en évidence une altération de la mémoire chez ces souris, et nous avons montré qu’elle dépend de la glutamine car l’injection combinée de glutamine et de Gap26 est parvenue à rétablir complètement les performances mnésiques.
|
En utilisant une molécule de glutamine fluorescente permettant un traçage de la glutamine dans les cellules vivantes, nous avons apporté la preuve de l’existence d’un transfert de glutamine, dépendant de l’activité neuronale, des astrocytes périsynaptiques vers le compartiment présynaptique des neurones glutamatergiques dans des conditions physiologiques. En outre, nous avons montré l’implication des hémicanaux astrocytaires contenant la Cx43 dans ce processus essentiel au maintien de la transmission synaptique excitatrice physiologique ainsi qu’à la mémoire de reconnaissance. Nous mettons donc ainsi fin à une controverse de longue date en démontrant que la glutamine astrogliale est nécessaire à la transmission synaptique glutamatergique physiologique
(
Figure 1
)
et la mémoire par le biais d’un nouveau mécanisme, sous-tendu par les hémi-canaux de Cx43.
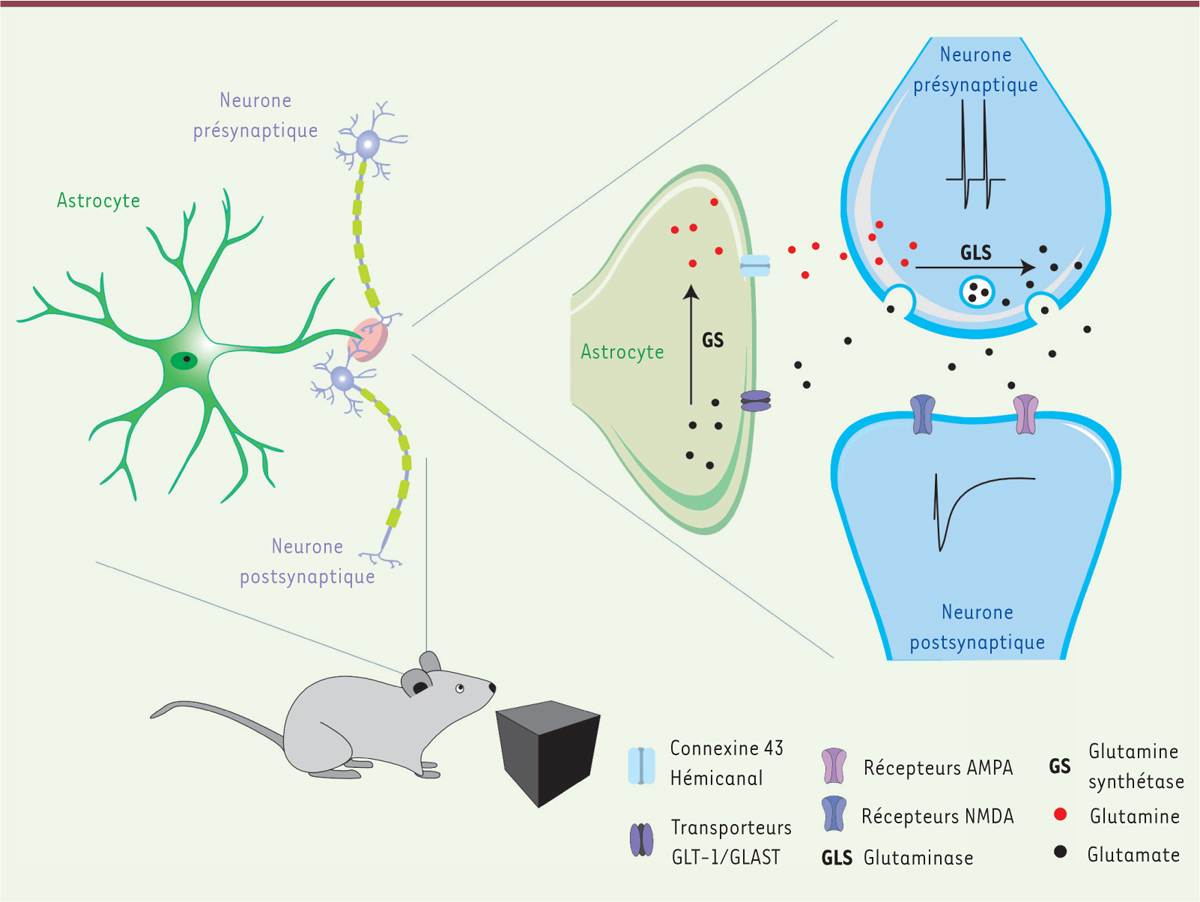
 | Figure 1.
Le cycle glutamate-glutamine des cellules neurogliales promeut la transmission synaptique et la mémoire.
Schéma des mécanismes impliqués dans la transmission synaptique et la mémorisation d’un nouvel objet par la souris. Ces processus sont sous-tendus par l’interaction entre les cellules astrocytaires et neuronales. L’arrivée de potentiels d’action dans le compartiment présynaptique du neurone glutamatergique provoque une libération du neurotransmetteur dans la fente synaptique. Le glutamate libéré peut activer ses récepteurs postsynaptiques de type AMPA et NMDA, et ainsi induire une réponse neuronale participant à la mise en mémoire (encodage) du nouvel objet. Ce processus de mémorisation requiert une libération soutenue du glutamate présynaptique. Pour ce faire, les astrocytes peuvent capturer le glutamate synaptique grâce à leurs transporteurs GLT-1/GLAST, puis le transformer en glutamine grâce à la glutamine synthétase (GS). Le transfert de la glutamine astrocytaire au compartiment présynaptique du neurone nécessite l’ouverture des hémicanaux (HC) astrocytaires contenant la connexine 43 (Cx43). Sous l’action de la glutaminase (GLS) neuronale, la glutamine est retransformée en glutamate, et contribue ainsi au maintien de l’activité synaptique.
|
Ces résultats ont des implications importantes pour les études futures sur les contributions astrocytaires au maintien des fonctions cérébrales physiologiques. La Cx43 astrocytaire étant impliquée dans la maladie d’Alzheimer [
10
], ces données suggèrent que les astrocytes sont impliqués dans les troubles cognitifs de cette maladie, ouvrant ainsi de nouvelles perspectives de recherche pour tenter d’en freiner l’évolution. Un apport exogène de glutamine pourrait remédier aux défauts de la transmission synaptique glutamatergique causés par l’absence de glutamine dans le réseau astrocytaire, et ainsi traiter ou même prévenir certains dysfonctionnements cérébraux tels que ceux impliqués dans les troubles mnésiques liés au vieillissement ou à certaines maladies neurodégénératives.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Nous exprimons notre gratitude à France Maloumian pour son aide dans la réalisation des figures de cet article, ainsi qu’à l’ensemble des auteurs de l’article original [
3
].
|
Footnotes |
1.
Danbolt
NC
,
Chaudhry
FA
,
Dehnes
Y
,
et al.
Properties and localization of glutamate transporters.
.
Prog Brain Res
.
1998;
;
116
:
:23.
–
43
.
2.
Marx
MC
,
Billups
D
,
Billups
B
.
Maintaining the presynaptic glutamate supply for excitatory neurotransmission.
.
J Neurosci Res
.
2015;
;
93
:
:1031.
–
1044
.
3.
Cheung
G
,
Bataveljic
D
,
Visser
J
,
et al
.
Physiological synaptic activity and recognition memory require astroglial glutamine.
.
Nat Commun
.
2022;
;
13
:
:753.
.
4.
Tani
H
,
Dulla
CG
,
Huguenard
JR
,
et al.
Glutamine is required for persistent epileptiform activity in the disinhibited neocortical brain slice.
.
J Neurosci
.
2010;
;
30
:
:1288.
–
1300
.
5.
Buzsaki
G.
Theta rhythm of navigation: link between path integration and landmark navigation, episodic and semantic memory.
.
Hippocampus
.
2005;
;
15
:
:827.
–
840
.
6.
Dobrunz
LE
,
Stevens
CF
.
Response of hippocampal synapses to natural stimulation patterns.
.
Neuron
.
1999;
;
22
:
:157.
–
166
.
7.
Chever
O
,
Lee
CY
,
Rouach
N
.
Astroglial connexin43 hemichannels tune basal excitatory synaptic transmission.
.
J Neurosci
.
2014;
;
34
:
:11228.
–
11232
.
8.
Purushotham
SS
,
Buskila
Y
.
Astrocytic modulation of neuronal signalling.
.
Front Netw Physiol
.
2023;
;
3
:
:1205544.
.
9.
Tordera
RM
,
Totterdell
S
,
Wojcik
SM
,
et al.
Enhanced anxiety, depressive-like behaviour and impaired recognition memory in mice with reduced expression of the vesicular glutamate transporter 1 (VGLUT1).
.
Eur J Neurosci
.
2007;
;
25
:
:281.
–
290
.
10.
Xing
L
,
Yang
T
,
Cui
S
,
et al.
Connexin hemichannels in astrocytes: Role in CNS disorders.
.
Front Mol Neurosci
.
2019;
;
12
:
:23.
.
|