| |
| Med Sci (Paris). 39(12): 937–944. doi: 10.1051/medsci/2023176.Thermoneutralité chez la souris et expérimentation animale Pierre-Louis Batrow,1* Isabelle Mothe-Satney,1 and Ez-Zoubir Amri1** 1Université Côte d’Azur, CNRS, Inserm, Institut de biologie Valrose (iBV)
,
06107Nice
,
France |
Vignette (© Ex-Zoubir Amri).
Les animaux sont utilisés depuis l’antiquité pour étudier l’anatomie. Pour comprendre le fonctionnement du corps, étudier les maladies et développer des thérapies, l’homme a toujours eu recours aux modèles animaux. Parmi les nombreuses découvertes importantes que ces modèles ont permis de faire, citons la mise en évidence par Luigi Galvani (1737-1798), professeur d’anatomie à Bologne (Italie), du rôle de l’électricité dans la transmission nerveuse, une science qui sera appelée électrophysiologie, qu’il révéla en utilisant des grenouilles comme modèle [
1
,
2
].
Les nouvelles réglementations régissant l’utilisation des animaux en laboratoire, en particulier les règles éthiques et de bien-être animal, associées au développement de nouvelles techniques expérimentales ont favorisé l’élaboration et l’utilisation de modèles cellulaires
in vitro
avec, plus récemment, la mise au point des organoïdes (structures cellulaires en trois dimensions) et la modélisation
in silico
[
3
](
→
). L’utilisation de modèles animaux reste cependant essentielle pour décrypter
in vivo
la physiologie et la physiopathologie. À ce jour, aucune alternative ne peut s’y substituer totalement. Aussi, même si elle tend à une diminution importante, la recherche scientifique continue d’utiliser des animaux. Depuis plus de 25 ans, des réglementations et recommandations ont cependant été élaborées afin de définir le cadre des expérimentations animales, comme les directives du
National Center for the Replacement, Refinement and Reduction of Animals in Research
(NC3Rs) :
Animal Research: Reporting of In Vivo Experiments
(ARRIVE) [
4
].
(→) Voir la série
Organoïdes
,
m/s
2019-2023
Une variable en lien avec le bien-être animal reste néanmoins encore trop peu considérée : la température d’hébergement. Bien que réglementée, elle doit être comprise entre 20 °C et 24 °C (22 °C ± 2 °C) (ce qui correspond plus au confort du manipulateur qu’à celui des animaux), cette température se situe généralement en dessous de la zone de thermoneutralité de l’animal utilisé, qui est comprise entre 28 °C et 30 °C chez la souris. Ainsi, en hébergement conventionnel, ce modèle qui est le plus utilisé dans la recherche, se retrouve en situation de stress thermique. L’impact de cette température ambiante et du stress qu’elle engendre sur les résultats expérimentaux soulève donc des questions sur la pertinence clinique de certains modèles murins de maladies humaines. Il est en effet primordial de prendre en compte la température d’hébergement des animaux utilisés pour appréhender des maladies humaines. Hébergés à des températures proches de leur zone de confort, les rongeurs développent des maladies dont les caractéristiques se révèlent plus proches de celles des êtres humains. Le choix de la température d’hébergement peut ainsi permettre de modéliser plus fidèlement certaines maladies humaines, mais aussi avoir des conséquences sur les résultats de l’expérience, en générant des faux-positifs ou des faux-négatifs, en affectant le bien-être animal. Désormais, la température ambiante de l’hébergement des animaux doit être considérée comme une variable expérimentale importante qui nécessite d’être rapportée de manière cohérente et précise. |
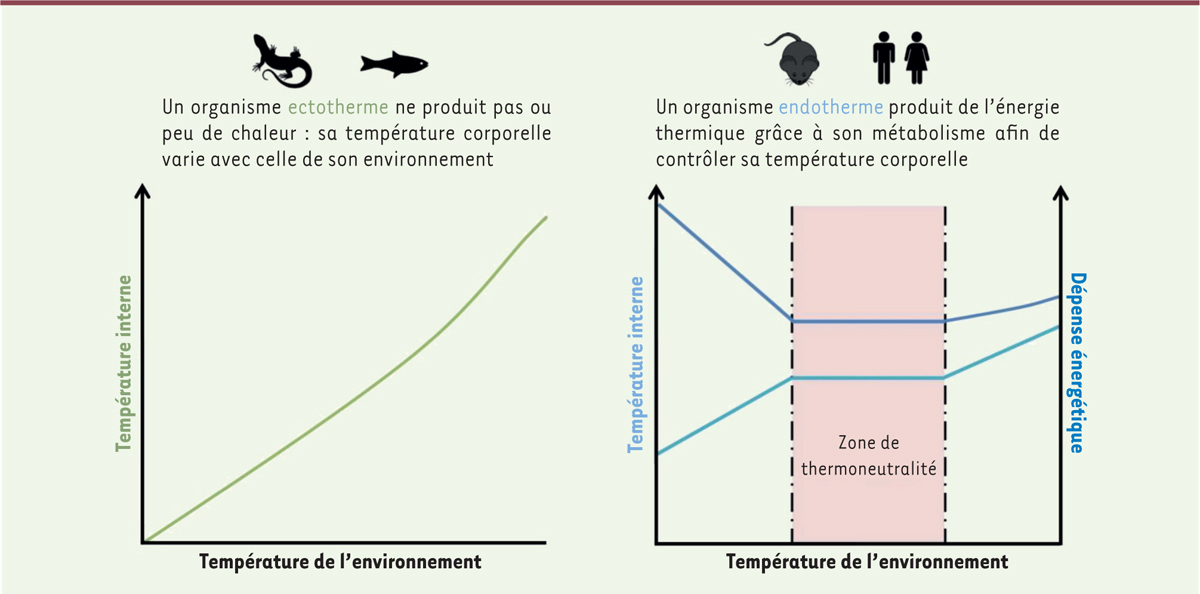
Organismes ectothermes, organismes endothermes
Plusieurs stratégies de gestion de la température corporelle en lien avec l’environnement ont été élaborées selon les organismes (
Figure 1
). Les organismes ectothermes ne produisent pas ou peu de chaleur pour maintenir leur corps à une température constante. Anciennement appelés poïkilothermes, ces organismes ont une température interne qui est directement reliée à la température de leur environnement. Cette stratégie de gestion de la température confère à ces animaux (arthropodes, annélides, mollusques, poissons, reptiles, amphibiens, etc.) un avantage important pour leurs besoins énergétiques qui sont donc réduits. En revanche, l’ectothermie présente certains inconvénients, comme une plus grande vulnérabilité au froid, au gel ou à la déshydratation par exemple. Ces organismes ont donc développé des adaptations physiologiques et comportementales afin de réguler leur température, comme l’optimisation de la surface corporelle lors d’une exposition au soleil [
5
–
8
].
 | Figure 1. Gestion de la température chez les organismes ectothermes et endothermes. |
Chez les organismes endothermes, au contraire, la température corporelle est maintenue constante grâce à l’énergie thermique (chaleur) produite par leur métabolisme interne, de sorte que la température corporelle est souvent supérieure à la température ambiante. Les mammifères et la plupart des oiseaux sont des organismes endothermes. Le taux métabolique au repos (quantité d’énergie que les organes utilisent pour rester fonctionnels au repos) des endothermes est 5 à 10 fois plus élevé que celui des ectothermes. Cette capacité de thermorégulation repose sur un ensemble de mécanismes de contrôle que l’on appelle thermogenèse dans le cas de la production de chaleur avec ou sans frisson, ou thermolyse, lors d’une évacuation de chaleur. Cette stratégie de thermorégulation active a cependant un inconvénient majeur pour les organismes endothermes : son coût énergétique important qui nécessite une consommation d’oxygène et un apport alimentaire très supérieurs à ceux des animaux ectothermes [
9
].
|
Dès le
xviii
e
siècle, Antoine-Laurent de Lavoisier (1743-1794) avait constaté que la dépense énergétique des mammifères augmentait avec le froid. Chez les animaux endothermes, la zone de thermoneutralité (ZTN) est définie comme l’intervalle de température dans lequel la dépense énergétique est la plus basse, tout en maintenant une température corporelle constante [
10
]. Tout écart par rapport à cette ZTN mobilise donc de l’énergie pour y revenir, soit par thermogenèse, soit par thermolyse. Notons que la ZTN n’est pas une entité fixe. Elle varie en effet avec d’autres composantes environnementales. Les conditions d’hébergement des animaux utilisés dans la recherche (seuls
vs
en groupe, nature et qualité de la litière et de l’enrichissement pour la nidification, hygrométrie, etc.) peuvent en effet augmenter la ZTN des animaux [
11
,
12
]. En revanche, l’augmentation du métabolisme des mammifères en gestation et en lactation produit de grandes quantités de chaleur diminuant de fait leur ZTN [
13
,
14
].
|
La souris et l’homme, deux mammifères endothermes pourtant différents
Différents modèles animaux sont utilisés dans la recherche ; les rongeurs, souris (64 %) et rats (9 %), comptent parmi les plus utilisés. Du fait de leur petite taille, ces animaux possèdent des ratios surface/volume et surface/masse parmi les plus élevés du règne animal. Or, le poids corporel d’un être humain est supérieur à 2 000 fois celui d’une souris de laboratoire (
Figure 2
). À dépense énergétique égale, les déperditions de chaleur seront donc bien plus élevées chez la souris que chez l’homme.
 | Figure 2.
La souris et l’être humain, deux mammifères endothermes très différents.
w : watt.
|
Au
xix
e
siècle, le biologiste allemand Carl Bergmann (1814-1865) avait observé, chez les animaux endothermes, qu’au sein d’un clade, la masse du corps était corrélée à la température de leur environnement [
15
]. Pour maintenir sa température corporelle, la souris utilise beaucoup plus la thermogenèse sans frisson que l’homme. Ce processus métabolique a principalement lieu au sein du tissu adipeux brun. Celui-ci possède en effet de nombreuses mitochondries, des organelles qui expriment la protéine découplante UCP1 (
uncoupling protein 1
) permettant de détourner le gradient de protons de la synthèse de l’ATP pour dissiper l’énergie sous la forme de chaleur. Chez la souris, le tissu adipeux brun représente une proportion significative de sa masse grasse totale. Dans l’espèce humaine, ce tissu adipeux brun est, en revanche, présent en quantité et en proportion plus faibles. Alors qu’il est présent chez le nourrisson, ce tissu tend en effet à régresser avec l’âge ; il peut même être totalement absent chez certaines personnes. Ces différences de constitution du tissu adipeux sont une caractéristique majeure qui nécessite d’être prises en compte lorsque les animaux sont utilisés dans la recherche dans le but d’étudier des maladies humaines [
10
,
16
].
|
Héberger des souris à 22 °C ou à 30 °C, quelles différences ?
La masse corporelle mais aussi l’adiposité totale des souris sont réduites lorsque ces animaux sont maintenus dans un hébergement à 22 °C (soit l’hébergement conventionnel). En revanche, après deux semaines d’exposition à 31 °C, la couche de tissu adipeux intradermique des animaux, le tissu adipeux situé sous la peau qui joue un rôle protecteur, est cinq fois moins épaisse que celle de souris maintenues à 22 °C [
17
], température à laquelle la souris met en place des mécanismes afin d’augmenter son isolement de l’environnement extérieur, en particulier en développant son tissu adipeux intradermique.
En hébergement conventionnel (22 °C), le tissu adipeux brun des souris est fortement activé pour maintenir une température corporelle « normale » pour cet animal. Il en résulte certains problèmes cutanés, affectant notamment la fourrure, qui entraînent une perte d’isolation, en modifiant la qualité de sa peau, de sa fourrure et de ses poils. Ces perturbations capillaires sont équivalentes à celles engendrées par une exposition à une température ambiante froide.
Les souris dont le gène
ACBP
(
acyl-CoA-binding protein
) a été invalidé, de manière globale ou spécifiquement dans la peau, présentent en conditions d’hébergement conventionnel une consommation alimentaire et une dépense énergétique accrues, un brunissement du tissu adipeux blanc inguinal, et une résistance à une obésité induite par manipulations nutritionnelles. Ce phénotype métabolique, y compris le brunissement du tissu adipeux blanc, s’inverse si les souris sont hébergées à 30 °C, la thermoneutralité de ces animaux [
18
]. Dans ce cas précis, les phénotypes qui sont observés à 22 °C ne semblent être que des conséquences d’un défaut d’isolement vis-à-vis de l’environnement extérieur.
Outre le tissu adipeux, la température d’hébergement influence également le développement du tissu osseux. L’exposition chronique des souris à une température ambiante de 20 °C affecte en effet l’architecture osseuse [
19
], la taille du squelette et la masse osseuse. Par rapport aux souris hébergées à une température proche de la thermoneutralité (28-30 °C), les souris hébergées à 20 °C ont un corps et une queue plus courts, un volume osseux trabéculaire plus faible, des trabécules plus éparses et moins connectées dans le fémur distal, un volume fémoral osseux cortical réduit et une tendance à une épaisseur corticale plus faible.
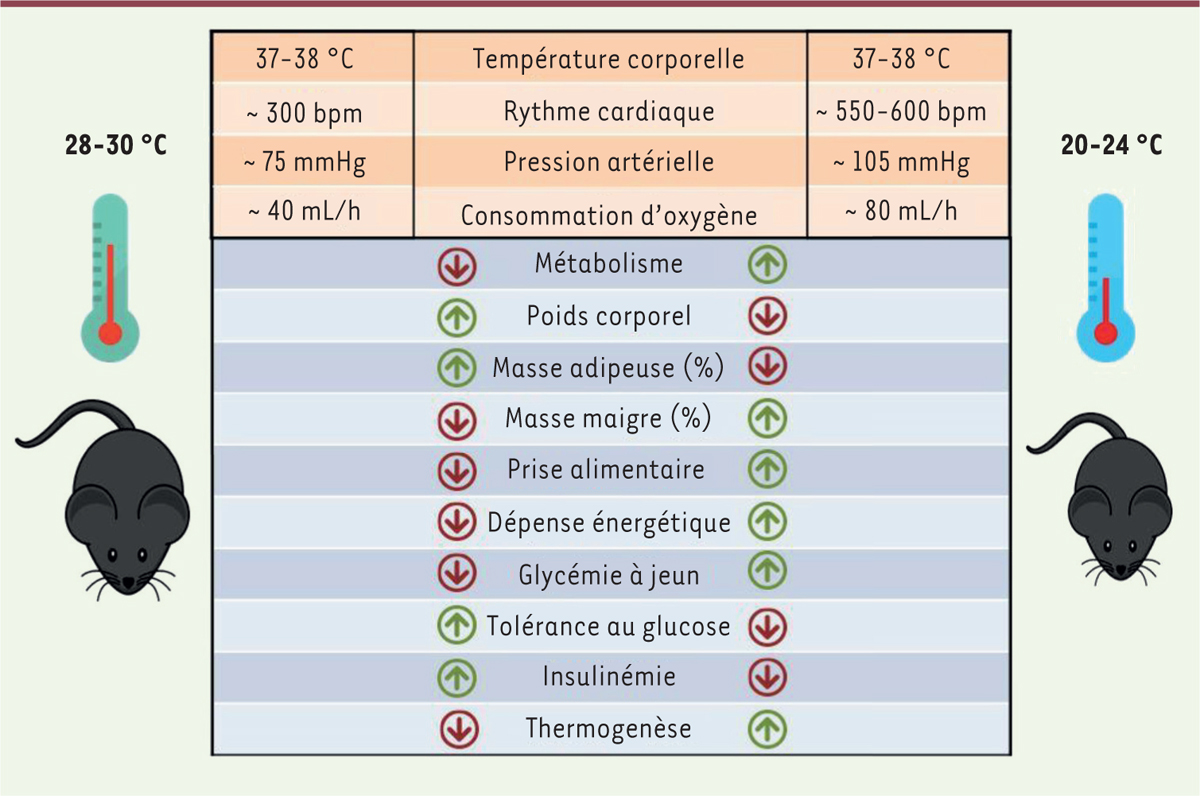
L’hébergement des souris à la température conventionnelle, par opposition à la thermoneutralité, provoque également des modifications physiologiques importantes (
Figure 3
). Chez ces souris, la fréquence cardiaque avoisine le double de celle de souris élevées en conditions physiologiques (600
vs
300 battements par minute) et la pression artérielle moyenne est accrue de 30 %. La dépense énergétique globale des animaux est également plus élevée que celle observée à la thermoneutralité (de 50 à 60 % plus élevée), ce qui est associé à une prise alimentaire accrue et à une augmentation soutenue de la production de catécholamines et de corticostéroïdes [
20
–
22
].
 | Figure 3. L’hébergement à 22 °C suractive le métabolisme de la souris. |
La température d’hébergement peut induire de nombreuses modifications des concentrations de métabolites circulants. Par exemple, après cinq jours d’exposition à 22 °C, les niveaux sanguins de glucose, d’insuline, de leptine ou de triglycérides des animaux sont plus bas par rapport à ceux enregistrés chez des animaux élevés à 29 °C. La concentration sérique de la grande majorité des acides aminés est également diminuée.
Différentes expériences mettant en situation les souris selon des températures variées, ont révélé que des souris, en particulier de fond génétique BALB/c, préféraient, pour leur environnement, une température de 30,9 °C [
23
], assez loin des 22 °C préconisés. Des souris minces, de fond génétique C57BL/6J, préfèrent également dormir à 31,2 °C, mais les souris génétiquement obèses (ob/ob) choisissent, quant à elles, une température de 29,4 °C. Notons que lorsque des cages maintenues à 20 °C, 25 °C ou 30 °C sont disponibles, les souris passent plus de temps à 30 °C, surtout lors de comportements inactifs et de maintenance [
24
]. Les souris préfèrent donc être à des températures proches de leur thermoneutralité
1
.
|
Température d’hébergement et maladies métaboliques
Les différences importantes de composition corporelle observées en fonction de la température d’hébergement peuvent modifier le développement ou la modélisation de certaines maladies (
Tableau I
). Un des exemples les plus marquants de l’importance de la température d’hébergement concerne les maladies métaboliques, en particulier l’obésité. Cette maladie apparaît lorque l’apport énergétique est supérieur à la dépense énergétique. La protéine découplante 1 (UCP1), exprimée de manière spécique dans le tissu adipeux brun, est un acteur majeur de la thermogenèse sans frisson. Feldmann
et al.
ont montré que l’invalidation du gène
UCP1
aggrave l’obésité induite par un régime riche en graisses et elle est suffisante pour induire une obésité lorsque les animaux sont maintenus à 29 °C, même chez des souris nourries avec un régime contrôle [
26
].
Tableau I.
| Modèle |
Phénotype à 20-22 °C |
Phénotype à 28-30 °C |
Références |
|
ACBP
-/-
|
Dépense énergétique et consommation alimentaire accrues, brunissement du tissu adipeux blanc inguinal et résistance à l’obésité induite par des manipulations nutritionnelles |
La thermoneutralité restore la dépense énergétique globale et le brunissement du tissu adipeux blanc |
[
18
]
|
|
|
Ucp1
-/-
|
Résistance à l’obésité induite par un régime riche en graisses et sucres |
Sensibilité à l’obésité induite par un régime riche en graisses et sucres, obésité induite même sous régime contrôle |
[
26
]
|
|
|
D2
-/-
|
Oxydation préférentielle des lipides, sensibilité similaire à l’obésité induite par le régime et meilleure tolérance au glucose |
Dysfonctions métaboliques (augmentation de l’adiposité, de la stéatose hépatique et de l’intolérance au glucose) |
[
27
]
|
|
|
ApoE
-/-
|
L’hébergement à thermoneutralité aggrave l’obésité et la pathogenèse de l’athérosclérose chez les souris
ApoE
-/-
|
|
[
31
]
|
|
| croissance tumorale |
La croissance tumorale après injection par voie sous-cutanée est plus rapide à 22 °C qu’à 30 °C |
|
[
35
]
|
|
| BMP7 |
Augmentation du volume du tissu adipeux brun et brunissement du tissu adipeux blanc |
Aucune augmentation du programme thermogénique |
[
29
]
|
|
| DNP |
Aucun effet sur le poids corporel, l’adiposité ou l’homéostasie du glucose |
Augmentation de la dépense énergétique, Réduction de la prise de poids, de l’adiposité et la stéatose hépatique, amélioration de la tolérance au glucose |
[
28
]
|
|
| lipopolysaccharide |
Hypothermie |
Hyperthermie (fièvre) |
[
33
,
34
]
|
Phénotypes variables selon la température d’hébergement dans plusieurs modèles murins. |
Un autre exemple concerne la modélisation de l’hypothyroïdie. Les souris déficientes pour la déiodinase de type 2, une enzyme nécessaire à la conversion de la prohormone T4 en hormone thyroïdienne active T3, ne développent pas de dysfonctionnement métabolique significatif lorsqu’elles sont hébergées à une température de 22 °C, contrairement à l’être humain en cas d’hypothyroïdie. En revanche, lorsque ces souris sont maintenues à thermoneutralité, elles présentent une augmentation de l’adiposité, une stéatose hépatique et une intolérance au glucose. L’hébergement à une température de 22 °C entraînerait donc une augmentation de l’activité adrénergique du tissu adipeux brun, ce qui compenserait la perte de l’activité de la déiodinase de type 2 et de la T3 [
27
].
|
Température et activation de certaines voies de signalisation La température ambiante à laquelle les animaux sont hébergés est également importante pour l’évaluation d’un médicament, en particulier chez la souris pour les médicaments anti-obésité, surtout lorsqu’ils agissent sur la dépense énergétique.
Dans les années 1930, le DNP (2,4-dinitrophénol), un agent découplant de la phosphorylation oxydante, avait été utilisé comme médicament amaigrissant ; il a depuis été interdit à cause de graves effets secondaires. Des études réalisées chez la souris avaient montré qu’à thermoneutralité, situation où le tissu adipeux brun n’est pas stimulé, le traitement par le DNP augmentait la dépense énergétique, réduisait la prise de poids, l’adiposité et la stéatose hépatique, et induisait une amélioration de la tolérance au glucose. Ces effets du DNP n’étaient pas, en revanche, observés lorsque les souris étaient maintenues à 22 °C [
28
].
Au contraire, chez les souris maintenues à 21 °C, l’administration, durant 4 semaines, de BMP7 (
bone morphogenetic protein 7
), un facteur de croissance membre de la superfamille du TGF-β, augmente le volume de tissu adipeux brun et accroît l’expression d’
UCP1
au sein de ce tissu, des conséquences qui ne sont pas observées lorsque les souris sont à thermoneutralité. Ce traitement agit également sur la formation de cellules
brites
2,
dans le tissu adipeux blanc de façon plus marquée à 21 °C qu’à 30 °C [
29
].
Certaines maladies retrouvées chez l’homme peuvent être exacerbées chez la souris maintenue à thermoneutralité. La thermoneutralité augmente en effet les réponses immunitaires pro-inflammatoires de la souris et exacerbe de manière significative la pathogenèse de la NAFLD (
non alcoholic fatty liver disease
) induite par un régime riche en graisses. Alors que les souris femelles hébergées en conditions conventionelles sont typiquement plus résistantes que les souris mâles à l’obésité et à la NAFLD induites par le régime riche en graisses, celles-ci développent toutes les caractéristiques de ces maladies lorsqu’elles sont maintenues à thermoneutralité [
30
]. Associé à un régime alimentaire obésogène, l’hébergement des souris à thermoneutralité favorise le développement de l’obésité, initie le développement de l’athérosclérose chez les souris contrôles et exacerbe l’athérosclérose chez les souris déficientes pour l’apolipoprotéine E (
ApoE
-/-
) [
31
].
|
Influence de la température sur l’immunité et les infections
Certaines maladies non métaboliques sont aussi dépendantes de la température. L’hébergement des souris à thermoneutralité réduit le stress et augmente l’inflammation. À 30 °C, la concentration sérique de corticostérone est réduite alors que celles du TNF-α (
tumor necrosis factor-
a) et de l’interleukine 6 (IL-6) sont augmentées comparativement à celles observées à 22 °C. La thermoneutralité est également associée à une augmentation de la perméabilité intestinale et à une dysbiose du microbiote intestinal [
30
]. Des observations empiriques datant des années 1940 soulignaient déjà que la température d’hébergement des souris avait un impact significatif sur leurs réponses immunitaires face aux infections. Moragues et Pinkerton avaient notamment constaté que les changements de la température en fonction des saisons affectaient la survie des souris soumises à un typhus expérimental [
32
] : lorsque la température du laboratoire devenait plus fraîche (de 29,4-36,6 °C en été, à 18,3-22,8 °C en hiver), la mortalité des souris infectées passait de 9 % à 100 %. De même, placées à des températures conventionnelles (20-22 °C), les souris ne développent pas de fièvre mais une hypothermie après une stimulation par du lipopolysaccharide (LPS) bactérien, contrairement à des souris hébergées à thermoneutralité [
33
]. Des résultats similaires ont été obtenus chez des rats après traitement avec du LPS ou infectés par la bactérie
Escherichia coli
[
34
].
|
Chez la souris, l’immunité antitumorale est significativement influencée par la température d’hébergement. À thermoneutralité, une réduction de la formation et de la vitesse de croissance des tumeurs et des métastases est observée dans plusieurs modèles tumoraux [
35
]. Ces effets sont liés à l’augmentation significative du nombre de lymphocytes T CD8
+
activés dans le microenvironnement tumoral. La température d’hébergement des souris affecte en effet les propriétés et les fonctions des cellules dendritiques, les cellules qui sont essentielles à l’activation des lymphocytes T CD8
+
[
36
]. Cette activation des cellules dendritiques et des lymphocytes T CD8
+
à thermoneutralité est accompagnée d’une réduction significative du nombre de cellules myéloïdes suppressives (MDSC, pour
myeloid-derived suppressor cell
) et de lymphocytes T régulateurs [
37
]. Au contraire, à 22 °C, la signalisation β-adrénergique, qui est activée par le stress thermique, inhibe la réponse immunitaire, favorisant la croissance tumorale. En effet, il a été montré, en bloquant la signalisation β-adrénergique (par traitement par le propranolol, qui inhibe les récepteurs adrénergiques, ou en utilisant les souris déficientes en récepteurs
adrenoceptor beta 2
,
Adrb2
-/-
), que les différences de croissance tumorale et de réponses immunitaires anti-tumorales observées entre les souris hébergées à 22 °C et celles maintenues à 30 °C dépendaient de la signalisation β-adrénergique [
37
].
|
La souris est le modèle le plus utilisé dans la recherche pour étudier les maladies humaines. Même si la souris possède de nombreux avantages (reproduction rapide, temps de vie compatible pour des études de vieillisement, etc.), aucun modèle n’est parfait et il subsiste de très grandes différences entre la physiologie de l’être humain et celle de la souris. Ces deux mammifères sont endothermes, pourtant leur gestion de la température est bien différente. Une souris est plus de 2 000 fois moins imposante qu’un homme et le maintien de sa température corporelle est bien plus dépendant de l’activité de son tissu adipeux brun.
La température conventionnelle d’hébergement en animalerie est comprise entre 20 °C et 24 °C, essentiellement pour le confort des animaliers, car maintenue à cette température, la souris est en état de stress thermique chronique, activant fortement son tissu thermogénique et modifiant profondément son métabolisme. La plupart du temps, l’être humain s’acclimate et vit à une température de confort, grâce notamment à des adaptations, telles que les vêtements, le chauffage ou la climatisation, ce que la souris ne peut faire en conditions de laboratoire. Ces différences soulèvent donc la question de la pertinence des résultats obtenus uniquement à 22 °C car dans de nombreux cas (maladies métaboliques, infections, cancers), les résultats peuvent varier selon la température. L’hébergement conventionnel éloigne ainsi un peu plus la souris de la physiologie humaine. À 22 °C, le développement de certaines maladies (obésité, atteintes hépatiques du type NAFLD [
non alcoholic fatty liver disease
], athérosclérose, etc.) est freiné chez la souris.
Lorque le choix est possible, une souris préfèrera un environnement à une température proche de sa zone de thermoneutralité. Aussi, que ce soit pour des raisons de bien-être animal ou pour mieux modéliser des maladies humaines, un hébergement à 30 °C semble souvent plus approprié. Notons néanmoins que l’exposition au froid, qui active le tissu thermogénique, est à l’origine de nombreuses réponses métaboliques dont la compréhension améliorerait le développement de traitements de l’obésité ou des cancers, en lien avec l’activation du tissu thermogénique [
38
].
Au vu des politiques de réduction de l’utilisation d’animaux dans la recherche, il est difficile de mener toutes les études en parallèle à la fois à 22 °C et à 30 °C. C’est pourquoi, il est actuellement fortement recommandé que la température ambiante de l’hébergement des animaux qui sont utilisés soit rapportée de manière cohérente, précise et que celle-ci soit reconnue comme une variable expérimentale importante. Notons que, en plus de la température d’hébergement, d’autres facteurs, tout aussi importants, devraient être considérés, tels que l’hygrométrie, le nombre de souris par cage, l’enrichissement, le bruit ou encore la gestion des rythmes circadiens. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Ce travail a été soutenu par le CNRS, l’Inserm, l’université Côte d’Azur et par l’Agence nationale de la recherche (ANR-17-CE14-0015, HepAdialogue ; ANR-19-CE14-0029, AdipoPiezo).
|
Footnotes |
1.
Aloysio Luigi Galvani.
.
(1737–1798) discoverer of animal electricity.
.
JAMA
1967;
;
201
:
:626.
–
627
.
2.
Wenzel
E.
.
Luigi GALVANI-Alexander von Humboldt-Hans Berger. (From the history of electroencephalography.
.
Munch Med Wochenschr
1962;
;
104
:
:1146.
–
1150
.
3.
Cacciamali
A
,
Villa
R
,
Dotti
S
.
3D Cell Cultures: Evolution of an Ancient Tool for New Applications.
.
Front Physiol
2022;
;
13
:
:836480.
.
4.
Group NCRRGW.
.
Animal research: reporting in vivo experiments: the ARRIVE guidelines.
.
Exp Physiol
2010;
;
95
:
:842.
–
4
.
5.
Lillywhite
HB
,
Zippel
KC
,
Farrell
AP
.
Resting and maximal heart rates in ectothermic vertebrates.
.
Comp Biochem Physiol A Mol Integr Physiol
1999;
;
124
:
:369.
–
382
.
6.
Wieser
W.
.
A new look at energy conversion in ectothermic and endothermic animals.
.
Oecologia
1985;
;
66
:
:506.
–
510
.
7.
Milsom
WK
,
Gilmour
KM
,
Perry
S
,
et al.
Control of Breathing in Ectothermic Vertebrates.
.
Compr Physiol
2022;
;
12
:
:3869.
–
988
.
8.
Ritchie
DJ
,
Friesen
CR
.
Invited review: Thermal effects on oxidative stress in vertebrate ectotherms.
.
Comp Biochem Physiol A Mol Integr Physiol
2022;
;
263
:
:111082.
.
9.
Blondin
DP
,
Labbe
SM
,
Tingelstad
HC
,
et al.
Increased brown adipose tissue oxidative capacity in cold-acclimated humans.
.
J Clin Endocrinol Metab
2014;
;
99
:
:E438.
–
E446
.
10.
Kingma
B
,
Frijns
A
,
van Marken Lichtenbelt
W
.
The thermoneutral zone: implications for metabolic studies.
.
Front Biosci (Elite Ed)
2012;
;
4
:
:1975.
–
85
.
11.
Gaskill
BN
,
Gordon
CJ
,
Pajor
EA
,
et al.
Heat or insulation: behavioral titration of mouse preference for warmth or access to a nest.
.
PLoS One
2012;
;
7
:
:e32799.
.
12.
Gaskill
BN
,
Gordon
CJ
,
Pajor
EA
,
et al.
Impact of nesting material on mouse body temperature and physiology.
.
Physiol Behav
2013;
;
110–111
:
:87.
–
95
.
13.
Quek
VS
,
Trayhurn
P
.
Calorimetric study of the energetics of pregnancy in golden hamsters.
.
Am J Physiol
1990;
;
259
:
:R807.
–
R812
.
14.
Roberts
SB
,
Coward
WA
.
The effects of lactation on the relationship between metabolic rate and ambient temperature in the rat.
.
Ann Nutr Metab
1985;
;
29
:
:19.
–
22
.
15.
Bogin
B
,
Hermanussen
M
,
Scheffler
C
.
Bergmann’s rule is a “just-so” story of human body size.
.
J Physiol Anthropol
2022;
;
41
:
:15.
.
16.
Maloney
SK
,
Fuller
A
,
Mitchell
D
,
et al.
Translating animal model research: does it matter that our rodents are cold?
.
Physiology (Bethesda)
2014;
;
29
:
:413.
–
420
.
17.
Kasza
I
,
Suh
Y
,
Wollny
D
,
et al.
Syndecan-1 is required to maintain intradermal fat and prevent cold stress.
.
PLoS Genet
2014;
;
10
:
:e1004514.
.
18.
Neess
D
,
Kruse
V
,
Marcher
AB
,
et al.
Epidermal Acyl-CoA-binding protein is indispensable for systemic energy homeostasis.
.
Molecular metabolism
2021;
;
44
:
:101144.
.
19.
Robbins
A
,
Tom
C
,
Cosman
MN
,
et al.
Low temperature decreases bone mass in mice: Implications for humans.
.
Am J Phys Anthropol
2018;
;
167
:
:557.
–
568
.
20.
Swoap
SJ
,
Li
C
,
Wess
J
,
et al.
Vagal tone dominates autonomic control of mouse heart rate at thermoneutrality.
.
Am J Physiol Heart Circ Physiol
2008;
;
294
:
:H1581.
–
H1588
.
21.
Deemer
SE
,
Plaisance
EP
,
Martins
C
.
Impact of ketosis on appetite regulation-a review.
.
Nutr Res
2020;
;
77
:
:1.
–
11
.
22.
Gordon
CJ
.
Relationship between autonomic and behavioral thermoregulation in the mouse.
.
Physiol Behav
1985;
;
34
:
:687.
–
690
.
23.
Carlisle
HJ
,
Dubuc
PU
.
Temperature preference of genetically obese (ob/ob) mice.
.
Physiol Behav
1984;
;
33
:
:899.
–
902
.
24.
Gaskill
BN
,
Garner
JP
.
Letter-to-the-editor on “Not so hot: Optimal housing temperatures for mice to mimic the thermal environment of humans”.
.
Molecular metabolism
2014;
;
3
:
:335.
–
336
.
25.
Bautista
DM
,
Siemens
J
,
Glazer
JM
,
et al.
The menthol receptor TRPM8 is the principal detector of environmental cold.
.
Nature
2007;
;
448
:
:204.
–
208
.
26.
Feldmann
HM
,
Golozoubova
V
,
Cannon
B
,
Nedergaard
J
.
UCP1 ablation induces obesity and abolishes diet-induced thermogenesis in mice exempt from thermal stress by living at thermoneutrality.
.
Cell metabolism
2009;
;
9
:
:203.
–
209
.
27.
Castillo
M
,
Hall
JA
,
Correa-Medina
M
,
et al.
Disruption of thyroid hormone activation in type 2 deiodinase knockout mice causes obesity with glucose intolerance and liver steatosis only at thermoneutrality.
.
Diabetes
2011;
;
60
:
:1082.
–
1089
.
28.
Goldgof
M
,
Xiao
C
,
Chanturiya
T
,
et al.
The chemical uncoupler 2,4-dinitrophenol (DNP) protects against diet-induced obesity and improves energy homeostasis in mice at thermoneutrality.
.
J Biol Chem
2014;
;
289
:
:19341.
–
19350
.
29.
Boon
MR
,
van den Berg
SA
,
Wang
Y
,
et al.
BMP7 activates brown adipose tissue and reduces diet-induced obesity only at subthermoneutrality.
.
PLoS One
2013;
;
8
:
:e74083.
.
30.
Giles
DA
,
Moreno-Fernandez
ME
,
Stankiewicz
TE
,
et al.
Thermoneutral housing exacerbates nonalcoholic fatty liver disease in mice and allows for sex-independent disease modeling.
.
Nat Med
2017;
;
23
:
:829.
–
838
.
31.
Giles
DA
,
Ramkhelawon
B
,
Donelan
EM
,
et al.
Modulation of ambient temperature promotes inflammation and initiates atherosclerosis in wild type C57BL/6 mice.
.
Molecular metabolism
2016;
;
5
:
:1121.
–
1130
.
32.
Moragues
V
,
Pinkerton
H
.
Variation in Morbidity and Mortality of Murine Typhus Infection in Mice with Changes in the Environmental Temperature.
.
J Exp Med
1944;
;
79
:
:41.
–
43
.
33.
Rudaya
AY
,
Steiner
AA
,
Robbins
JR
,
et al.
Thermoregulatory responses to lipopolysaccharide in the mouse: dependence on the dose and ambient temperature.
.
Am J Physiol Regul Integr Comp Physiol
2005;
;
289
:
:R1244.
–
R1252
.
34.
Liu
E
,
Lewis
K
,
Al-Saffar
H
,
et al.
Naturally occurring hypothermia is more advantageous than fever in severe forms of lipopolysaccharide- and Escherichia coli-induced systemic inflammation.
.
Am J Physiol Regul Integr Comp Physiol
2012;
;
302
:
:R1372.
–
R1383
.
35.
Kokolus
KM
,
Capitano
ML
,
Lee
CT
,
et al.
Baseline tumor growth and immune control in laboratory mice are significantly influenced by subthermoneutral housing temperature.
.
Proc Natl Acad Sci U S A
2013;
;
110
:
:20176.
–
20181
.
36.
Kokolus
KM
,
Spangler
HM
,
Povinelli
BJ
,
et al.
Stressful presentations: mild cold stress in laboratory mice influences phenotype of dendritic cells in naïve and tumor-bearing mice.
.
Front Immunol
2014;
;
5
:
:23.
.
37.
Mohammadpour
H
,
MacDonald
CR
,
Qiao
G
,
et al.
beta2 adrenergic receptor-mediated signaling regulates the immunosuppressive potential of myeloid-derived suppressor cells.
.
J Clin Invest
2019;
;
129
:
:5537.
–
5552
.
38.
Seki
T
,
Yang
Y
,
Sun
X
,
et al.
Brown-fat-mediated tumour suppression by cold-altered global metabolism.
.
Nature
2022;
;
608
:
:421.
–
8
.
|