| |
| Med Sci (Paris). 39(12): 967–974. doi: 10.1051/medsci/2023181.La frontière latérale somitique, source des cellules somitiques multipotentes chez le xénope Bruno della Gaspera1* and Christophe Chanoine1** 1Université Paris Cité, Inserm U1124, campus Saint-Germain
,
45 rue des saints-pères
,
75006Paris
,
France |
Vignette (© Christophe Chanoine).
Les somites sont des structures métamériques transitoires d’origine mésodermique caractéristiques des chordés (
Figure 1A
,
B
). Ils se forment à partir du mésoderme paraxial, localisé de part et d’autre du tube neural et de la chorde [
1
]. Au cours de la somitogenèse embryonnaire, le mésoderme paraxial se segmente et se différencie progressivement dans la direction céphalo-caudale. Dans la partie la plus caudale de l’embryon, il demeure sous forme non segmentée. Au cours de leur différenciation, les somites se subdivisent en plusieurs compartiments distincts : le dermomyotome, le myotome, le sclérotome et le syndétome, qui sont à l’origine du système musculosquelettique axial (
Figure 1A
). Les muscles squelettiques du tronc et des membres proviennent du dermomyotome, tandis que les vertèbres et les côtes dérivent du sclérotome, et les tendons dorsaux du syndétome. Les somites sont également à l’origine du derme dorsal, de tissus vasculaires et, au moins chez les mammifères, de tissus graisseux.
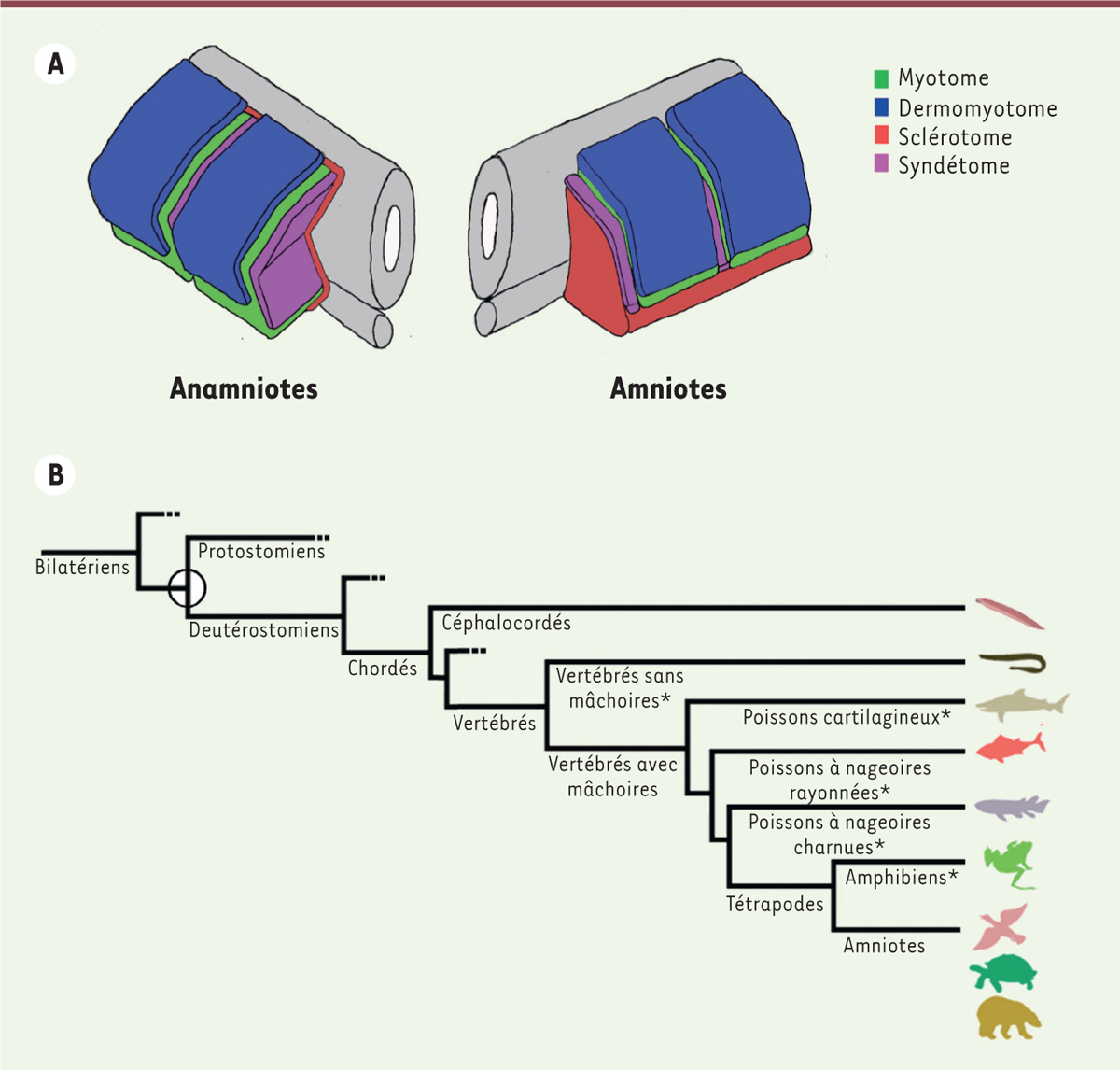
 | Figure 1.
A. Comparaison schématique de l’organisation des somites chez les amniotes et les anamniotes au stade phylotypique.
Le stade phylotypique est le stade du développement présentant le plus d’homologies au sein des vertébrés. Chez les anamniotes, le somite a une forme en chevron adapté à la nage ondulatoire rapide. Le myotome occupe la majorité du somite. Le dermomyotome est localisé en position dorsolatérale et la fine couche de cellules du sclérotome est en position ventromédiane entre le myotome et les structures de la ligne médiane (tube neural et notocorde). Le syndétome est constitué de ténocytes projetant des extensions cytoplasmiques entre les cellules musculaires des somites adjacents. Chez les amniotes, l’organisation spatiale est la même, mais le compartiment du myotome est réduit et le sclérotome est plus développé.
B. Présentation schématique de l’arbre phylogénique conduisant à la formation des vertébrés amniotes et anamniotes.
Urbilateria
(cercle creux), l’ancêtre commun de la plupart des animaux à symétrie bilatérale est à l’origine des protostomiens et des deutérostomiens qui diffèrent par la destinée du blastopore suite à la gastrulation. Les Chordés sont un embranchement des deutérostomiens dont les céphalocordés représentent un sous-embranchement au même titre que les vertébrés (et les urocordés qui ont perdu leurs somites). Parmi les vertébrés, on distingue également les vertébrés sans (comme la lamproie) ou avec mâchoires, puis les poissons cartilagineux, les poissons osseux et les poissons à nageoires rayonnées (comme le poisson zèbre) de ceux à nageoires charnues. Les poissons et les amphibiens sont des vertébrés anamniotes (*) dont les embryons se développent en absence d’amnios contrairement aux vertébrés amniotes (reptiles, oiseaux, mammifères). Les amphibiens sont les seuls tétrapodes anamniotes.
|
Les amniotes et les anamniotes présentent des variations dans les phases initiales de la compartimentation somitique (
Figure 2
). Chez les amniotes, les jeunes somites sont des structures composées de cellules somitiques multipotentes (CSM) organisées sous la forme d’une sphère de cellules épithéliales et se subdivisent rapidement en un dermomyotome dorsal et un sclérotome ventral (
Figure 2B
). Les cellules du dermomyotome restent sous forme épithéliale tandis que celles du sclérotome subissent une transition épithélio-mésenchymateuse. Par la suite, les muscles épaxiaux (les muscles du dos innervés par la branche dorsale des nerfs rachidiens) se forment à partir de la délamination (ou séparation) de cellules du dermomyotome médian qui contribuent à la formation du myotome (
Figure 2B
). Les muscles hypaxiaux (myotome hypaxial, muscles ventro-latéraux et muscles des membres, innervés par la branche ventrale des nerfs rachidiens) sont issus de la partie latérale du dermomyotome [
2
].
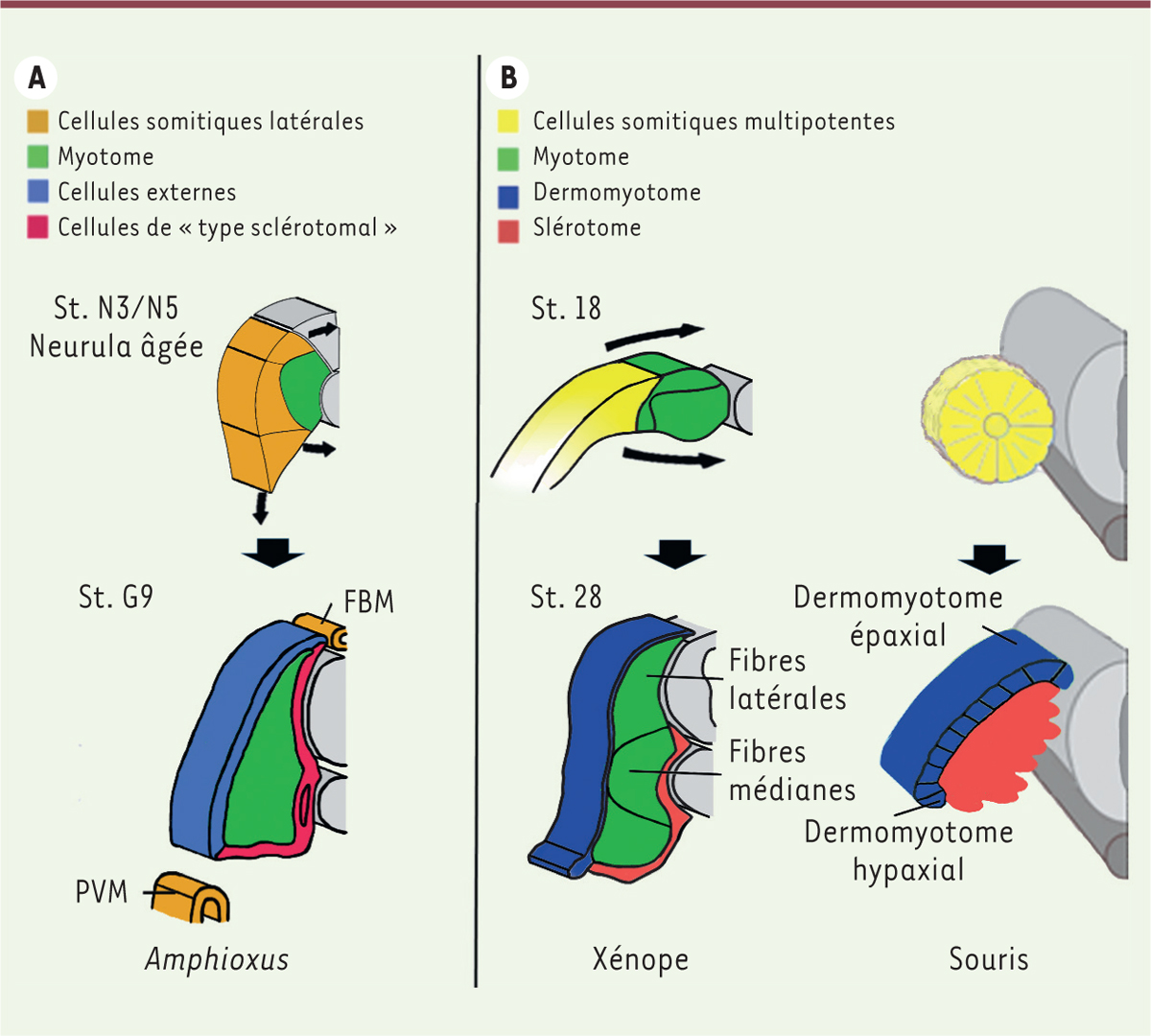
 | Figure 2.
Comparaison des modes de compartimentation somitique chez l’amphioxus, le xénope, et la souris. A.
Chez l’
amphioxus
, dès le stade
Neurula
âgée, les somites sont subdivisés en un myotome médian et un domaine latéral. Ce dernier possède des précurseurs qui donnent naissance dorsalement aux cellules externes et ventralement à des cellules de type sclérotomal. Le domaine latéral donne également naissance au FBM (
fin box mesothelium
) et au PVM (
perivisceral mesothelium
).
B.
La première phase de compartimentation somitique est principalement médiolatérale chez le xénope et dorsoventrale chez la souris. Chez le xénope, le domaine somitique latéral enveloppe le myotome ventralement et dorsalement pour donner naissance au dermomyotome et au sclérotome. Chez les amniotes, comme la souris, les somites nouvellement formés sont constitués de CSM qui donneront par la suite un dermomyotome dorsolatéral, à l’origine du myotome, et un sclérotome ventromédian. St : stade de développement ; N3/N5 :
Neurula
; G9 : fentes brachiales (
Gill slits
) ; St. 18 :
mi-neurula
; St. 28 : bourgeon caudal développé.
|
Chez les anamniotes (
Figure 1B
), à l’inverse, la compartimentation commence avant la formation des somites et adopte une organisation médiolatérale : un myotome primitif se met initialement en place à partir du mésoderme paraxial dans la région médiane, alors que le territoire latéral reste indifférencié [
3
,
4
]. Les céphalocordés
1,
, un sous-embranchement basal de chordés
2
, présentent le même schéma de compartimentation [
5
], suggérant qu’il était partagé par le dernier ancêtre commun des chordés (
Figure 1B
et
Figure 2A
).
Si la compartimentation et la différenciation des somites ont fait l’objet de nombreuses synthèses chez les amniotes [
1
], l’origine des lignages somitiques est restée longtemps mal connue chez les anamniotes [
6
]. À partir de nos travaux réalisés chez le xénope [
7
], nous faisons, dans cette revue, le point sur l’origine des différents lignages somitiques et la contribution évolutive de la frontière latérale somitique (FLS), qui sépare de manière dynamique les mésodermes somitique et latéral lors de l’embryogenèse [
8
].
|
Le myotome primitif et la formation du dermomyotome
Chez les vertébrés, la myogenèse du muscle squelettique est orchestrée par les quatre facteurs de transcription à domaine bHLH
3
de la famille Myod (Myod1, Myf5, Mrf4 et la myogénine) capables, après transfection, de convertir des fibroblastes en cellules musculaires squelettiques [
9
]. L’analyse de leurs expressions a permis d’identifier au moins trois vagues myogéniques chez le xénope [
10
]. Les premiers signes de la myogenèse surviennent précocement, lors de la transition de la
blastula
à la
gastrula
, bien avant la formation des somites [
11
]. Cette première vague myogénique provient directement du mésoderme paraxial et forme le myotome primitif qui apparaît avant le dermomyotome (
Figure 2B
). Elle est composée de deux populations distinctes, médiane et latérale, qui expriment un faible niveau de myogénine. Les fibres médianes restent proches de la notocorde
4,
et sont ensuite recouvertes dorsalement et ventralement par les fibres latérales lors de la neurulation [
7
].
Le dermomyotome est à l’origine du derme dorsal, des fibres musculaires du tronc et des membres, mais aussi des cellules souches musculaires, les cellules satellites [
1
,
2
,
12
] (
→
).
(→) Voir la Synthèse de P.Y. Rescan,
m/s
n° 5, mai 2010, page 504
L’existence d’un dermomyotome chez les anamniotes a longtemps été discutée et ce n’est qu’en 2006 que Devoto
et al
. [
13
] ont émis l’hypothèse que les somites de tous les embryons de vertébrés possèdent un dermomyotome. L’expression de gènes codant le collagène dans les cellules dorsolatérales somitiques chez les poissons téléostéens
5
[
14
] (
→
) et chez le xénope [
15
] est venue confirmer que le derme dorsal provient de ce compartiment somitique. En outre, l’expression des facteurs de transcription marqueurs des précurseurs myogéniques, Pax3 et Pax7, a également été détectée dans des cellules dorsolatérales de somites de lamproies [
16
], de poissons zèbres et d’esturgeons [
13
], corroborant l’existence d’un dermomyotome chez les poissons. Chez le xénope, une structure nommée à l’origine « dermatome » a été décrite pour la première fois histologiquement dans la région dorsolatérale des somites [
17
]. Plus récemment, Grimaldi
et al.
[
15
] ont montré que cette région est l’équivalent du dermomyotome des amniotes puisqu’elle exprime Pax3 et donne naissance aux progéniteurs myogéniques des domaines épaxial et hypaxial
6
des somites [
18
]. Cette deuxième vague myogénique participe à la croissance du myotome primitif au stade bourgeon caudal, et est caractérisée par une forte expression de la myogénine [
10
]. La myogenèse hypaxiale donne également naissance à la musculature ventrolatérale [
18
]. En fin de phase embryonnaire, la troisième vague myogénique est mise en évidence par la présence de cellules positives pour le facteur Myf5 dans le myotome [
10
], qui pourraient participer à la formation de fibres plurinucléées lors de la transition vers la phase larvaire [
7
].
(→) Voir la Nouvelle de M. Lagha
et al.
,
m/s
n° 10, octobre 2005, page 801
Chez le xénope,
Meox2,
le seul gène de la famille
Meox
(
mesenchyme homeobox
) à s’exprimer, est le marqueur le plus spécifique de la FLS (
Figure 3A
), et son expression se maintient dans le dermomyotome. Les expériences de perte de fonction par injection d’oligomorpholinos
7,
montrent que
Meox2
est nécessaire à la formation du dermomyotome, comme c’est le cas des souris dont le gène
Meox2
a été invalidé et des souris dont les deux gènes
Meox1
et
Meox2
ont été invalidés [
4
,
7
]. Chez la jeune
neurula
, nos expériences de lignage cellulaire [
4
] avec un traceur fluorescent montrent que le dermomyotome provient de précurseurs migrant dorsalement à partir de la FLS (
Figure 3C
,
D
). De plus, l’ablation expérimentale de la FLS entraîne une chute drastique de l’expression de
Pax3
, montrant que ces précurseurs sont nécessaires à la formation du dermomyotome.
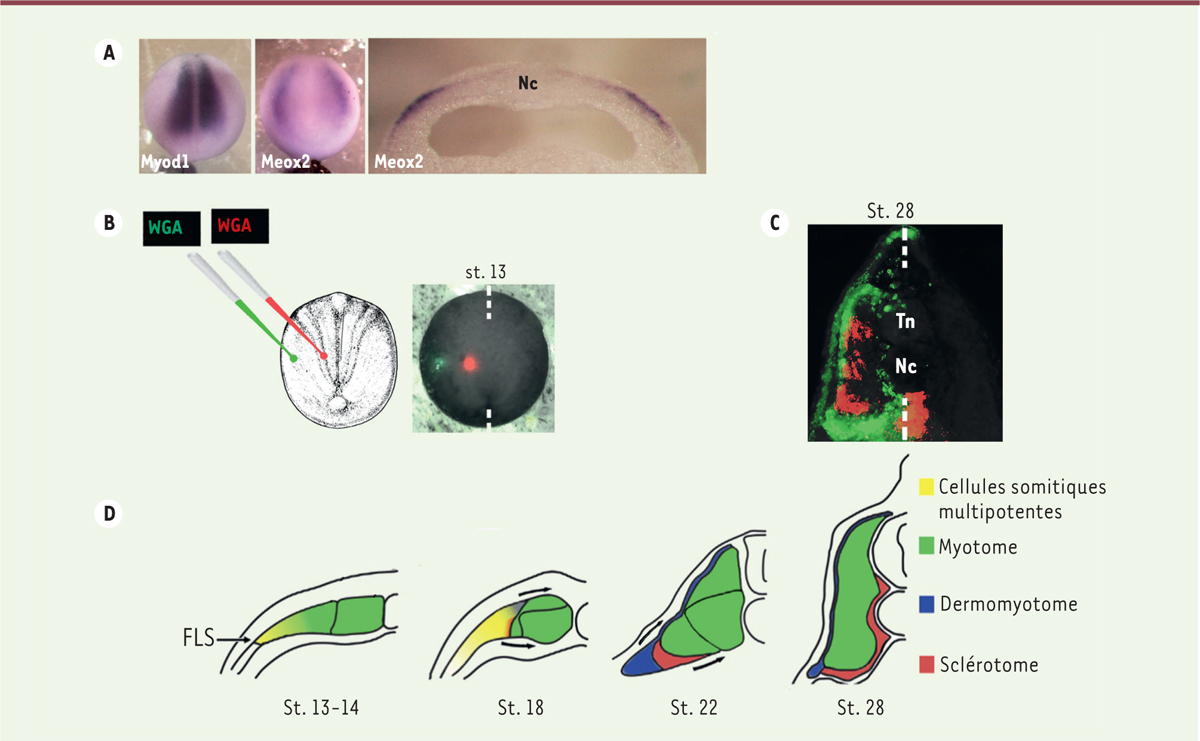
 | Figure 3.
Destin des cellules de la FLS chez le xénope. A.
L’ARNm Myod1 est exprimé par le myotome primitif, tandis que l’ARNm Meox2 est le marqueur le plus spécifique de la FLS chez le xénope. Meox2 s’accumule au niveau de la partie la plus latérale du mésoderme paraxial au stade (St.) 14. À gauche et au centre, stade 14, vue dorsale. À droite, stade 14, coupe transversale. L’expression du gène est détectée par hybridation
in situ
.
B.
Les embryons au stade 13 sont injectés avec deux traceurs fluorescents, rouge dans la partie médiane et vert dans la partie latérale du mésoderme paraxial. WGA (
wheat germ agglutinin
) est une lectine qui se fixe aux glycoprotéines de surface pour marquer les cellules de la région injectée.
C.
Les embryons sont fixés au stade bourgeon caudal (stade 28), et le destin des cellules injectées est analysé. Les cellules de la FLS enveloppent le myotome médian dorsalement et ventralement.
D.
Représentation schématique de la dynamique de compartimentation des somites du stade jeune
Neurula
(stade 13) jusqu’à la fin du stade jeune bourgeon caudal (stade 28). La flèche désigne la FLS, frontière latérale des somites. Tn : tube neural ; Nc : notocorde.
|
Chez le céphalocordé
amphioxus
, les analyses histologiques ont montré qu’il n’existe pas de structure équivalente au dermomyotome [
19
]. Cependant, des cellules disposées en couche recouvrent le myotome dorsalement ; ces cellules ont été nommées cellules externes. Plus récemment, Yong
et al.
[
20
] ont montré qu’un compartiment de la région dorsolatérale des somites exprime
Amphipax3/7
(homologues de
Pax3/7
) indiquant que ces cellules possèdent certaines caractéristiques du dermomyotome. Comme chez le xénope, Mansfield
et al
. [
5
] ont observé chez l’
amphioxus
que des cellules provenant de la région somitique latérale, migrent dorsalement et recouvrent le myotome primitif pour donner les cellules externes (
Figure 2A
).
|
Chez les amniotes, le sclérotome est le premier compartiment somitique à se différencier à partir d’environ la moitié des cellules somitiques [
21
]. Chez les anamniotes [
6
], le sclérotome, moins volumineux, se forme, en revanche, plus tardivement, constitué d’une fine couche ventromédiane de cellules mésenchymateuses située entre un myotome très développé et les structures axiales (
Figure 1
et
Figure 2B
).
Pendant longtemps, l’ontogenèse du sclérotome est restée inconnue chez les amphibiens. Cependant, des travaux historiques ont identifié la présence d’un petit nombre de cellules au bord ventromédian du somite, bien après la formation du myotome et du « dermatome ». Ces cellules sont capables de migrer au stade larvaire dans les espaces périnotochordal et périneural pour donner naissance au squelette axial [
7
,
22
]. Récemment, ces cellules ont été caractérisées par hybridation
in situ
à l’aide de marqueurs du sclérotome,
Twist1
,
Pax1
et
Pax9
, au stade jeune bourgeon caudal [
23
,
24
]. Les analyses de lignage cellulaire utilisant un traceur fluorescent, couplées à l’hybridation
in situ
des ARNm
Twist1
permettent de visualiser les précurseurs migrant ventralement à partir de la FLS pour venir former le sclérotome (
Figure 3B
,
C
,
D
). De plus, l’ablation par microchirurgie du domaine de la FLS, empêche l’expression de
Twist1
, indiquant que ces précurseurs sont nécessaires à la formation du sclérotome. La dynamique d’expression de
Twist1
au cours de la somitogenèse de l’axolotl, un amphibien urodèle
8,
, confirme le caractère général de l’origine latérale des cellules du sclérotome chez les amphibiens [
24
].
Chez l’
amphioxus
, des travaux anciens décrivaient déjà une population de cellules ventromédianes formant un diverticule s’étendant vers la notocorde, qui pourrait être homologue au sclérotome [
25
]. Plus récemment, Mansfield
et al
. [
5
] ont montré que des cellules latérales migrent ventralement et s’insinuent médialement entre le myotome et les structures axiales pour donner une couche de cellules de type sclérotomal. Chez l’
amphioxus
, la compartimentation et l’ontogenèse des somites sont donc similaires à celles du xénope, avec un myotome primitif positionné médialement, enveloppé dorsalement et ventralement par les cellules du domaine latéral (
Figure 2A
).
|
Chez les amniotes, le syndétome est le compartiment dérivé du sclérotome, qui donne naissance aux tendons dorsaux [
26
]. Chez la souris, le marqueur le plus précoce et le plus persistant de la lignée tendineuse, Scleraxis, est un autre membre de la famille des facteurs de transcription Twist [
27
]. Il est exprimé au niveau du syndétome, localisé en bordure du myotome de chaque somite (
Figure 1
). Plus récemment, un compartiment somitique exprimant
Scleraxis
a été identifié chez le xénope [
28
], et, encore plus récemment, chez plusieurs espèces de poissons [
31
,
30
]. Chez le poisson zèbre, les ténocytes, cellules de la composante cellulaire des tendons, présentent des prolongements cellulaires intersomitiques [
30
], montrant que l’organisation générale est conservée entre anamniotes et amniotes. Cependant, chez la larve d’anamniotes, les jonctions myotendineuses semblent relier les fibres musculaires de somites voisins contrairement aux amniotes où les tendons relient les jonctions myotendineuses à l’os [
31
].
Un autre marqueur du syndétome a également été identifié chez le xénope, Mef2c, un membre de la famille des facteurs de transcription Mef2 impliquée dans le développement musculaire [
28
]. Les gènes codant Mef2a et Mef2d sont caractérisés par une expression continue au niveau musculaire. Les études d’hybridation
in situ
ont en outre montré que les ARNm Mef2c et Scleraxis s’accumulent dans le tissu conjonctif en bordure des masses musculaires hypaxiales et crâniennes. Cependant, la fonction de Mef2c dans cette population cellulaire reste inconnue. Dans nos expériences d’ablation de la FLS chez le xénope, l’expression de Mef2c est également fortement diminuée, suggérant que le syndétome comme le sclérotome provient de la FLS [
24
].
|
La frontière latérale somitique et la compartimentation somitique
Les travaux effectués chez l’
amphioxus
et le xénope conduisent à proposer un modèle évolutif de la compartimentation des somites. Chez l’embryon de xénope, les cellules de la FLS enveloppent dorsalement et ventralement le myotome primitif pour donner l’ensemble des nouveautés tissulaires du somite, c’est-à-dire le sclérotome, le dermomyotome et sa région hypaxiale [
24
]. Le destin cellulaire adopté par ces cellules suggère fortement que les précurseurs de la FLS sont constitués de CSM. Chez l’
amphioxus
, il est probable que des proto-CSM existent déjà, puisque des précurseurs latéraux enveloppent également le myotome pour donner les cellules externes et les cellules de type sclérotomal. Des expériences de RNAseq (séquençage de l’ARN) sur cellules uniques pourraient permettre une meilleure caractérisation (et comparaison) de ces précurseurs chez l’
amphioxus
et le xénope. Cette homologie dans l’ontogenèse des somites suggère aussi que la FLS représente l’emplacement ancestral des CSM [
5
], étayant son rôle dans le développement et l’évolution du tronc des vertébrés [
8
]. Cependant, chez le poisson zèbre, le schéma de compartimentation des somites est à la fois médiolatéral et antéropostérieur alors que la localisation du domaine des CSM reste à préciser [
3
]. L’étude de la compartimentation des somites chez les autres classes de vertébrés pourrait permettre de confirmer que la FLS est le positionnement ancestral des CSM (
Figure 1B
)
9
.
Chez les amniotes, le territoire des CSM s’étend au somite entier aux dépens du myotome primitif (
Figure 2B
). À l’appui de cette conception, les marqueurs des CSM du xénope (
Meox2
, mais également d’autres marqueurs moins spécifiques comme
Tcf15
[
transcription factor 15
],
Foxc
[
forkhead box C
]
1
et
2
) sont exprimés dans l’ensemble des somites des amniotes, dont la différenciation dépend des signaux émis par les tissus environnants. Aux niveaux épaxial et hypaxial du dermomyotome des amniotes, la formation du myotome présente de plus de fortes homologies avec la seconde vague myogénique des amphibiens (xénope et axolotl), indiquant que le myotome primitif a été largement perdu chez les amniotes [
10
,
32
]. Les avantages évolutifs de l’extension du domaine des CSM pourraient être liés à l’apparition d’un sclérotome plus volumineux, facilitant la formation de ses dérivés. À l’inverse, le myotome volumineux et fonctionnel des anamniotes est formé à partir du myotome primitif et permet aux larves de se nourrir et de fuir les prédateurs. Selon l’hypothèse du « goulot d’étranglement des chordés », seuls certains muscles longitudinaux ancestraux auraient subsisté pour donner naissance au myotome primitif et auraient ainsi permis le développement de la nage ondulatoire rapide, grâce à l’apparition d’une structure axiale rigide, la notocorde [
33
,
34
].
Chez les céphalocordés et les anamniotes, les proto-CSM (ancestraux) et les CSM se développent en étant associés au myotome primitif, indiquant qu’un précurseur ancestral associé au tissu musculaire pourrait être à l’origine des proto-CSM (
Figure 1B
et
Figure 2
). Les précurseurs des cellules souches musculaires semblent être de bons candidats. En effet, les cellules souches de type satellite ont été observées aussi bien chez les protostomiens, comme la drosophile et les crustacés [
35
,
36
], que chez les deutérostomiens, comme dans les somites de l’
amphioxus
[
37
]. Chez la drosophile, leurs précurseurs sont effectivement liés au développement musculaire durant la phase embryonnaire [
35
]. Chez les premiers chordés (
amphioxus
), les proto-CSM produisent un tissu conjonctif en partie compartimenté reliant le myotome aux structures adjacentes et génèrent probablement des précurseurs musculaires [
20
]. Les CSM, quant à elles, sont à l’origine de compartiments différenciés de tissu conjonctif (le dermatome, le sclérotome et le syndétome) et donnent des précurseurs musculaires. La double duplication du génome (hypothèse 2R WGD [
two rounds of whole genome duplication
]), qui se serait produite entre les chordés et les vertébrés à mâchoires, pourrait contribuer à l’évolution du lignage des proto-CSM par néo- ou sub-fonctionnalisation des gènes dupliqués [
38
]. Chez l’
amphioxus
, les cellules de type sclérotomal constituent bien l’un des composants du tissu conjonctif enveloppant le myotome mais elles n’expriment pas les gènes codant les facteurs de transcription du programme génétique cartilagineux, comme
SoxE
. Des tissus cartilagineux ont pourtant été identifiés, aussi bien chez les protostomiens que chez les deutérostomiens. Yong
et al.
[
20
] suggèrent que la cooptation du programme cartilagineux ancestral par le lignage des CSM aurait eu lieu uniquement chez les vertébrés, illustrant ainsi l’un des modes d’évolution de ce lignage cellulaire. Chez le xénope, les cellules du mésoderme paraxial donnent naissance aux CSM ou au myotome primitif en fonction de leur position sur l’axe médiolatéral [
4
,
7
,
24
]. L’expansion du territoire des CSM chez les amniotes pourrait aussi bien résulter de l’augmentation de signaux conduisant à leur formation, que de la perte de compétence des progéniteurs du mésoderme paraxial pour la différenciation musculaire. Cette expansion pourrait également être attribuée à une augmentation du nombre de CSM, par le biais de la prolifération cellulaire. Cependant, les CSM ne montrent pas de capacité manifeste d’auto-renouvellement caractéristique de cellules souches, bien qu’elles soient capables de maintenir temporairement un état multipotent. En ce qui concerne les progéniteurs du mésoderme paraxial, on peut les diviser en deux types, au moins. Les premiers progéniteurs à s’invaginer durant la gastrulation donnent naissance aux somites antérieurs, tandis que les progéniteurs axiaux contribuent par la suite à la formation des somites postérieurs [
39
,
40
]. Ces derniers, uniquement, appelés progéniteurs neuromésodermiques (PNM), sont bipotents, coexpriment
Brachyury
(marqueur du mésoderme) et
Sox2
(marqueur neural), et sont impliqués dans la formation des somites et du tube neural. La contribution des PNM à la formation des somites postérieurs varie en fonction de l’espèce. Elle est réduite à la formation des somites caudaux chez les anamniotes, tandis qu’elle s’étend aux somites troncaux chez les amniotes [
39
]. La participation plus importante des PNM à la somitogenèse des amniotes ne semble pas suffire à expliquer par elle-même l’expansion du territoire des CSM, dans la mesure où les PNM, tout comme les progéniteurs antérieurs, semblent également à l’origine du myotome primitif des anamniotes [
40
]. Cependant, cette caractéristique des amniotes repose sur l’acquisition par les PNM de la capacité d’auto-renouvellement propre aux cellules souches, et il ne peut être exclu que cette spécificité puisse être liée à une perte de compétence pour la différenciation musculaire.
|
Le lignage des CSM pourrait donc dériver de précurseurs ancestraux associés au développement musculaire, à la suite de transformations successives dont les grandes étapes sont décrites dans le modèle que nous proposons (
Figure 4
). L’identification, la caractérisation moléculaire et l’étude du lignage de ces précurseurs chez les protostomiens et d’autres deutérostomiens pourraient venir conforter ce modèle.
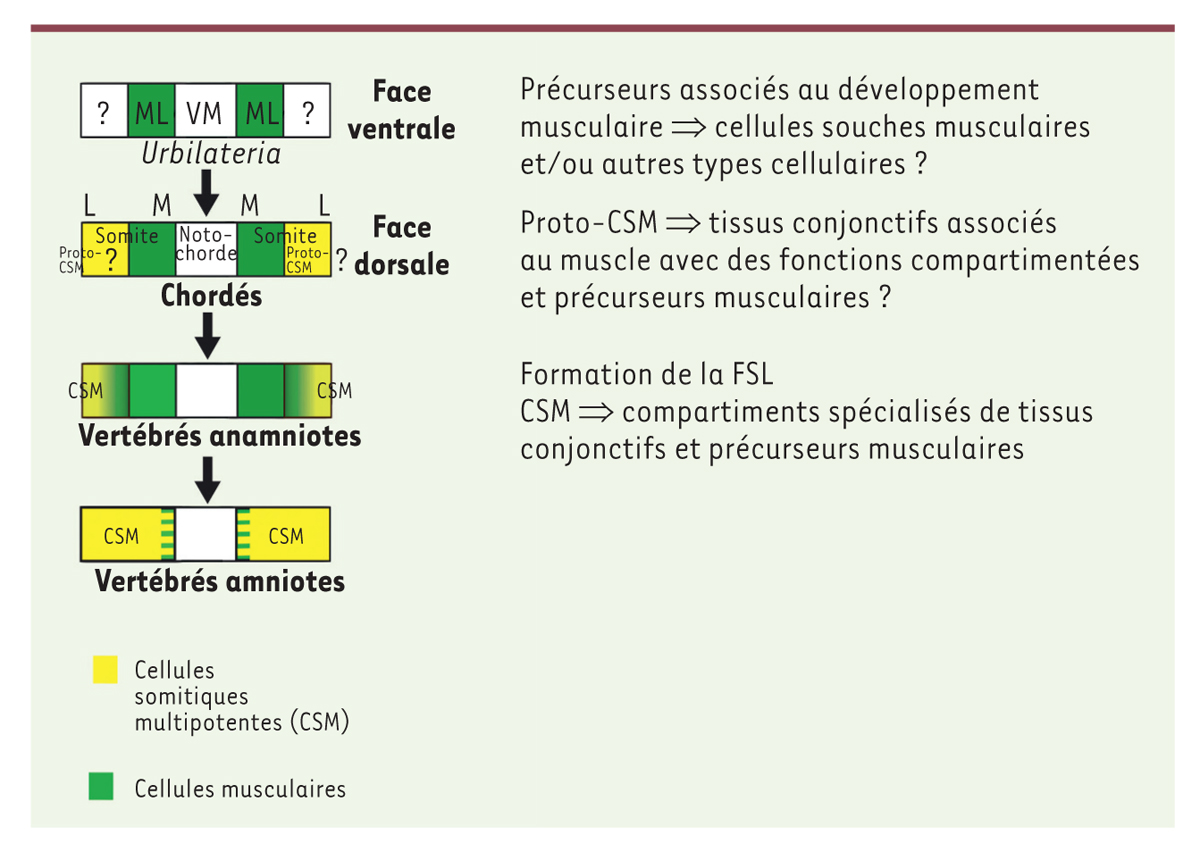
 | Figure 4.
Modèle évolutif décrivant les principales étapes conduisant à l’apparition des CSM chez les vertébrés.
Nous proposons qu’un précurseur associé au développement musculaire chez
urbilateria
est à l’origine du lignage des proto-CSM des chordés puis des CSM des vertébrés à la suite de transformations successives. L’axe dorsoventral des chordés et des vertébrés est inversé par rapport à
urbilateria
. M : domaine médian des somites ; L : domaine latéral des somites ; ML : muscles longitudinaux ; MV : mésoderme ventromédian à l’origine de la notochorde.
|
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Buckingham
M.
.
Skeletal muscle formation in vertebrates.
.
Curr Opin Genet Dev
2001;
;
11
:
:440.
–
448
.
2.
Comai
G
,
Tajbakhsh
S
.
Molecular and cellular regulation of skeletal myogenesis.
.
Curr Top Dev Biol
2014;
;
110
:
:1.
–
73
.
3.
Keenan
SR
,
Currie
PD
.
The Developmental Phases of Zebrafish Myogenesis.
.
J Dev Biol
2019;
;
7
:
:12.
.
4.
Della Gaspera
B
,
Armand
A-S
,
Lecolle
S
,
et al.
Mef2d acts upstream of muscle identity genes and couples lateral myogenesis to dermomyotome formation in Xenopus laevis.
.
PLoS One
2012;
;
7
:
:e52359.
.
5.
Mansfield
JH
,
Haller
E
,
Holland
ND
,
et al.
Development of somites and their derivatives in amphioxus, and implications for the evolution of vertebrate somites.
.
Evodevo
2015;
;
6
:
:21.
.
6.
Scaal
M
,
Wiegreffe
C
.
Somite compartments in anamniotes.
.
Anat Embryol (Berl)
2006;
;
211
(
(Suppl 1)
):
:9.
–
19
.
7.
Della Gaspera
B
,
Weill
L
,
Chanoine
C
.
Evolution of Somite Compartmentalization: A View From Xenopus.
.
Front Cell Dev Biol
2021;
;
9
:
:790847.
.
8.
Shearman
RM
,
Burke
AC
.
The lateral somitic frontier in ontogeny and phylogeny.
.
J Exp Zool B Mol Dev Evol
2009;
;
312
:
:603.
–
612
.
9.
Davis
RL
,
Weintraub
H
,
Lassar
AB
.
Expression of a single transfected cDNA converts fibroblasts to myoblasts.
.
Cell
1987;
;
51
:
:987.
–
1000
.
10.
Della Gaspera
B
,
Armand
A-S
,
Sequeira
I
,
et al.
Myogenic waves and myogenic programs during Xenopus embryonic myogenesis.
.
Dev Dyn
2012;
;
241
:
:995.
–
1007
.
11.
Hopwood
ND
,
Pluck
A
,
Gurdon
JB
,
et al.
Expression of XMyoD protein in early Xenopus laevis embryos.
.
Development
1992;
;
114
:
:31.
–
38
.
12.
Lagha
M
,
Rocancourt
D
,
Relaix
F
.
Origine du muscle squelettique: roles de Pax3/Pax7.
.
Med Sci (Paris)
2005;
;
21
:
:801.
–
803
.
13.
Devoto
SH
,
Stoiber
W
,
Hammond
CL
,
et al.
Generality of vertebrate developmental patterns: evidence for a dermomyotome in fish.
.
Evol Dev
2006;
;
8
:
:101.
–
110
.
14.
Rescan
PY
.
Un dermomyotome chez les poissons ?
.
Med Sci (Paris)
2010;
;
26
:
:504.
–
508
.
15.
Grimaldi
A
,
Tettamanti
G
,
Martin
BL
,
et al.
Hedgehog regulation of superficial slow muscle fibres in Xenopus and the evolution of tetrapod trunk myogenesis.
.
Development
2004;
;
131
:
:3249.
–
3262
.
16.
Kusakabe
R
,
Kuratani
S
.
Evolution and developmental patterning of the vertebrate skeletal muscles: perspectives from the lamprey.
.
Dev Dyn
2005;
;
234
:
:824.
–
834
.
17.
Hamilton
L.
.
The formation of somites in Xenopus.
.
J Embryol Exp Morphol
1969;
;
22
:
:253.
–
264
.
18.
Martin
BL
,
Harland
RM
.
Hypaxial muscle migration during primary myogenesis in Xenopus laevis.
.
Dev Biol
2001;
;
239
:
:270.
–
280
.
19.
Holland
LZ
.
Muscle Development in Amphioxus: Morphology, Biochemistry, and Molecular Biology.
.
Israel Journal of Zoology
1996;
;
42
:
:S235.
–
S246
.
20.
Yong
LW
,
Lu
T-M
,
Tung
C-H
,
et al.
Somite Compartments in Amphioxus and Its Implications on the Evolution of the Vertebrate Skeletal Tissues.
.
Front Cell Dev Biol
2021;
;
9
:
:607057.
.
21.
Scaal
M.
.
Early development of the vertebral column.
.
Semin Cell Dev Biol
2016;
;
49
:
:83.
–
91
.
22.
Ryke
P a. J
.
The Ontogenetic Development of the Somatic Musculature of the Trunk of the Aglossal Anuran Xenopus Laevis (daudin).
.
Acta Zoologica
1953;
;
34
:
:1.
–
70
.
23.
Sánchez
RS
,
Sánchez
SS
.
Characterization of pax1, pax9, and uncx sclerotomal genes during Xenopus laevis embryogenesis.
.
Dev Dyn
2013;
;
242
:
:572.
–
579
.
24.
Della Gaspera
B
,
Mateus
A
,
Andéol
Y
,
et al.
Lineage tracing of sclerotome cells in amphibian reveals that multipotent somitic cells originate from lateral somitic frontier.
.
Dev Biol
2019;
;
453
:
:11.
–
8
.
25.
Hatschek
B
.
Die Metamerie des Amphioxus und des Ammocoetes.
.
Anat Anz, Ergänz.-H, Verh Anat Ges, Jena
1892;
;
7
:
:136.
–
62
.
26.
Brent
AE
,
Schweitzer
R
,
Tabin
CJ
.
A somitic compartment of tendon progenitors.
.
Cell
2003;
;
113
:
:235.
–
248
.
27.
Schweitzer
R
,
Chyung
JH
,
Murtaugh
LC
,
et al.
Analysis of the tendon cell fate using Scleraxis, a specific marker for tendons and ligaments.
.
Development
2001;
;
128
:
:3855.
–
3866
.
28.
Della Gaspera
B
,
Armand
A-S
,
Sequeira
I
,
et al.
The Xenopus MEF2 gene family: evidence of a role for XMEF2C in larval tendon development.
.
Dev Biol
2009;
;
328
:
:392.
–
402
.
29.
Bricard
Y
,
Rallière
C
,
Lebret
V
,
et al.
Early fish myoseptal cells: insights from the trout and relationships with amniote axial tenocytes.
.
PLoS One
2014;
;
9
:
:e91876.
.
30.
Ma
RC
,
Jacobs
CT
,
Sharma
P
,
et al.
Stereotypic generation of axial tenocytes from bipartite sclerotome domains in zebrafish.
.
PLoS Genet
2018;
;
14
:
:e1007775.
.
31.
Charvet
B
,
Malbouyres
M
,
Pagnon-Minot
A
,
et al.
Development of the zebrafish myoseptum with emphasis on the myotendinous junction.
.
Cell Tissue Res
2011;
;
346
:
:439.
–
449
.
32.
Banfi
S
,
Monti
L
,
Acquati
F
,
et al.
Muscle development and differentiation in the urodele Ambystoma mexicanum.
.
Dev Growth Differ
2012;
;
54
:
:489.
–
502
.
33.
Thor
S
,
Thomas
JB
.
Motor neuron specification in worms, flies and mice: conserved and “lost” mechanisms.
.
Curr Opin Genet Dev
2002;
;
12
:
:558.
–
564
.
34.
Brunet
T
,
Fischer
AH
,
Steinmetz
PR
,
et al.
The evolutionary origin of bilaterian smooth and striated myocytes.
.
Elife
2016;
;
5
:
:e19607.
.
35.
Chaturvedi
D
,
Reichert
H
,
Gunage
RD
,
et al.
Identification and functional characterization of muscle satellite cells in Drosophila.
.
Elife
2017;
;
6
:
:e30107.
.
36.
Konstantinides
N
,
Averof
M
.
A common cellular basis for muscle regeneration in arthropods and vertebrates.
.
Science
2014;
;
343
:
:788.
–
791
.
37.
Somorjai
IML
,
Somorjai
RL
,
Garcia-Fernàndez
J
,
et al.
Vertebrate-like regeneration in the invertebrate chordate amphioxus.
.
Proc Natl Acad Sci U S A
2012;
;
109
:
:517.
–
522
.
38.
Innan
H
,
Kondrashov
F
.
The evolution of gene duplications: classifying and distinguishing between models.
.
Nat Rev Genet
2010;
;
11
:
:97.
–
108
.
39.
Steventon
B
,
Martinez Arias
A
.
Evo-engineering and the cellular and molecular origins of the vertebrate spinal cord.
.
Dev Biol
2017;
;
432
:
:3.
–
13
.
40.
Martin
BL
,
Steventon
B
.
A fishy tail: Insights into the cell and molecular biology of neuromesodermal cells from zebrafish embryos.
.
Dev Biol
2022;
;
487
:
:67.
–
73
.
41.
Kariyayama
H
,
Gogoleva
N
,
Harada
K
,
et al.
Development of the vertebra and fin skeleton in the lamprey and its implications for the homology of vertebrate vertebrae.
.
Dev Dyn
2023
. doi:
10.1002/dvdy.657
.
|