La fascinante mosaïque des FAPs
D’un point de vue fonctionnel, les FAPs sont décrits pour fournir un environnement de soutien aux cellules myogéniques ; ils représentent la principale source de composants de la matrice extra-cellulaire (MEC), tels que les collagènes (par exemple Col6a1, Col5a1), la laminine (Lama2, Lamb1) et la fibronectine (Fbn1) [
5
]. Cette structure joue un rôle essentiel dans la transmission de la force musculaire, fonction principale du muscle. Les FAPs permettent ainsi le maintien de l’organisation de la MEC et donc d’assurer la pérennité de la fonction musculaire.
FAPs quiescents : les gardiens de la structure
Une vingtaine d’études fondées sur des analyses de type
omics
sur cellule unique ont permis de documenter l’hétérogénéité de la population de FAPs. Chez la souris, Malecova
et al
. ont d’abord rapporté l’existence de deux populations, caractérisées par les marqueurs
tie2
et
vcam1
, la forte expression de
vcam1
étant préférentiellement associée à un profil pro-fibrotique [
6
]. Par la suite, d’autres études ont décrit la présence de deux populations de FAPs: i) une population de progéniteurs multipotents ayant pour marqueurs
dpp4
+
,
fbn1
+
et
cd55
+
et ii) une population
cxcl14
+
,
lum
+
, exprimant des gènes impliqués dans le remodelage de la MEC (
Tableau 1
) [
7
-
10
] . Le sécrétome « virtuel » proposé par Negroni
et al.
soutient le rôle fonctionnel de ces deux sous-populations de FAPs dans l’organisation structurelle de la MEC [
11
].
Tableau 1.
| Tissu |
Groupe de FAPs / ASCs |
Marqueurs |
Espèce |
Références |
| Muscle |
FAPs Quiescents (État basal) |
F1 : Tie2
low
, Vcam1
low
|
souris |
Malecova
et al.
2018
|
|
F2 : Tie2
high
, Vcam1
high
|
|
|
|
F1 :
Dpp4
+
,
Pi16,
Igfbp5, Fbn1, Cd55, Mfap5
, Pcolce2
|
souris |
Oprescu
et al.
2020
|
|
F2 :
Cxcl14
+
,
Smoc2
, Gsn,
Lum, Col15a1, Col4a1
|
|
|
|
F1 :
Sfrp4,
Igfbp5
, Sema3c,
Dpp4
, Tgfrb2
,
Wnt2
|
souris |
Scott
et al.
2019
|
|
F2 :
CxCl14
,
Col4a1,Col4a2
, Col6a1,6a2, 6a3,
Col15a1,Lum
, Sparcl1,Podn,
Smoc2
,Mgp,Bgn
|
|
|
|
F1 :
Fbn1
+
,
Cd55, Mfap5
,Fstl1
|
Souris/Humain |
Rubenstein
et al.
2020
|
|
F2 :
Lum
+
,
Col4a2, Col15a1, Cxcl14, Smoc2
, Dcn
|
|
|
|
F1 :
Fbn1
, Mfap5,
Cd55
|
Humain |
De Michelli
et al.
2020
|
|
F2 :
Smoc2
,Adh1b,Abc18,
Cxcl14
|
|
|
|
F3 :
Col1a1,Sfrp4, Serpine1,Ccl2
|
|
|
|
Adipocytes : Apod, Gpx3, Glul, Cxcl14
|
|
|
|
F1 :
Cd55
+
,
Tnxb, Mfap5, Pcolce2,
Fbn1
,Prg4
|
|
|
F2 :
Mme
+
,Ptgds,
Cxcl14,Smoc2
|
|
Humain |
Fitzgerald
et al.
2023
|
|
|
F3 :
Gpc3
+
, Sfrp2
|
|
|
|
| Muscle |
FAPs « Activés » / « Réactifs »(0,5 - 1,5 jpl) |
Cxcl5
, Cxcl3,
Ccl7
,
Ccl2
|
Souris |
Oprescu
et al.
2020
|
|
Cxcl1, Cxcl5
, Cxcl2, Cxcl14, Csf1 et Ccl7
|
Souris |
Scott
et al.
2019
|
|
Ccl7, Cxcl5
,
Cxcl1
|
Souris |
De Michelli
et al.
2020
|
|
| Muscle |
FAPs Remodelage(3 - 10 jpl) |
Wisp
+
,
Col8a1, Col12a1, Col16a1, Col11a1, Tnc, Fbn2 et
Adam12
|
Dlk1
+
,
B830012L14Rik, Meg3, Airn, Peg3, Zim1, H19,
et
Igf2
|
Souris |
Oprescu
et al.
2020
|
|
Col8a2
,
Col14a1
,
Col15a1
,
Fbln1
,
Fbln5
,
Hspg2
,
Lama2
,
Lama4
,
Lamc1
,
Lamb2
,
Nid2,
Adam12, Postn, Lox
, Acta2
,
Col1a1
,
Col1a2
|
Souris |
Scott
et al.
2019
|
|
Col1a1, Col1a2, Postn
, Bgn,Sparc
|
Souris |
De Michelli
et al.
2020
|
|
| Muscle |
FAPs Résolution(7 - 21 jpl) |
Dpp4
+
, Pi16, Wnt2
|
Cxcl14
+
,
Enpp2
,
Crispld2
,
Hsd11b1
|
Souris |
Oprescu
et al.
2020
|
| « return to baseline level » |
Souris |
Scott
et al.
2019
|
| « return to baseline level » |
Souris |
De Michelli
et al.
2020
|
|
| Tissu adipeux |
ASCs Quiescents (État basal) |
A1 :
Dpp4
+
,
Wnt2,Bmp7,
Pi16
|
Souris / Humain |
Merrick
et al.
2019
|
|
A2 :
Icam1
+
,
Dlk1,
Pparg,Fabp4,Cd36
|
|
|
|
A3 :
Cd142
+
,
Clec11a
|
|
|
|
A1 :
Cd55, Il13ra1
|
Souris |
Schwalie
et al.
2018
|
|
A2 :
Pparg,Fabp4
,Prdm16,Adam12
|
|
|
|
A3 :
Cd142
,Abcg1
|
|
|
|
A1 :
Pparg,Fabp4
|
Souris |
Emont
et al.
2022
|
|
A2 :
Cd36,Plin1
|
|
|
|
Précurseurs fibro-inflammatoires :
Ly6C1,Sfrp4,
Pi16
,Limch1
|
|
|
|
A1 :
Foxp2,Hes1,Lox,Igf1,Lpb
|
Souris |
Sárvári
et al.
2021
|
|
A2 :
Cd36
,Lpl,Gata2,
Pparg
,Fgf10
|
|
|
|
A3 :
Ebf2,Rock2,Zfp521,Bmp6,Ebf1
|
|
|
|
A4 :
Fbn1,Klf4,Klf2,Fn1,Loxl1
|
|
|
|
A1 :
Dpp4, Pi16
|
Souris |
Burl
et al.
2018
|
|
A2 :
Icam1
, Col4a2,Cav1
|
|
|
|
Diff. ASC :
Lipe,Adipoq,
Plin1
,Car3
|
|
|
Liste des gènes exprimés par chaque sous-populations de FAPs et ASCs murines et humaines.
En gras, les marqueurs majeurs choisis par les auteurs pour définir la sous-population. Les gènes soulignés sont communs aux différentes études.
|
Chez l’homme, la première description de l’hétérogénéité des FAPs a été réalisée par Rubenstein
et al
. dans une étude incluant des jeunes individus sains [
9
]. Dans ce travail, ils rapportent la présence de deux populations de FAPs similaires à celles identifiées chez la souris,
i.e.
une population FAPs
lum
+
et une autre
fbn1
+
(
Tableau 1
). Par ailleurs, un atlas représentatif de toutes les populations cellulaires retrouvées au sein du muscle squelettique chez l’homme a été publié [
12
] et a confirmé la présence de ces sous-populations de FAPs (
Tableau 1
). Récemment, Fitzgerald et ses collaborateurs ont identifié une population supplémentaire de FAPs exprimant le marqueur
mme
+
et présentant un profil pro-adipogénique (
Tableau 1
) [
26
].
FAPs activés : les émissaires de la régénération musculaire
Afin d’étudier la diversité et l’évolution des populations de FAPs en condition de régénération musculaire, le modèle murin de lésion musculaire induite par des agents myotoxiques tels que la cardiotoxine ou la notexine, est le plus utilisé en laboratoire. Quantitativement, la population de FAPs, mesurée par cytométrie en flux, augmente dès le premier jour post lésionnel (jpl) pour atteindre un maximum autour de 3-4 jpl. Cette augmentation de FAPs est soutenue par une prolifération qui, elle, débute à 2 jpl [
1
,
13
], laissant la phase précoce d’amplification des FAPs sans explication (
Figure 1
). Qualitativement, dans la phase précoce (0.5-2 jpl), différents auteurs décrivent un changement d’expression génique des FAPs caractérisé par l’expression de marqueurs communs, dont de nombreuses cyto/chimiokines (
Tableau 1
), et qui se traduit par une « activation » des FAPs. On notera que cette population apparaît dès 12 h [
7
] en post-lésionnel et perdure à 48 h [
8
,
10
].
 | Figure 1.
Évolution de l’hétérogénéité des FAPs au cours de la régénération musculaire chez la souris.
La courbe bleue correspond à l’évolution de la quantité de FAPs en situation post-lésionnelle (tirée de l’étude de Lemos et al. 2015) [
13
]. Les encadrés correspondent à chaque population de FAPs définie par leur(s) marqueur(s). Les flèches en gras correspondent au changement d’état de chacune des populations conformément à l’hypothèse des différents auteurs.
|
D’un point de vue fonctionnel, l’importance de la production de cytokines par les FAPs nécessaire à une régénération musculaire efficace a été largement démontrée [
14
-
17
]. C’est le cas, par exemple, de l’interleukine (IL)-33, majoritairement produite par les FAPs au cours des 12 premières heures après la lésion, et qui permet de stimuler la prolifération des cellules immunitaires Treg [
16
]. Les FAPs sont aussi connues pour sécréter de l’IL-10 en réponse à une lésion [
18
], jouant ainsi un rôle important dans le changement phénotypique des macrophages vers un profil anti-inflammatoire et favorisant la régénération musculaire [
19
]. De plus, les travaux de Negroni
et al.
visant à analyser le « sécrétome virtuel » des FAPs, identifient la follistatine, l’IL-6, le Cxcl1 et le Cxcl5 [
11
] à ce stade de la régénération musculaire. L’IL-6 et la follistatine ont été rapportées comme étant produites au cours de la régénération [
1
,
17
] et favorisent respectivement la prolifération [
20
] et la fusion [
17
] des cellules souches musculaires.
En résumé, à ce stade précoce du processus de régénération, les FAPs « quiescents » subissent un changement d’état vers un statut « activé ». Ce profil d’expression génique distinct, orienté vers la sécrétion de cytokines et de chimiokines, permettrait d’établir une communication spécifique avec les cellules environnantes, notamment les cellules satellites et les cellules immunitaires, lesquelles sont essentielles à l’initiation du processus de régénération musculaire. Pour illustrer l’adaptation très rapide des FAPs au changement du microenvironnement induit par la lésion et leur mission support dès l’initiation de la régénération musculaire, nous proposons un statut de FAPs « réactifs » plutôt qu’« activés » comme mentionné dans plusieurs articles de la littérature [
7
,
10
].
FAPs de remodelage : les ouvriers de la régénération
La régénération musculaire est considérée comme aboutie lorsque la morphologie et la fonction du tissu sont rétablies, soit généralement à partir de 21-28 jpl dans les modèles murins cités dans la revue de Hardy
et al
. [
21
]. Dans le processus de régénération chez la souris, le nombre de FAPs atteint un pic autour de 3 jpl pour retrouver le nombre initial autour de 9 jpl [
13
]. Dans ce contexte, les analyses de type
omics
en cellule unique ont révélé un changement de l’expression des gènes des FAPs « réactifs ». Entre 3 et 10 jpl, une diminution de l’expression des cytokines et chimiokines est observée au profit de l’expression de gènes liés à la modulation de la MEC tels que ceux codant la grande famille des collagènes, les laminines et les fibrillines [
7
,
8
,
10
] (
Tableau 1
). L’étude d’Oprescu
et al.
définit cette population de FAPs par l’expression dominante du marqueur wisp1 [
7
]. À 10 jpl
,
les FAPs adoptent ensuite un profil qui se caractérise par l’expression majeure de dlk1 (
Figure 1
), un marqueur connu des progéniteurs adipogéniques [
22
]. Ces éléments suggèrent un engagement de cette population vers un profil adipeux dans des temps plus tardifs de la régénération. L’étude menée par Negroni
et al.
va à l’appui de ces observations, mettant en évidence la prédiction de la sécrétion de protéines essentielles à la composition et l’organisation de la MEC [
11
], un processus nécessaire à la régénération musculaire [
23
]. Par leurs sécrétions, les FAPs en quantité adéquate agissent transitoirement comme des « ouvriers » capables de restaurer le réseau matriciel ayant été désorganisé suite à une lésion musculaire [
24
,
25
].
FAPs de résolution : pour un retour à l’équilibre
Lors des stades ultimes de la régénération musculaire, entre 21 et 28 jpl, Oprescu
et al
. ont identifié une population de FAPs caractérisée par l’expression de
osr1
. Au sein de cette population, l’étude de trajectoire permettant de suggérer le devenir de cette population à partir de l’expression génique, a permis de révéler une divergence de la population osr1
+
vers deux sous-populations distinctes marquées par l’expression respective de
dpp4
et
cxcl14
, décrits initialement à l’état basal (
Tableau 1
). Entre 7 jpl [
10
] et 14 jpl [
8
], De Micheli
et al
. et Scott
et al
. décrivent une réapparition des populations de FAPs « quiescents ».
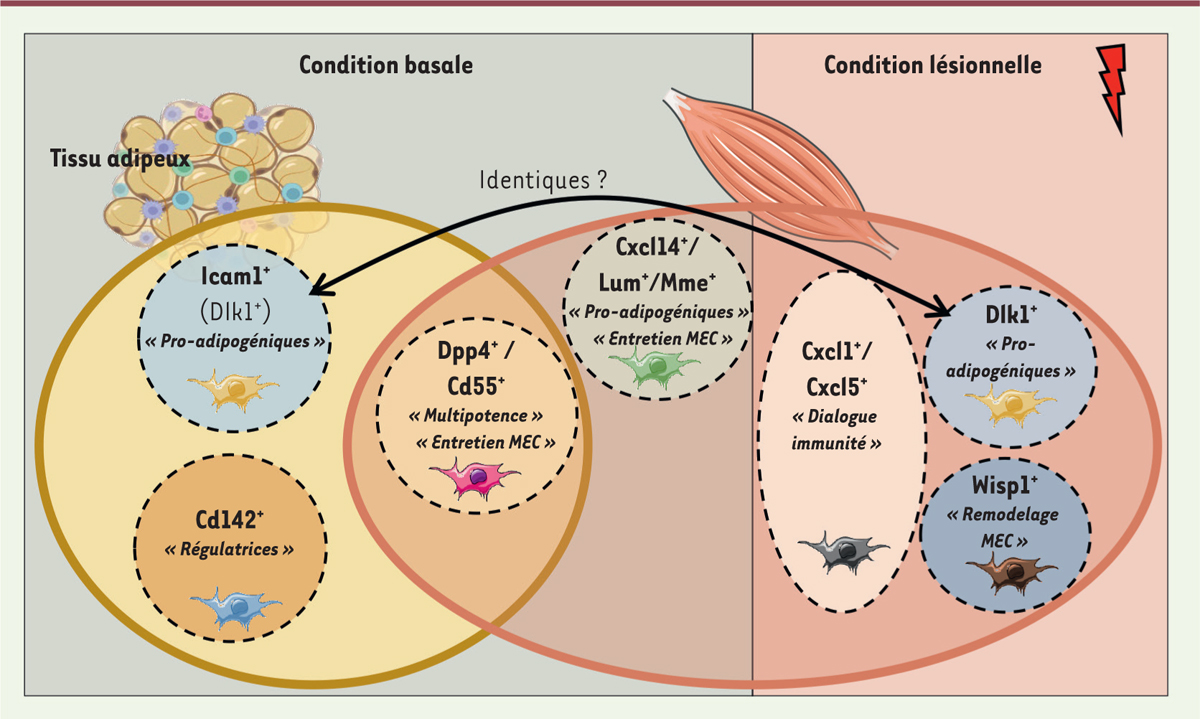
Les FAPs en condition pathologique : émergence ou dérégulation ?
La perte de masse musculaire et son remplacement par des tissus fibreux et adipeux sont des phénomènes fréquemment observés dans de nombreuses maladies musculaires dont la myopathie de Duchenne (DMD). Pour tenter d’expliquer l’origine de ces dépôts anormaux, l’attention s’est portée sur les FAPs du fait de leur capacité à se différencier en adipocytes ou en cellules fibroblastiques [
1
,
2
]. Dans ce contexte, l’hétérogénéité des FAPs a également été décrite [
26
].
Contrairement à une lésion aiguë qui induit une expansion transitoire de la population de FAPs (
Figure 1
), une augmentation persistante du nombre et de l’hétérogénéité des FAPs est observée dans les muscles dystrophiques murins. Deux sous-populations de FAPs caractérisées par leurs niveaux d’expression des marqueurs de surface Sca-1 et Cd34 [
27
] sont présentes dans les muscles dystrophiques de ces animaux. Un niveau élevé de Sca-1 est associé à un état prolifératif tandis qu’un niveau faible semble plutôt pro-adipogénique [
27
]. Plus récemment, une étude a été réalisée chez l’homme à partir de biopsies de patients ayant subi une arthroplastie de la hanche (THA), une condition également associée à une dégénérescence adipeuse des muscles à proximité. Les auteurs ont identifié et caractérisé fonctionnellement une population particulière de FAPs pro-adipogéniques exprimant le marqueur
mme
+
ainsi que d’autres gènes comme
ptgds
,
cxcl14
et
smoc2
impliqués dans l’immunorégulation et l’organisation de la MEC [
26
]. En revanche, cette étude n’apporte pas d’éléments de comparaison avec des sujets sains, ce qui aurait permis de mieux caractériser cette population et surtout de comprendre son évolution au début du processus pathologique. À ce jour, les données de la littérature ne permettent pas de déterminer si la fibrose et/ou l’accumulation adipeuse observée dans des conditions physiopathologiques résulte de l’émergence d’une nouvelle population de FAPs dans le muscle ou de modifications quantitatives et/ou qualitatives d’une population déjà présente à l’état basal (
Figure 1
).
L’étude des facteurs micro-environnementaux régissant l’engagement fibro-adipeux des FAPs demeure nécessaire à la compréhension globale des myopathies. Différentes études ont illustré le rôle du TGF-β, pro-fibrotique et anti-adipogénique [
24
] en condition de régénération défectueuse. D’autre part, la sécrétion de TGF-β par les macrophages inhibe l’apoptose des FAPs et favorise leur sécrétion de MEC mettant ainsi en évidence leur rôle pro-fibrotique dans le muscle dystrophique [
13
].
Pour résumer, les techniques récentes de séquençage de l’ARN en cellule unique ont permis d’affiner nos connaissances sur les FAPs et de décrire la diversité de cette population cellulaire. Les différents travaux en situation physiologique et suite à une lésion musculaire ont révélé des sous-populations tour à tour « quiescentes », « réactives » et « remodelantes », avec réapparition du profil initial au terme de la régénération. Sur le plan quantitatif, les études montrent une augmentation du nombre de FAPs dès les phases précoces de la régénération (1 jpl), mais paradoxalement sans soutien prolifératif à ce stade. Cette observation soulève l’hypothèse d’une origine extra-musculaire de certaines sous-populations de FAPs apparaissant en condition post-lésionnelle. |
1.
Joe
AWB
,
Yi
L
,
Natarajan
A
,
et al
.
Muscle injury activates resident fibro/adipogenic progenitors that facilitate myogenesis.
.
Nat Cell Biol
.
2010;
;
12
:
:153.
–
163
.
2.
Uezumi
A
,
Fukada
S
,
Yamamoto
N
,
et al
.
Mesenchymal progenitors distinct from satellite cells contribute to ectopic fat cell formation in skeletal muscle.
.
Nat Cell Biol
.
2010;
;
12
:
:143.
–
152
.
3.
Friedenstein
AJ
,
Deriglasova
UF
,
Kulagina
NN
,
et al
.
Precursors for fibroblasts in different populations of hematopoietic cells as detected by the in vitro colony assay method.
.
Exp Hematol
.
1974;
;
2
:
:83.
–
92
.
4.
Theret
M
,
Rossi
FMV
,
Contreras
O
.
Evolving Roles of Muscle-Resident Fibro-Adipogenic Progenitors in Health, Regeneration, Neuromuscular Disorders, and Aging.
.
Front Physiol
.
2021;
;
12
:
:673404.
.
5.
Chapman
MA
,
Mukund
K
,
Subramaniam
S
,
et al
.
Three distinct cell populations express extracellular matrix proteins and increase in number during skeletal muscle fibrosis.
.
Am J Physiol Cell Physiol
.
2017;
;
312
:
:C131.
–
C143
.
6.
Malecova
B
,
Gatto
S
,
Etxaniz
U
,
et al
.
Dynamics of cellular states of fibro-adipogenic progenitors during myogenesis and muscular dystrophy.
.
Nat Commun
.
2018;
;
9
:
:1.
–
12
.
7.
Oprescu
SN
,
Yue
F
,
Qiu
J
,
et al.
Temporal dynamics and heterogeneity of cell populations during Skeletal Muscle Regeneration.
.
iScience
.
2020;
;
23
:
:100993.
.
8.
Scott
RW
,
Arostegui
M
,
Schweitzer
R
,
et al
.
Hic1 Defines Quiescent Mesenchymal Progenitor Subpopulations with Distinct Functions and Fates in Skeletal Muscle Regeneration.
.
Cell Stem Cell
.
2019;
;
25
:
:797.
–
813.e9
.
9.
Rubenstein
AB
,
Smith
GR
,
Raue
U
,
et al.
Single-cell transcriptional profiles in human skeletal muscle.
.
Sci Rep
.
2020;
;
10
:
:229.
.
10.
De Micheli
AJ
,
Laurilliard
EJ
,
Heinke
CL
,
et al.
Single-cell analysis of the muscle stem cell hierarchy identifies heterotypic communication signals Involved in skeletal muscle regeneration.
.
Cell Rep
.
2020;
;
30
:
:3583.
–
95.e5
.
11.
Negroni
E
,
Kondili
M
,
Muraine
L
,
et al.
Muscle fibro-adipogenic progenitors from a single-cell perspective: Focus on their “virtual” secretome.
.
Front Cell Dev Biol
.
2022;
;
10
:
:952041.
.
12.
De Micheli
AJ
,
Spector
JA
,
Elemento
O
,
et al.
A reference single-cell transcriptomic atlas of human skeletal muscle tissue reveals bifurcated muscle stem cell populations.
.
Skelet Muscle
.
2020;
;
10
:
:19.
.
13.
Lemos
DR
,
Babaeijandaghi
F
,
Low
M
,
et al
.
Nilotinib reduces muscle fibrosis in chronic muscle injury by promoting TNF-mediated apoptosis of fibro/adipogenic progenitors.
.
Nat Med
.
2015;
;
21
:
:786.
–
794
.
14.
Biferali
B
,
Proietti
D
,
Mozzetta
C
,
et al
.
Fibro-adipogenic progenitors cross-talk in skeletal muscle: The social network.
.
Front Physiol
.
2019;
;
10
:
:1074.
.
15.
Chargé
SBP
,
Rudnicki
MA
.
Cellular and molecular regulation of muscle regeneration.
.
Physiol Rev
.
2004;
;
84
:
:209.
–
238
.
16.
Kuswanto
W
,
Burzyn
D
,
Panduro
M
,
et al
.
Poor repair of skeletal muscle in aging mice reflects a defect in local, interleukin-33-dependent accumulation of regulatory T cells.
.
Immunity
.
2016;
;
44
:
:355.
–
367
.
17.
Mozzetta
C
,
Consalvi
S
,
Saccone
V
,
et al
.
Fibroadipogenic progenitors mediate the ability of HDAC inhibitors to promote regeneration in dystrophic muscles of young, but not old Mdx mice.
.
EMBO Mol Med
.
2013;
;
5
:
:626.
–
639
.
18.
Lemos
DR
,
Paylor
B
,
Chang
C
,
et al
.
Functionally convergent white adipogenic progenitors of different lineages participate in a diffused system supporting tissue regeneration.
.
Stem Cells
.
2012;
;
30
:
:1152.
–
1162
.
19.
Dort
J
,
Fabre
P
,
Molina
T
,
et al
.
Macrophages are key regulators of stem cells during skeletal muscle regeneration and diseases.
.
Stem Cells Int
.
2019;
;
2019
:
:4761427.
.
20.
Serrano
AL
,
Baeza-Raja
B
,
Perdiguero
E
,
et al
.
Interleukin-6 is an essential regulator of satellite cell-mediated skeletal muscle hypertrophy.
.
Cell Metab
.
2008;
;
7
:
:33.
–
44
.
21.
Hardy
D
,
Besnard
A
,
Latil
M
,
et al
.
Comparative study of injury models for studying muscle regeneration in mice.
.
Plos One
.
2016;
;
11
:
:e0147198.
.
22.
Sul
HS
.
Minireview: Pref-1: Role in adipogenesis and mesenchymal cell fate.
.
Mol Endocrinol
.
2009;
;
23
:
:1717.
–
1725
.
23.
Gillies
AR
,
Lieber
RL
.
Structure and function of the skeletal muscle extracellular matrix.
.
Muscle Nerve
.
2011;
;
44
:
:318.
–
331
.
24.
Contreras
O
,
Rossi
FMV
,
Theret
M
.
Origins, potency, and heterogeneity of skeletal muscle fibro-adipogenic progenitors - time for new definitions.
.
Skelet Muscle
.
2021;
;
11
:
:16.
.
25.
Laumonier
T
,
Menetrey
J
.
Muscle injuries and strategies for improving their repair.
.
J Exp Orthop
.
2016;
;
3
:
:15.
.
26.
Fitzgerald
G
,
Turiel
G
,
Gorski
T
,
et al.
MME+ fibro-adipogenic progenitors are the dominant adipogenic population during fatty infiltration in human skeletal muscle.
.
Commun Biol
.
2023;
;
6
:
:111.
.
27.
Giuliani
G
,
Vumbaca
S
,
Fuoco
C
,
et al.
SCA-1 micro-heterogeneity in the fate decision of dystrophic fibro/adipogenic progenitors.
.
Cell Death Dis
.
2021;
;
12
:
:1.
–
24
.
28.
Zuk
PA
,
Zhu
M
,
Mizuno
H
,
et al
.
Multilineage cells from human adipose tissue: implications for cell-based therapies.
.
Tissue Eng
.
2001;
;
7
:
:211.
–
228
.
29.
Merrick
D
,
Sakers
A
,
Irgebay
Z
,
et al.
Identification of a mesenchymal progenitor cell hierarchy in adipose tissue.
.
Science
.
2019;
;
364
:
:eaav2501.
.
30.
Schwalie
PC
,
Dong
H
,
Zachara
M
,
et al
.
A stromal cell population that inhibits adipogenesis in mammalian fat depots.
.
Nature
.
2018;
;
559
:
:103.
–
108
.
31.
Emont
MP
,
Jacobs
C
,
Essene
AL
,
et al.
A single-cell atlas of human and mouse white adipose tissue.
.
Nature
.
2022;
;
603
:
:926.
–
33
.
32.
Sárvári
AK
,
Van Hauwaert
EL
,
Markussen
LK
,
et al.
Plasticity of epididymal adipose tissue in response to diet-induced obesity at single-nucleus resolution.
.
Cell Metab
.
2021;
;
33
:
:437.
–
53.e5
.
33.
Burl
RB
,
Ramseyer
VD
,
Rondini
EA
,
et al
.
Deconstructing adipogenesis induced by β3-adrenergic receptor activation with single-cell expression profiling.
.
Cell Metab
.
2018;
;
28
:
:300.
–
9.e4
.
34.
Liu
X
,
Yuan
M
,
Xiang
Q
,
et al.
Single-cell RNA sequencing of subcutaneous adipose tissues identifies therapeutic targets for cancer-associated lymphedema.
.
Cell Discov
.
2022;
;
8
:
:1.
–
20
.
35.
Biltz
NK
,
Collins
KH
,
Shen
KC
,
et al.
Infiltration of intramuscular adipose tissue impairs skeletal muscle contraction.
.
J Physiol
.
2020;
;
598
:
:2669.
–
83
.
36.
Sastourné-Arrey
Q
,
Mathieu
M
,
Contreras
X
,
et al.
Adipose tissue is a source of regenerative cells that augment the repair of skeletal muscle after injury.
.
Nat Commun
.
2023;
;
14
:
:80.
.
37.
Gil-Ortega
M
,
Garidou
L
,
Barreau
C
,
et al
.
Native adipose stromal cells egress from adipose tissue in vivo: Evidence during lymph node activation.
.
Stem Cells
.
2013;
;
31
:
:1309.
–
1320
.
38.
Girousse
A
,
Gil-Ortega
M
,
Bourlier
V
,
et al
.
The release of adipose stromal cells from subcutaneous adipose tissue regulates ectopic intramuscular adipocyte deposition.
.
Cell Rep
.
2019;
;
27
:
:323.
–
33.e5
.
|