| |
| Med Sci (Paris). 39: 37–46. doi: 10.1051/medsci/2023133.Le syndrome de Schwartz-Jampel J. Andoni Urtizberea,1* Gianmarco Severa,1 Juliette Ropars,1 and Edoardo Malfatti1 1Institut de Myologie
,
Paris
,
France 2Centre de référence neuromusculaire du CHU Henri-Mondor
,
Créteil
,
France 3Centre de référence neuromusculaire du CHU Morvan
,
Brest
,
France |
© V. Allamand/Servier Medical Art Le syndrome de Schwartz-Jampel (SJS, OMIM #255800, ORPHA:800) est une affection génétique autosomique récessive ultra-rare (prévalence < 1/1 000 000) qui se caractérise par des manifestations d’allure myotonique et des anomalies ostéo-articulaires. |
Si l’histoire a retenu les noms d’Oscar Schwartz et de de Richard S. Jampel, principalement à cause de leur publication de 1962 [
1
], d’autres auteurs ont également été associés aux premières descriptions du SJS [2-6]. Schwartz et Jampel étaient deux praticiens américains exerçant dans le même hôpital de Brooklyn, l’un comme pédiatre, l’autre comme ophtalmologue. En 1962, ils rapportent conjointement l’observation d’un frère et d’une sœur nés d’un couple non apparenté et en bonne santé. Ces deux enfants présentaient un blépharophimosis congénital associé à une myopathie, des déformations articulaires et une taille en dessous du troisième percentile [
1
]. La composante myotonique du syndrome n’a pas été identifiée à l’époque car il n’avait pas été possible de réaliser un électromyogramme (EMG) chez aucun des enfants. Faute de cet élément capital, les auteurs avaient proposé de classer cette observation originale plutôt dans le groupe des arthrogryposes multiples complexes. Trois ans plus tard, en 1965, Donald C. Aberfeld, exerçant comme neurologue dans le même hôpital new-yorkais, rapporte, en compagnie de confrères orthopédistes, les données cliniques et paracliniques de la même fratrie, cette fois-ci dans la revue
Brain,
mais en omettant volontairement de citer les travaux de Schwartz et Jampel ! [
3
] La comparaison des photographies des deux articles ne laisse aucun doute sur le fait qu’il s’agissait bien des deux mêmes malades. Aberfeld va même jusqu’à revendiquer le fait qu’il s’agit d’un nouveau syndrome comme l’indique le titre de son article -
Myotonia, dwarfism, diffuse bone disease and unusual ocular and facial abnormalities – a new syndrome.
Les enfants ont grandi, bien que gardant une petite taille. Aberfeld note le caractère strident de leur voix ainsi qu’une incontestable myotonie lors du mouvement volontaire ainsi qu’à la percussion des éminences thénar. Cette fois-ci, un EMG démontre clairement la présence d’anomalies s’apparentant à des phénomènes myotoniques (d’après l’auteur, le son enregistré est comparable à celui d’un bombardier en piqué) avec en plus, un tracé de type interférentiel. La biopsie musculaire s’avère néanmoins non concluante, ne décelant qu’une discrète atrophie des fibres musculaires au caractère non spécifique. Les anomalies articulaires et osseuses sont mieux décrites, et l’hypothèse d’une composante chondrodysplasique conduisant à un nanisme est formulée. En revanche, la piste de l’origine congénitale de l’arthrogrypose est abandonnée, toujours selon Aberfeld, car ces deux enfants étaient, d’après les parents et les professionnels de santé, normaux à la naissance. La sœur cadette décédera brutalement dans un accident de voiture quelque temps après et son autopsie n’apportera pas plus d’information médicale.
Pour des raisons peu claires, seuls les noms de Schwartz et Jampel se sont imposés au fil des ans, même si le SJS continue d’être référencé par certains spécialistes comme le syndrome de Schwartz-Jampel-Aberfeld. D’autres auteurs ont préféré s’en tenir à une terminologie plus descriptive parlant alors de syndrome myotonique chondrodystrophique comme proposée en 1970 par Aberfeld dans le but de couper court à toute polémique. Dans son article publié en 1970 [
6
], ce dernier précise que, description clinique et photographies à l’appui, la paternité du syndrome SJS revient en fait à Werner Catel, un éminent spécialiste allemand des anomalies osseuses constitutionnelles en général et des chondrodysplasies en particulier. Ce dernier avait publié dès 1951 un patient au phénotype clinique strictement identique mais ceci dans une revue en langue allemande à faible diffusion et à l’écho par conséquent limité [
2
]. Catel avait qualifié les lésions ostéo-articulaires de dysostose endochondrale méta-épiphysaire. Toujours dans le même article de 1970, Aberfeld cite cette-fois Schwartz et Jampel mais pour critiquer leur description de 1962 et en particulier pour contester le caractère congénital du blépharophimosis. Le neurologue américain en a longtemps conçu une certaine amertume comme en témoigne aussi une lettre au vitriol envoyée en 1979 à l’éditeur du journal
Annals of Neurology
dans laquelle il fustige les travaux d’auteurs canadiens au motif que ces derniers faisaient de nouveau référence exclusivement à Schwartz et à Jampel… [
7
]
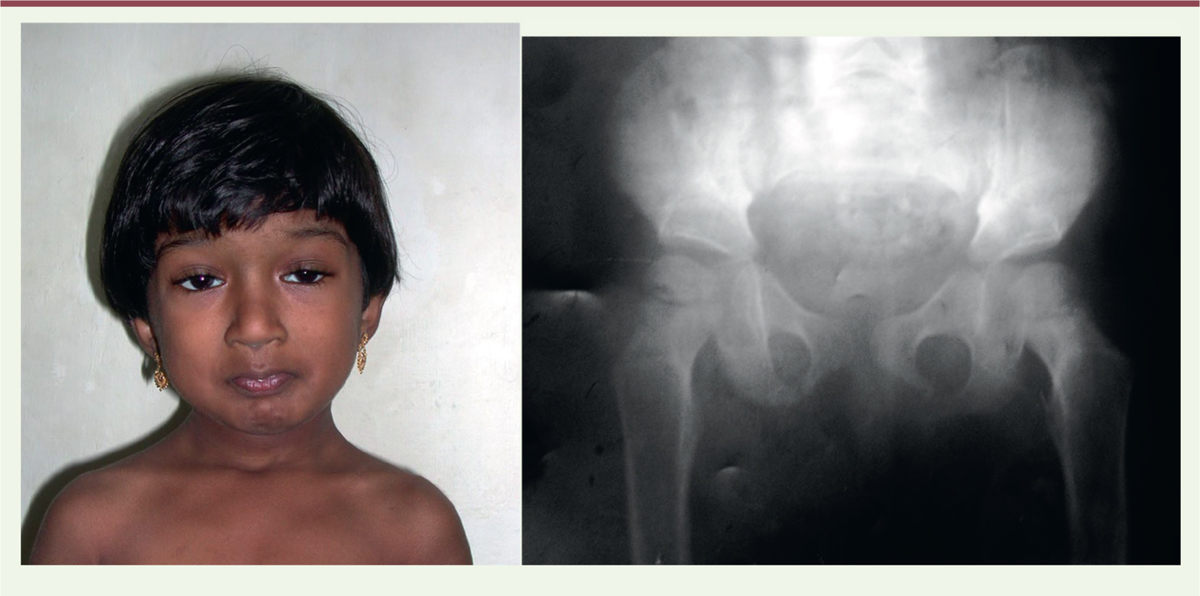
 | Figure 1.
Une fratrie indienne atteinte d’une forme sévère de syndrome de Schwartz-Jampel.
Notez l’asymétrie du blépharophimosis de la soeur ainée, la musculature hyperdéveloppée du jeune frère, et la petite taille des deux (DR J. Andoni Urtizberea).
|
Tout au long de ces années faites de polémiques, un nombre significatif de publications concernant le SJS ont continué à voir le jour [8-17] en Europe, aux USA et en Afrique, tout particulièrement en Afrique du Sud et en Afrique du Nord. Peter Beighton et Denis Viljoen, deux généticiens spécialistes des malformations osseuses basés à Cape Town, ont été les premiers à décrire le SJS dans des populations noires. Le groupe tunisien de Mongi Ben Hamida, au sein de l’Institut national de neurologie de la Rabta, a également largement contribué à une meilleure connaissance du SJS au Maghreb. Un peu plus à l’Est, Haluk Topaloglu, enfin, jeune neuropédiatre formé à Londres, avait également diagnostiqué de nombreuses familles consanguines en Turquie.
En 1991, un neurologue américain d’Indianapolis, Robert Pascuzzi, compile les données de la littérature de tous les cas de SJS publiés et tente, assez adroitement, de rendre à César ce qui est à César, citant les travaux des auteurs cités précédemment (Catel, Schwartz, Jampel et Aberfeld) tout en promouvant l’appellation, plus neutre, de myotonie chondrodystrophique [
18
]. Cette méta-analyse permet également de mieux définir le syndrome avec comme guide le double prisme neuromusculaire et malformatif.
La description des formes ultra-précoces de SJS ont fait, dès 1978, l’objet de vifs débats parmi les experts, certains voulant en faire une entité à part (d’où l’apparition d’une classification binaire entre SJS1 – classique et SJS2 – à début néonatal) ou, au contraire, des variants alléliques de la même maladie. Les années 90 sont également la période durant laquelle d’importants travaux de cartographie génétique sont entrepris afin d’identifier le gène du SJS. Il fallait, pour cela, collecter l’ADN des patients atteints de SJS, en particulier celui des familles consanguines multiplex afin de cheminer plus vite et plus sûrement sur le génome grâce à la méthode dite du clonage positionnel.
Ces travaux menés par un consortium international avec à sa tête les équipes de l’unité INSERM, ainsi que celles du Généthon et du futur Institut de Myologie de Paris, ont été une première fois couronnés de succès en 1995 avec la découverte du premier locus du SJS dans la région 35-36 du bras court du chromosome 1 par Sophie Nicole au sein du laboratoire INSERM dirigé par Bertrand Fontaine [
19
]. En 1995, Giedon propose d’intégrer toutes ces nouvelles données dans une classification du SJS en trois sous-groupes : le SJS1A, le SJS1B et le SJS2 [
20
]
(
Tableau 1
)
.
Tableau 1.
| |
Type 1A (SJS1A) |
Type 1B (SJS1B) |
Type 2 (SJS2) |
| Début habituel des troubles |
Myotonie
: dans l’enfance
Dysplasie osseuse
: dans l’enfance
|
Myotonie
: chez le nourrisson ou dans l’enfance
Dysplasie osseuse
: à la naissance
|
Myotonie
: à la naissance
Dysplasie osseuse
: à la naissance
|
|
| Principaux signes radiologiques |
Dysplasie épi-métaphysaire modérée avec élargissement épiphysaire au niveau des genoux |
Chez le nourrisson
: dysplasie avec raccourcissement des membres et fémurs en forme d’haltères (dysplasie de type Kniest)
Dans l’enfance
: dysplasie épi-métaphysaire
|
Chez le nourrisson
: dysplasie avec raccourcissement des membres et jambes arquées
Dans l’enfance
: aspect de maladie de Pyle avec sous-tubulation des os longs
|
|
| Rachis |
Platyspondylie modérée |
Platyspondylie modérée, fentes coronales |
Sans particularités |
|
| Bassin |
Échancrure sciatique étroite |
Évasement des ailes iliaques |
Sans particularités |
|
| Épiphyses |
Modérément élargies au niveau des genoux et des autres os longs |
Modérément élargies au niveau des genoux |
Aplaties au niveau des genoux |
Les signes distinctifs entre les différentes formes de syndromes de Schwartz-Jampel avant la découverte des gènes HSPG2 et LIFR
(d’après l’article de Gideon
et al
., 1997 [20]).
|
Cinq années supplémentaires seront nécessaires pour cloner définitivement le gène du SJS et mettre en évidence les premiers variants de séquence du gène causal du SJS [
21
].
HSPG2
, le gène identifié en 2000 par le groupe de Sophie Nicole [
21
] et confirmé par un groupe japonais deux ans plus tard [
22
], s’est avéré coder le perlecan, une protéine de grande taille située dans la matrice extra-cellulaire des cellules endothéliales et épithéliales. Le fait qu’il s’agisse d’une protéine de structure a été en soi une surprise. SJS1A et SJS1B se sont avérés en relation avec des mutations dans le gène codant cette même protéine de structure. Il a ensuite rapidement été démontré que les formes néonatales de SJS (SJS2 selon la nomenclature en vigueur à l’époque) n’étaient pas liées à ce nouveau gène. Une analyse phénotypique plus poussée a également permis de rapprocher ces dernières d’une autre entité malformative appelée syndrome de Stüve-Wiedemann (SWS). Dans le SWS, les malformations ostéo-articulaires sont plus marquées et plus précoces. Les enfants porteurs du syndrome survivent rarement au-delà de quelques semaines ou mois de vie. Le gène
LIFR
à l’origine du SWS mais aussi du SJS2, perlécan
,
sera finalement identifié en 2004 par un autre groupe français sous la direction de Valérie Cormier-Daire [
23
]. Avec ces travaux, il est désormais établi que SWS et SJS2 ne font donc finalement qu’un.
La découverte du perlecan, le produit du gène
HSPG2,
n’a pas levé les doutes sur la physiopathologie du SJS et donc sur la façon de le classer. Comme d’autres pathologies à cheval entre plusieurs organes / systèmes, il est parfois difficile de faire rentrer le SJS dans le cadre des maladies neuromusculaires. Ainsi, et s
tricto sensu,
le SJS ne fait pas partie des syndromes myotoniques non dystrophiques, à l’inverse des canalopathies musculaires liées aux canaux chlore ou sodium.
Quand bien même il y aurait consensus pour qualifier le SJS de maladie neuromusculaire, la question de savoir s’il correspond à une authentique myotonie, clinique et/ou électrique, continue de faire débat, certains contributeurs n’hésitant pas à le ranger dans les neuromyotonies (cf. aspects physiopathologiques) ou, de façon plus globale, dans les syndromes d’hyperexcitabilité membranaire. |
Épidémiologie et génétique
Il n’existe pas officiellement de registre de patients atteints de SJS au niveau national ou international. A ce jour, on estime à environ 150 le nombre de cas de SJS publiés dans le monde. Tous, loin s’en faut, n’ont pas été validés par une étude positive du gène
HSPG2
en biologie moléculaire. En France, on estime l’incidence à un nouveau cas tous les deux ans environ et la prévalence à une dizaine de patients régulièrement suivis dans l'hexagone.
La transmission autosomique récessive est la règle dans le SJS et explique pourquoi la prévalence du syndrome est plus élevée dans les zones de forte endogamie comme le sous-continent indien, le Moyen-Orient ou le Maghreb [19, 24-26]. Les cas à transmission autosomique dominante rapportés par quelques auteurs relèvent de l’exception voire, selon certains analystes, d’une erreur de diagnostic [27, 28]. La maladie est observée sous toutes les latitudes, indépendamment de l’origine ethnique. Le fait que le SJS ait été un moment sur-représenté en Afrique du Sud est probablement lié à un biais de recrutement, Peter Beighton et Denis Viljoen ayant développé une authentique passion pour ce syndrome et les patients qui en souffraient [15, 16]. Il faut enfin signaler, dans certaines communautés très endogames, d’authentiques mais rarissimes cas de SJS pseudo-dominants ont été rapportés (communication personnelle). Les patients atteints de SJS passés à l’âge adulte ne sont en effet pas infertiles et il n’est pas exceptionnel que certains d’entre eux fondent une famille.
La complexité et la taille du gène
HSPG2
ne facilitent pas le recensement et la validation des diagnostics de SJS à travers le monde même si les techniques de séquençage à haut débit (NGS) rendent cette tâche moins ardue qu’auparavant [29-31].
A contrario
, la banalisation du recours au NGS dans l’exploration étiologique des syndromes polymalformatifs non ou mal étiquetés permet d’élargir le spectre phénotypique du SJS en direction de formes moins typiques et/ou moins graves de la maladie.
Le gène
HSPG2
est habituellement criblé à l’aide de panels de gènes (panel « myotonies », panel neuromusculaire large, panel « dysplasies osseuses », panel « nanisme », etc.) ou d’une étude en exome entier. Le séquençage complet en Sanger du seul gène
HSPG2
a vécu, car chronophage et paradoxalement plus onéreux que le NGS. Une étude de la ségrégation familiale des variants de séquence potentiellement pathologiques est fortement recommandée tant les polymorphismes bénins de
HSPG2
sont fréquents du fait de la grande taille du gène.
Des études fonctionnelles sont parfois utilisées pour valider les résultats de biologie moléculaire dont la signification reste équivoque. Elles consistent, en autres, à étudier l'expression du perlécan dans les fibroblastes. Ces analyses complémentaires relèvent néanmoins de la recherche et non de la routine.
Toutes sortes de variants du gène
HSPG2
ont été rapportées [32, 33]. Les mutations faux-sens existant à l’état homozygote ou hétérozygote composite sont les plus fréquentes. Les délétions tronquantes du gène ne sont pas exceptionnelles tout comme les mutations introniques. Il n’existe pas à proprement parler de réelle corrélation génotype-phénotype. L’interprétation des variants du gène
HSPG2
reste globalement un exercice délicat. Les cas avec un seul variant
HSPG2
identifié malgré un phénotype SJS indiscutable sont assez fréquents.
|
HSPG2,
le gène en cause dans le SJS, code le perlécan (
heparan-sulfate-proteoglycan)
, une protéoglycane ubiquitaire située au niveau des lames basales. Le gène est constitué de 97 exons correspondant à une taille de 120 kilobases.
HSPG2
code une protéine composée de 4 391 acides aminés. Le perlécan a un poids naturel de 467 kDa auquel s’ajoute le poids de résidus 3-4 glycosaminoglycanes. L’ensemble, d’un poids moléculaire total de 750 kDa, constitue une des principales molécules monomériques de la matrice-extracellulaire [34-39]. Le gène lui-même est très conservé dans l’évolution comme en témoignent de nombreuses homologies de séquence entre différentes espèces.
Le perlécan contient cinq domaines (de I à V) composés d’éléments répétitifs en tandem, d’où la référence au terme de « perle ». Les gènes orthologues de
HSPG2
ont été décrits chez le ver
C.elegans (Unc-52)
et chez la drosophile (
Trol
). Les fonctions du perlécan sont multiples et encore mal connues. Ce dernier jouerait un rôle important dans le développement, la réparation tissulaire et la morphogenèse, tout particulièrement au niveau du cartilage. L’invalidation complète du gène
HSPG2
chez la souris est létale pendant la période embryonnaire du fait de malformations du cerveau et du cœur mais aussi d’hémorragies dans plusieurs tissus et organes. Plusieurs modèles hypomorphes du SJS ont été développés chez la souris. Dans l’un deux, un défaut de maturation des terminaisons nerveuses a été noté ainsi que l’apparition, plus tardive, d’une neuropathie et d’une dystrophie musculaire [
40
].
Des mutations de
HSPG2
sont en pathologie humaine à l’origine de deux maladies héréditaires : le SJS d’une part et la dysplasie segmentaire de type Silverman-Handmaker (DDSH, OMIM#224410) de l’autre. Le DDSH est une variante exceptionnellement rare, plus sévère et rapidement létale, du SJS dans laquelle le perlécan n’est pas sécrété du tout [
41
].
Les mécanismes de l’hyperexcitabilité membranaire sont encore mal connus. Deux théories, possiblement complémentaires, ont été développées jusqu’à présent. Dans la première, le perlécan interagirait au niveau de la jonction neuromusculaire en fixant d’un côté les molécules d’acétylcholinestérase et de l’autre celles du dystroglycane. Le dysfonctionnement secondaire de l’acétylcholine-estérase empêcherait la dégradation physiologique de l’acétylcholine et abaisserait ainsi le seuil de sensibilité du récepteur à l’acétylcholine [
42
]. Dans la seconde, le perlécan pourrait agir directement sur les canaux ioniques sodium et chlore en perturbant leur fonction.
|
Des critères diagnostiques simples et un tableau clinique facilement reconnaissable Ce n’est généralement pas dans les premiers jours ou semaines de vie que le diagnostic de SJS est évoqué. Du fait des différents modes d’entrée et d’expression de la maladie, les enfants atteints de SJS sont amenés, le cas échéant, à consulter plusieurs spécialistes : l’ophtalmologue, du fait d’anomalies oculaires qui deviennent évidentes au fil des années, un généticien du fait de l’aspect dysmorphique du visage et/ou de la constatation d’un retard de croissance staturale, un orthopédiste du fait d’une dysplasie de hanches précoce ou de troubles de la marche, ou enfin un pédiatre généraliste. Il est rare que le neuropédiatre soit sollicité d’emblée sauf en cas de syndrome myotonique au premier plan. Les formes très précoces de SJS peuvent être vues en néonatalogie mais ce cas de figure reste exceptionnel. La conjonction des signes cliniques suffit à évoquer très fortement le diagnostic, notamment la dysmorphie faciale caractéristique avec blépharophimosis, la petite taille et les déformations ostéo-articulaires. En revanche, la myotonie peut être très discrète ou absente, surtout chez les plus jeunes, comme rapporté antérieurement. ce n'est donc pas un élément très fort pour affirmer ou infirmer le diagnostic.
La
dysmorphie faciale
a une origine double. Comme résultat de la contraction permanente du muscle, on observe un faciès figé des enfants, volontiers qualifié de rire sardonique (en référence à au « sourire amer » d’Ulysse lors d’une étape de son périple odysséen), avec un rétrécissement des fentes palpébrales et le blépharophimosis, et un même phénomène de rétrécissement au niveau du muscle
orbicularis oris
avec un aspect de lèvres pincées. Un menton plissé et une dystopie canthale complètent souvent le syndrome dysmorphique. D’autres anomalies oculaires sont plus rarement rapportées : microphtalmie, micro-cornée, cataracte juvénile et myopie. En revanche, une rétro-micrognathie, des oreilles décollées à implantation basse ainsi que d’autres malformations ostéo-articulaires du visage sont à mettre plutôt sur le compte du processus chondrodysplasique.
L’apparition de la myotonie est insidieuse et se fait sur plusieurs semaines ou mois. Elle est à rechercher en priorité au niveau des mains et des paupières (blépharospasme). Elle peut être plus subtile à détecter et n’être visible que lors de la percussion des masses musculaires (éminence thénar, muscles radiaux ou autres). Elle s’accompagne d’une
hypertrophie musculaire
parfois impressionnante d’où un aspect pseudo-herculéen très évocateur. Cet aspect est d’autant plus visible que le tissu sous-cutané est souvent de faible épaisseur chez ces patients. La myotonie n’est ni aggravée par le froid ni améliorée par l’échauffement. Chez certains patients, on peut noter une faiblesse musculaire mais celle-ci est rarement progressive. De façon générale, il est souvent difficile de faire la part du déficit musculaire, de la myotonie et des malformations articulaires dans la limitation des mouvements.
Les troubles ostéo-articulaires sont très variés dans le SJS. Au niveau des membres, on note classiquement des anomalies de développement au niveau des hanches, des coudes et des genoux. Celles-ci sont à l’origine d’enraidissements articulaires ou, beaucoup plus rarement, de recurvatum multiples. Les os longs sont volontiers arqués. Quant au rachis, il est le siège d’une dysplasie vertébrale épiphysaire d’importance variable et, assez souvent, d’une cypho-scoliose associée. Le tout aboutit à des troubles de la marche, et à des déformations des membres, du rachis et du thorax, et à un nanisme. Une atteinte respiratoire est à redouter en cas de déformations thoracique/rachidienne importantes avec comme corollaire, des infections pulmonaires à répétition. Un syndrome d’apnées du sommeil peut venir, le cas échéant, majorer ces troubles. D’autres signes moins fréquents ont été rapportés dans le SJS : stridor laryngé, palais ogival, hernies inguinales ou ombilicales, micro-orchidie… Les personnes atteintes de SJS ont, sauf exception, une intelligence et une cognition normales. Du fait de leur dysmorphie et de leur petite taille, beaucoup d’entre elles souffrent toutefois de stigmatisation sociale et d’isolement, le tout pouvant conduire à des troubles de l’humeur réactionnels (dépression, autres). |
Le bilan à visée diagnostique Le bilan initial comporte une examen physique complet à la recherche des signes cardinaux qui caractérisent le SJS : la dysmorphie faciale, le blépharophimosis, avec ou sans blépharospasme, le nanisme, la rigidité articulaire, la myotonie et l’hypertrophie des masses musculaires. Le bilan doit comporter :
- un
bilan radiologique complet (radios du rachis, du thorax et des membres, âge osseux)
afin d’apprécier tout signe de dysplasie, en particulier au niveau des hanches et des vertèbres.
- les taux des
créatine-phospho-kinase (CPK)
sont en général normaux ou modérément augmentés. Il n’existe pas d’autres marqueurs biologiques dans le SJS à ce jour. Le bilan phospho-calcique et les dosages hormonaux ne révèlent pas d’anomalie.
- les études électrophysiologiques sont difficiles à réaliser, surtout chez les tout-petits. L’EMG est le plus souvent très contributif en montrant des décharges répétitives complexes mais sans variations
crescendo
ou
decrescendo
comme celles observées dans les myotonies vraies. Ces tracés évoquent plus une hyperexcitabilité membranaire qu’une véritable myotonie. Cette activité persiste au repos, lors du sommeil et même lors d’une anesthésie générale induite par les curares. Un pattern de type I a été mis en évidence dans une fratrie atteinte de SJS grâce à un protocole EMG d'exercice court. De façon générale, rappelons, s’il en était besoin, que l’EMG ne fait pas partie des outils de suivi, une fois le diagnostic initial de SJS posé. En revanche, tester les parents en EMG au moment du bilan initial, fait partie des pratiques acceptables, surtout s’il s’agit d’éliminer un autre syndrome myotonique (dystrophie myotonique de type 1, myotonie congénitale).
- la
biopsie musculaire
n’a pas d’intérêt diagnostique sauf pour éliminer une autre pathologie neuromusculaire. Les lésions rapportées par différents auteurs sont peu ou pas spécifiques.
- une
biopsie de peau
peut être utile dans le but de cultiver des fibroblastes qui serviront, si nécessaire, à étudier la l'expression du perlécan.
- le
dosage sur buvard de l’activité de la maltase acide
doit être systématique, la maladie de Pompe pouvant mimer, sur certains points, un SJS (décharges complexes répétitives surtout au niveau des muscles paraspinaux, hypertrophie musculaire).
- les épreuves fonctionnelles respiratoires (EFR) sont recommandées, a fortiori s’il existe une déformation thoracique. Elles permettent de détecter précocement une baisse de la capacité vitale respiratoire, signe d’une insuffisance respiratoire chronique débutante, et de rechercher une hypoventilation alvéolaire notamment nocturne (intérêt de l’oxymétrie nocturne). - du fait de la grande fréquence des anomalies dentaires et maxillaires, l'avis d'un dentiste, d'un chirurgien maxillo-facial ou d'un orthodontiste est vivement conseillé. Un panoramique dentaire, voire une reconstruction en 3D des os de la face, permettront d’évaluer le degré de malocclusion et la présence de malformations dentaires.
- l’étude du gène
HSPG2
est recommandée pour conforter le diagnostic mais peut s’avérer complexe à interpréter (
cf
. supra).
 | Figure 2.
Une forme de SJS peu sévère avec dysmorphie faciale modérée et discrète dysplasie de l’articulation coxo-fémorale
(DR J. Andoni Urtizberea).
|
|
Dans la forme classique du SJS, le doute est rarement permis. Encore faut-il avoir le réflexe de penser à ce syndrome ultra-rare devant un faciès très évocateur associé à une petite taille, une myotonie et une musculature hyper développée. Le problème se pose encore plus dans les formes incomplètes ou de sévérité intermédiaire qui peuvent conduire à une longue errance diagnostique. La dysmorphie peut être plus discrète tout comme les phénomènes myotoniques. Le faciès figé ou le rire sardonique par exemple ne sont pas l’apanage du SJS. On peut l’observer dans le tétanos, l’intoxication à la strychnine ou encore dans la maladie de Wilson. Par ailleurs, certains patients ont une taille et des articulations coxo-fémorales normales. Il faut alors discuter d’autres diagnostics en fonction de la porte d’entrée. Si la myotonie est au premier plan, les autres étiologies à éliminer en priorité sont les dystrophies myotoniques (avant tout, la forme congénitale de maladie de Steinert) et les myotonies non-dystrophiques (plus la myotonie de Becker, par définition autosomique récessive, que la maladie de Thomsen à transmission autosomique dominante). La paramyotonie congénitale pourrait également donner le change avec un SJS mais le caractère aggravant du froid n’existe pas chez ce dernier. De façon générale, un aspect pseudo-herculéen est fréquent dans les myotonies congénitales mais aussi dans la myopathie liée au gène codant la myostatine.
Comme vu plus haut, et si l’on considère que les anomalies EMG observées ne relèvent pas d’une vraie myotonie dans le SJS, les autres causes génétiques d’hyperexcitabilité de la membrane musculaire ou d’hyperactivité musculaire continue sont à considérer (pathologies liées à
HINT1,
maladie de Brody, autres). Des études électrophysiologiques complémentaires (protocoles d’exercice de longue et courte durée) peuvent être utiles avant le retour des analyses moléculaires.
In fine
, les tests génétiques (panel de gènes « syndromes myotoniques », autres) permettent en général de lever le doute avec ces diagnostics alternatifs, à la nuance près que la recherche de la maladie de Steinert requiert un test spécifique (recherche d’une expansion de triplets nucléotidiques CTG) non couvert par les techniques actuelles de NGS.
Si les troubles orthopédiques sont le motif principal de consultation, le praticien sera amené, avant l’obtention des résultats des tests génétiques, à discuter des autres malformations osseuses constitutionnelles au premier rang desquels figurent le syndrome de Kniest et le syndrome de Pyle. En cas de forme précoce et gravissime, comme déjà évoqué, le SWS a une base moléculaire distincte (mutation du gène
LIFR
). En revanche, des études génétiques récentes ont permis d’affirmer que la dysplasie squelettique de Burton, tout comme la dysplasie de type Catel-Hempel, correspondaient en fait à d’authentiques SJS. Les subluxations ou luxations complètes de hanche peuvent également évoquer une épiphysiolyse (maladie de Legg-Perthes-Calvé) ou les conséquences d’une myopathie congénitale. Une mucopolysaccharidose de type Morquio peut être également discutée d’autant que des cas de SJS avec syndrome du canal carpien associé ont été rapportés. De manière générale, les autres causes de nanisme et de dysplasie osseuse sont à évoquer font désormais l’objet d’études NGS sur panels de gènes.
Quant à la dysmorphie faciale, elle peut faire évoquer celle décrite dans le syndrome de Freeman-Sheldon. |
Un suivi régulier dans un centre spécialisé Les patients atteints de SJS nécessitent un suivi médical régulier, et ce tout au long de leur existence. Une fois passée la phase diagnostique, les enfants les plus jeunes requièrent des visites de suivi au minimum semestrielles tout au long de la croissance. Chez les adultes stabilisés, l’intervalle entre deux visites de contrôle peut être plus espacé. Selon les cas et en fonction de l’offre de soins locale, les malades sont généralement suivis dans des centres de référence ou de compétence pour maladies rares, en particulier ceux dédiés à la pathologie neuromusculaire (filière FILNEMUS) ou aux pathologies osseuses constitutionnelles rares (filière OSCAR). En particulier, le centre de référence pour les canalopathies musculaires de la Salpêtrière a une grande expérience dans le domaine. Dans ces consultations ou centres spécialisés, l’approche se doit d’être pluridisciplinaire, la priorité étant donnée à l’évaluation de la myotonie, des troubles orthopédiques et des répercussions possibles au niveau respiratoire et au niveau oculaire. L’avis du psychologue est également primordial, surtout dans cette pathologie très souvent stigmatisante du fait du nanisme et de la dysmorphie faciale. L’accompagnement des patients atteints de SJS et de leurs familles peut se faire avec les référents parcours santé (RPS) de l’AFM-Téléthon, cette dernière reconnaissant le syndrome de Schwartz-Jampel comme une maladie neuromusculaire à part entière. |
Une histoire naturelle de la maladie imparfaitement connue Logiquement, le SJS a d’abord été décrit dans la population pédiatrique. Les formes de l’adolescence ou de l’adulte sont rarement publiées et correspondent toujours à des enfants atteints de SJS ayant grandi et/ou ayant connu de très longues périodes d’errance diagnostique. Il faut tenir compte des trois composantes essentielles de la maladie pour imaginer comment les patients diagnostiqués dans l’enfance vont évoluer. Beaucoup de malades atteints de SJS ont un risque important de perdre la marche, non pas tant du fait de la faiblesse musculaire que des déformations articulaires et de l'enraidissement qui en découle. Les rétractions sont volontiers progressives jusqu’à l’adolescence puis ont tendance à se stabiliser. L’atteinte oculaire, traitée ou non traitée, est rarement évolutive en tant que telle, tout comme la dysmorphie faciale laquelle aurait même tendance à s’estomper un peu avec le temps. Pour autant, le blépharophimosis peut parfois mettre en jeu le pronostic visuel. Quant à la myotonie, elle a nettement tendance à s’amender après l’adolescence à la différence de l’hypertrophie musculaire qui semble persister plus longtemps. Les complications cardiaques ne sont pas décrites dans le SJS ce qui ne dispense pas de les rechercher à titre systématique au moment du diagnostic puis lors du suivi. Sauf complication intercurrente, les patients atteints de SJS semblent avoir une espérance de vie dans la norme, en tout cas dans la forme classique du syndrome. |
Des recommandations pour la prise en charge
En l’absence de traitement curatif, la prise en charge dans le SJS vise : - à préserver l’autonomie, notamment au niveau des déplacements, - à diminuer autant que faire se peut les phénomènes myotoniques, - à préserver la vision et enfin, - à favoriser le développement neurocognitif de l’enfant concerné, gage de réussite d’une bonne intégration familiale, scolaire et sociétale. Cette approche symptomatique ne fait pas encore l’objet de recommandations officielles, sans doute au vu de la rareté de ce syndrome. En France, il n’existe pas encore de Protocole National de Diagnostic et de Soins (PNDS) pour le syndrome de Schwartz-Jampel. Le sujet est rarement abordé dans les congrès internationaux dédiés aux pathologies neuromusculaires. De ce point de vue, le seul workshop organisé en 2001 par
l’European Neuromuscular Centre
(ENMC) fait figure d’exception [
43
]. Cet atelier s’était attaché plus aux aspects moléculaires et physiopathologiques de la maladie qu’aux questions de prise en charge.
Les familles concernées par le SJS et éparpillées à travers le monde n’hésitent pas à partager leurs expériences personnelles sur les réseaux sociaux, en particulier par l’intermédiaire du
Schwartz-Jampel Group
hébergé par Metavers et qui revendique jusqu’à 300 membres, patients, familles et amis inclus.
Le traitement de la myotonie
Quel que soit le nom qu’on lui donne, myotonie, pseudomyotonie ou neuromyotonie, ou encore hyperexcitabilité membranaire, l’objectif du traitement de la raideur musculaire est de diminuer au maximum l’hyperactivité permanente qui la sous-tend. Les thérapies médicamenteuses utilisées classiquement dans les canalopathies musculaires comme la carbamazépine, la mexilétine ou d’autres (phénytoïne, procaïnamide, acétazolamide), ont des effets très limités [
44
,
45
]. La carbamazépine serait la moins décevante d’entre elles, au prix toutefois d’une possible somnolence ou troubles de la concentration. L’utilisation au long cours de ces drogues pose également la question de leur innocuité, surtout chez l’enfant. Il faut également prendre en compte le fait que la myotonie a tendance à spontanément tendance à diminuer après l’adolescence, comme en témoignent beaucoup d’adultes concernés.
Les injections de toxine botulinique, déjà tentées dans plusieurs études, se heurtent à des problèmes de faisabilité (quel(s) muscle(s) choisir ? quelle(s) dose(s) à quelle fréquence ?) et, dans certains pays, à des problèmes de remboursement (faute d’AMM dans cette indication). Les autres traitements La place de la kinésithérapie reste discutée. Elle vise à prévenir les enraidissements articulaires. Elle doit être douce et non douloureuse. L’hydrothérapie peut être utile à condition d’être réalisée à bonne température. Il n’y a pas de contre-indications connues aux vaccinations quelles qu’elles soient. Toute anesthésie générale chez un patient atteint de SJS nécessite certaines précautions. Ces enfants sont difficiles à intuber du fait de la microstomie, de la crispation des muscles massétérins et de la brièveté du cou. Les déformations thoraciques peuvent majorer ce risque, notamment en cas de cyphoscoliose. Enfin, on notera qu’un cas d’hyperthermie maligne a été documenté chez un patient sud-africain souffrant de SJS. La prise en charge respiratoire s'impose dans les formes sévères où existe une déformation thoracique importante retentissant sur les échanges gazeux. Des apnées obstructives sévères en rapport avec les malformations bucco-faciales ont été rapportées. Plusieurs enfants atteints de SJS ont ainsi nécessité une ventilation assistée invasive sur trachéostomie. Un accompagnement psychologique du patient et de sa famille est indispensable, tant au moment de l’annonce du diagnostic que lors du suivi. Outre la petite taille, les difficultés rencontrées par l’enfant pour communiquer ses émotions du fait de la tension permanente des muscles du visage sont à l’origine d’une stigmatisation ou d’une incompréhension contre lesquelles il faut lutter. Prise en charge des troubles orthopédiques
Les déformations orthopédiques observées dans le SJS sont le résultat de la chondrodysplasie mais aussi, de manière indirecte, de l’activité musculaire permanente. Celles-ci sont particulièrement notables au niveau des hanches (
coxa vara, coxa plana
), du thorax (
pectus carinatum)
, des genoux, des coudes ou du rachis (vertèbres aplaties, cyphoscoliose). Elles sont d’autant plus marquées et potentiellement invalidantes qu’elles surviennent précocement lors de la croissance de l’enfant.
Un traitement orthopédique de la dysplasie de hanche (harnais ou plâtres en abduction chez les tout-petits) peut être proposé mais n’est pas d’une grande efficacité pour prévenir au long cours la déformation coxo-fémorale. La chirurgie des hanches, son timing et ses modalités, reste discutée. Une évaluation sur plateau dynamique de marche peut être utile pour bien poser les indications. Chez les plus jeunes n’ayant pas terminé leur croissance, et en cas de gêne fonctionnelle importante, une chirurgie de dérotation fémorale peut s’avérer utile. Une arthroplastie de hanche par voie sanglante est parfois proposée chez les sujets plus âgés. L’intérêt du port d’attelles orthopédiques des membres inférieurs reste débattu. Le traitement orthopédique (par corset, étirements, et/ou tiges de croissance) des scolioses sévères et évolutives est souvent mis en échec et peut amener à une chirurgie rachidienne avec le risque d’une dégradation de la fonction respiratoire en post-opératoire. La dysplasie vertébrale responsable du nanisme observé dans la quasi-totalité des patients n’est pas accessible à un traitement médicamenteux spécifique, l’hormone de croissance de synthèse n’étant pas efficace de façon générale dans ce type de déformations osseuses. La prise en charge en odontologie Microstomie, malocclusion et anomalies dentaires sont monnaie courante dans le SJS. Des interventions de reconstruction maxillo-faciale ont été rapportées dont certaines avec un résultat esthétique appréciable. Elles doivent être réservées aux formes les plus esthétiquement invalidantes et requièrent des praticiens expérimentés. On peut rapprocher cette prise en charge odontologie de la chirurgie reconstructrice du visage qui a été réalisée chez quelques adolescents atteints de SJS. Le traitement du blépharophimosis La chirurgie peut avoir son intérêt, notamment en cas de rétrécissement fonctionnel du champ visuel. Une résection de l’aponévrose du muscle releveur des paupières a été tentée, avec succès, chez plusieurs enfants atteints d’une forme sévère de SJS avec mise en jeu du pronostic visuel. Une myectomie du muscle orbiculaire des yeux a également été proposée. L’efficacité du traitement par toxine botulinique est en revanche plus débattu. Le conseil génétique
Le conseil génétique fait partie intégrante de la prise en charge. Il vise à informer l’individu et/ou ses proches des risques en rapport avec le syndrome. La première étape consiste à confirmer, chez le propositus, le diagnostic de SJS en biologie moléculaire. Ceci permet ensuite d’identifier les autres personnes à risque et d’analyser le risque de récurrence du syndrome à l’intérieur de la famille. Dans la plupart des cas, l’étude moléculaire permet de répondre à toutes ces interrogations et à déterminer le statut de chacun (homozygote ou hétérozygote). Le risque de récurrence dans la descendance de parents ayant déjà eu un enfant atteint de SJS est de 25 %, à l’instar des autres maladies autosomiques récessives. Ce risque est plus élevé en cas de forte endogamie communautaire. Les mutations
de novo
n’ont pas été rapportées dans le SJS. Quant aux formes autosomiques dominantes (cf. supra), elles constituent une exception voire une incongruité.
Dans les cas de génotype complexe ou incertain, les études fonctionnelles pour valider certains diagnostics moléculaires sont envisageables mais restent du domaine de la recherche. Un diagnostic prénatal est en théorie possible pour cette pathologie considérée comme gravement invalidante et sans traitement curatif. On ne dispose cependant pas de statistiques précises pour évaluer le nombre de familles y ayant réellement recours. Les adultes atteints de SJS et en âge de procréer peuvent avoir une descendance, et ce malgré leur situation de handicap. Dans les zones de forte endogamie, il leur est fortement déconseillé de choisir un conjoint à l’intérieur du cercle familial élargi, le risque de récurrence pour leur descendance devenant alors non négligeable. |
Peu de cliniciens et/ou de chercheurs se consacrent actuellement au SJS. Après la période, quelque peu euphorique, de la découverte du gène
HSPG2
en 2000, on constate un tarissement progressif des publications scientifiques sur le sujet. Le nombre de projets de recherche est également en berne (aucune étude récente concernant le SJS n’est recensée ni sur le site clinicaltrials.gov ni sur celui de l’Agence Nationale de la Recherche [ANR]). Une équipe de chercheurs du Texas dédiée à l’étude de la matrice extra-cellulaire continue toutefois à s’intéresser au perlécan et à ses fonctions. Des chercheurs chinois ont mis au point des cellules souches pluripotentes issues de patients atteints de SJS avec lesquelles ils ont pu récemment montrer que l’hyperexcitabilité se situait plus au niveau du muscle que des terminaisons nerveuses [
46
].
À notre connaissance, il n’y a pas non plus de laboratoire pharmaceutique impliqué dans un quelconque développement thérapeutique. Il est vrai que le SJS reste ultra-rare et qu’il ne s’agit pas, sauf exception, d’une affection mortelle. Les questions qu’il pose néanmoins au niveau physiopathologique et thérapeutique devraient pourtant susciter un certain intérêt. Parmi les pistes envisageables, et purement théoriques à ce stade, on peut citer la mise au point de médicaments plus efficaces sur la myotonie, la thérapie de transfert de gène (mais la grande taille de
HSPG2
semble rédhibitoire à ce niveau), ou l’application de molécules agissant sur l’épissage du gène.
En attendant ces développements, plusieurs projets concrets pourraient être proposés comme la création d’un registre international de patients atteints de SJS, un protocole d’histoire naturelle de la maladie, et des collaborations entre cliniciens et chercheurs au sein d’un nouveau groupe de travail promu récemment par la filière FILNEMUS et consacré à la recherche translationnelle sur la matrice extra-cellulaire. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Sophie Nicole, Bertrand Fontaine et Savine Vicart pour l’ensemble de leurs travaux dans le domaine. Veena Kalra et Vish Wisvanathan pour l’iconographie.
|
1.
Schwartz
O
,
Jampel
RS
.
Congenital blepharophimosis associated with a unique generalized myopathy.
.
Arch Ophthal
.
1962;
;
68
:
:52.
–
57
.
2.
Catel
W
.
Differentialdiagnostiche Symptomatologie von Krankheiten des Kinderalters
.
.
Stuttgart:
:
George Thieme Ed;
,
1951
:
:48.
–
52
.
3.
Aberfeld
DC
,
Hinterbuchner
LP
,
Schneider
M
.
Myotonia, dwarfism, diffuse bone disease and unusual ocular and facial abnormalities (a new syndrome).
.
Brain
.
1965;
;
88
:
:313.
–
322
.
4.
Huttenlocher
PR
,
Landwirth
J
,
Hanson
V
,
et al.
Osteo-chondro-muscular dystrophy. A disorder manifested by multiple skeletal deformities, myotonia, and dystrophic changes in muscle.
.
Pediatrics
.
1969;
;
44
:
:945.
–
958
.
5.
Mereu
TR
,
Porter
IH
,
Hug
G
.
Myotonia, shortness of stature, and hip dysplasia.
.
Am J Dis Child
.
1969;
;
117
:
:470.
–
478
.
6.
Aberfeld
DC
,
Namba
T
,
Vye
MV
,
et al.
Chondrodystrophic myotonia: report of two cases: myotonic dwarfism, diffuse bone disease, and unusual ocular and facial abnormalities.
.
Arch Neurol
.
1970;
;
22
:
:455.
–
462
.
7.
Aberfeld
DC
.
Chondrodystrophic myotonia versus Schwartz-Jampel syndrome (Letter).
.
Ann Neurol
.
1979;
;
5
:
:210.
.
8.
Beighton
P.
.
The Schwartz syndrome in southern Africa.
.
Clin Genet
.
1973;
;
4
:
:548.
–
555
.
9.
Fowler
WM
,
Layzer
RB
,
Taylor
RG
,
et al.
The Schwartz-Jampel syndrome: its clinical, physiological and histological expressions.
.
J Neurol Sci
.
1974;
;
22
:
:127.
–
146
.
10.
van Huffelen
AC
,
Gabreels
FJM
,
van Luypen-van den Horst
JS
,
et al.
Chondrodystrophic myotonia: a report of two unrelated Dutch patients.
.
Neuropadiatrie
.
1974;
;
5
:
:71.
–
90
.
11.
Pavone
L
,
Mollica
F
,
Grasso
A
,
et al.
Schwartz-Jampel syndrome in two daughters of first cousins.
.
J Neurol Neurosurg Psychiat
.
1978;
;
41
:
:161.
–
169
.
12.
Cao
A
,
Cianchetti
C
,
Calisti
L
,
et al.
Schwartz-Jampel syndrome: clinical electrophysiological and histopathological study of a severe variant.
.
J Neurol Sci
.
1978;
;
35
:
:175.
–
187
.
13.
Scaff
M
,
Mendonca
LIZ
,
Levy
JA
,
et al.
Chondrodystrophic myotonia: electromyographic and cardiac features of a case.
.
Acta Neurol Scand
.
1979;
;
60
:
:243.
–
249
.
14.
Edwards
WC
,
Root
AW
.
Chondrodystrophic myotonia (Schwartz-Jampel syndrome): report of a new case and follow-up of patients initially reported in 1969.
.
Am J Med Genet
.
1982;
;
13
:
:51.
–
56
.
15.
Moodley
M
,
Moosa
A
.
Chondrodystrophic myotonia (Schwartz-Jampel syndrome) in South African children.
.
Neuropediatrics
.
1990;
;
21
:
:206.
–
210
.
16.
Viljoen
D
,
Beighton
P
.
Schwartz-Jampel syndrome (chondrodystrophic myotonia).
.
J Med Genet
.
1992;
;
29
:
:58.
–
62
.
17.
Pinto-Escalante
D
,
Ceballos-Quintal
JM
,
Canto-Herrera
J
.
Identical twins with the classical form of Schwartz-Jampel syndrome.
.
Clin Dysmorph
.
1997;
;
6
:
:45.
–
49
.
18.
Pascuzzi
RM
,
Gratianne
R
,
Azzarelli
B
,
et al.
Schwartz-Jampel syndrome with dominant inheritance.
.
Muscle Nerve
.
1990;
;
13
:
:1152.
–
1163
.
19.
Nicole
S
,
Ben Hamida
C
,
Beighton
P
,
et al.
Localization of the Schwartz-Jampel syndrome (SJS) locus to chromosome 1p34-p36.1 by homozygosity mapping.
.
Hum Mol Genet
.
1995;
;
4
:
:1633.
–
1636
.
20.
Giedion
A
,
Boltshauser
E
,
Briner
J
,
et al.
Heterogeneity in Schwartz-Jampel chondrodystrophic myotonia.
.
Eur J Pediat
.
1997;
;
156
:
:214.
–
223
.
21.
Nicole
S
,
Davoine
CS
,
Topaloglu
H
,
et al.
Perlecan, the major proteoglycan of basement membranes, is altered in patients with Schwartz-Jampel syndrome (chondrodystrophic myotonia).
.
Nat Genet
.
2000;
;
26
:
:480.
–
483
.
22.
Arikawa-Hirasawa
E
,
Le
AH
,
Nishino
I
,
et al.
Structural and functional mutations of the perlecan gene cause Schwartz-Jampel syndrome, with myotonic myopathy and chondrodysplasia.
.
Am J Hum Genet
.
2002;
;
70
:
:1368.
–
1375
.
23.
Dagoneau
N
,
Scheffer
D
,
Huber
C
,
et al.
Null leukemia inhibitory factor receptor (LIFR) mutations in Stüve-Wiedemann/Schwartz-Jampel Type 2 syndrome.
.
Am J Hum Genet
.
2004;
;
74
:
:298.
–
305
.
24.
Arya
R
,
Sharma
S
,
Gupta
N
,
et al.
Schwartz Jampel syndrome in children.
.
J Clin Neurosci
.
2013;
;
220
:
:313.
–
317
.
25.
Bastola
P.
Schwartz-Jampel syndrome. Kathmandu Univ Med J
.
2010;
;
8
:
:348.
–
351
.
26.
Padmanabha
H
,
Suthar
R
,
Sankhyan
N
,
et al.
Stiffness, facial dysmorphism, and skeletal abnormalities: Schwartz-Jampel syndrome 1A.
.
J Pediatr
.
2018;
;
200
:
:286.e1.
.
27.
Ferrannini
E
,
Perniola
T
,
Krajewska
G
,
et al.
Schwartz-Jampel syndrome with autosomal-dominant inheritance.
.
Eur Neurol
.
1982;
;
21
:
:137.
–
146
.
28.
Spaans
F.
.
Schwartz-Jampel syndrome with dominant inheritance (Letter).
.
Muscle Nerve
.
1991;
;
14
:
:1142.
.
29.
Iwata
S
,
Ito
M
,
Nakata
T
,
et al.
A missense mutation in domain III in HSPG2 in Schwartz-Jampel syndrome compromises secretion of perlecan into the extracellular space.
.
Neuromuscul Disord
.
2015;
;
25
:
:667.
–
671
.
30.
Das Bhowmik
A
,
Dalal
A
,
Matta
D
,
et al.
Identification of a novel splice site HSPG2 mutation and prenatal diagnosis in Schwartz Jampel Syndrome type 1 using whole exome sequencing.
.
Neuromuscul Disord
.
2016;
;
26
:
:809.
–
14
.
31.
Yan
W
,
Dai
J
,
Shi
D
,
et al.
Novel HSPG2 mutations causing Schwartz-Jampel syndrome type 1 in a Chinese family: a case report.
.
Mol Med Rep
.
2018;
;
18
:
:1761.
–
1765
.
32.
Stum
M
,
Davoine
CS
,
Vicart
S
,
et al.
Spectrum of HSPG2 (perlecan) mutations in patients with Schwartz-Jampel syndrome.
.
Hum Mutat
.
2006;
;
27
:
:1082.
–
1091
.
33.
Martinez
JR
,
Dhawan
A
,
Farach-Carson
MC
.
Modular Proteoglycan Perlecan/HSPG2: mutations, phenotypes, and functions.
.
Genes
.
2018;
;
9
:
:556.
.
34.
Kallunki
P
,
Eddy
RL
,
Byers
MG
,
et al.
Cloning of human heparan sulfate proteoglycan core protein, assignment of the gene (HSPG2) to 1p36.1-p35 and identification of a BamHI restriction fragment length polymorphism.
.
Genomics
.
1991;
;
11
:
:389.
–
396
.
35.
Noonan
DM
,
Fulle
A
,
Valente
P
,
et al.
The complete sequence of perlecan, a basement membrane heparan sulfate proteoglycan, reveals extensive similarity with laminin A chain, low density lipoprotein-receptor, and the neural cell adhesion molecule.
.
J Biol Chem
.
1991;
;
266
:
:22939.
–
22947
.
36.
Graham
LD
,
Whitelock
JM
,
Underwood
PA
.
Expression of human perlecan domain I as a recombinant heparan sulfate proteoglycan with 20-kDa glycosaminoglycan chains.
.
Biochem Biophys Res Commun
.
1999;
;
256
:
:542.
–
548
.
37.
Xu
Z
,
Ichikawa
N
,
Kosaki
K
,
et al.
Perlecan deficiency causes muscle hypertrophy, a decrease in myostatin expression, and changes in muscle fiber composition.
.
Matrix Biol
.
2010;
;
29
:
:461.
–
470
.
38.
Ning
L
,
Xu
Z
,
Furuya
N
,
et al.
Perlecan inhibits autophagy to maintain muscle homeostasis in mouse soleus muscle.
.
Matrix Biol
.
2015;
;
48
:
:26.
–
35
.
39.
Pei
S
,
Parthasarathy
S
,
Parajuli
A
,
et al.
Perlecan/Hspg2 deficiency impairs bone’s calcium signaling and associated transcriptome in response to mechanical loading.
.
Bone
.
2020;
;
131
:
:115078.
.
40.
Bauche
S
,
Boerio
D
,
Davoine
CS
,
et al.
Peripheral nerve hyperexcitability with preterminal nerve and neuromuscular junction remodeling is a hallmark of Schwartz-Jampel syndrome.
.
Neuromuscul Disord
.
2013;
;
23
:
:998.
–
1009
.
41.
Arikawa-Hirasawa
E
,
Wilcox
WR
,
Yamada
Y
.
Dyssegmental dysplasia, Silverman-Handmaker type: unexpected role of perlecan in cartilage development.
.
Am J Med Genet
.
2001;
;
106
:
:254.
–
257
.
42.
Arikawa-Hirasawa
E
,
Rossi
SG
,
et al.
Absence of acetylcholinesterase at the neuromuscular junctions of perlecan-null mice.
.
Nat Neurosci
.
2002;
;
5
:
:119.
–
123
.
43.
Nicole
S
,
Topaloglu
H
,
Fontaine
B
.
102nd ENMC International Workshop on Schwartz-Jampel syndrome, 14–16 December, 2001, Naarden.
.
The Netherlands. Neuromuscul Disord
.
2003;
;
13
:
:347.
–
351
.
44.
Spaans
F
,
Wagenmakers
A
,
Saris
W
,
et al.
Procainamide therapy, physical performance and energy expenditure in the Schwartz-Jampel syndrome.
.
Neuromuscul Disord
.
1991;
;
1
:
:371.
–
374
.
45.
Gurbuz
G
,
Albayrak
HM
.
Schwartz Jampel syndrome responding positively to carbamazepine therapy: a case report and a novel mutation.
.
Turk J Pediatr
.
2019;
;
61
:
:967.
–
970
.
46.
Yamashita
Y
,
Nakada
S
,
Nakamura
K
,
et al.
Evaluation of human-induced pluripotent stem cells derived from a patient with Schwartz-Jampel syndrome revealed distinct hyperexcitability in the skeletal muscles.
.
Biomedicines
.
2023;
;
11
:
:814.
.
|