| |
| Med Sci (Paris). 39: 58–63. doi: 10.1051/medsci/2023135.Les syndromes myasthéniques congénitaux avec anomalies cinétiques du récepteur à l’acétylcholine Mohamed Islam Kediha,1* Meriem Tazir,1 Damien Sternberg,2 Bruno Eymard,3 and Lamia Ali Pacha1 1Service de Neurologie, CHU Mustapha Bacha, Place 1er mai, 16000 Alger, Algérie. Université Benyoucef Benkhedda, Alger 1 2Myogenetics unit, Département de biochimie métabolique, Hôpital universitaire Pitié-Salpêtrière
,
75651Paris Cedex 13
,
France 3Fondation Rothschild
,
Paris
,
France |
© V. Allamand
Les syndromes myasthéniques congénitaux (SMC) constituent un groupe d’affections génétiques très hétérogènes à l’origine d’un dysfonctionnement de la jonction neuromusculaire (JNM). Il s’agit de maladies dans lesquelles la transmission neuromusculaire (TNM) est compromise par des perturbations spécifiques siégeant aux niveaux présynaptique, synaptique ou post-synaptique. Leur hétérogénéité phénotypique et leur rareté font que neurologues et pédiatres en ont une expérience limitée, y compris chez les spécialistes en pathologie neuromusculaire. Trente cinq gènes responsables de SMC ont été identifiés à ce jour [
1
].
Lorsqu’un SMC est suspecté, la démarche diagnostique repose sur la combinaison de trois éléments majeurs : 1.
Le syndrome myasthénique
: faiblesse et/ou fatigabilité des muscles des ceintures et des muscles oculobulbaires, fluctuation à court terme (dans la journée), ou à long terme (semaines ou mois), avec présence d’un bloc neuromusculaire à l’ENMG après stimulation nerveuse répétitive (SNR), ou d’un dédoublement du potentiel global d’action musculaire (PGAM). En période néonatale, les principaux signes à rechercher sont le déficit de la succion et du cri, des épisodes aigus de dyspnée et/ou un ptosis. Une fatigabilité musculaire anormale est plutôt retrouvée en période infantile ou juvénile. 2.
L’origine congénitale
est évoquée devant le début précoce, une histoire familiale positive, et une hérédité le plus souvent autosomique récessive. 3.
La négativité des auto-anticorps
(AC) dirigés contre le récepteur à l'acétyl choline (RACh) et la protéine MuSK.
Il a été proposé de classer les SMC en trois groupes selon le type de dysfonction de la JNM : SMC pré synaptique, SMC synaptique et SMC post synaptique sans oublier les SMC dans lesquels des déficits portant sur les protéines de glycosylation ont été identifiés (voir
Figure 1
). Les SMC post synaptiques sont les plus fréquents et sont essentiellement dus à un déficit quantitatif (dit «
Low Expressor
») ou à des anomalies fonctionnelles du RACh (voir
Figure 2
). La composition du RACh chez l'adulte est de type α2βγδ. La sous-unité epsilon (δ) est le siège du plus grand nombre de variants pathogènes dont la mutation fondatrice décrite au Maghreb [
2
]. Toujours parmi les SMC post synaptiques, on retrouve des anomalies cinétiques spécifiques du RACh, qui entrainent des ouvertures de canal anormalement prolongées (syndrome du canal lent ou
Slow Channel Syndrome
SCS, ou SMC de type 1A), ou anormalement brèves (syndrome du canal rapide ou
Fast channel Syndrome
FCS, ou SMC de type 1B), avec des effets délétères sur la JNM.
 | Figure 1.
La jonction neuromusculaire : interactions des principales protéines et enzymes impliquées
(DR Kediha M).
|
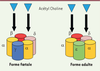 | Figure 2.
Récepteur à l’acétyl choline, dans ses deux formes (foetale et adulte) et ses différentes sous unités
(DR Kediha M).
|
|
Le syndrome du canal lent (SCS)
Il s’agit de l’anomalie cinétique du RACh la plus fréquente parmi les SMC. Ce syndrome référencé SMC de type 1A est de transmission autosomique dominante (AD). Il est caractérisé par l’allongement du temps d’ouverture du RACh, mise en évidence par étude micro-électrophysiologique, d’où le nom de « canal lent ». Ce syndrome partage certains traits avec le déficit en acétylcholinestérase (AChE) résultant de mutations dans le gène codant la queue du collagène (
COLQ
).
Le SCS est causé par des mutations aboutissant à un gain de fonction dans les domaines de liaison aux ligands extracellulaires du RACh, prolongeant ainsi la décroissance des potentiels synaptiques. Ceci engendre un blocage de la désensibilisation du RACh avec des dommages musculaires secondaires par surcharge en calcium. Cette surcharge cationique prolongée va induire un état myopathique, une perte secondaire en récepteurs ainsi qu’une altération architecturale de la JNM [
3
]. Les mutations dans le domaine de liaison aux ligands améliorent l’affinité pour l’acétylcholine (ACh), ralentissant sa dissociation du récepteur, lequel s’ouvre à plusieurs reprises pendant la période d’occupation agoniste. Comme dans les déficits en AChE, les potentiels synaptiques prolongés dépassent la période réfractaire absolue de la fibre musculaire et déclenchent des potentiels d’action répétitifs constituant ainsi un test électrodiagnostique connu sous le nom de double potentiel global d’action musculaire. Les différentes sous-unités du récepteur peuvent être impliquées [
4
]. Les mutations les plus fréquentes intéressent la sous-unité alpha.
Cliniquement, le SCS est caractérisé par une atteinte sélective et sévère des muscles cervicaux, scapulaires, dorsaux et surtout, des extenseurs des poignets et des doigts. Les anticholinestérasiques (ACEs) peuvent l’aggraver et sont donc contre indiqués.
Trois arguments orientent vers un SCS :
-
L’hérédité autosomique dominante.
-
L’absence de réponse aux ACEs.
-
Le dédoublement du potentiel moteur après stimulation unique.
Nous présentons ici deux familles de SCS. La famille 1
Il s’agit d’un cas en apparence sporadique : jeune femme âgée actuellement de 28 ans, issue d’un mariage non consanguin, avec un cas similaire probable dans la famille mais non documenté (une cousine du côté paternel présente un ptosis depuis l’enfance). Les troubles ont débuté vers l’âge de 19 ans par des fausses routes associées à deux épisodes de détresse respiratoire. Un an plus tard, une faiblesse musculaire des membres inférieurs s’est installée avec des difficultés à monter les escaliers ; puis extension six mois plus tard aux membres supérieurs, avec difficultés pour se coiffer, voix nasonnée et vision double. Ces troubles s’accentuent en fin de journée. L’examen neurologique de référence (en 2018) avait objectivé une patiente très asthénique, une limitation de l’abduction des globes oculaires, un ptosis gauche, une dysphonie, un déficit des muscles faciaux, un déficit moteur proximal des quatre membres, coté 4/5 au testing musculaire, ainsi qu’un déficit axial. Le score myasthénique était de 35/100 et le score QMG (
Quantitative Myasthenia Gravis
) était à 17/39. L’EMG objectivait un décrément net lors de la SNR de six couples nerf/muscle, ainsi qu’un double PGAM (
Figure 3
). Un an plus tard, la patiente se présente avec un déficit des extenseurs des doigts et des poignets, ainsi qu’une gêne respiratoire modérée. L’étude génétique a confirmé le diagnostic de SCS en mettant en évidence un variant faux-sens à l’état hétérozygote dans l’exon 5 du gène
CHRNA1
(sous‑unité alpha). La mutation retrouvée (p.G153S) était localisée au site de liaison de l’acétylcholine au niveau de la sous-unité alpha. Sur la base de ces résultats, une association fluoxétine et salbutamol a été proposée. La patiente a alors évolué favorablement au bout de quelques semaines, avec un score myasthénique passant à 90/100 et un score QMG à 3/39.
 | Figure 3.
Décrément net (graphique de gauche) et double PGAM (graphique de droite) chez la patiente de la famille 1.
|
La famille 2
Le propositus est actuellement âgé de 35 ans, est issu d’un mariage consanguin, avec, dans la famille, la notion de deux cas similaires, en l'occurrence deux frères décédés vers l’âge de 17-18 ans des suites d’une détresse respiratoire (
Figure 4
). Tous les deux avaient un ptosis bilatéral objectivé sur d’anciennes photos. Les troubles se sont installés vers l’âge de 16 ans avec une chute bilatérale des paupières fluctuant dans la journée. Vers l’âge de 25 ans sont apparus une voix nasonnée ainsi que des troubles de la déglutition aux solides. L’examen neurologique (en 2018) avait objectivé un ptosis bilatéral, une ophtalmoplégie extrinsèque et un déficit des muscles orbiculaires des yeux. Le score myasthénique était à 80/100 et le score QMG à 15/39. L’EMG avait objectivé un décrément net lors de la SNR de quatre couples nerf/muscle, mais un dédoublement du PGAM n’avait pas été recherché. L’étude génétique a révélé la présence d’un variant pathogénique (p.P131L) à l’état hétérozygote dans l’exon 5 du gène
CHRND
(sous-unité delta du RACh), responsable d’un SCS, alors que l’hérédité de cette famille consanguine évoquait plutôt une transmission autosomique récessive. Ce variant n’est pas retrouvé dans les populations déjà séquencées, ni dans les bases de données. Il s’agit d’un SCS du gène
CHRND
à pseudo-transmission récessive. Le traitement par fluoxétine à faibles doses (20 mg/jour) a permis une amélioration nette des troubles et des scores fonctionnels (score myasthénique à 95/100 et le score QMG à 3/39).
 | Figure 4.
Arbre généalogique de la famille 2. Le propositus est indiqué par une flèche.
Deux autres cas sont probables dans la fratrie mais n’ont pas été documentés (les deux sont décédés). On notera la consanguinité familiale.
|
Commentaires
. Les SMC liés au gène
CHRND
sont très rarement rapportés dans la littérature. Un patient, décrit en 2002 [
7
], avait un phénotype assez sévère avec hypotonie à un mois, ptosis à six mois et retard des acquisitions motrices. Il a par la suite développé un tableau pseudo-myopathique et nécessité un fauteuil roulant à l’âge de neuf ans. Il a par ailleurs présenté de nombreux épisodes de détresse respiratoire ayant nécessité une assistance venétaitest responsable d’un SCS. Ce tableau pseudo-myopathique associé à de nombreux épisodes apnéiques de SCS ne correspond pas à notre cas. Par ailleurs, notre patient présente un SCS de transmission d’allure récessive, or les SCS sont par définition de transmission AD. Dans la littérature, deux familles consanguines présentant un pattern physiopathologique en rapport avec un SCS et donc de transmission AR apparente, ont été décrites [
8
]. Le
Tableau II
résume le comparatif phénotypique entre notre patient et les deux patients issus de ces familles.
Nous remarquons une relative homogénéité phénotypique entre les trois familles, à l’exception du déficit des muscles extenseurs des doigts et des muscles cervicaux, qui n’est pas retrouvé chez notre patient. Un autre point commun est la pseudo-transmission récessive, alors que la mutation est hétérozygote dans les trois familles. Il semble que la pénétrance variable en soit la cause principale. Le génotypage des parents et de la fratrie permettrait de conforter cette hypothèse mais n’a pas pu être réalisée dans le cas présent.
Commentaires
: cette première observation illustre, le phénotype d’une patiente algérienne présentant un SCS en rapport avec une mutation déjà identifiée dans la sous-unité alpha du RACh. Un indice évocateur du diagnostic était présent chez elle : un déficit moteur distal aux avant-bras mais sans déficit net des muscles cervicaux. Le traitement à base de salbutamol associé à la fluoxétine a été bénéfique chez cette patiente, cette amélioration ayant déjà été rapportée chez un malade présentant un SCS mais avec une mutation intéressant cette fois-ci le gène
CHRNE
(sous-unité epsilon) [
5
]. Dans une série anglaise de 15 patients présentant un SCS [
6
], trois étaient porteurs de la même mutation que notre patiente. Le
Tableau I
compare les données cliniques, paracliniques et thérapeutiques de notre patiente avec les trois patients de cette série.
Tableau I.
| |
Série Chaouch
et al
., 2012 [
6
]
|
Notre patiente |
| P1 |
P4 |
P12 |
| Âge (années) / Genre |
44 / F |
16 / F |
48 / M |
25 / F |
|
| Cas similaires |
- |
- |
+ |
+ |
|
| Âge de début (années) |
25 |
1 |
43 |
19 |
|
| Symptômes |
Dyspnée |
Faiblesse proximale |
Troubles de la déglutition / fatigue |
Dysphonie/diplopie/dysphagie |
|
| Atteinte oculaire |
- |
- |
++ |
+ |
|
| Atteinte muscles cervicaux |
+++ |
+ |
++ |
- |
|
| Atteinte proximale mbres sup |
++ |
+ |
+ |
+ |
|
| Atteinte proximale mbres inf |
++ |
+ |
+ |
+ |
|
| Atteinte distale mbres sup |
+ |
+ |
+ |
++ |
|
| Atteinte distale mbres inf |
+ |
- |
- |
- |
|
| Fatigue |
+ |
+ |
+ |
+ |
|
| Évolution |
Stat |
Progressive |
Progressive |
Stat |
|
| Décrément |
+ |
+ |
+ |
+ |
|
| Double PGAM |
+ |
+ |
+ |
+ |
|
| Traitement |
Fluoxétine 40 mg/ j |
Fluoxétine 60 mg / j |
Fluoxétine 60 mg/ j |
Fluoxetine 40mg/j + Salbutamol 8mg/j |
|
| Réponse au traitement |
Bénéfique, mais effets secondaires |
Bénéfique, sans effets secondaires |
Bénéfique, sans effets secondaires |
Bénéfique, sans effets secondaires |
Comparatif des données phénotypiques de notre patiente avec les trois patients de la série anglaise
(Chaouch
et al
., 2012). [
6
]. P (patient), mbres (membres), inf (inferieur), sup (supérieur), Stat (stationnaire).
|
Tableau II.
| |
Série Croxen
et al.
, 2002 [
8
]
|
Notre patient |
| P1 |
P2 |
| Consanguinité |
+ |
+ |
+ |
|
| Âge début (années) |
20 ans |
17 ans |
16 ans |
|
| Cas similaires dans la famille |
1 cas |
3 cas |
2 cas |
|
| Ptosis/Ophtalmoplégie/Dysphagie |
+/+/- |
+/-/- |
+/-/+ |
|
| Décrément |
+ |
+ |
+ |
|
| Double PGAM |
- |
+ |
NR |
|
| Déficit des extenseurs des doigts |
+ |
+ |
- |
|
| Déficit cervical |
- |
+ |
- |
|
| Traitement par pyridostigmine |
- |
- |
+/- |
Comparatif phénotypique entre notre patient et ceux de la série Croxen, 2002
[
8
]. P (patient), NR (non recherché), + (présent), - (absent).
|
|
Le syndrome du canal rapide (FCS)
Le syndrome du canal rapide (SMC de type 1B) est de transmission autosomique récessive. Il est dû à des mutations entrainant une perte de fonction, avec raccourcissement du temps d’ouverture du pore du récepteur. C’est, fonctionnellement parlant, l’opposé du SCS. Les mutations concernent différents domaines des sous-unités du RACh. Elles exercent leurs effets par différents mécanismes : - dans le domaine extra cellulaire, elles diminuent l’affinité de l’ACh et interférent dans le couplage de liaison avec le ligand [
9
]. – dans le domaine transmembranaire, elles peuvent réduire l’efficacité du déclenchement [
10
]. – certaines mutations sont pathogènes en combinant plusieurs de ces facteurs [
11
].
Aucune caractéristique électrophysiologique particulière n'est spécifique du FCS. Par conséquent, des études
in vitro
sur micro-électrodes de la JNM sont nécessaires à la mise en évidence de l’anomalie cinétique du RACh. Ceci relève toutefois de la recherche. Cliniquement, une faiblesse sévère est rapportée, avec de graves crises respiratoires menaçant le pronostic vital durant la petite enfance et l’enfance [
12
]. La pyridostigmine (PD) et la 3,4-diaminopyridine (3,4-DAP) ont un effet bénéfique mais qui tend à diminuer avec le temps [
3
]. Nous rapportons les aspects phénotypiques et évolutifs d’une patiente algérienne présentant un FCS (SMC type 1B).
La famille 3
La propositus est une fillette âgée actuellement de 10 ans, issue d’un mariage non consanguin mais avec des parents qui sont originaires du même village. Le début des troubles est noté en période néonatale avec un cri de naissance faible, des difficultés pour téter et une gêne respiratoire. Un ptosis bilatéral s’est installé vers l’âge de quatre mois. Par la suite, elle a présenté de nombreux épisodes de décompensation respiratoire allant parfois jusqu’au coma et nécessitant à chaque fois de la néostigmine injectable. Le déficit moteur s’est aggravé par la suite et est devenu fixe avec un arrêt de la marche survenu vers l’âge de 4 ans. L’examen neurologique (en 2018) a retrouvé une hypomimie faciale, des difficultés pour sourire, un ptosis bilatéral, une hypotonie axiale et segmentaire, un réflexe de toux faible et un déficit moteur proximal coté à 3/5 aux membres inférieurs et 4/5 aux membres supérieurs. Son score myasthénique était de 30/100 et son score QMG à 21/39. Alors que les signes cliniques fluctuaient au cours d'une même journée, la fatigabilité évoluait sur des périodes plus longues pouvant se compter en semaines. L’EMG a retrouvé un décrément net à la SNR de six couples nerf/muscle. Mise sous PD, la patiente s’est améliorée sur certains aspects (ptosis, dysphonie et dysphagie) mais aucune amélioration n’a été objectivée concernant la marche. L’étude génétique a mis en évidence un variant pathogène (p.P121L) déjà rapportée comme responsable d’un FCS. Ce variant est décrit comme provoquant des phénotypes assez sévères avec, notamment, des complications respiratoires et bulbaires [
12
]. Lors d’un passage aux urgences pour une nouvelle crise respiratoire, notre patiente a reçu un bolus de corticoïdes, ce qui a grandement amélioré le ptosis, l’atteinte bulbaire et l’état respiratoire. Au vu cette réponse positive, un traitement d’épreuve (10 mg/jour) a été tenté avec succès et l’évolution a été spectaculaire. La patiente a repris la marche et même la montée des escaliers, alors qu’elle était en fauteuil roulant depuis huit mois.
Cette évolution très positive et inattendue avec un traitement non conventionnel des SMC, nous a d’abord fait penser à l’association d’une affection génétique (SMC type 1B) à une myasthénie auto-immune. Un dosage des anticorps anti RACh et anti MuSK s’est avéré négatif à deux reprises ainsi que la recherche d’une tumeur de la loge thymique. Cette association exceptionnelle a été rapportée avec le gène
CHRNA1
[
13
], le gène
CHRND
[
14
] et le gène
CHRNE
[
15
] ; mais tous les patients avaient au moins une hyperplasie thymique et/ou un anticorps positif. Ces associations rarissimes soulèvent la question d’une possible prédisposition génétique (variants dans une des sous-unités du RACh) à développer une forme auto-immune de myasthénie. De ce fait, des interrogations se posent quant à la possibilité d’une découverte fortuite de l’action d’un traitement non conventionnel sur ce type de SMC, comme cela fut le cas de nombreuses thérapeutiques utilisées dans les SMC, tels que le salbutamol, l’éphédrine, la fluoxétine ou la quinidine. Cependant, aucune publication sur cet effet thérapeutique des corticoïdes dans les SMC n’a été retrouvée.
|
L’éventail phénotypique des SMC est très large, et beaucoup de ces derniers présentent des tableaux cliniques trompeurs. Les mécanismes physiopathologiques qui les sous-tendent peuvent être très complexes. Parmi ceux-ci, les anomalies cinétiques des RACh sont rares, mais peuvent avoir une issue dramatique, quelle que soit la sous-unité du récepteur en cause. Si la prise en charge thérapeutique est assez bien codifiée pour les SCS, elle l’est beaucoup moins pour les FCS. Dans tous les cas, il est important de connaitre les risques d’aggravation des SCS sous anti-cholinestérasiques conventionnels. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Ohno
K
,
Ohkawara
B
,
Shen
XM
et al
.
Clinical and apthologic features of congenital myasthenic syndromes caused by 35 genes. A comprehensive review.
.
Int J Mol Sci
.
2023;
;
24
:
:3730.
.
2.
Richard
P
,
Gaudon
K
,
Haddad
H
,
et al.
The CHRNE 1293insG founder mutation is a frequent cause of congenital myasthenia in North Africa.
.
Neurology
.
2008;
;
71
:
:1967.
–
1972
.
3.
Rodríguez Cruz PM.
.
Palace J, Beeson D. Inherited disorders of the neuromuscular junction: an update.
.
J Neurol
.
2014;
;
261
:
:2234.
–
2243
.
4.
Gomez
CM
,
Maselli
R
,
Staub
J
,
et al.
Novel delta and beta subunit acetylcholine receptor mutations in the slow-channel syndrome demonstrate phenotypic variability.
.
Soc Neurosci Abstr
.
1998;
;
24
:
:284.
.
5.
Finlayson
S
,
Spillane
J
,
Kullmann
DM
,
et al.
Slow channel congenital myasthenic syndrome responsive to a combination of fluoxetine and salbutamol.
.
Muscle Nerve
.
2013;
;
47
:
:279.
–
282
.
6.
Chaouch
A
,
Müller
JS
,
Guergueltcheva
V
,
et al.
A retrospective clinical study of the treatment of slow-channel congenital myasthenic syndrome.
.
J Neurol
.
2012;
;
259
:
:474.
–
481
.
7.
Gomez
CM
,
Maselli
RA
,
Vohra
BP
,
et al.
Novel delta subunit mutation in slow-channel syndrome causes severe weakness by novel mechanisms.
.
Ann Neurol
.
2002;
;
51
:
:102.
–
112
.
8.
Croxen
R
,
Hatton
C
,
Shelley
C
,
et al.
Recessive inheritance and variable penetrance of slow-channel congenital myasthenic syndromes.
.
Neurology
.
2002;
;
72
:
:294.
.
9.
Ohno
K
,
Wang
HL
,
Milone
M
,
et al.
Congenital myasthenic syndrome caused by decreased agonist binding affinity due to a mutation in the acetylcholine receptor epsilon subunit.
.
Neuron
.
1996;
;
17
:
:157.
–
170
.
10.
Wang
HL
,
Milone
M
,
Ohno
K
,
et al.
.
Acetylcholine receptor M3 domain: stereochemical and volume contributions to channel gating.
.
Nat Neurosci
.
,
1999;
2
:
:226.
–
33
.
Erratum in Nat Neurosci.
1999 ; 2 : 485.
11.
Shen
XM
,
Brengman
JM
,
Edvardson
S
,
et al.
Highly fatal fast-channel syndrome caused by AChR ε subunit mutation at the agonist binding site.
.
Neurology
.
2012;
;
79
:
:449.
–
454
.
12.
Palace
J
,
Lashley
D
,
Bailey
S
,
et al.
Clinical features in a series of fast channel congenital myasthenia syndrome.
.
Neuromuscul Disord
.
2012;
;
22
:
:112.
–
117
.
13.
Heckmann
JM
,
Morrison
KE
,
Emeryk-Szajewska
B
,
et al.
Human muscle acetylcholine receptor alpha-subunit gene (CHRNA1) association with autoimmune myasthenia gravis in black, mixed-ancestry and Caucasian subjects.
.
J Autoimmun
.
1996;
;
9
:
:175.
–
180
.
14.
Giraud
M
,
Eymard
B
,
Tranchant
C
,
et al.
Association of the gene encoding the delta-subunit of the muscle acetylcholine receptor (CHRND) with acquired autoimmune myasthenia gravis.
.
Genes Immun
.
2004;
;
5
:
:80.
–
83
.
15.
Santos
E
,
Moreira
I
,
Coutinho
E
,
et al.
Congenital myasthenic syndrome due to mutation in CHRNE gene with clinical worsening and thymic hyperplasia attributed to association with autoimmune-myasthenia gravis.
.
Neuromuscul Disord
.
2015;
;
25
:
:928.
–
931
.
|