Pharmacodépendances et mésusages
2012
| ANALYSE |
13-
Pharmacodépendance : facteurs génétiques et épigénétiques
Lorsqu’on parle de maladies génétiques, on fait référence à des maladies dues à la présence d’un ou plusieurs gènes défectueux, entraînant des dysfonctionnements plus ou moins sévères. En outre, deux situations existent. Soit un gène est clairement identifié comme la cause de la maladie, soit la maladie résulte de l’interaction entre plusieurs gènes et de l’action de facteurs environnementaux, comme c’est le cas pour la pharmacodépendance.
Le risque de développer une dépendance à des substances psychoactives en général et à des médicaments psychotropes en particulier est en effet partiellement lié à des facteurs génétiques. Il n’existe pas un gène spécifique à la dépendance à une substance donnée, mais il est probable que plusieurs gènes influencent les risques, notamment ceux qui sont impliqués dans le codage des sites de reconnaissance (récepteurs, transporteurs...) des médicaments psychotropes. Néanmoins, les facteurs environnementaux (facteurs de stress, maltraitance) qui peuvent se traduire par des modifications épigénétiques, jouent également un large rôle dans le développement de la dépendance.
Études épidémiogénétiques sur mésusage, abus et dépendance aux médicaments psychotropes
On regroupe généralement sous le terme d’épidémiologie génétique les études réalisées chez l’Homme qui cherchent à mettre en évidence des facteurs de risque génétiques associés à la survenue de troubles ou de maladies. Cette épidémiologie peut faire appel à différentes techniques : études d’agrégation familiale, études de jumeaux, études d’association avec des gènes définis a priori, ou études pangénomiques sans a priori, études d’interactions gène-environnement. Ces différentes techniques se développent et devraient contribuer à construire de nouveaux modèles physiopathologiques du mésusage, de l’abus ou de la dépendance aux médicaments psychotropes dans les prochaines années.
Le mésusage de médicaments psychotropes, tout comme l’abus ou la dépendance à ces mêmes médicaments, sont des comportements complexes dont l’étiologie est multifactorielle, mêlant des facteurs sociaux, environnementaux et génétiques. Ces derniers sont polygéniques et à pénétrance variable, impliquant une multitude de gènes chacun jouant un rôle mineur (Kendler et coll., 2006 ; Gorwood et coll., 2007
; Gorwood et coll., 2007 ; Agrawal et Lynskey, 2008
; Agrawal et Lynskey, 2008 ). L’action de ces facteurs n’est pas simplement additive puisqu’ils s’influencent mutuellement. Pour ajouter à la complexité, différents profils génétiques qui déterminent des protéines dont les fonctions n’ont rien en commun peuvent concourir par des chemins physiopathologiques divers à la survenue d’un même trouble ou d’une même maladie.
). L’action de ces facteurs n’est pas simplement additive puisqu’ils s’influencent mutuellement. Pour ajouter à la complexité, différents profils génétiques qui déterminent des protéines dont les fonctions n’ont rien en commun peuvent concourir par des chemins physiopathologiques divers à la survenue d’un même trouble ou d’une même maladie.
 ; Gorwood et coll., 2007
; Gorwood et coll., 2007 ; Agrawal et Lynskey, 2008
; Agrawal et Lynskey, 2008 ). L’action de ces facteurs n’est pas simplement additive puisqu’ils s’influencent mutuellement. Pour ajouter à la complexité, différents profils génétiques qui déterminent des protéines dont les fonctions n’ont rien en commun peuvent concourir par des chemins physiopathologiques divers à la survenue d’un même trouble ou d’une même maladie.
). L’action de ces facteurs n’est pas simplement additive puisqu’ils s’influencent mutuellement. Pour ajouter à la complexité, différents profils génétiques qui déterminent des protéines dont les fonctions n’ont rien en commun peuvent concourir par des chemins physiopathologiques divers à la survenue d’un même trouble ou d’une même maladie.Les études réalisées dans le domaine des addictions s’intéressent moins souvent aux troubles liés à l’usage de médicaments psychotropes isolément qu’aux addictions en général. Dans la mesure où les addictions à des produits licites ou illicites sont très fréquemment associées chez les mêmes individus, il est probable que l’ensemble des troubles addictifs partagent des facteurs de risque génétiques communs. Néanmoins, l’existence de facteurs de risque spécifiques prédisposant au mésusage de médicaments psychotropes, à leur abus ou dépendance n’est pas exclue. Il pourrait notamment s’agir de gènes impliqués dans une variabilité de la pharmacodynamie ou du métabolisme des médicaments en question.
Les facteurs génétiques influencent le risque d’abus et de dépendance à plusieurs niveaux : la prédisposition des individus à s’exposer et expérimenter la substance ; l’installation de la consommation régulière ; ou plus spécifiquement la vulnérabilité à la dépendance (Agrawal et Lynskey, 2008 ; Bierut, 2011
; Bierut, 2011 ). Concernant l’ensemble des addictions, les facteurs génétiques jouent un rôle modéré dans le risque d’usage de substances (26-40 %) et un rôle plus important dans celui de troubles liés à l’usage de substances (28-79 %) (Agrawal et coll., 2005
). Concernant l’ensemble des addictions, les facteurs génétiques jouent un rôle modéré dans le risque d’usage de substances (26-40 %) et un rôle plus important dans celui de troubles liés à l’usage de substances (28-79 %) (Agrawal et coll., 2005 ; Beseler et coll., 2006
; Beseler et coll., 2006 ). De fait, il existe des facteurs génétiques et environnementaux communs à l’usage, l’abus et la dépendance, ainsi que des facteurs spécifiques à l’abus et la dépendance (Agrawal et coll., 2005
). De fait, il existe des facteurs génétiques et environnementaux communs à l’usage, l’abus et la dépendance, ainsi que des facteurs spécifiques à l’abus et la dépendance (Agrawal et coll., 2005 ; Beseler et coll., 2006
; Beseler et coll., 2006 ). En général, il semble que les facteurs environnementaux sont plus impliqués dans l’initiation de la consommation, tandis que les facteurs génétiques ont un rôle important sur la transition entre un usage régulier et le développement d’une addiction (Kendler et coll., 2000
). En général, il semble que les facteurs environnementaux sont plus impliqués dans l’initiation de la consommation, tandis que les facteurs génétiques ont un rôle important sur la transition entre un usage régulier et le développement d’une addiction (Kendler et coll., 2000 ; Bierut, 2011
; Bierut, 2011 ).
).
 ; Bierut, 2011
; Bierut, 2011 ). Concernant l’ensemble des addictions, les facteurs génétiques jouent un rôle modéré dans le risque d’usage de substances (26-40 %) et un rôle plus important dans celui de troubles liés à l’usage de substances (28-79 %) (Agrawal et coll., 2005
). Concernant l’ensemble des addictions, les facteurs génétiques jouent un rôle modéré dans le risque d’usage de substances (26-40 %) et un rôle plus important dans celui de troubles liés à l’usage de substances (28-79 %) (Agrawal et coll., 2005 ; Beseler et coll., 2006
; Beseler et coll., 2006 ). De fait, il existe des facteurs génétiques et environnementaux communs à l’usage, l’abus et la dépendance, ainsi que des facteurs spécifiques à l’abus et la dépendance (Agrawal et coll., 2005
). De fait, il existe des facteurs génétiques et environnementaux communs à l’usage, l’abus et la dépendance, ainsi que des facteurs spécifiques à l’abus et la dépendance (Agrawal et coll., 2005 ; Beseler et coll., 2006
; Beseler et coll., 2006 ). En général, il semble que les facteurs environnementaux sont plus impliqués dans l’initiation de la consommation, tandis que les facteurs génétiques ont un rôle important sur la transition entre un usage régulier et le développement d’une addiction (Kendler et coll., 2000
). En général, il semble que les facteurs environnementaux sont plus impliqués dans l’initiation de la consommation, tandis que les facteurs génétiques ont un rôle important sur la transition entre un usage régulier et le développement d’une addiction (Kendler et coll., 2000 ; Bierut, 2011
; Bierut, 2011 ).
).Les études d’agrégation familiale ont montré une élévation du risque de dépendance chez les apparentés des sujets présentant une dépendance aux substances. Cette accentuation du risque semble spécifique pour chaque substance psychoactive (Agrawal et Lynskey, 2008 ; Bierut, 2011
; Bierut, 2011 ). Ainsi, il pourrait exister des facteurs de risque familiaux qui sous-tendent les troubles liés à l’usage de substances en général et des facteurs de risque familiaux spécifiques à certaines classes de substances psychoactives. Néanmoins, ces études familiales ne permettent pas de distinguer l’influence des facteurs génétiques et environnementaux, à la différence des études d’adoption qui évaluent les facteurs liés aux parents biologiques et les facteurs liés aux parents adoptifs. Ces dernières montrent une élévation du risque de mésusage de substances chez les enfants lorsque les parents biologiques en souffrent (Agrawal et Lynskey, 2008
). Ainsi, il pourrait exister des facteurs de risque familiaux qui sous-tendent les troubles liés à l’usage de substances en général et des facteurs de risque familiaux spécifiques à certaines classes de substances psychoactives. Néanmoins, ces études familiales ne permettent pas de distinguer l’influence des facteurs génétiques et environnementaux, à la différence des études d’adoption qui évaluent les facteurs liés aux parents biologiques et les facteurs liés aux parents adoptifs. Ces dernières montrent une élévation du risque de mésusage de substances chez les enfants lorsque les parents biologiques en souffrent (Agrawal et Lynskey, 2008 ). Ce sur-risque ferait intervenir deux mécanismes : direct et indirect par l’intermédiaire du trouble de la personnalité de type antisocial. Ce trouble a une étiologie partiellement génétique et le fait d’en être atteint constitue en soi un facteur de risque d’usage de produits et d’addiction.
). Ce sur-risque ferait intervenir deux mécanismes : direct et indirect par l’intermédiaire du trouble de la personnalité de type antisocial. Ce trouble a une étiologie partiellement génétique et le fait d’en être atteint constitue en soi un facteur de risque d’usage de produits et d’addiction.
 ; Bierut, 2011
; Bierut, 2011 ). Ainsi, il pourrait exister des facteurs de risque familiaux qui sous-tendent les troubles liés à l’usage de substances en général et des facteurs de risque familiaux spécifiques à certaines classes de substances psychoactives. Néanmoins, ces études familiales ne permettent pas de distinguer l’influence des facteurs génétiques et environnementaux, à la différence des études d’adoption qui évaluent les facteurs liés aux parents biologiques et les facteurs liés aux parents adoptifs. Ces dernières montrent une élévation du risque de mésusage de substances chez les enfants lorsque les parents biologiques en souffrent (Agrawal et Lynskey, 2008
). Ainsi, il pourrait exister des facteurs de risque familiaux qui sous-tendent les troubles liés à l’usage de substances en général et des facteurs de risque familiaux spécifiques à certaines classes de substances psychoactives. Néanmoins, ces études familiales ne permettent pas de distinguer l’influence des facteurs génétiques et environnementaux, à la différence des études d’adoption qui évaluent les facteurs liés aux parents biologiques et les facteurs liés aux parents adoptifs. Ces dernières montrent une élévation du risque de mésusage de substances chez les enfants lorsque les parents biologiques en souffrent (Agrawal et Lynskey, 2008 ). Ce sur-risque ferait intervenir deux mécanismes : direct et indirect par l’intermédiaire du trouble de la personnalité de type antisocial. Ce trouble a une étiologie partiellement génétique et le fait d’en être atteint constitue en soi un facteur de risque d’usage de produits et d’addiction.
). Ce sur-risque ferait intervenir deux mécanismes : direct et indirect par l’intermédiaire du trouble de la personnalité de type antisocial. Ce trouble a une étiologie partiellement génétique et le fait d’en être atteint constitue en soi un facteur de risque d’usage de produits et d’addiction.Les études de jumeaux permettent de distinguer les facteurs génétiques (100 % en commun chez les monozygotes et 50 % chez les dizygotes), les facteurs environnementaux partagés par les jumeaux (100 % en commun) et les facteurs environnementaux individuels (0 % en commun). Elles ont montré que la vulnérabilité génétique pour les addictions repose en grande partie sur des facteurs communs pour le tabac, l’alcool et les autres substances (Kendler et coll., 2003 ; Gorwood et coll., 2007
; Gorwood et coll., 2007 ; Bierut, 2011
; Bierut, 2011 ). Des facteurs génétiques spécifiques des différentes substances auraient une influence modeste sur l’usage (Kendler et coll., 2003
). Des facteurs génétiques spécifiques des différentes substances auraient une influence modeste sur l’usage (Kendler et coll., 2003 ). Ces travaux ont permis d’estimer que 87 % de la variance de la dépendance aux sédatifs reposaient sur des facteurs génétiques (Agrawal et Lynskey, 2008
). Ces travaux ont permis d’estimer que 87 % de la variance de la dépendance aux sédatifs reposaient sur des facteurs génétiques (Agrawal et Lynskey, 2008 ). Dans une étude conduite chez des jumeaux, le mésusage des sédatifs semble se distinguer des autres substances par une moindre participation des facteurs environnementaux partagés à la fois pour le risque d’usage, d’abus et de dépendance. De plus, la participation des facteurs génétiques pour le risque d’abus et de dépendance apparaît plus élevé chez les femmes, alors que la participation des facteurs génétiques pour le risque d’usage est peu différente entre les femmes et les hommes (Agrawal et coll., 2005
). Dans une étude conduite chez des jumeaux, le mésusage des sédatifs semble se distinguer des autres substances par une moindre participation des facteurs environnementaux partagés à la fois pour le risque d’usage, d’abus et de dépendance. De plus, la participation des facteurs génétiques pour le risque d’abus et de dépendance apparaît plus élevé chez les femmes, alors que la participation des facteurs génétiques pour le risque d’usage est peu différente entre les femmes et les hommes (Agrawal et coll., 2005 ). Dans une étude de jumeaux n’incluant que des femmes, l’usage des médicaments sédatifs n’était lié qu’à des facteurs génétiques, de même que la dépendance quelle que soit la substance étudiée (hallucinogènes, psychostimulants, opiacés, médicaments sédatifs) (Kendler et coll., 1999
). Dans une étude de jumeaux n’incluant que des femmes, l’usage des médicaments sédatifs n’était lié qu’à des facteurs génétiques, de même que la dépendance quelle que soit la substance étudiée (hallucinogènes, psychostimulants, opiacés, médicaments sédatifs) (Kendler et coll., 1999 ).
).
 ; Gorwood et coll., 2007
; Gorwood et coll., 2007 ; Bierut, 2011
; Bierut, 2011 ). Des facteurs génétiques spécifiques des différentes substances auraient une influence modeste sur l’usage (Kendler et coll., 2003
). Des facteurs génétiques spécifiques des différentes substances auraient une influence modeste sur l’usage (Kendler et coll., 2003 ). Ces travaux ont permis d’estimer que 87 % de la variance de la dépendance aux sédatifs reposaient sur des facteurs génétiques (Agrawal et Lynskey, 2008
). Ces travaux ont permis d’estimer que 87 % de la variance de la dépendance aux sédatifs reposaient sur des facteurs génétiques (Agrawal et Lynskey, 2008 ). Dans une étude conduite chez des jumeaux, le mésusage des sédatifs semble se distinguer des autres substances par une moindre participation des facteurs environnementaux partagés à la fois pour le risque d’usage, d’abus et de dépendance. De plus, la participation des facteurs génétiques pour le risque d’abus et de dépendance apparaît plus élevé chez les femmes, alors que la participation des facteurs génétiques pour le risque d’usage est peu différente entre les femmes et les hommes (Agrawal et coll., 2005
). Dans une étude conduite chez des jumeaux, le mésusage des sédatifs semble se distinguer des autres substances par une moindre participation des facteurs environnementaux partagés à la fois pour le risque d’usage, d’abus et de dépendance. De plus, la participation des facteurs génétiques pour le risque d’abus et de dépendance apparaît plus élevé chez les femmes, alors que la participation des facteurs génétiques pour le risque d’usage est peu différente entre les femmes et les hommes (Agrawal et coll., 2005 ). Dans une étude de jumeaux n’incluant que des femmes, l’usage des médicaments sédatifs n’était lié qu’à des facteurs génétiques, de même que la dépendance quelle que soit la substance étudiée (hallucinogènes, psychostimulants, opiacés, médicaments sédatifs) (Kendler et coll., 1999
). Dans une étude de jumeaux n’incluant que des femmes, l’usage des médicaments sédatifs n’était lié qu’à des facteurs génétiques, de même que la dépendance quelle que soit la substance étudiée (hallucinogènes, psychostimulants, opiacés, médicaments sédatifs) (Kendler et coll., 1999 ).
).Les études pangénomiques cherchent à corréler la présence d’un trouble ou d’une maladie avec l’ensemble du génome sans a priori de gènes candidats. Cette approche est récente dans les addictions (Li et coll., 2011 ). Elle permet de suggérer des pistes de gènes susceptibles de constituer des facteurs de risque pour les addictions qui sont en dehors des voies métaboliques classiques (gènes impliqués dans la pharmacodynamie ou le métabolisme des substances abusées, dans le métabolisme des amines cérébrales ou dans le fonctionnement des neurones du circuit de récompense, ou associés à des troubles psychiatriques). Aucune étude pangénomique publiée ne s’est précisément intéressée au mésusage ou à l’abus-dépendance aux médicaments psychotropes.
). Elle permet de suggérer des pistes de gènes susceptibles de constituer des facteurs de risque pour les addictions qui sont en dehors des voies métaboliques classiques (gènes impliqués dans la pharmacodynamie ou le métabolisme des substances abusées, dans le métabolisme des amines cérébrales ou dans le fonctionnement des neurones du circuit de récompense, ou associés à des troubles psychiatriques). Aucune étude pangénomique publiée ne s’est précisément intéressée au mésusage ou à l’abus-dépendance aux médicaments psychotropes.
 ). Elle permet de suggérer des pistes de gènes susceptibles de constituer des facteurs de risque pour les addictions qui sont en dehors des voies métaboliques classiques (gènes impliqués dans la pharmacodynamie ou le métabolisme des substances abusées, dans le métabolisme des amines cérébrales ou dans le fonctionnement des neurones du circuit de récompense, ou associés à des troubles psychiatriques). Aucune étude pangénomique publiée ne s’est précisément intéressée au mésusage ou à l’abus-dépendance aux médicaments psychotropes.
). Elle permet de suggérer des pistes de gènes susceptibles de constituer des facteurs de risque pour les addictions qui sont en dehors des voies métaboliques classiques (gènes impliqués dans la pharmacodynamie ou le métabolisme des substances abusées, dans le métabolisme des amines cérébrales ou dans le fonctionnement des neurones du circuit de récompense, ou associés à des troubles psychiatriques). Aucune étude pangénomique publiée ne s’est précisément intéressée au mésusage ou à l’abus-dépendance aux médicaments psychotropes.Enfin, il est important de préciser que les facteurs génétiques et environnementaux interagissent et se modulent entre eux (Gorwood et coll., 2007 ). Dans le domaine des addictions, les études qui, chez l’Homme, modélisent le risque de survenue d’une dépendance en fonction de l’interaction de facteurs d’environnement précoce (notamment les antécédents de traumatismes et de violences subis dans l’enfance) avec la présence de facteurs de risque génétiques sont en plein développement. Les résultats actuellement publiés concernent la dépendance au tabac, à l’alcool, à l’héroïne et à la cocaïne. Il n’existe pas à notre connaissance d’étude d’interactions gènes-environnement dans le mésusage, l’abus ou la dépendance aux traitements psychotropes.
). Dans le domaine des addictions, les études qui, chez l’Homme, modélisent le risque de survenue d’une dépendance en fonction de l’interaction de facteurs d’environnement précoce (notamment les antécédents de traumatismes et de violences subis dans l’enfance) avec la présence de facteurs de risque génétiques sont en plein développement. Les résultats actuellement publiés concernent la dépendance au tabac, à l’alcool, à l’héroïne et à la cocaïne. Il n’existe pas à notre connaissance d’étude d’interactions gènes-environnement dans le mésusage, l’abus ou la dépendance aux traitements psychotropes.
 ). Dans le domaine des addictions, les études qui, chez l’Homme, modélisent le risque de survenue d’une dépendance en fonction de l’interaction de facteurs d’environnement précoce (notamment les antécédents de traumatismes et de violences subis dans l’enfance) avec la présence de facteurs de risque génétiques sont en plein développement. Les résultats actuellement publiés concernent la dépendance au tabac, à l’alcool, à l’héroïne et à la cocaïne. Il n’existe pas à notre connaissance d’étude d’interactions gènes-environnement dans le mésusage, l’abus ou la dépendance aux traitements psychotropes.
). Dans le domaine des addictions, les études qui, chez l’Homme, modélisent le risque de survenue d’une dépendance en fonction de l’interaction de facteurs d’environnement précoce (notamment les antécédents de traumatismes et de violences subis dans l’enfance) avec la présence de facteurs de risque génétiques sont en plein développement. Les résultats actuellement publiés concernent la dépendance au tabac, à l’alcool, à l’héroïne et à la cocaïne. Il n’existe pas à notre connaissance d’étude d’interactions gènes-environnement dans le mésusage, l’abus ou la dépendance aux traitements psychotropes.Cette approche de modélisation des interactions gène-environnement concourant au risque d’addiction s’appuie sur des études réalisées dans des modèles animaux qui montrent que des facteurs environnementaux (séparation précoce d’avec la mère, élevage par des animaux ayant moins de comportement de léchage vis-à-vis des nouveaux-nés...) ont une action sur les comportements de prise de produit une fois les animaux devenus adultes. Ces modifications de comportements s’accompagnent de marques épigénétiques qui favorisent ou répriment l’expression des gènes (Wong et coll., 2011 ).
).
 ).
).Les premiers résultats issus de ce type d’approche commencent à être publiés dans le domaine des addictions. Il a ainsi été démontré que des individus seraient génétiquement plus vulnérables à l’environnement (Gorwood et coll., 2007 ). Un autre exemple d’interaction gène-environnement peut être trouvé dans le fait que l’héritabilité de la dépendance à l’alcool est bien supérieure chez une femme âgée et seule que chez une femme jeune mariée, ou chez des jeunes vivant en zone urbaine que chez des jeunes en zone rurale (Agrawal et Lynskey, 2008
). Un autre exemple d’interaction gène-environnement peut être trouvé dans le fait que l’héritabilité de la dépendance à l’alcool est bien supérieure chez une femme âgée et seule que chez une femme jeune mariée, ou chez des jeunes vivant en zone urbaine que chez des jeunes en zone rurale (Agrawal et Lynskey, 2008 ). Il existerait également des interactions entre les différents facteurs génétiques entre eux.
). Il existerait également des interactions entre les différents facteurs génétiques entre eux.
 ). Un autre exemple d’interaction gène-environnement peut être trouvé dans le fait que l’héritabilité de la dépendance à l’alcool est bien supérieure chez une femme âgée et seule que chez une femme jeune mariée, ou chez des jeunes vivant en zone urbaine que chez des jeunes en zone rurale (Agrawal et Lynskey, 2008
). Un autre exemple d’interaction gène-environnement peut être trouvé dans le fait que l’héritabilité de la dépendance à l’alcool est bien supérieure chez une femme âgée et seule que chez une femme jeune mariée, ou chez des jeunes vivant en zone urbaine que chez des jeunes en zone rurale (Agrawal et Lynskey, 2008 ). Il existerait également des interactions entre les différents facteurs génétiques entre eux.
). Il existerait également des interactions entre les différents facteurs génétiques entre eux.En résumé, tous ces travaux illustrent le fait que si susceptibilité génétique il y a, elle doit être appréhendée dans une dynamique d’interactions entre différents facteurs étiologiques. Il est probable que les développements des techniques d’études épidémiogénétiques apportent dans les prochaines années de nouvelles connaissances sur la physiopathologie des dépendances aux différents traitements psychotropes, notamment en complexifiant les modèles d’interactions des différents facteurs de risque ou de protection.
Facteurs génétiques de la dépendance aux médicaments psychotropes
L’intervention de facteurs génétiques dans la dépendance aux médicaments psychotropes est documentée de façon variée selon le type de médicaments. De façon étonnante, au vu du pouvoir addictogène élevé des benzodiazépines, peu d’études aussi bien cliniques que précliniques se sont intéressées aux différents gènes candidats vis-à-vis d’une sensibilité particulière à cette classe de médicaments anxiolytiques et/ou hypnotiques.
Génétique et susceptibilité aux benzodiazépines
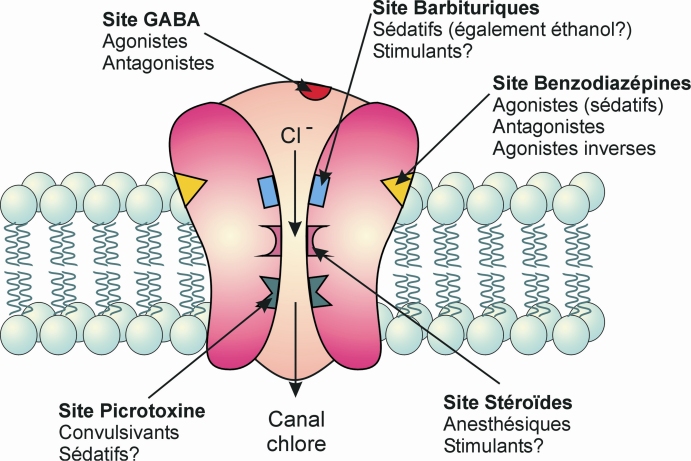
Les benzodiazépines exercent leurs effets pharmacologiques via leur interaction avec un site du récepteur GABAA (figure 13.1 ). Le GABA, principal neurotransmetteur inhibiteur, est en effet reconnu par deux familles de récepteurs, le récepteur ionotrope GABAA et le récepteur métabotrope GABAB.
). Le GABA, principal neurotransmetteur inhibiteur, est en effet reconnu par deux familles de récepteurs, le récepteur ionotrope GABAA et le récepteur métabotrope GABAB.
 ). Le GABA, principal neurotransmetteur inhibiteur, est en effet reconnu par deux familles de récepteurs, le récepteur ionotrope GABAA et le récepteur métabotrope GABAB.
). Le GABA, principal neurotransmetteur inhibiteur, est en effet reconnu par deux familles de récepteurs, le récepteur ionotrope GABAA et le récepteur métabotrope GABAB.Le récepteur GABAA qui intéresse le mode d’action des benzodiazépines, est composé de cinq sous-unités glycoprotéiques dont il existe 6 types : alpha (1 à 6), bêta (1 à 3), gamma (1 à 2), delta, pi, thêta. Ces sous-unités s’organisent autour d’un pore de conduction des ions chlore. Chaque sous-unité comporte un domaine extra-membranaire contenant les sites de fixation du GABA et d’autres effecteurs (stéroïdes, alcool, benzodiazépines, barbituriques, anesthésiques, convulsivants), et un domaine hydrophobe membranaire qui définit le pore.
Après fixation du GABA, un changement de conformation du récepteur est transmis au pore qui le fait passer d’un état fermé à un état ouvert, ce qui a pour conséquence de le rendre perméable aux ions chlore. Ceux-ci pénètrent alors dans la cellule et l’hyperpolarisent.
Certains gènes codant pour des sous-unités des récepteurs GABAA ont été identifiés comme étant des candidats potentiels à l’origine d’une susceptibilité particulière aux effets des benzodiazépines.
Chez la souris, le gène Gabrg2 (gamma-aminobutyric acid A receptor, gamma 2) codant pour la sous-unité GABAA γ2 a été proposé comme candidat à l’origine de différences phénotypiques dans la dépendance aux pouvoirs sédatif et hypnotique des benzodiazépines. En effet, la lignée murine DBA2/J, qui présente des signes sévères de sevrage aux hypnotiques, possède un allèle unique Gabrg2 qui diffère des autres lignées murines par trois résidus nucléotidiques, ce qui se traduit par une séquence protéique particulière (Hood et coll., 2006 ). De même, la variation allélique de ce même gène Gabrg2 a été associée à l’intensité des effets aigus de l’alcool et des anesthésiques (Buck et coll., 1997
). De même, la variation allélique de ce même gène Gabrg2 a été associée à l’intensité des effets aigus de l’alcool et des anesthésiques (Buck et coll., 1997 ), mettant ainsi en évidence l’implication de cette sous-unité dans la sensibilité aux effecteurs du récepteur GABAA, et en particulier aux benzodiazépines.
), mettant ainsi en évidence l’implication de cette sous-unité dans la sensibilité aux effecteurs du récepteur GABAA, et en particulier aux benzodiazépines.
 ). De même, la variation allélique de ce même gène Gabrg2 a été associée à l’intensité des effets aigus de l’alcool et des anesthésiques (Buck et coll., 1997
). De même, la variation allélique de ce même gène Gabrg2 a été associée à l’intensité des effets aigus de l’alcool et des anesthésiques (Buck et coll., 1997 ), mettant ainsi en évidence l’implication de cette sous-unité dans la sensibilité aux effecteurs du récepteur GABAA, et en particulier aux benzodiazépines.
), mettant ainsi en évidence l’implication de cette sous-unité dans la sensibilité aux effecteurs du récepteur GABAA, et en particulier aux benzodiazépines.Les travaux de Korpi et Seeburg (1993 ) avaient montré dès 1993 qu’un variant du gène Gabra6 codant la sous-unité du récepteur GABAA α6 était impliqué aussi bien dans la sensibilité différencielle à l’alcool que dans la réponse au diazépam. De même, des données chez l’Homme ont impliqué la substitution Pro385Ser de la sous-unité α6 dans la sensibilité aux benzodiazépines, les porteurs de l’allèle Ser385 du gène Gabra6 étant moins sensibles à leurs effets sédatifs (Iwata et coll., 1999
) avaient montré dès 1993 qu’un variant du gène Gabra6 codant la sous-unité du récepteur GABAA α6 était impliqué aussi bien dans la sensibilité différencielle à l’alcool que dans la réponse au diazépam. De même, des données chez l’Homme ont impliqué la substitution Pro385Ser de la sous-unité α6 dans la sensibilité aux benzodiazépines, les porteurs de l’allèle Ser385 du gène Gabra6 étant moins sensibles à leurs effets sédatifs (Iwata et coll., 1999 ).
).
 ) avaient montré dès 1993 qu’un variant du gène Gabra6 codant la sous-unité du récepteur GABAA α6 était impliqué aussi bien dans la sensibilité différencielle à l’alcool que dans la réponse au diazépam. De même, des données chez l’Homme ont impliqué la substitution Pro385Ser de la sous-unité α6 dans la sensibilité aux benzodiazépines, les porteurs de l’allèle Ser385 du gène Gabra6 étant moins sensibles à leurs effets sédatifs (Iwata et coll., 1999
) avaient montré dès 1993 qu’un variant du gène Gabra6 codant la sous-unité du récepteur GABAA α6 était impliqué aussi bien dans la sensibilité différencielle à l’alcool que dans la réponse au diazépam. De même, des données chez l’Homme ont impliqué la substitution Pro385Ser de la sous-unité α6 dans la sensibilité aux benzodiazépines, les porteurs de l’allèle Ser385 du gène Gabra6 étant moins sensibles à leurs effets sédatifs (Iwata et coll., 1999 ).
).Les nombreuses formes du gène Gabra2 ont été associées chez l’Homme au risque d’alcoolo-dépendance, sans que des études portant sur la susceptibilité aux effets des benzodiazépines ne soient rapportées (Tian et coll., 2005 ).
).
 ).
).Par ailleurs, d’autres systèmes de neurotransmission ont été impliqués dans les mécanismes sous-tendant la tolérance et la dépendance aux benzodiazépines. C’est le cas du système glutamatergique et en particulier de son récepteur ionotrope AMPA. En effet, la délétion génique de la sous-unité GluR-A de ce récepteur modifie l’adaptation aux effets aigus et chroniques des benzodiazépines. Les souris dépourvues de ce récepteur développent une moindre tolérance motrice vis-à-vis du flurazépam (Aitta-Aho et coll., 2009 ).
).
 ).
).Génétique et susceptibilité aux opiacés
En regard de ces quelques études portant sur la susceptibilité génétique vis-à-vis des benzodiazépines, de nombreux travaux se sont intéressés aux facteurs génétiques de la pharmacodépendance en lien avec les opiacés, et en particulier la sensibilité à la méthadone. Il existe en effet une très large variabilité interindividuelle de la concentration sanguine de méthadone pour une dose administrée donnée, et donc pour son effet thérapeutique. Le polymorphisme des gènes codant le transporteur de la méthadone, les enzymes de son métabolisme ou encore ses récepteurs peut – du moins en partie – expliquer cette variabilité.
La méthadone est le substrat de la glycoprotéine P (P-gp) 170 (transporteur d’efflux des xénobiotiques) codée par le gène Abcb1b. Plusieurs stratégies ont conduit à démontrer de façon claire une association entre les variants du gène Abcb1b et les doses requises de méthadone pour atteindre l’efficacité thérapeutique chez les patients héroïnomanes en substitution.
Le gène Abcb1b est très polymorphe, avec plus de 100 SNPs (Single Nucleotide Polymorphism) identifiés aussi bien dans ses régions codantes que non-codantes. Cinq SNPs sont fréquemment observés et parmi eux, les variants 3435C>T et 2677G>T sont associés à une diminution de l’expression de P-gp 170 et par conséquent à une augmentation de la concentration sanguine de méthadone (Li et coll., 2008 ). Au niveau fonctionnel, les SNPs 1236C>T et 3435C>T seraient impliqués dans la différence entre les doses thérapeutiques « hautes » versus « basses » de méthadone nécessaires à la stabilisation clinique du patient (Levran et coll., 2008
). Au niveau fonctionnel, les SNPs 1236C>T et 3435C>T seraient impliqués dans la différence entre les doses thérapeutiques « hautes » versus « basses » de méthadone nécessaires à la stabilisation clinique du patient (Levran et coll., 2008 ; Li et coll., 2008
; Li et coll., 2008 ; Yuferov et coll., 2010
; Yuferov et coll., 2010 ). Néanmoins, même s’il existe un faisceau d’arguments en faveur de la relation entre les variants Abcb1b et la sensibilité à la méthadone, ces résultats doivent être analysés en fonction de l’ethnicité de la population concernée.
). Néanmoins, même s’il existe un faisceau d’arguments en faveur de la relation entre les variants Abcb1b et la sensibilité à la méthadone, ces résultats doivent être analysés en fonction de l’ethnicité de la population concernée.
 ). Au niveau fonctionnel, les SNPs 1236C>T et 3435C>T seraient impliqués dans la différence entre les doses thérapeutiques « hautes » versus « basses » de méthadone nécessaires à la stabilisation clinique du patient (Levran et coll., 2008
). Au niveau fonctionnel, les SNPs 1236C>T et 3435C>T seraient impliqués dans la différence entre les doses thérapeutiques « hautes » versus « basses » de méthadone nécessaires à la stabilisation clinique du patient (Levran et coll., 2008 ; Li et coll., 2008
; Li et coll., 2008 ; Yuferov et coll., 2010
; Yuferov et coll., 2010 ). Néanmoins, même s’il existe un faisceau d’arguments en faveur de la relation entre les variants Abcb1b et la sensibilité à la méthadone, ces résultats doivent être analysés en fonction de l’ethnicité de la population concernée.
). Néanmoins, même s’il existe un faisceau d’arguments en faveur de la relation entre les variants Abcb1b et la sensibilité à la méthadone, ces résultats doivent être analysés en fonction de l’ethnicité de la population concernée.Les données établies chez l’Homme sont corroborées par des travaux effectués chez le rongeur. Chez la souris, l’utilisation de carte haplotype, pouvant servir à sélectionner un ensemble optimal de sites polymorphes à nucléotide unique, a clairement démontré que les variants du gène Abcb1b pouvaient expliquer les différences interlignées de la sensibilité à la morphine – opiacé analgésique – dans un modèle d’hyperalgie (Liang et coll., 2006 ). Par ailleurs, chez les souris n’exprimant pas la protéine P-gp, la concentration cérébrale de méthadone est augmentée ainsi que ses effets anti-nociceptifs (Liang et coll., 2006
). Par ailleurs, chez les souris n’exprimant pas la protéine P-gp, la concentration cérébrale de méthadone est augmentée ainsi que ses effets anti-nociceptifs (Liang et coll., 2006 ).
).
 ). Par ailleurs, chez les souris n’exprimant pas la protéine P-gp, la concentration cérébrale de méthadone est augmentée ainsi que ses effets anti-nociceptifs (Liang et coll., 2006
). Par ailleurs, chez les souris n’exprimant pas la protéine P-gp, la concentration cérébrale de méthadone est augmentée ainsi que ses effets anti-nociceptifs (Liang et coll., 2006 ).
).D’autres cibles ont été étudiées dans la réponse à la méthadone. C’est le cas des cytochromes P450 (CYP) (Howard et coll., 2002 ). Plusieurs travaux ont montré que CYP3A4 et CYP2B6 étaient les isoformes majoritaires impliquées dans le métabolisme de la méthadone. Les porteurs du variant CYP3A4 *1B nécessitent une dose moins importante de méthadone, de même que les porteurs de l’allèle 6 de CYP2B6 (Li et coll., 2008
). Plusieurs travaux ont montré que CYP3A4 et CYP2B6 étaient les isoformes majoritaires impliquées dans le métabolisme de la méthadone. Les porteurs du variant CYP3A4 *1B nécessitent une dose moins importante de méthadone, de même que les porteurs de l’allèle 6 de CYP2B6 (Li et coll., 2008 ; Yuferov et coll., 2010
; Yuferov et coll., 2010 ).
).
 ). Plusieurs travaux ont montré que CYP3A4 et CYP2B6 étaient les isoformes majoritaires impliquées dans le métabolisme de la méthadone. Les porteurs du variant CYP3A4 *1B nécessitent une dose moins importante de méthadone, de même que les porteurs de l’allèle 6 de CYP2B6 (Li et coll., 2008
). Plusieurs travaux ont montré que CYP3A4 et CYP2B6 étaient les isoformes majoritaires impliquées dans le métabolisme de la méthadone. Les porteurs du variant CYP3A4 *1B nécessitent une dose moins importante de méthadone, de même que les porteurs de l’allèle 6 de CYP2B6 (Li et coll., 2008 ; Yuferov et coll., 2010
; Yuferov et coll., 2010 ).
).Enfin, le polymorphisme du gène OPRM1 codant le récepteur μ des opiacés joue également un rôle majeur dans la réponse à la méthadone. Une centaine de variants ont été identifiés pour ce gène OPRM1, dont une vingtaine produisant une modification d’acides aminés. Le variant 118A>G est le plus fréquent. Malgré quelques disparités dans les données de la littérature, il semble que le variant 118A>G diminue les effets de la morphine (myosis, analgésie, dépression respiratoire) et de la méthadone (myosis) (Li et coll., 2008 ).
).
 ).
).En outre, il faut souligner que la méthadone se lie également sur le récepteur glutamatergique NMDA, mais, à ce jour, aucune relation n’a été établie entre un polymorphisme génétique du gène codant le récepteur NMDA et la réponse à la méthadone.
Par ailleurs, des études d’association du génome (Genome-Wide Association Studies, GWAS), technique qui consiste à rechercher les polymorphismes nucléotidiques uniques (SNPs) chez les patients versus témoins, ont été conduites chez des dépendants aux opiacés traités par la méthadone. Les données obtenues sont souvent hétérogènes, variant d’une population ethnique à une autre et d’un sexe à l’autre. De ces études, ressortent néanmoins des gènes d’intérêt tels que NRXN3 qui code la neurexin 3 (protéine d’adhésion présynaptique impliquée dans la juxtaposition des synapses), déjà identifié comme un gène candidat potentiel lié à l’addiction (Hishimoto et coll., 2007 ; Lachman et coll., 2007
; Lachman et coll., 2007 ; Ardayfio et coll., 2010
; Ardayfio et coll., 2010 ). Cette même approche méthodologique a montré par ailleurs une association de 5 gènes avec le développement de l’addiction à l’héroïne, ces gènes étant ceux codant le récepteur μ des opiacés, les récepteurs mGluR6 et mGluR8 du glutamate, le récepteur nucléaire NR4A2, et le photorécepteur cryptochrome 1 (Yuferov et coll., 2010
). Cette même approche méthodologique a montré par ailleurs une association de 5 gènes avec le développement de l’addiction à l’héroïne, ces gènes étant ceux codant le récepteur μ des opiacés, les récepteurs mGluR6 et mGluR8 du glutamate, le récepteur nucléaire NR4A2, et le photorécepteur cryptochrome 1 (Yuferov et coll., 2010 ).
).
 ; Lachman et coll., 2007
; Lachman et coll., 2007 ; Ardayfio et coll., 2010
; Ardayfio et coll., 2010 ). Cette même approche méthodologique a montré par ailleurs une association de 5 gènes avec le développement de l’addiction à l’héroïne, ces gènes étant ceux codant le récepteur μ des opiacés, les récepteurs mGluR6 et mGluR8 du glutamate, le récepteur nucléaire NR4A2, et le photorécepteur cryptochrome 1 (Yuferov et coll., 2010
). Cette même approche méthodologique a montré par ailleurs une association de 5 gènes avec le développement de l’addiction à l’héroïne, ces gènes étant ceux codant le récepteur μ des opiacés, les récepteurs mGluR6 et mGluR8 du glutamate, le récepteur nucléaire NR4A2, et le photorécepteur cryptochrome 1 (Yuferov et coll., 2010 ).
).D’autres acteurs ont été étudiés dans le domaine de la dépendance aux opiacés et la réponse à la méthadone. Le rôle des récepteurs des monoamines a été souligné, en particulier ceux du système dopaminergique (Doehring et coll., 2009 ). Considérant le rôle-clé du récepteur dopaminergique D2 (DRD2) dans le comportement addictif, la modulation de son fonctionnement par les variants du gène DRD2 a été particulièrement étudiée. Les études de Doehring et coll. (2009
). Considérant le rôle-clé du récepteur dopaminergique D2 (DRD2) dans le comportement addictif, la modulation de son fonctionnement par les variants du gène DRD2 a été particulièrement étudiée. Les études de Doehring et coll. (2009 ) et de Crettol et coll. (2008
) et de Crettol et coll. (2008 ) montrent respectivement une association fonctionnelle du SNP DRD2 rs6275C>T et du SNP DRD2 957C>T avec la dose de méthadone nécessaire au traitement. Outre les variants du gène DRD2, il faut aussi considérer les variants de gène appartenant aux kinases sérine/thréonine impliquées dans la transduction du signal D2.
) montrent respectivement une association fonctionnelle du SNP DRD2 rs6275C>T et du SNP DRD2 957C>T avec la dose de méthadone nécessaire au traitement. Outre les variants du gène DRD2, il faut aussi considérer les variants de gène appartenant aux kinases sérine/thréonine impliquées dans la transduction du signal D2.
 ). Considérant le rôle-clé du récepteur dopaminergique D2 (DRD2) dans le comportement addictif, la modulation de son fonctionnement par les variants du gène DRD2 a été particulièrement étudiée. Les études de Doehring et coll. (2009
). Considérant le rôle-clé du récepteur dopaminergique D2 (DRD2) dans le comportement addictif, la modulation de son fonctionnement par les variants du gène DRD2 a été particulièrement étudiée. Les études de Doehring et coll. (2009 ) et de Crettol et coll. (2008
) et de Crettol et coll. (2008 ) montrent respectivement une association fonctionnelle du SNP DRD2 rs6275C>T et du SNP DRD2 957C>T avec la dose de méthadone nécessaire au traitement. Outre les variants du gène DRD2, il faut aussi considérer les variants de gène appartenant aux kinases sérine/thréonine impliquées dans la transduction du signal D2.
) montrent respectivement une association fonctionnelle du SNP DRD2 rs6275C>T et du SNP DRD2 957C>T avec la dose de méthadone nécessaire au traitement. Outre les variants du gène DRD2, il faut aussi considérer les variants de gène appartenant aux kinases sérine/thréonine impliquées dans la transduction du signal D2.La variabilité de l’expression du gène du facteur trophique BDNF (Brain-Derived Neurotrophic Factor) a été également mise en cause dans la réponse thérapeutique à la méthadone. Il a été montré que parmi les 21 SNPs de BDNF, 6 étaient associés à l’effet de la méthadone, avec pour conséquence une faible réponse des porteurs de l’haplotype CCGCCG (de Cid et coll., 2008 ).
).
 ).
).Enfin, le polymorphisme du gène KCNJ6 qui code le canal potassique Kir3.2 ou GIRK2 module les effets des opioïdes et la réponse à la méthadone, puisqu’une plus forte dose journalière est nécessaire aux porteurs du génotype KCNJ6 rs2070995 AA (Lotsch et coll., 2010 ).
).
 ).
).Les polymorphismes de certains gènes-clés de la régulation monoaminergique ont été clairement impliqués dans le développement des addictions aux opiacés et à la cocaïne et leur traitement. La catéchol-O-méthyltransférase (COMT) exerce un rôle important dans le métabolisme des catécholamines (dont la dopamine, fortement impliquée dans l’addiction) et l’allèle 158Val de son gène est associé avec différents comportements addictifs dans différentes populations ethniques (Yuferov et coll., 2010 ). En ce qui concerne les enzymes de synthèse de la sérotonine (tryptophane hydroxylases TPH1 et TPH2), la situation est plus complexe car l’association entre variants de gènes et addiction diffère selon les groupes ethniques et le produit (Yuferov et coll., 2010
). En ce qui concerne les enzymes de synthèse de la sérotonine (tryptophane hydroxylases TPH1 et TPH2), la situation est plus complexe car l’association entre variants de gènes et addiction diffère selon les groupes ethniques et le produit (Yuferov et coll., 2010 ). Néanmoins, ces études ne concernent pas spécifiquement l’addiction aux médicaments psychotropes.
). Néanmoins, ces études ne concernent pas spécifiquement l’addiction aux médicaments psychotropes.
 ). En ce qui concerne les enzymes de synthèse de la sérotonine (tryptophane hydroxylases TPH1 et TPH2), la situation est plus complexe car l’association entre variants de gènes et addiction diffère selon les groupes ethniques et le produit (Yuferov et coll., 2010
). En ce qui concerne les enzymes de synthèse de la sérotonine (tryptophane hydroxylases TPH1 et TPH2), la situation est plus complexe car l’association entre variants de gènes et addiction diffère selon les groupes ethniques et le produit (Yuferov et coll., 2010 ). Néanmoins, ces études ne concernent pas spécifiquement l’addiction aux médicaments psychotropes.
). Néanmoins, ces études ne concernent pas spécifiquement l’addiction aux médicaments psychotropes.Enfin, des gènes codant d’autres protéines semblent avoir une place non négligeable dans le développement de l’addiction aux opiacés. C’est le cas de gènes codant la protéine régulatrice des protéines G, RGS4, qui agit comme régulateur négatif de la récompense à la morphine (Han et coll., 2010 ), ou encore la cytokine IL-1β dont les variants 511C et 31T sont plus fréquents dans une population de dépendants aux opiacés que chez les sujets sains (Liu et coll., 2009
), ou encore la cytokine IL-1β dont les variants 511C et 31T sont plus fréquents dans une population de dépendants aux opiacés que chez les sujets sains (Liu et coll., 2009 ).
).
 ), ou encore la cytokine IL-1β dont les variants 511C et 31T sont plus fréquents dans une population de dépendants aux opiacés que chez les sujets sains (Liu et coll., 2009
), ou encore la cytokine IL-1β dont les variants 511C et 31T sont plus fréquents dans une population de dépendants aux opiacés que chez les sujets sains (Liu et coll., 2009 ).
).Génétique et susceptibilité aux psychostimulants
En ce qui concerne la dépendance aux psychostimulants, les études effectuées sur des modèles de souris transgéniques ont montré que de nombreux éléments des systèmes dopaminergique et sérotoninergique sont impliqués, que ce soient les récepteurs dopaminergiques, les transporteurs de la dopamine et de la sérotonine, ou encore les récepteurs de la sérotonine 5-HT1A, 5-HT1B, 5-HT2A ou 5-HT2C (Chen et coll., 2005 ; Zhu et Reith, 2008
; Zhu et Reith, 2008 ; Sora et coll., 2010
; Sora et coll., 2010 ). Toutefois, là encore, la plupart des travaux ont analysé la relation entre des variants géniques de ces cibles moléculaires et les effets des drogues d’abus que sont la cocaïne, les amphétamines, la méthamphétamine, la MDMA (ou ecstasy) et peu de travaux se sont intéressés spécifiquement aux médicaments psychotropes.
). Toutefois, là encore, la plupart des travaux ont analysé la relation entre des variants géniques de ces cibles moléculaires et les effets des drogues d’abus que sont la cocaïne, les amphétamines, la méthamphétamine, la MDMA (ou ecstasy) et peu de travaux se sont intéressés spécifiquement aux médicaments psychotropes.
 ; Zhu et Reith, 2008
; Zhu et Reith, 2008 ; Sora et coll., 2010
; Sora et coll., 2010 ). Toutefois, là encore, la plupart des travaux ont analysé la relation entre des variants géniques de ces cibles moléculaires et les effets des drogues d’abus que sont la cocaïne, les amphétamines, la méthamphétamine, la MDMA (ou ecstasy) et peu de travaux se sont intéressés spécifiquement aux médicaments psychotropes.
). Toutefois, là encore, la plupart des travaux ont analysé la relation entre des variants géniques de ces cibles moléculaires et les effets des drogues d’abus que sont la cocaïne, les amphétamines, la méthamphétamine, la MDMA (ou ecstasy) et peu de travaux se sont intéressés spécifiquement aux médicaments psychotropes.La délétion de ces éléments-clés de la transmission monoaminergique diminue en général le comportement lié à la prise de psychostimulants chez la souris, et ceci est particulièrement vrai pour le méthylphénidate. Utilisée dans le cadre du traitement de l’hyperactivité avec troubles attentionnels chez l’enfant, cette molécule bloque de manière non spécifique la recapture des monoamines, avec une meilleure affinité pour les transporteurs de la noradrénaline et de la dopamine que pour ceux de la sérotonine. Les études précliniques montrent que chez les souris dépourvues de transporteur de la dopamine (DAT), certaines réponses comportementales au méthylphénidate sont altérées. En ce qui concerne les effets récompensants de cette substance, ils ne sont modifiés que chez des souris dont l’expression du DAT a été supprimée pendant la période développementale (Sora et coll., 2010 ).
).
 ).
).En résumé, les études citées plus haut montrent que, comme pour les drogues d’abus, plusieurs variants de gènes sont impliqués dans la survenue d’une dépendance aux médicaments psychotropes. Néanmoins, et même s’il existe des arguments montrant la relation entre variants de gènes et sensibilité à des médicaments psychotropes, les études doivent être approfondies et confirmées. En ce qui concerne l’aspect clinique, les études nécessitent d’être évaluées précisément, par exemple avec la prise en compte rigoureuse de l’ethnicité de la population concernée.
Toutefois, les données recueillies par la seule analyse génétique de la pharmacodépendance ne suffisent pas à obtenir une vision claire et convergente de l’implication d’un gène donné dans cette pathologie. Récemment, les études consacrées au rôle des mécanismes épigénétiques ont mis en lumière l’importance de l’environnement dans l’expression de gènes impliqués dans les phénomènes de dépendance.
Facteurs épigénétiques de la dépendance aux médicaments psychotropes
Des travaux ont récemment montré qu’un lien pouvait être établi entre une modification environnementale précoce, la prise d’une substance d’abus et l’expression de gènes à l’âge adulte. C’est le cas par exemple de l’effet de la séparation maternelle dans les deux premières semaines de vie chez le rat. Cet évènement précoce diminue le seuil d’appétence pour la morphine et l’expression du gène codant la pré-pro enképhaline chez le rat devenu adulte (Morel et coll., 2009 ). C’est également le cas chez l’Homme, comme rapporté par McGowan et coll. (2009
). C’est également le cas chez l’Homme, comme rapporté par McGowan et coll. (2009 ). Cette étude montre en effet une plus forte proportion de consommateurs d’alcool et de drogues chez des individus suicidés qui avaient été abusés sexuellement dans leur enfance par rapport à des individus suicidés qui n’avaient pas subi de sévices sexuels. Là encore, l’expression de récepteurs, ici les récepteurs des glucocorticoïdes, est diminuée et la méthylation du promoteur du gène codant ces récepteurs est augmentée, démontrant ainsi l’implication de régulations d’ordre épigénétique suite à un évènement traumatique subi pendant la petite enfance.
). Cette étude montre en effet une plus forte proportion de consommateurs d’alcool et de drogues chez des individus suicidés qui avaient été abusés sexuellement dans leur enfance par rapport à des individus suicidés qui n’avaient pas subi de sévices sexuels. Là encore, l’expression de récepteurs, ici les récepteurs des glucocorticoïdes, est diminuée et la méthylation du promoteur du gène codant ces récepteurs est augmentée, démontrant ainsi l’implication de régulations d’ordre épigénétique suite à un évènement traumatique subi pendant la petite enfance.
 ). C’est également le cas chez l’Homme, comme rapporté par McGowan et coll. (2009
). C’est également le cas chez l’Homme, comme rapporté par McGowan et coll. (2009 ). Cette étude montre en effet une plus forte proportion de consommateurs d’alcool et de drogues chez des individus suicidés qui avaient été abusés sexuellement dans leur enfance par rapport à des individus suicidés qui n’avaient pas subi de sévices sexuels. Là encore, l’expression de récepteurs, ici les récepteurs des glucocorticoïdes, est diminuée et la méthylation du promoteur du gène codant ces récepteurs est augmentée, démontrant ainsi l’implication de régulations d’ordre épigénétique suite à un évènement traumatique subi pendant la petite enfance.
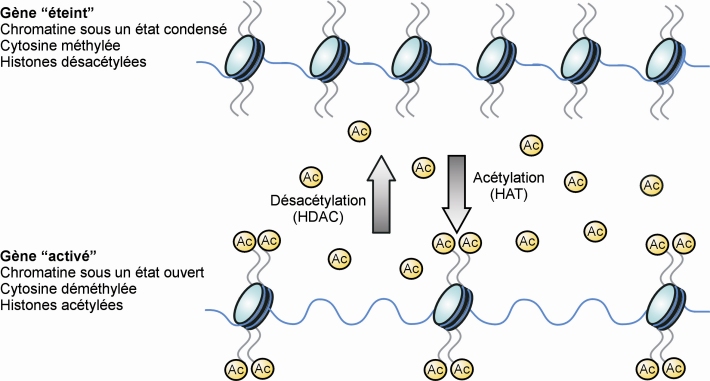
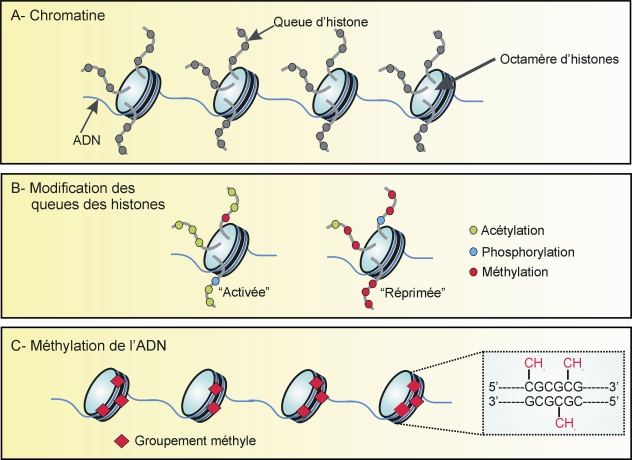
). Cette étude montre en effet une plus forte proportion de consommateurs d’alcool et de drogues chez des individus suicidés qui avaient été abusés sexuellement dans leur enfance par rapport à des individus suicidés qui n’avaient pas subi de sévices sexuels. Là encore, l’expression de récepteurs, ici les récepteurs des glucocorticoïdes, est diminuée et la méthylation du promoteur du gène codant ces récepteurs est augmentée, démontrant ainsi l’implication de régulations d’ordre épigénétique suite à un évènement traumatique subi pendant la petite enfance.Le terme « épigénétique » définit en effet les modifications transmissibles et réversibles de l’expression des gènes ne s’accompagnant pas de changements de séquences nucléotidiques au niveau de l’ADN. L’expression d’un gène peut être régulée par différents facteurs, parmi lesquels l’état compacté ou décompacté de la chromatine (figure 13.2 ).
).
 ).
).L’état de la chromatine est contrôlé par plusieurs facteurs (figure 13.3 ), dont les modifications des histones liées à l’ADN (figure 13.3 A et B
), dont les modifications des histones liées à l’ADN (figure 13.3 A et B ). Ces modifications aboutissant à une réorganisation de la structure chromatinienne et jouant un rôle dans la régulation transcriptionnelle, elles constituent un phénomène combinatoire fondamental. Le « code histone » résulte de la combinaison des modifications de la queue des histones. Contrairement au code génétique qui est permanent sur le génome, le code histone est temporel. Ces modifications post-traductionnelles telles que l’acétylation, la méthylation, la phosphorylation ou l’ubiquitinylation des histones nécessitent l’action d’enzymes spécifiques modifiant l’extrémité N-terminale des histones.
). Ces modifications aboutissant à une réorganisation de la structure chromatinienne et jouant un rôle dans la régulation transcriptionnelle, elles constituent un phénomène combinatoire fondamental. Le « code histone » résulte de la combinaison des modifications de la queue des histones. Contrairement au code génétique qui est permanent sur le génome, le code histone est temporel. Ces modifications post-traductionnelles telles que l’acétylation, la méthylation, la phosphorylation ou l’ubiquitinylation des histones nécessitent l’action d’enzymes spécifiques modifiant l’extrémité N-terminale des histones.
 ), dont les modifications des histones liées à l’ADN (figure 13.3 A et B
), dont les modifications des histones liées à l’ADN (figure 13.3 A et B ). Ces modifications aboutissant à une réorganisation de la structure chromatinienne et jouant un rôle dans la régulation transcriptionnelle, elles constituent un phénomène combinatoire fondamental. Le « code histone » résulte de la combinaison des modifications de la queue des histones. Contrairement au code génétique qui est permanent sur le génome, le code histone est temporel. Ces modifications post-traductionnelles telles que l’acétylation, la méthylation, la phosphorylation ou l’ubiquitinylation des histones nécessitent l’action d’enzymes spécifiques modifiant l’extrémité N-terminale des histones.
). Ces modifications aboutissant à une réorganisation de la structure chromatinienne et jouant un rôle dans la régulation transcriptionnelle, elles constituent un phénomène combinatoire fondamental. Le « code histone » résulte de la combinaison des modifications de la queue des histones. Contrairement au code génétique qui est permanent sur le génome, le code histone est temporel. Ces modifications post-traductionnelles telles que l’acétylation, la méthylation, la phosphorylation ou l’ubiquitinylation des histones nécessitent l’action d’enzymes spécifiques modifiant l’extrémité N-terminale des histones.La méthylation de ces protéines au niveau de résidus lysine ou arginine induit une fermeture de la chromatine. À l’inverse, l’acétylation de lysine entraîne une ouverture de la chromatine, facilitant ainsi la transcription.
L’état de la chromatine est également régulé par la méthylation de l’ADN au niveau des résidus cytosine des îlots CpG qui se trouvent essentiellement dans les régions proximales des promoteurs des gènes (figure 13.3C ). Une faible méthylation se traduit le plus souvent par une forte expression du gène (activation transcriptionnelle), alors qu’un haut niveau de méthylation inactive le gène (répression transcriptionnelle). Cette méthylation s’effectue par les enzymes spécifiques appelées DNMTs (DNA Méthyltransférases). Le dérèglement de la méthylation des îlots CpG est associé à un certain nombre de pathologies. Les origines de cette dérégulation sont mal connues mais pourraient faire intervenir des produits toxiques, certains régimes alimentaires (déficit en acide folique ou en vitamine B12, par exemple), ou encore des évènements de vie précoces négatifs (tels que le stress chronique).
). Une faible méthylation se traduit le plus souvent par une forte expression du gène (activation transcriptionnelle), alors qu’un haut niveau de méthylation inactive le gène (répression transcriptionnelle). Cette méthylation s’effectue par les enzymes spécifiques appelées DNMTs (DNA Méthyltransférases). Le dérèglement de la méthylation des îlots CpG est associé à un certain nombre de pathologies. Les origines de cette dérégulation sont mal connues mais pourraient faire intervenir des produits toxiques, certains régimes alimentaires (déficit en acide folique ou en vitamine B12, par exemple), ou encore des évènements de vie précoces négatifs (tels que le stress chronique).
 ). Une faible méthylation se traduit le plus souvent par une forte expression du gène (activation transcriptionnelle), alors qu’un haut niveau de méthylation inactive le gène (répression transcriptionnelle). Cette méthylation s’effectue par les enzymes spécifiques appelées DNMTs (DNA Méthyltransférases). Le dérèglement de la méthylation des îlots CpG est associé à un certain nombre de pathologies. Les origines de cette dérégulation sont mal connues mais pourraient faire intervenir des produits toxiques, certains régimes alimentaires (déficit en acide folique ou en vitamine B12, par exemple), ou encore des évènements de vie précoces négatifs (tels que le stress chronique).
). Une faible méthylation se traduit le plus souvent par une forte expression du gène (activation transcriptionnelle), alors qu’un haut niveau de méthylation inactive le gène (répression transcriptionnelle). Cette méthylation s’effectue par les enzymes spécifiques appelées DNMTs (DNA Méthyltransférases). Le dérèglement de la méthylation des îlots CpG est associé à un certain nombre de pathologies. Les origines de cette dérégulation sont mal connues mais pourraient faire intervenir des produits toxiques, certains régimes alimentaires (déficit en acide folique ou en vitamine B12, par exemple), ou encore des évènements de vie précoces négatifs (tels que le stress chronique).Des hypothèses émergentes suggèrent que ces altérations épigénétiques, incluant la méthylation de l’ADN et les modifications des histones, sont des mécanismes importants sous-tendant la dépendance et la réponse neurobiologique aux substances addictives, que ce soit l’alcool, la nicotine, la cocaïne, les amphétamines ou les opiacés. La dépendance à différents types de substances implique des adaptations liées à la plasticité neuronale dans le circuit de récompense. Ces adaptations sont médiées en partie par des modifications épigénétiques de l’expression de certains gènes. Ainsi, la cocaïne augmente l’acétylation de l’histone H3 au niveau des promoteurs de certains gènes comme celui du BDNF (Renthal et coll., 2008 ). Néanmoins, elle induit aussi des modifications épigénétiques particulières qui dépendent de la fréquence d’administration de la drogue. Après une administration unique à dose élevée, ce sont les histones H4 qui sont acétylées, alors qu’à la suite d’une administration chronique, les histones H3 sont acétylées. Certains gènes sont activés dans les deux cas. Les gènes activés par la cocaïne peuvent aussi être activés par d’autres drogues et possiblement par des médicaments psychotropes à potentiel d’abus (Tsankova et coll., 2007
). Néanmoins, elle induit aussi des modifications épigénétiques particulières qui dépendent de la fréquence d’administration de la drogue. Après une administration unique à dose élevée, ce sont les histones H4 qui sont acétylées, alors qu’à la suite d’une administration chronique, les histones H3 sont acétylées. Certains gènes sont activés dans les deux cas. Les gènes activés par la cocaïne peuvent aussi être activés par d’autres drogues et possiblement par des médicaments psychotropes à potentiel d’abus (Tsankova et coll., 2007 ).
).
 ). Néanmoins, elle induit aussi des modifications épigénétiques particulières qui dépendent de la fréquence d’administration de la drogue. Après une administration unique à dose élevée, ce sont les histones H4 qui sont acétylées, alors qu’à la suite d’une administration chronique, les histones H3 sont acétylées. Certains gènes sont activés dans les deux cas. Les gènes activés par la cocaïne peuvent aussi être activés par d’autres drogues et possiblement par des médicaments psychotropes à potentiel d’abus (Tsankova et coll., 2007
). Néanmoins, elle induit aussi des modifications épigénétiques particulières qui dépendent de la fréquence d’administration de la drogue. Après une administration unique à dose élevée, ce sont les histones H4 qui sont acétylées, alors qu’à la suite d’une administration chronique, les histones H3 sont acétylées. Certains gènes sont activés dans les deux cas. Les gènes activés par la cocaïne peuvent aussi être activés par d’autres drogues et possiblement par des médicaments psychotropes à potentiel d’abus (Tsankova et coll., 2007 ).
).De même, le rôle de MeCP2 (methyl CpG-binding protein-2, facteur de répression de la transcription de différents gènes impliqués dans la neuroplasticité) dans la réponse comportementale aux psychostimulants a été clairement établi par deux études récentes. Les psychostimulants comme l’amphétamine induisent en effet la phosphorylation de MeCP2, altérant ainsi ses fonctions de répresseur transcriptionnel (Deng et coll., 2010 ; Im et coll., 2010
; Im et coll., 2010 ).
).
 ; Im et coll., 2010
; Im et coll., 2010 ).
).Toutefois, la majorité de ces travaux ont été réalisés chez les rongeurs et peu de données sont disponibles chez l’Homme où la plupart des études ont trait à la régulation épigénétique de certains gènes en relation avec l’alcool et/ou la nicotine. Néanmoins, l’étude de Yuferov et coll. (2010 ) a comparé la méthylation d’îlots CpG du promoteur du gène OPRM1 codant le récepteur μ des opiacés dans des lymphocytes d’héroïnomanes stabilisés à la méthadone avec celle de sujets sains. Ces travaux montrent une hyperméthylation au niveau de deux des 16 sites CpG du promoteur du gène OPRM1, réduisant probablement son expression. Cependant, cette étude doit être complétée afin de savoir si cette hyperméthylation est due à la prise d’héroïne, de méthadone ou encore à des évènements de vie précoces. Notons de plus l’absence actuelle de preuves de modifications épigénétiques équivalentes au niveau lymphocytaire et cérébral.
) a comparé la méthylation d’îlots CpG du promoteur du gène OPRM1 codant le récepteur μ des opiacés dans des lymphocytes d’héroïnomanes stabilisés à la méthadone avec celle de sujets sains. Ces travaux montrent une hyperméthylation au niveau de deux des 16 sites CpG du promoteur du gène OPRM1, réduisant probablement son expression. Cependant, cette étude doit être complétée afin de savoir si cette hyperméthylation est due à la prise d’héroïne, de méthadone ou encore à des évènements de vie précoces. Notons de plus l’absence actuelle de preuves de modifications épigénétiques équivalentes au niveau lymphocytaire et cérébral.
 ) a comparé la méthylation d’îlots CpG du promoteur du gène OPRM1 codant le récepteur μ des opiacés dans des lymphocytes d’héroïnomanes stabilisés à la méthadone avec celle de sujets sains. Ces travaux montrent une hyperméthylation au niveau de deux des 16 sites CpG du promoteur du gène OPRM1, réduisant probablement son expression. Cependant, cette étude doit être complétée afin de savoir si cette hyperméthylation est due à la prise d’héroïne, de méthadone ou encore à des évènements de vie précoces. Notons de plus l’absence actuelle de preuves de modifications épigénétiques équivalentes au niveau lymphocytaire et cérébral.
) a comparé la méthylation d’îlots CpG du promoteur du gène OPRM1 codant le récepteur μ des opiacés dans des lymphocytes d’héroïnomanes stabilisés à la méthadone avec celle de sujets sains. Ces travaux montrent une hyperméthylation au niveau de deux des 16 sites CpG du promoteur du gène OPRM1, réduisant probablement son expression. Cependant, cette étude doit être complétée afin de savoir si cette hyperméthylation est due à la prise d’héroïne, de méthadone ou encore à des évènements de vie précoces. Notons de plus l’absence actuelle de preuves de modifications épigénétiques équivalentes au niveau lymphocytaire et cérébral.Cette recherche épigénétique est actuellement en plein essor et les avancées technologiques permettront dans un proche futur d’analyser les profils de méthylation de l’ADN (« méthylome ») et les profils épigénétiques (« épigénome ») liés en particulier aux pathologies addictives.
En conclusion, au cours des dernières années, l’impact sur le cerveau des substances à risque d’abus a fait l’objet de nombreuses études portant sur différents modèles animaux. Néanmoins, peu d’études ont été dévolues aux médicaments psychotropes. L’expression différentielle de gènes impliqués dans la réponse et la susceptibilité à des composés psychotropes a été montrée aussi bien chez l’Homme que chez les rongeurs, et semble être reliée au développement de la dépendance aux drogues en général et aux médicaments psychotropes en particulier. En outre, de plus en plus de données dans la littérature suggèrent que les drogues d’abus induisent des modifications d’expression de gènes qui deviennent stables dans les neurones via des mécanismes épigénétiques au niveau des promoteurs de gènes spécifiques dans la structure chromatinienne. L’étude de ces modifications épigénétiques par les drogues en est encore à ses débuts. Plus particulièrement, la recherche en épigénétique en lien avec les médicaments psychotropes est balbutiante mais d’une importance capitale pour comprendre comment l’exposition à ces produits psychotropes, même pendant un temps court, peut avoir des répercussions à très long terme.
Bibliographie
[1] AGRAWAL A, LYNSKEY MT. Are there genetic influences on addiction: evidence from family, adoption and twin studies.
Addiction. 2008;
103:1069- 1081

[2] AGRAWAL A, NEALE MC, JACOBSON KC, PRESCOTT CA, KENDLER KS. Illicit drug use and abuse/dependence: modeling of two-stage variables using the CCC approach.
Addictive Behaviors. 2005;
30:1043- 1048

[3] AITTA-AHO T, VEKOVISCHEVA OY, NEUVONEN PJ, KORPI ER. Reduced benzodiazepine tolerance, but increased flumazenil-precipitated withdrawal in AMPA-receptor GluR-A subunit-deficient mice.
Pharmacology Biochemistry and Behavior. 2009;
92:283- 290

[4] ARDAYFIO PA, LEUNG A, PARK J, HWANG DY, MORAN-GATES T, et coll.. Pitx3-deficient aphakia mice display unique behavioral responses to psychostimulant and antipsychotic drugs.
Neuroscience. 2010;
166:391- 396

[5] BESELER C, JACOBSON KC, KREMEN WS, LYONS MJ, GLATT SJ, et coll.. Is there heterogeneity among syndromes of substance use disorder for illicit drugs?.
Addictive Behaviors. 2006;
31:929- 947

[6] BIERUT LJ. Genetic vulnerability and susceptibility to substance dependence.
Neuron. 2011;
69:618- 627

[7] BUCK KJ, METTEN P, BELKNAP JK, CRABBE JC. Quantitative trait loci involved in genetic predisposition to acute alcohol withdrawal in mice.
J Neurosci. 1997;
17:3946- 3955

[8] CHEN R, HAN DD, GU HH.A triple mutation in the second transmembrane domain of mouse dopamine transporter markedly decreases sensitivity to cocaine and methylphenidate. Journal of Neurochemistry. 2005;
94:352359

[9] CRETTOL S, BESSON J, CROQUETTE-KROKAR M, HAMMIG R, GOTHUEY I, et coll.. Association of dopamine and opioid receptor genetic polymorphisms with response to methadone maintenance treatment.
Prog Neuropsychopharmacol Biol Psychiatry. 2008;
32:1722- 1727

[10] DE CID R, FONSECA F, GRATACOS M, GUTIERREZ F, MARTIN-SANTOS R, et coll.. BDNF variability in opioid addicts and response to methadone treatment: preliminary findings.
Genes Brain and Behavior. 2008;
7:515- 522

[11] DENG JV, RODRIGUIZ RM, HUTCHINSON AN, KIM IH, WETSEL WC, WEST AE. MeCP2 in the nucleus accumbens contributes to neural and behavioral responses to psychostimulants.
Nat Neurosci. 2010;
13:1128- 1136

[12] DOEHRING A, HENTIG N, GRAFF J, SALAMAT S, SCHMIDT M, et coll.. Genetic variants altering dopamine D2 receptor expression or function modulate the risk of opiate addiction and the dosage requirements of methadone substitution.
Pharmacogenet Genomics. 2009;
19:407- 414

[13] GORWOOD P, WOHL M, LE STRAT Y, ROUILLON F. Gene–environment interactions in addictive disorders: epidemiological and methodological aspects.
CR Biologies. 2007;
330:329- 338

[14] HAN MH, RENTHAL W, RING RH, RAHMAN Z, PSIFOGEORGOU K, et coll.. Brain region specific actions of regulator of G Protein signaling 4 oppose morphine reward and dependence but promote analgesia.
Biological Psychiatry. 2010;
67:761- 769

[15] HISHIMOTO A, LIU QR, DRGON T, PLETNIKOVA O, WALTHER D, ZHU XG, TRONCOSO JC, UHL GR. Neurexin 3 polymorphisms are associated with alcohol dependence and altered expression of specific isoforms.
Hum Mol Genet. 2007;
16:2880- 2891

[16] HOOD HM, METTEN P, CRABBE JC, BUCK KJ. Fine mapping of a sedative-hypnotic drug withdrawal locus on mouse chromosome 11.
Genes Brain Behav. 2006;
5:1- 10

[17] HOWARD LA, SELLERS EM, TYNDALE RF. The role of pharmacogenetically-variable cytochrome P450 enzymes in drug abuse and dependence.
Pharmacogenomics. 2002;
3:185- 199

[18] IM HI, HOLLANDER JA, BALI P, KENNY PJ. MeCP2 controls BDNF expression and cocaine intake through homeostatic interactions with microRNA-212.
Nat Neurosci. 2010;
13:1120- 1127

[19] IWATA N, COWLEY DS, RADEL M, ROY-BYRNE PP, GOLDMAN D. Relationship between a GABAA alpha 6 Pro385Ser substitution and benzodiazepine sensitivity.
Am J Psychiatry. 1999;
156:1447- 1449

[20] JIANG Y, LANGLEY B, LUBIN FD, RENTHAL W, WOOD MA, et coll.. Epigenetics in the nervous system.
J Neurosci. 2008;
28:11753- 11759

[21] KENDLER KS, KARKOWSKI LM, PRESCOTT CA. Hallucinogen, opiate, sedative and stimulant use and abuse in a population-based sample of female twins.
Acta Psychiatr Scand. 1999;
99:368- 376

[22] KENDLER KS, KARKOWSKI LM, NEALE MC, PRESCOTT CA. Illicit psychoactive substance use, heavy use, abuse, and dependence in a US population-based sample of male twins.
Arch Gen Psychiatry. 2000;
57:261- 269

[23] KENDLER KS, JACOBSON KC, PRESCOTT CA, NEALE MC. Specificity of genetic and environmental risk factors for use and abuse/dependence of cannabis, cocaine, hallucinogens, sedatives, stimulants, and opiates in male twins.
Am J Psychiatry. 2003;
160:687- 695

[24] KENDLER KS, AGGEN SH, TAMBS K, REICHBORN-KJENNERUD T. Illicit psychoactive substance use, abuse and dependence in a population-based sample of Norwegian twins.
Psychol Med. 2006;
36:955- 962

[25] KORPI ER, SEEBURG PH. Natural mutation of GABAA receptor alpha 6 subunit alters benzodiazepine affinity but not allosteric GABA effects.
Eur J Pharmacol. 1993;
247:23- 27

[26] LACHMAN HM, FANN CSJ, BARTZIS M, EVGRAFOV OV, ROSENTHAL RN, et coll.. Genomewide suggestive linkage of opioid dependence to chromosome 14q.
Human Molecular Genetics. 2007;
16:1327- 1334

[27] LEVRAN O, O’HARA K, PELES E, LI D, BARRAL S, et coll.. ABCB1 (MDR1) genetic variants are associated with methadone doses required for effective treatment of heroin dependence.
Human Molecular Genetics. 2008;
17:2219- 2227

[28] LI CY, ZHOU WZ, ZHANG PW, JOHNSON C, WEI L, UHL GR. Meta-analysis and genome-wide interpretation of genetic susceptibility to drug addiction.
BMC Genomics. 2011;
12:508

[29] LI Y, KANTELIP JP, GERRITSEN-VAN SP, DAVANI S. Interindividual variability of methadone response: impact of genetic polymorphism.
Mol Diagn Ther. 2008;
12:109- 124

[30] LIANG DY, LIAO G, LIGHTHALL GK, PELTZ G, CLARK DJ. Genetic variants of the P-glycoprotein gene Abcb1b modulate opioid-induced hyperalgesia, tolerance and dependence.
Pharmacogenetics and Genomics. 2006;
16:825- 835

[31] LIU L, HUTCHINSON MR, WHITE JM, SOMOGYI AA, COLLER JK. Association of IL-1B genetic polymorphisms with an increased risk of opioid and alcohol dependence.
Pharmacogenetics and Genomics. 2009;
19:869- 876

[32] LOTSCH J, PRUSS H, VEH RW, DOEHRING A. A KCNJ6 (Kir3.2, GIRK2) gene polymorphism modulates opioid effects on analgesia and addiction but not on pupil size.
Pharmacogenetics and Genomics. 2010;
20:291- 297

[33] MCGOWAN PO, SASAKI A, D’ALESSIO AC, DYMOV S, LABONTÉ B, et coll.. Epigenetic regulation of the glucocorticoid receptor in human brain associates with childhood abuse.
Nat Neurosci. 2009;
12:342- 348

[34] MOREL LJ, GIROS B, DAUGÉ V. Adolescent exposure to chronic delta-9-tetrahydrocannabinol blocks opiate dependence in maternally deprived rats.
Neuropsychopharmacology. 2009;
34:2469- 2476

[35] PONS D, DE VRIES FR, VAN DEN ELSEN PJ, HEIJMANS BT, QUAX PH, JUKEMA JW. Epigenetic histone acetylation modifiers in vascular remodelling: new targets for therapy in cardiovascular disease.
Eur Heart J. 2009;
30:266- 277

[36] RENTHAL W, CARLE TL, MAZE I, COVINGTON HE, III, TRUONG HT, et coll.. Delta FosB mediates epigenetic desensitization of the c-fos gene after chronic amphetamine exposure.
J Neurosci. 2008;
28:7344- 7349

[37] SORA I, LI B, IGARI M, HALL FS, IKEDA K. Transgenic mice in the study of drug addiction and the effects of psychostimulant drugs.
Ann N Y Acad Sci. 2010;
1187:218- 246

[38] TIAN H, CHEN HJ, CROSS TH, EDENBERG HJ. Alternative splicing and promoter use in the human GABRA2 gene.
Brain Res Mol Brain Res. 2005;
137:174- 183

[39] TSANKOVA N, RENTHAL W, KUMAR A, NESTLER EJ. Epigenetic regulation in psychiatric disorders.
Nat Rev Neurosci. 2007;
8:355- 367

[40] WONG CC, MILL J, FERNANDES C. Drugs and addiction: an introduction to epigenetics.
Addiction. 2011;
106:480- 489

[41] YUFEROV V, LEVRAN O, PROUDNIKOV D, NIELSEN DA, KREEK MJ. Search for genetic markers and functional variants involved in the development of opiate and cocaine addiction and treatment.
Ann N Y Acad Sci. 2010;
1187:184- 207

[42] ZHU J, REITH MEA. Role of the dopamine transporter in the action of psychostimulants, nicotine, and other drugs of abuse.
Cns & Neurological Disorders-Drug Targets. 2008;
7:393- 409

→ Aller vers SYNTHESE