Fonction de reproduction et différences entre espèces
2011
| ANALYSE |
12-
Modifications épigénétiques
La notion d’épigénétique a été pour la première fois formulée dans les années 1950 par Conrad Waddington comme « tout ce qui relie le génotype au phénotype », à savoir comment une simple information codée peut être modulée en fonction de stimuli développementaux et environnementaux et donner lieu à une identité cellulaire ou individuelle complexe. La définition moléculaire actuelle s’entend comme « l’étude des changements héritables (mitotiquement ou méiotiquement) et réversibles de l’expression génique qui n’impliquent pas de changement de la séquence d’ADN » (Holliday, 1990 ).
).
 ).
).L’information épigénétique correspond à des modifications biochimiques qui vont cibler soit la molécule d’ADN, soit les protéines histones et en particulier leurs extrémités amino-terminales qui sortent librement du nucléosome. Chez les mammifères, la méthylation de l’ADN est ciblée spécifiquement sur les cytosines et fait intervenir des enzymes spécialisées, les ADN-méthyltransférases ou DNMT, qui existent au nombre de 4 chez l’Homme (Goll et Bestor, 2005 ). Les protéines DNMT3A, DNMT3B et leur co-facteur DNMT3L sont responsables de l’établissement des profils de méthylation, tandis que DNMT1 est une enzyme de maintenance qui assure la propagation des profils de méthylation à chaque cycle de réplication. Lorsque localisée en densité suffisante sur les régions promotrices des gènes, la méthylation de l’ADN entraîne une répression des gènes associés. Elle agirait directement par encombrement stérique, en empêchant la liaison de facteurs de transcription, ou indirectement par le recrutement de protéines spécialisées, appelées protéines de liaison à l’ADN méthylé (MBD) et qui agiraient elles-mêmes au sein de complexe de remodelage de la structure chromatinienne. Les modifications post-traductionnelles des histones composent un système de régulation beaucoup plus complexe, combinant plus de 70 sites de modifications identifiés à ce jour (Kouzarides, 2007
). Les protéines DNMT3A, DNMT3B et leur co-facteur DNMT3L sont responsables de l’établissement des profils de méthylation, tandis que DNMT1 est une enzyme de maintenance qui assure la propagation des profils de méthylation à chaque cycle de réplication. Lorsque localisée en densité suffisante sur les régions promotrices des gènes, la méthylation de l’ADN entraîne une répression des gènes associés. Elle agirait directement par encombrement stérique, en empêchant la liaison de facteurs de transcription, ou indirectement par le recrutement de protéines spécialisées, appelées protéines de liaison à l’ADN méthylé (MBD) et qui agiraient elles-mêmes au sein de complexe de remodelage de la structure chromatinienne. Les modifications post-traductionnelles des histones composent un système de régulation beaucoup plus complexe, combinant plus de 70 sites de modifications identifiés à ce jour (Kouzarides, 2007 ) et quelques centaines de protéines catalysant l’ajout ou le retrait de ces modifications. Les modifications d’histones agissent pour certaines directement sur la conformation chromatinienne, comme cela a été démontré pour l’acétylation, mais aussi indirectement par le recrutement de protéines chromatiniennes accessoires. D’une manière générale, l’acétylation des résidus lysine indique un état actif, tandis que la méthylation des lysines et arginines peut avoir un effet activateur ou répresseur suivant leur position. Pour ne citer que les plus connues, les marques de méthylation sur les lysines en position 9 et 27 de l’extrémité de l’histone H3 (respectivement H3K9 et H3K27) sont répressives, la marque de méthylation en H3K4 est activatrice. Les relations épistatiques entre méthylation de l’ADN et modifications des histones sont bi-directionnelles, traduisant une boucle de renforcement mutuel : la méthylation de l’ADN d’une séquence influence les profils de modifications des histones associées, mais à l’inverse, la réaction de méthylation de l’ADN dépend aussi de profils de modifications d’histones pré-existants. La combinatoire de modifications épigénétiques à l’échelle du génome entier compose l’épigénome.
) et quelques centaines de protéines catalysant l’ajout ou le retrait de ces modifications. Les modifications d’histones agissent pour certaines directement sur la conformation chromatinienne, comme cela a été démontré pour l’acétylation, mais aussi indirectement par le recrutement de protéines chromatiniennes accessoires. D’une manière générale, l’acétylation des résidus lysine indique un état actif, tandis que la méthylation des lysines et arginines peut avoir un effet activateur ou répresseur suivant leur position. Pour ne citer que les plus connues, les marques de méthylation sur les lysines en position 9 et 27 de l’extrémité de l’histone H3 (respectivement H3K9 et H3K27) sont répressives, la marque de méthylation en H3K4 est activatrice. Les relations épistatiques entre méthylation de l’ADN et modifications des histones sont bi-directionnelles, traduisant une boucle de renforcement mutuel : la méthylation de l’ADN d’une séquence influence les profils de modifications des histones associées, mais à l’inverse, la réaction de méthylation de l’ADN dépend aussi de profils de modifications d’histones pré-existants. La combinatoire de modifications épigénétiques à l’échelle du génome entier compose l’épigénome.
 ). Les protéines DNMT3A, DNMT3B et leur co-facteur DNMT3L sont responsables de l’établissement des profils de méthylation, tandis que DNMT1 est une enzyme de maintenance qui assure la propagation des profils de méthylation à chaque cycle de réplication. Lorsque localisée en densité suffisante sur les régions promotrices des gènes, la méthylation de l’ADN entraîne une répression des gènes associés. Elle agirait directement par encombrement stérique, en empêchant la liaison de facteurs de transcription, ou indirectement par le recrutement de protéines spécialisées, appelées protéines de liaison à l’ADN méthylé (MBD) et qui agiraient elles-mêmes au sein de complexe de remodelage de la structure chromatinienne. Les modifications post-traductionnelles des histones composent un système de régulation beaucoup plus complexe, combinant plus de 70 sites de modifications identifiés à ce jour (Kouzarides, 2007
). Les protéines DNMT3A, DNMT3B et leur co-facteur DNMT3L sont responsables de l’établissement des profils de méthylation, tandis que DNMT1 est une enzyme de maintenance qui assure la propagation des profils de méthylation à chaque cycle de réplication. Lorsque localisée en densité suffisante sur les régions promotrices des gènes, la méthylation de l’ADN entraîne une répression des gènes associés. Elle agirait directement par encombrement stérique, en empêchant la liaison de facteurs de transcription, ou indirectement par le recrutement de protéines spécialisées, appelées protéines de liaison à l’ADN méthylé (MBD) et qui agiraient elles-mêmes au sein de complexe de remodelage de la structure chromatinienne. Les modifications post-traductionnelles des histones composent un système de régulation beaucoup plus complexe, combinant plus de 70 sites de modifications identifiés à ce jour (Kouzarides, 2007 ) et quelques centaines de protéines catalysant l’ajout ou le retrait de ces modifications. Les modifications d’histones agissent pour certaines directement sur la conformation chromatinienne, comme cela a été démontré pour l’acétylation, mais aussi indirectement par le recrutement de protéines chromatiniennes accessoires. D’une manière générale, l’acétylation des résidus lysine indique un état actif, tandis que la méthylation des lysines et arginines peut avoir un effet activateur ou répresseur suivant leur position. Pour ne citer que les plus connues, les marques de méthylation sur les lysines en position 9 et 27 de l’extrémité de l’histone H3 (respectivement H3K9 et H3K27) sont répressives, la marque de méthylation en H3K4 est activatrice. Les relations épistatiques entre méthylation de l’ADN et modifications des histones sont bi-directionnelles, traduisant une boucle de renforcement mutuel : la méthylation de l’ADN d’une séquence influence les profils de modifications des histones associées, mais à l’inverse, la réaction de méthylation de l’ADN dépend aussi de profils de modifications d’histones pré-existants. La combinatoire de modifications épigénétiques à l’échelle du génome entier compose l’épigénome.
) et quelques centaines de protéines catalysant l’ajout ou le retrait de ces modifications. Les modifications d’histones agissent pour certaines directement sur la conformation chromatinienne, comme cela a été démontré pour l’acétylation, mais aussi indirectement par le recrutement de protéines chromatiniennes accessoires. D’une manière générale, l’acétylation des résidus lysine indique un état actif, tandis que la méthylation des lysines et arginines peut avoir un effet activateur ou répresseur suivant leur position. Pour ne citer que les plus connues, les marques de méthylation sur les lysines en position 9 et 27 de l’extrémité de l’histone H3 (respectivement H3K9 et H3K27) sont répressives, la marque de méthylation en H3K4 est activatrice. Les relations épistatiques entre méthylation de l’ADN et modifications des histones sont bi-directionnelles, traduisant une boucle de renforcement mutuel : la méthylation de l’ADN d’une séquence influence les profils de modifications des histones associées, mais à l’inverse, la réaction de méthylation de l’ADN dépend aussi de profils de modifications d’histones pré-existants. La combinatoire de modifications épigénétiques à l’échelle du génome entier compose l’épigénome.La régulation épigénétique participe au programme développemental et cellulaire normal. Ainsi, l’engagement vers un programme particulier est initié par divers stimuli, le plus souvent sous forme de signaux tels qu’une molécule développementale, une hormone, un changement de température, l’application de forces physiques... Cette perception de l’environnement extérieur est traduite au sein de la cellule par des voies de signalisation intracellulaires, qui aboutissent dans le noyau à l’activation ou la répression de gènes cibles, par la liaison de facteurs de transcription. Cette réponse transcriptionnelle est ensuite consolidée par des modifications épigénétiques, comme la méthylation de l’ADN et les modifications post-traductionnelles des histones. Ces modifications vont assurer la stabilité de la décision cellulaire en l’absence du signal inducteur d’origine, mais également la perpétuation de cette identité aux cellules filles issues de la cellule d’origine qui a été confrontée au signal inducteur. Sans ce verrou final, les décisions développementales seraient labiles et la constitution de tissus homogènes impossible.
Des anomalies épigénétiques peuvent survenir à la suite de mutations génétiques dans des enzymes impliquées dans le répertoire de modifications épigénétiques. On peut citer pour exemple le syndrome ICF (Immunodeficiency, Centromeric instability and Facial anomalies), une pathologie de défaut constitutif de méthylation de l’ADN, associée à des mutations dans le gène codant pour l’ADN-méthyltransférase DNMT3B (Xu et coll., 1999 ). Des anomalies épigénétiques, ou épimutations, peuvent aussi être la conséquence d’une altération d’un programme développemental ou cellulaire donné, et leur incidence est augmentée par des facteurs clairement identifiés : le régime alimentaire, l’âge, le cancer, le comportement maternel, le contexte hormonal, les infections virales ou bactériennes, l’exposition à des agents chimiques présents dans l’environnement (Van Vliet et coll., 2007
). Des anomalies épigénétiques, ou épimutations, peuvent aussi être la conséquence d’une altération d’un programme développemental ou cellulaire donné, et leur incidence est augmentée par des facteurs clairement identifiés : le régime alimentaire, l’âge, le cancer, le comportement maternel, le contexte hormonal, les infections virales ou bactériennes, l’exposition à des agents chimiques présents dans l’environnement (Van Vliet et coll., 2007 ). Ces altérations de méthylation peuvent être locales, ou concerner des régions plus étendues du génome et signent généralement dans ce cas une perturbation de l’expression des ADN-méthyltransférases.
). Ces altérations de méthylation peuvent être locales, ou concerner des régions plus étendues du génome et signent généralement dans ce cas une perturbation de l’expression des ADN-méthyltransférases.
 ). Des anomalies épigénétiques, ou épimutations, peuvent aussi être la conséquence d’une altération d’un programme développemental ou cellulaire donné, et leur incidence est augmentée par des facteurs clairement identifiés : le régime alimentaire, l’âge, le cancer, le comportement maternel, le contexte hormonal, les infections virales ou bactériennes, l’exposition à des agents chimiques présents dans l’environnement (Van Vliet et coll., 2007
). Des anomalies épigénétiques, ou épimutations, peuvent aussi être la conséquence d’une altération d’un programme développemental ou cellulaire donné, et leur incidence est augmentée par des facteurs clairement identifiés : le régime alimentaire, l’âge, le cancer, le comportement maternel, le contexte hormonal, les infections virales ou bactériennes, l’exposition à des agents chimiques présents dans l’environnement (Van Vliet et coll., 2007 ). Ces altérations de méthylation peuvent être locales, ou concerner des régions plus étendues du génome et signent généralement dans ce cas une perturbation de l’expression des ADN-méthyltransférases.
). Ces altérations de méthylation peuvent être locales, ou concerner des régions plus étendues du génome et signent généralement dans ce cas une perturbation de l’expression des ADN-méthyltransférases.Pour illustration de la modulation possible des profils épigénétiques, des analyses familiales étendues et suivies sur plusieurs années ont permis de révéler la dérive épigénétique des individus au cours de leur vie (Sandovici et coll., 2005 ). Les couples de jumeaux monozygotes constituent un modèle d’étude typique de l’influence de l’environnement et de l’expérience de chacun sur son patrimoine épigénétique. Avec l’âge, les jumeaux mono zygotes apparaissent de plus en plus discordants épigénétiquement, accumulant au cours de leur vie des différences de profils de méthylation, dans les cellules du sang circulant (Fraga et coll., 2005
). Les couples de jumeaux monozygotes constituent un modèle d’étude typique de l’influence de l’environnement et de l’expérience de chacun sur son patrimoine épigénétique. Avec l’âge, les jumeaux mono zygotes apparaissent de plus en plus discordants épigénétiquement, accumulant au cours de leur vie des différences de profils de méthylation, dans les cellules du sang circulant (Fraga et coll., 2005 ; Kaminsky et coll., 2009
; Kaminsky et coll., 2009 ). Ces variations épigénétiques ne sont cependant pas pour autant synonymes de pathologies et, comme dans le cas de variations génétiques, ont dans leur majorité un impact neutre sur le phénotype. Il existe cependant également des cas de discordance pathologique entre jumeaux monozygotes, qui signent l’acquisition de profils épigénétiques non conformes et délétères chez l’un d’eux. Un cas classique est celui du syndrome de Wiedeman-Beckwith, où l’anomalie de méthylation a pu être identifiée sur une région de contrôle de gènes soumis à empreinte parentale uniquement chez les jumeaux atteints (Orstavik et coll., 1995
). Ces variations épigénétiques ne sont cependant pas pour autant synonymes de pathologies et, comme dans le cas de variations génétiques, ont dans leur majorité un impact neutre sur le phénotype. Il existe cependant également des cas de discordance pathologique entre jumeaux monozygotes, qui signent l’acquisition de profils épigénétiques non conformes et délétères chez l’un d’eux. Un cas classique est celui du syndrome de Wiedeman-Beckwith, où l’anomalie de méthylation a pu être identifiée sur une région de contrôle de gènes soumis à empreinte parentale uniquement chez les jumeaux atteints (Orstavik et coll., 1995 ). Le défaut épigénétique serait dans ce cas apparu de manière quasi concomitante avec la scission de l’embryon précoce. Il existe également des individus totalement chimères pour cette condition, indiquant ici encore l’acquisition assez précocement au cours du développement d’une anomalie de méthylation dans une cellule ou quelques cellules, suivie de leur expansion clonale. Enfin, l’existence d’allèles « épistables » a permis de mettre en évidence chez la souris l’influence possible du régime alimentaire de la mère, et en particulier la disponibilité en folates qui sont utilisés comme donneurs de groupements méthyles pour la cellule, sur le profil de méthylation de ces allèles chez les petits exposés in utero à ce régime (Wolff et coll., 1998
). Le défaut épigénétique serait dans ce cas apparu de manière quasi concomitante avec la scission de l’embryon précoce. Il existe également des individus totalement chimères pour cette condition, indiquant ici encore l’acquisition assez précocement au cours du développement d’une anomalie de méthylation dans une cellule ou quelques cellules, suivie de leur expansion clonale. Enfin, l’existence d’allèles « épistables » a permis de mettre en évidence chez la souris l’influence possible du régime alimentaire de la mère, et en particulier la disponibilité en folates qui sont utilisés comme donneurs de groupements méthyles pour la cellule, sur le profil de méthylation de ces allèles chez les petits exposés in utero à ce régime (Wolff et coll., 1998 ; Waterland et coll., 2006
; Waterland et coll., 2006 ). Le statut de méthylation de ces allèles est également sensible à des expositions in utero au bisphénol A (Dolinoy et coll., 2007
). Le statut de méthylation de ces allèles est également sensible à des expositions in utero au bisphénol A (Dolinoy et coll., 2007 ).
).
 ). Les couples de jumeaux monozygotes constituent un modèle d’étude typique de l’influence de l’environnement et de l’expérience de chacun sur son patrimoine épigénétique. Avec l’âge, les jumeaux mono zygotes apparaissent de plus en plus discordants épigénétiquement, accumulant au cours de leur vie des différences de profils de méthylation, dans les cellules du sang circulant (Fraga et coll., 2005
). Les couples de jumeaux monozygotes constituent un modèle d’étude typique de l’influence de l’environnement et de l’expérience de chacun sur son patrimoine épigénétique. Avec l’âge, les jumeaux mono zygotes apparaissent de plus en plus discordants épigénétiquement, accumulant au cours de leur vie des différences de profils de méthylation, dans les cellules du sang circulant (Fraga et coll., 2005 ; Kaminsky et coll., 2009
; Kaminsky et coll., 2009 ). Ces variations épigénétiques ne sont cependant pas pour autant synonymes de pathologies et, comme dans le cas de variations génétiques, ont dans leur majorité un impact neutre sur le phénotype. Il existe cependant également des cas de discordance pathologique entre jumeaux monozygotes, qui signent l’acquisition de profils épigénétiques non conformes et délétères chez l’un d’eux. Un cas classique est celui du syndrome de Wiedeman-Beckwith, où l’anomalie de méthylation a pu être identifiée sur une région de contrôle de gènes soumis à empreinte parentale uniquement chez les jumeaux atteints (Orstavik et coll., 1995
). Ces variations épigénétiques ne sont cependant pas pour autant synonymes de pathologies et, comme dans le cas de variations génétiques, ont dans leur majorité un impact neutre sur le phénotype. Il existe cependant également des cas de discordance pathologique entre jumeaux monozygotes, qui signent l’acquisition de profils épigénétiques non conformes et délétères chez l’un d’eux. Un cas classique est celui du syndrome de Wiedeman-Beckwith, où l’anomalie de méthylation a pu être identifiée sur une région de contrôle de gènes soumis à empreinte parentale uniquement chez les jumeaux atteints (Orstavik et coll., 1995 ). Le défaut épigénétique serait dans ce cas apparu de manière quasi concomitante avec la scission de l’embryon précoce. Il existe également des individus totalement chimères pour cette condition, indiquant ici encore l’acquisition assez précocement au cours du développement d’une anomalie de méthylation dans une cellule ou quelques cellules, suivie de leur expansion clonale. Enfin, l’existence d’allèles « épistables » a permis de mettre en évidence chez la souris l’influence possible du régime alimentaire de la mère, et en particulier la disponibilité en folates qui sont utilisés comme donneurs de groupements méthyles pour la cellule, sur le profil de méthylation de ces allèles chez les petits exposés in utero à ce régime (Wolff et coll., 1998
). Le défaut épigénétique serait dans ce cas apparu de manière quasi concomitante avec la scission de l’embryon précoce. Il existe également des individus totalement chimères pour cette condition, indiquant ici encore l’acquisition assez précocement au cours du développement d’une anomalie de méthylation dans une cellule ou quelques cellules, suivie de leur expansion clonale. Enfin, l’existence d’allèles « épistables » a permis de mettre en évidence chez la souris l’influence possible du régime alimentaire de la mère, et en particulier la disponibilité en folates qui sont utilisés comme donneurs de groupements méthyles pour la cellule, sur le profil de méthylation de ces allèles chez les petits exposés in utero à ce régime (Wolff et coll., 1998 ; Waterland et coll., 2006
; Waterland et coll., 2006 ). Le statut de méthylation de ces allèles est également sensible à des expositions in utero au bisphénol A (Dolinoy et coll., 2007
). Le statut de méthylation de ces allèles est également sensible à des expositions in utero au bisphénol A (Dolinoy et coll., 2007 ).
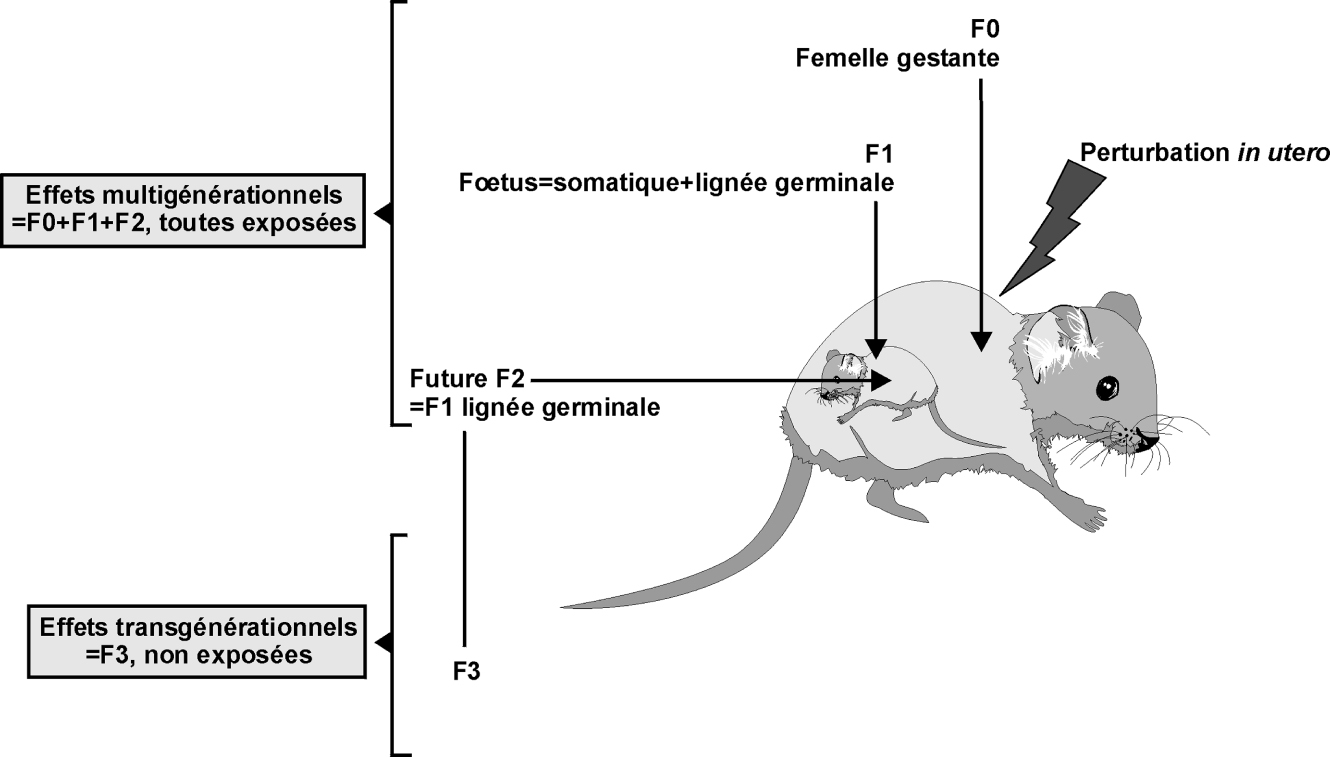
).D’une manière générale, un mode d’action épigénétique est suspecté lorsque des perturbations précoces en vie embryonnaire, fœtale ou néonatale induisent un phénotype adulte. Lorsque ces perturbations atteignent la lignée germinale, ces effets peuvent se manifester à la génération suivante, dans la descendance produite de ces gamètes épigénétiquement anormaux. On parle alors d’effets multigénérationnels (figure 12.1 ). Si ces anomalies persistent encore à la génération suivante et sont donc à nouveau transmis par la lignée germinale qui n’a pas elle-même été exposée, on parle alors d’effets transgénérationnels. Comme développé dans le paragraphe suivant, la reprogrammation épigénétique extensive que connaît la lignée germinale des mammifères rend cependant ce type de phénotype transgénérationnel peu probable, dans l’espèce humaine en particulier.
). Si ces anomalies persistent encore à la génération suivante et sont donc à nouveau transmis par la lignée germinale qui n’a pas elle-même été exposée, on parle alors d’effets transgénérationnels. Comme développé dans le paragraphe suivant, la reprogrammation épigénétique extensive que connaît la lignée germinale des mammifères rend cependant ce type de phénotype transgénérationnel peu probable, dans l’espèce humaine en particulier.
 ). Si ces anomalies persistent encore à la génération suivante et sont donc à nouveau transmis par la lignée germinale qui n’a pas elle-même été exposée, on parle alors d’effets transgénérationnels. Comme développé dans le paragraphe suivant, la reprogrammation épigénétique extensive que connaît la lignée germinale des mammifères rend cependant ce type de phénotype transgénérationnel peu probable, dans l’espèce humaine en particulier.
). Si ces anomalies persistent encore à la génération suivante et sont donc à nouveau transmis par la lignée germinale qui n’a pas elle-même été exposée, on parle alors d’effets transgénérationnels. Comme développé dans le paragraphe suivant, la reprogrammation épigénétique extensive que connaît la lignée germinale des mammifères rend cependant ce type de phénotype transgénérationnel peu probable, dans l’espèce humaine en particulier.Développement germinal et méthylation de l’ADN : remise à zéro et acquisition du programme germinal
Tout programme de différenciation normal s’accompagne de profils épigénétiques spécifiques. Les cellules germinales des mammifères subissent notamment des remaniements importants de leurs profils de méthylation au cours de leur émergence et de leur différenciation vers la formation de gamètes (Trasler, 2006 ). Des études sur le modèle murin ont démontré que la programmation épigénétique de la lignée germinale est particulièrement importante pour l’acquisition de l’empreinte génomique (ou empreinte parentale), et le maintien de l’intégrité génomique via la répression des éléments transposables du génome (Bourc’his et coll., 2001
). Des études sur le modèle murin ont démontré que la programmation épigénétique de la lignée germinale est particulièrement importante pour l’acquisition de l’empreinte génomique (ou empreinte parentale), et le maintien de l’intégrité génomique via la répression des éléments transposables du génome (Bourc’his et coll., 2001 ; Bourc’his et Bestor, 2004
; Bourc’his et Bestor, 2004 ).
).
 ). Des études sur le modèle murin ont démontré que la programmation épigénétique de la lignée germinale est particulièrement importante pour l’acquisition de l’empreinte génomique (ou empreinte parentale), et le maintien de l’intégrité génomique via la répression des éléments transposables du génome (Bourc’his et coll., 2001
). Des études sur le modèle murin ont démontré que la programmation épigénétique de la lignée germinale est particulièrement importante pour l’acquisition de l’empreinte génomique (ou empreinte parentale), et le maintien de l’intégrité génomique via la répression des éléments transposables du génome (Bourc’his et coll., 2001 ; Bourc’his et Bestor, 2004
; Bourc’his et Bestor, 2004 ).
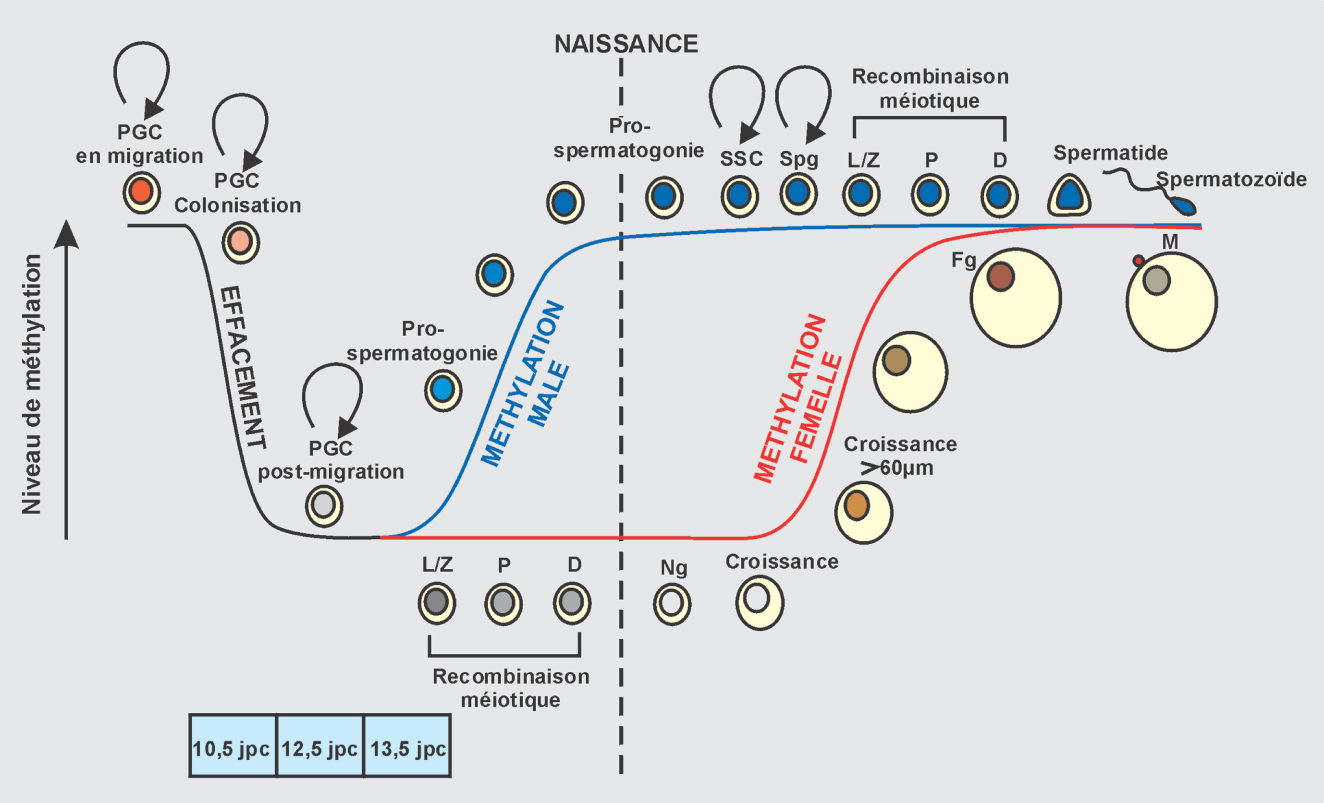
).Les transitions de méthylation que connaît la lignée germinale sont étroitement liées au programme de différenciation de la gonade (figure 12.2 ). L’entrée des cellules germinales dans les ébauches gonadiques (qui a lieu vers 10,5 jours de gestation chez la souris) déclenche ainsi un effacement des profils de méthylation : d’un statut globalement méthylé de 60 %, la cellule germinale primordiale passe à un taux de 7 % (Popp et coll., 2010
). L’entrée des cellules germinales dans les ébauches gonadiques (qui a lieu vers 10,5 jours de gestation chez la souris) déclenche ainsi un effacement des profils de méthylation : d’un statut globalement méthylé de 60 %, la cellule germinale primordiale passe à un taux de 7 % (Popp et coll., 2010 ). Cette relaxation coïncide avec l’acquisition de la pluripotence, et donc de la potentialité développementale et épigénétique du gamète à donner lieu au développement d’un individu dans sa totalité. Cette phase d’effacement permet aussi potentiellement de remettre à zéro dans la nouvelle lignée germinale toute anomalie de méthylation ou épimutation acquise, et empêche ainsi sa transmission à la génération suivante. En d’autres termes, cette reprogrammation empêche a priori tout effet transgénérationnel des épimutations. Suite à cette déméthylation s’effectue un programme de reméthylation, sous la gouvernance des enzymes DNMT3A, DNMT3B et du co-facteur DNMT3L, qui s’exécute selon des cinétiques différentes en fonction du sexe de l’individu, signant cette fois l’importance de l’environnement gonadique sexué sur ce processus (Schaefer et coll., 2007
). Cette relaxation coïncide avec l’acquisition de la pluripotence, et donc de la potentialité développementale et épigénétique du gamète à donner lieu au développement d’un individu dans sa totalité. Cette phase d’effacement permet aussi potentiellement de remettre à zéro dans la nouvelle lignée germinale toute anomalie de méthylation ou épimutation acquise, et empêche ainsi sa transmission à la génération suivante. En d’autres termes, cette reprogrammation empêche a priori tout effet transgénérationnel des épimutations. Suite à cette déméthylation s’effectue un programme de reméthylation, sous la gouvernance des enzymes DNMT3A, DNMT3B et du co-facteur DNMT3L, qui s’exécute selon des cinétiques différentes en fonction du sexe de l’individu, signant cette fois l’importance de l’environnement gonadique sexué sur ce processus (Schaefer et coll., 2007 ; Bourc’his et Proudhon, 2008
; Bourc’his et Proudhon, 2008 ). Chez le mâle, l’expression du gène de détermination sexuelle SRY porté par le chromosome Y, déclenche la reméthylation germinale en période fœtale, dès le jour 13,5 de gestation chez la souris. Les cibles identifiées de cette reméthylation mâle sont les éléments transposables qui comptent pour la moitié du génome, et les gènes soumis à empreinte paternelle. Ces profils de méthylation mâle sont ensuite maintenus et perpétués dans la lignée germinale après la naissance, au cours de la méiose et jusqu’à la formation de spermatozoïdes matures. Chez la femelle, la déméthylation est d’abord suivie par l’entrée en méiose, initiée vers 13,5 jours de gestation. La reméthylation n’a lieu qu’après la naissance chez la souris femelle, à chaque cycle d’ovulation, dans les cohortes d’ovocytes dictyés en phase de maturation. Une taille ovocytaire critique de 60 microns, et donc un stade assez avancé de maturation folliculaire, a été identifiée comme déterminante pour déclencher l’initiation de ce processus (Lucifero et coll., 2004
). Chez le mâle, l’expression du gène de détermination sexuelle SRY porté par le chromosome Y, déclenche la reméthylation germinale en période fœtale, dès le jour 13,5 de gestation chez la souris. Les cibles identifiées de cette reméthylation mâle sont les éléments transposables qui comptent pour la moitié du génome, et les gènes soumis à empreinte paternelle. Ces profils de méthylation mâle sont ensuite maintenus et perpétués dans la lignée germinale après la naissance, au cours de la méiose et jusqu’à la formation de spermatozoïdes matures. Chez la femelle, la déméthylation est d’abord suivie par l’entrée en méiose, initiée vers 13,5 jours de gestation. La reméthylation n’a lieu qu’après la naissance chez la souris femelle, à chaque cycle d’ovulation, dans les cohortes d’ovocytes dictyés en phase de maturation. Une taille ovocytaire critique de 60 microns, et donc un stade assez avancé de maturation folliculaire, a été identifiée comme déterminante pour déclencher l’initiation de ce processus (Lucifero et coll., 2004 ). Les cibles identifiées de cette reméthylation femelle sont les éléments transposables, les gènes soumis à empreinte maternelle et plusieurs gènes importants pour le développement (Borgel et coll., 2010
). Les cibles identifiées de cette reméthylation femelle sont les éléments transposables, les gènes soumis à empreinte maternelle et plusieurs gènes importants pour le développement (Borgel et coll., 2010 ). L’acquisition en vie adulte des profils de méthylation ovocytaire est connue pour être sensible à des perturbations hormonales ou l’induction de programmes accélérés de maturation ovocytaire comme ceux mis en jeu dans les protocoles de superovulation en assistance médicale à la procréation (Fauque et coll., 2007
). L’acquisition en vie adulte des profils de méthylation ovocytaire est connue pour être sensible à des perturbations hormonales ou l’induction de programmes accélérés de maturation ovocytaire comme ceux mis en jeu dans les protocoles de superovulation en assistance médicale à la procréation (Fauque et coll., 2007 ). Du fait de cette chronologie de reméthylation postnatale, la lignée germinale femelle pourrait cependant être moins exposée à des altérations survenant en période in utero, comparée à la lignée germinale mâle qui subit à la fois la déméthylation et la reméthylation avant la naissance.
). Du fait de cette chronologie de reméthylation postnatale, la lignée germinale femelle pourrait cependant être moins exposée à des altérations survenant en période in utero, comparée à la lignée germinale mâle qui subit à la fois la déméthylation et la reméthylation avant la naissance.
 ). L’entrée des cellules germinales dans les ébauches gonadiques (qui a lieu vers 10,5 jours de gestation chez la souris) déclenche ainsi un effacement des profils de méthylation : d’un statut globalement méthylé de 60 %, la cellule germinale primordiale passe à un taux de 7 % (Popp et coll., 2010
). L’entrée des cellules germinales dans les ébauches gonadiques (qui a lieu vers 10,5 jours de gestation chez la souris) déclenche ainsi un effacement des profils de méthylation : d’un statut globalement méthylé de 60 %, la cellule germinale primordiale passe à un taux de 7 % (Popp et coll., 2010 ). Cette relaxation coïncide avec l’acquisition de la pluripotence, et donc de la potentialité développementale et épigénétique du gamète à donner lieu au développement d’un individu dans sa totalité. Cette phase d’effacement permet aussi potentiellement de remettre à zéro dans la nouvelle lignée germinale toute anomalie de méthylation ou épimutation acquise, et empêche ainsi sa transmission à la génération suivante. En d’autres termes, cette reprogrammation empêche a priori tout effet transgénérationnel des épimutations. Suite à cette déméthylation s’effectue un programme de reméthylation, sous la gouvernance des enzymes DNMT3A, DNMT3B et du co-facteur DNMT3L, qui s’exécute selon des cinétiques différentes en fonction du sexe de l’individu, signant cette fois l’importance de l’environnement gonadique sexué sur ce processus (Schaefer et coll., 2007
). Cette relaxation coïncide avec l’acquisition de la pluripotence, et donc de la potentialité développementale et épigénétique du gamète à donner lieu au développement d’un individu dans sa totalité. Cette phase d’effacement permet aussi potentiellement de remettre à zéro dans la nouvelle lignée germinale toute anomalie de méthylation ou épimutation acquise, et empêche ainsi sa transmission à la génération suivante. En d’autres termes, cette reprogrammation empêche a priori tout effet transgénérationnel des épimutations. Suite à cette déméthylation s’effectue un programme de reméthylation, sous la gouvernance des enzymes DNMT3A, DNMT3B et du co-facteur DNMT3L, qui s’exécute selon des cinétiques différentes en fonction du sexe de l’individu, signant cette fois l’importance de l’environnement gonadique sexué sur ce processus (Schaefer et coll., 2007 ; Bourc’his et Proudhon, 2008
; Bourc’his et Proudhon, 2008 ). Chez le mâle, l’expression du gène de détermination sexuelle SRY porté par le chromosome Y, déclenche la reméthylation germinale en période fœtale, dès le jour 13,5 de gestation chez la souris. Les cibles identifiées de cette reméthylation mâle sont les éléments transposables qui comptent pour la moitié du génome, et les gènes soumis à empreinte paternelle. Ces profils de méthylation mâle sont ensuite maintenus et perpétués dans la lignée germinale après la naissance, au cours de la méiose et jusqu’à la formation de spermatozoïdes matures. Chez la femelle, la déméthylation est d’abord suivie par l’entrée en méiose, initiée vers 13,5 jours de gestation. La reméthylation n’a lieu qu’après la naissance chez la souris femelle, à chaque cycle d’ovulation, dans les cohortes d’ovocytes dictyés en phase de maturation. Une taille ovocytaire critique de 60 microns, et donc un stade assez avancé de maturation folliculaire, a été identifiée comme déterminante pour déclencher l’initiation de ce processus (Lucifero et coll., 2004
). Chez le mâle, l’expression du gène de détermination sexuelle SRY porté par le chromosome Y, déclenche la reméthylation germinale en période fœtale, dès le jour 13,5 de gestation chez la souris. Les cibles identifiées de cette reméthylation mâle sont les éléments transposables qui comptent pour la moitié du génome, et les gènes soumis à empreinte paternelle. Ces profils de méthylation mâle sont ensuite maintenus et perpétués dans la lignée germinale après la naissance, au cours de la méiose et jusqu’à la formation de spermatozoïdes matures. Chez la femelle, la déméthylation est d’abord suivie par l’entrée en méiose, initiée vers 13,5 jours de gestation. La reméthylation n’a lieu qu’après la naissance chez la souris femelle, à chaque cycle d’ovulation, dans les cohortes d’ovocytes dictyés en phase de maturation. Une taille ovocytaire critique de 60 microns, et donc un stade assez avancé de maturation folliculaire, a été identifiée comme déterminante pour déclencher l’initiation de ce processus (Lucifero et coll., 2004 ). Les cibles identifiées de cette reméthylation femelle sont les éléments transposables, les gènes soumis à empreinte maternelle et plusieurs gènes importants pour le développement (Borgel et coll., 2010
). Les cibles identifiées de cette reméthylation femelle sont les éléments transposables, les gènes soumis à empreinte maternelle et plusieurs gènes importants pour le développement (Borgel et coll., 2010 ). L’acquisition en vie adulte des profils de méthylation ovocytaire est connue pour être sensible à des perturbations hormonales ou l’induction de programmes accélérés de maturation ovocytaire comme ceux mis en jeu dans les protocoles de superovulation en assistance médicale à la procréation (Fauque et coll., 2007
). L’acquisition en vie adulte des profils de méthylation ovocytaire est connue pour être sensible à des perturbations hormonales ou l’induction de programmes accélérés de maturation ovocytaire comme ceux mis en jeu dans les protocoles de superovulation en assistance médicale à la procréation (Fauque et coll., 2007 ). Du fait de cette chronologie de reméthylation postnatale, la lignée germinale femelle pourrait cependant être moins exposée à des altérations survenant en période in utero, comparée à la lignée germinale mâle qui subit à la fois la déméthylation et la reméthylation avant la naissance.
). Du fait de cette chronologie de reméthylation postnatale, la lignée germinale femelle pourrait cependant être moins exposée à des altérations survenant en période in utero, comparée à la lignée germinale mâle qui subit à la fois la déméthylation et la reméthylation avant la naissance. | Figure 12.2 Cinétique d’acquisition de la méthylation de l’ADN au cours du développement de la lignée germinale mâle et femelle chez la souris (d’après Bourc’his et Proudhon, 2008 ) ) |
En accord avec la remise à zéro complète des profils de méthylation dans la lignée germinale précoce des mammifères, il n’existe à présent aucun cas prouvé chez l’Homme de transmission de caractères épigénétiques acquis à la descendance. Une limitation technique majeure s’impose : même si une anomalie de méthylation de l’ADN apparaît comme héréditaire au sein d’une famille, il faudrait séquencer le génome entier de l’individu et de ses apparentés pour prouver le caractère autonome de cette épimutation, ou en d’autres termes qu’il ne s’agit pas d’une mutation génétique qui a pour effet secondaire cette anomalie de méthylation. Cependant, il ne peut être totalement exclu à l’heure actuelle que l’effacement dans la lignée germinale soit total, qu’il n’existe pas un niveau basal de méthylation persistante. Chez la souris, les allèles épistables mentionnés plus haut auraient des effets transgénérationnels potentiels (Morgan et coll., 1999 ; Rakyan et coll., 2003
; Rakyan et coll., 2003 ). Ces cas sont en fait associés à des séquences qui sont connues pour ne pas être totalement remises à zéro dans la lignée germinale des rongeurs, les séquences IAP (Intracisternal A Particles) (Hajkova et coll., 2002
). Ces cas sont en fait associés à des séquences qui sont connues pour ne pas être totalement remises à zéro dans la lignée germinale des rongeurs, les séquences IAP (Intracisternal A Particles) (Hajkova et coll., 2002 ). De tels exemples de séquences résistantes à la reprogrammation germinale, assez uniques il faut tout de même le mentionner, pourraient également exister dans le génome humain. Cette idée suscite de nombreux fantasmes et des rapports sur l’existence de tels phénomènes se multiplient de nos jours. Cependant, une analyse rigoureuse du mécanisme moléculaire en cause et la preuve formelle qu’il s’agit bien d’une épimutation héréditaire et non pas des effets confondants doivent être absolument apportés avant toute conclusion (Youngson et Whitelaw, 2008
). De tels exemples de séquences résistantes à la reprogrammation germinale, assez uniques il faut tout de même le mentionner, pourraient également exister dans le génome humain. Cette idée suscite de nombreux fantasmes et des rapports sur l’existence de tels phénomènes se multiplient de nos jours. Cependant, une analyse rigoureuse du mécanisme moléculaire en cause et la preuve formelle qu’il s’agit bien d’une épimutation héréditaire et non pas des effets confondants doivent être absolument apportés avant toute conclusion (Youngson et Whitelaw, 2008 ; Galvani et Bourc’his, 2008
; Galvani et Bourc’his, 2008 ).
).
 ; Rakyan et coll., 2003
; Rakyan et coll., 2003 ). Ces cas sont en fait associés à des séquences qui sont connues pour ne pas être totalement remises à zéro dans la lignée germinale des rongeurs, les séquences IAP (Intracisternal A Particles) (Hajkova et coll., 2002
). Ces cas sont en fait associés à des séquences qui sont connues pour ne pas être totalement remises à zéro dans la lignée germinale des rongeurs, les séquences IAP (Intracisternal A Particles) (Hajkova et coll., 2002 ). De tels exemples de séquences résistantes à la reprogrammation germinale, assez uniques il faut tout de même le mentionner, pourraient également exister dans le génome humain. Cette idée suscite de nombreux fantasmes et des rapports sur l’existence de tels phénomènes se multiplient de nos jours. Cependant, une analyse rigoureuse du mécanisme moléculaire en cause et la preuve formelle qu’il s’agit bien d’une épimutation héréditaire et non pas des effets confondants doivent être absolument apportés avant toute conclusion (Youngson et Whitelaw, 2008
). De tels exemples de séquences résistantes à la reprogrammation germinale, assez uniques il faut tout de même le mentionner, pourraient également exister dans le génome humain. Cette idée suscite de nombreux fantasmes et des rapports sur l’existence de tels phénomènes se multiplient de nos jours. Cependant, une analyse rigoureuse du mécanisme moléculaire en cause et la preuve formelle qu’il s’agit bien d’une épimutation héréditaire et non pas des effets confondants doivent être absolument apportés avant toute conclusion (Youngson et Whitelaw, 2008 ; Galvani et Bourc’his, 2008
; Galvani et Bourc’his, 2008 ).
).Compte tenu du rôle crucial de la gonade pour la diffusion de signaux déclenchant la déméthylation et la reméthylation dans les deux sexes, il apparaît clair qu’une exposition précoce à des pertubateurs endocriniens est susceptible d’altérer les profils transcriptionnels et épigénétiques des organes cibles des androgènes et œstrogènes, et aussi directement ou indirectement la programmation épigénétique de la lignée germinale. Ci-dessous sont décrits des cas avérés d’altération épigénétique faisant suite à une exposition à des perturbateurs endocriniens connus, avec des effets potentiels sur la reproduction.
Perturbations « épigénotoxiques » liées à la reproduction
Des perturbateurs endocriniens présents dans une large gamme d’insecticides et fongicides, ont des effets adverses connus sur le système reproductif femelle et mâle après exposition in utero. L’étude de leurs effets épigénétiques a souvent été limitée à quelques séquences cibles, choisies pour leur implication dans le développement de la gonade ou du tractus génital en général. Très peu d’études ont étudié directement les profils épigénétiques de la lignée germinale, malgré la documentation d’effets multi- voire transgénérationnels potentiels. Compte tenu de la plus grande facilité d’investigation de la méthylation de l’ADN, ces études sont pour l’instant limitées principalement à cette modification épigénétique.
L’étude la plus médiatisée a été celle développée en réponse à une exposition chez la femelle gestante au fongicide vinclozoline au potentiel anti-androgénique, en prenant pour modèle le rat de fond génétique mixte Sprague-Dawley (Anway et coll., 2005 ). Des expositions par injection de doses élevées de ce composant induisent une variété de phénotypes somatiques et d’anomalies de la spermatogenèse chez le mâle, qui peuvent se perpétuer sur 3 générations (Anway et coll., 2006a
). Des expositions par injection de doses élevées de ce composant induisent une variété de phénotypes somatiques et d’anomalies de la spermatogenèse chez le mâle, qui peuvent se perpétuer sur 3 générations (Anway et coll., 2006a ; Anway et coll., 2006b
; Anway et coll., 2006b ), signant ainsi une imprégnation possible de la lignée germinale. Des anomalies multi-loci dans le sens d’hyper- et d’hypométhylations ont tout d’abord été reportées dans le testicule mais également dans une gamme de tissus somatiques sur plusieurs générations (Chang et coll., 2006
), signant ainsi une imprégnation possible de la lignée germinale. Des anomalies multi-loci dans le sens d’hyper- et d’hypométhylations ont tout d’abord été reportées dans le testicule mais également dans une gamme de tissus somatiques sur plusieurs générations (Chang et coll., 2006 ), avant que cette étude ne soit rétractée pour cause de non reproductibilité des données (Retraction : Chang et coll., 2009). Une étude plus récente des profils de méthylation à grande échelle établis sur le sperme de pools d’individus sur 3 générations après exposition in utero de la F1 à la vinclozoline reporte quelques anomalies modestes de méthylation, toujours dans le sens à la fois de pertes et de gains (Guerrero-Bosagna et coll., 2010
), avant que cette étude ne soit rétractée pour cause de non reproductibilité des données (Retraction : Chang et coll., 2009). Une étude plus récente des profils de méthylation à grande échelle établis sur le sperme de pools d’individus sur 3 générations après exposition in utero de la F1 à la vinclozoline reporte quelques anomalies modestes de méthylation, toujours dans le sens à la fois de pertes et de gains (Guerrero-Bosagna et coll., 2010 ). La méthode de « poolage » ne permet cependant pas de distinguer les effets directs sur la F1 des effets transmis aux générations suivantes. Basées sur l’étude nucléotidique de 16 séquences identifiées comme altérées dans leur méthylation, les anomalies sembleraient préférentiellement toucher une séquence consensus, pourtant appauvrie en cytosines, qui sont les cibles de la méthylation de l’ADN. Pour conclure sur ce chapitre de la vinclozoline, des effets anti-androgéniques sur la génération directement exposée in utero ont été reportés par plusieurs études, avec une altération des organes génitaux externes, mais pas d’effet sur la spermatogenèse (Matsuura et coll., 2005
). La méthode de « poolage » ne permet cependant pas de distinguer les effets directs sur la F1 des effets transmis aux générations suivantes. Basées sur l’étude nucléotidique de 16 séquences identifiées comme altérées dans leur méthylation, les anomalies sembleraient préférentiellement toucher une séquence consensus, pourtant appauvrie en cytosines, qui sont les cibles de la méthylation de l’ADN. Pour conclure sur ce chapitre de la vinclozoline, des effets anti-androgéniques sur la génération directement exposée in utero ont été reportés par plusieurs études, avec une altération des organes génitaux externes, mais pas d’effet sur la spermatogenèse (Matsuura et coll., 2005 ). De plus, les phénotypes épigénétiques transgénérationnels n’ont pas été reproduits, notamment par une équipe de recherche affiliée au producteur allemand de vinclozoline, après un protocole de gavage de la mère gestante plutôt que d’injection et sur une lignée congénique de rats, la lignée Wistar (Schneider et coll., 2008
). De plus, les phénotypes épigénétiques transgénérationnels n’ont pas été reproduits, notamment par une équipe de recherche affiliée au producteur allemand de vinclozoline, après un protocole de gavage de la mère gestante plutôt que d’injection et sur une lignée congénique de rats, la lignée Wistar (Schneider et coll., 2008 ).
).
 ). Des expositions par injection de doses élevées de ce composant induisent une variété de phénotypes somatiques et d’anomalies de la spermatogenèse chez le mâle, qui peuvent se perpétuer sur 3 générations (Anway et coll., 2006a
). Des expositions par injection de doses élevées de ce composant induisent une variété de phénotypes somatiques et d’anomalies de la spermatogenèse chez le mâle, qui peuvent se perpétuer sur 3 générations (Anway et coll., 2006a ; Anway et coll., 2006b
; Anway et coll., 2006b ), signant ainsi une imprégnation possible de la lignée germinale. Des anomalies multi-loci dans le sens d’hyper- et d’hypométhylations ont tout d’abord été reportées dans le testicule mais également dans une gamme de tissus somatiques sur plusieurs générations (Chang et coll., 2006
), signant ainsi une imprégnation possible de la lignée germinale. Des anomalies multi-loci dans le sens d’hyper- et d’hypométhylations ont tout d’abord été reportées dans le testicule mais également dans une gamme de tissus somatiques sur plusieurs générations (Chang et coll., 2006 ), avant que cette étude ne soit rétractée pour cause de non reproductibilité des données (Retraction : Chang et coll., 2009). Une étude plus récente des profils de méthylation à grande échelle établis sur le sperme de pools d’individus sur 3 générations après exposition in utero de la F1 à la vinclozoline reporte quelques anomalies modestes de méthylation, toujours dans le sens à la fois de pertes et de gains (Guerrero-Bosagna et coll., 2010
), avant que cette étude ne soit rétractée pour cause de non reproductibilité des données (Retraction : Chang et coll., 2009). Une étude plus récente des profils de méthylation à grande échelle établis sur le sperme de pools d’individus sur 3 générations après exposition in utero de la F1 à la vinclozoline reporte quelques anomalies modestes de méthylation, toujours dans le sens à la fois de pertes et de gains (Guerrero-Bosagna et coll., 2010 ). La méthode de « poolage » ne permet cependant pas de distinguer les effets directs sur la F1 des effets transmis aux générations suivantes. Basées sur l’étude nucléotidique de 16 séquences identifiées comme altérées dans leur méthylation, les anomalies sembleraient préférentiellement toucher une séquence consensus, pourtant appauvrie en cytosines, qui sont les cibles de la méthylation de l’ADN. Pour conclure sur ce chapitre de la vinclozoline, des effets anti-androgéniques sur la génération directement exposée in utero ont été reportés par plusieurs études, avec une altération des organes génitaux externes, mais pas d’effet sur la spermatogenèse (Matsuura et coll., 2005
). La méthode de « poolage » ne permet cependant pas de distinguer les effets directs sur la F1 des effets transmis aux générations suivantes. Basées sur l’étude nucléotidique de 16 séquences identifiées comme altérées dans leur méthylation, les anomalies sembleraient préférentiellement toucher une séquence consensus, pourtant appauvrie en cytosines, qui sont les cibles de la méthylation de l’ADN. Pour conclure sur ce chapitre de la vinclozoline, des effets anti-androgéniques sur la génération directement exposée in utero ont été reportés par plusieurs études, avec une altération des organes génitaux externes, mais pas d’effet sur la spermatogenèse (Matsuura et coll., 2005 ). De plus, les phénotypes épigénétiques transgénérationnels n’ont pas été reproduits, notamment par une équipe de recherche affiliée au producteur allemand de vinclozoline, après un protocole de gavage de la mère gestante plutôt que d’injection et sur une lignée congénique de rats, la lignée Wistar (Schneider et coll., 2008
). De plus, les phénotypes épigénétiques transgénérationnels n’ont pas été reproduits, notamment par une équipe de recherche affiliée au producteur allemand de vinclozoline, après un protocole de gavage de la mère gestante plutôt que d’injection et sur une lignée congénique de rats, la lignée Wistar (Schneider et coll., 2008 ).
).L’exposition à 100 mg/kg/j de méthoxychlore, un composé utilisé dans les pesticides en remplacement du DTT, en période fœtale et néonatale induit chez le rat femelle une dysfonction ovarienne, associée à des hyperméthylations modestes d’une cohorte de gènes importants pour le développement ovarien, tel que le récepteur beta aux œstrogènes (Zama et Uzumcu, 2009 ). Les effets sur l’expression de ces cibles n’ont malheureusement pas été analysés, d’où la difficulté de conclure sur une participation réelle de ces anomalies de méthylation sur le phénotype. Ces hyperméthylations seraient accompagnées d’une hausse de l’expression de l’ADN-méthyltransférase DNMT3B. Chez le mâle, une exposition en vie adulte au méthoxychlore n’altère pas les paramètres spermatiques, mais induit de modestes anomalies de méthylation des gènes soumis à empreinte. En revanche, l’exposition in utero conduit à une réduction de 30 % du nombre de spermatozoïdes, qui sont de plus porteurs d’anomalies sévères de méthylation sur les gènes soumis à empreinte paternelle (dans le sens d’une hypométhylation) et aussi à empreinte maternelle (dans le sens d’une hyperméthylation) (Stouder et Paoloni-Giacobino, 2010
). Les effets sur l’expression de ces cibles n’ont malheureusement pas été analysés, d’où la difficulté de conclure sur une participation réelle de ces anomalies de méthylation sur le phénotype. Ces hyperméthylations seraient accompagnées d’une hausse de l’expression de l’ADN-méthyltransférase DNMT3B. Chez le mâle, une exposition en vie adulte au méthoxychlore n’altère pas les paramètres spermatiques, mais induit de modestes anomalies de méthylation des gènes soumis à empreinte. En revanche, l’exposition in utero conduit à une réduction de 30 % du nombre de spermatozoïdes, qui sont de plus porteurs d’anomalies sévères de méthylation sur les gènes soumis à empreinte paternelle (dans le sens d’une hypométhylation) et aussi à empreinte maternelle (dans le sens d’une hyperméthylation) (Stouder et Paoloni-Giacobino, 2010 ). Ces effets sur la lignée germinale s’estompent en génération F2 pour disparaître en F3, n’impliquant donc pas de transmission transgénérationnelle.
). Ces effets sur la lignée germinale s’estompent en génération F2 pour disparaître en F3, n’impliquant donc pas de transmission transgénérationnelle.
 ). Les effets sur l’expression de ces cibles n’ont malheureusement pas été analysés, d’où la difficulté de conclure sur une participation réelle de ces anomalies de méthylation sur le phénotype. Ces hyperméthylations seraient accompagnées d’une hausse de l’expression de l’ADN-méthyltransférase DNMT3B. Chez le mâle, une exposition en vie adulte au méthoxychlore n’altère pas les paramètres spermatiques, mais induit de modestes anomalies de méthylation des gènes soumis à empreinte. En revanche, l’exposition in utero conduit à une réduction de 30 % du nombre de spermatozoïdes, qui sont de plus porteurs d’anomalies sévères de méthylation sur les gènes soumis à empreinte paternelle (dans le sens d’une hypométhylation) et aussi à empreinte maternelle (dans le sens d’une hyperméthylation) (Stouder et Paoloni-Giacobino, 2010
). Les effets sur l’expression de ces cibles n’ont malheureusement pas été analysés, d’où la difficulté de conclure sur une participation réelle de ces anomalies de méthylation sur le phénotype. Ces hyperméthylations seraient accompagnées d’une hausse de l’expression de l’ADN-méthyltransférase DNMT3B. Chez le mâle, une exposition en vie adulte au méthoxychlore n’altère pas les paramètres spermatiques, mais induit de modestes anomalies de méthylation des gènes soumis à empreinte. En revanche, l’exposition in utero conduit à une réduction de 30 % du nombre de spermatozoïdes, qui sont de plus porteurs d’anomalies sévères de méthylation sur les gènes soumis à empreinte paternelle (dans le sens d’une hypométhylation) et aussi à empreinte maternelle (dans le sens d’une hyperméthylation) (Stouder et Paoloni-Giacobino, 2010 ). Ces effets sur la lignée germinale s’estompent en génération F2 pour disparaître en F3, n’impliquant donc pas de transmission transgénérationnelle.
). Ces effets sur la lignée germinale s’estompent en génération F2 pour disparaître en F3, n’impliquant donc pas de transmission transgénérationnelle.En réponse à une exposition in utero chez la souris à l’agent pro-œstrogénique diéthylstilbœstrol, une diminution de l’expression et une légère hyperméthylation ont été rapportées sur une cible du récepteur aux œstrogènes, le gène Hx10a, en association avec une expression accrue des DNMT3A et DNMT3B (Bromer et coll., 2009 ). Cette hyperméthylation pourrait participer au développement de tumeurs épithéliales de l’utérus observées chez les souris femelles ainsi exposées. Une étude menée sur plusieurs générations suggère que ces effets pourraient s’étendre à la lignée germinale des souris exposées in utero, puisque leurs descendants présentent le même phénotype de susceptibilité accrue à ce type de tumeur de l’utérus (Newbold et coll., 1998
). Cette hyperméthylation pourrait participer au développement de tumeurs épithéliales de l’utérus observées chez les souris femelles ainsi exposées. Une étude menée sur plusieurs générations suggère que ces effets pourraient s’étendre à la lignée germinale des souris exposées in utero, puisque leurs descendants présentent le même phénotype de susceptibilité accrue à ce type de tumeur de l’utérus (Newbold et coll., 1998 ; Newbold et coll., 2006
; Newbold et coll., 2006 ). Cet effet est cependant atténué en proportion par rapport à la génération directement exposée. Chez le mâle, l’exposition in utero au diéthylstilbœstrol induit aussi des tumeurs du tractus génital, chez le mâle directement exposé mais également chez la descendance mâle de femelles exposées (Newbold et coll., 2000
). Cet effet est cependant atténué en proportion par rapport à la génération directement exposée. Chez le mâle, l’exposition in utero au diéthylstilbœstrol induit aussi des tumeurs du tractus génital, chez le mâle directement exposé mais également chez la descendance mâle de femelles exposées (Newbold et coll., 2000 ). Aucune étude des profils épigénétiques n’a cependant été réalisée pour permettre de conclure sur l’origine et la transmission possible de ce phénotype chez le mâle.
). Aucune étude des profils épigénétiques n’a cependant été réalisée pour permettre de conclure sur l’origine et la transmission possible de ce phénotype chez le mâle.
 ). Cette hyperméthylation pourrait participer au développement de tumeurs épithéliales de l’utérus observées chez les souris femelles ainsi exposées. Une étude menée sur plusieurs générations suggère que ces effets pourraient s’étendre à la lignée germinale des souris exposées in utero, puisque leurs descendants présentent le même phénotype de susceptibilité accrue à ce type de tumeur de l’utérus (Newbold et coll., 1998
). Cette hyperméthylation pourrait participer au développement de tumeurs épithéliales de l’utérus observées chez les souris femelles ainsi exposées. Une étude menée sur plusieurs générations suggère que ces effets pourraient s’étendre à la lignée germinale des souris exposées in utero, puisque leurs descendants présentent le même phénotype de susceptibilité accrue à ce type de tumeur de l’utérus (Newbold et coll., 1998 ; Newbold et coll., 2006
; Newbold et coll., 2006 ). Cet effet est cependant atténué en proportion par rapport à la génération directement exposée. Chez le mâle, l’exposition in utero au diéthylstilbœstrol induit aussi des tumeurs du tractus génital, chez le mâle directement exposé mais également chez la descendance mâle de femelles exposées (Newbold et coll., 2000
). Cet effet est cependant atténué en proportion par rapport à la génération directement exposée. Chez le mâle, l’exposition in utero au diéthylstilbœstrol induit aussi des tumeurs du tractus génital, chez le mâle directement exposé mais également chez la descendance mâle de femelles exposées (Newbold et coll., 2000 ). Aucune étude des profils épigénétiques n’a cependant été réalisée pour permettre de conclure sur l’origine et la transmission possible de ce phénotype chez le mâle.
). Aucune étude des profils épigénétiques n’a cependant été réalisée pour permettre de conclure sur l’origine et la transmission possible de ce phénotype chez le mâle.Bibliographie
[1] ANWAY M, CUPP A, UZUMCU M, SKINNER MICHAEL K. Epigenetic Transgenerational Actions of Endocrine Disruptors and Male Fertility.
Science. 2005;
308:1466- 1469

[2] ANWAY MD, LEATHERS C, SKINNER MK. Endocrine disruptor vinclozolin induced epigenetic transgenerational adult-onset disease.
Endocrinology. 2006a;
147:5515- 5523

[3] ANWAY MD, MEMON MA, UZUMCU M, SKINNER MK. Transgenerational effect of the endocrine disruptor vinclozolin on male spermatogenesis.
J Androl. 2006b;
27:868- 879

[4] BORGEL J, GUIBERT S, LI Y, CHIBA H, SCHÜBELER D, SASAKI H, et coll. Targets and dynamics of promoter DNA methylation during early mouse development.
Nat Genet. 2010;
42:1093- 1100

[5] BOURC’HIS D, BESTOR TH. Meiotic catastrophe and retrotransposon reactivation in male germ cells lacking Dnmt3L.
Nature. 2004;
431:96- 99

[6] BOURC’HIS D, PROUDHON C. Sexual dimorphism in parental imprint ontogeny and contribution to embryonic development.
Mol Cell Endocrinol. 2008;
282:87- 94

[7] BOURC’HIS D, XU GL, LIN CS, BOLLMAN B, BESTOR TH. Dnmt3L and the establishment of maternal genomic imprints.
Science. 2001;
294:2536- 2539

[8] BROMER JG, WU J, ZHOU Y, TAYLOR HS. Hypermethylation of HOXA10 by in utero diethylstilbœstrol exposure: an epigenetic mechanism for altered developmental programming.
Endocrinology. 2009;
150:3376- 3382

[9] CHANG HS, ANWAY MD, REKOW SS, SKINNER MK. Transgenerational epigenetic imprinting of the male germline by endocrine disruptor exposure during gonadal sex determination.
Endocrinology. 2006;
147:55245541Retraction : Endocrinology 2009, 150 : 2976. 

[10] DOLINOY DC, HUANG D, JIRTLE RL. Maternal nutrient supplementation counteracts bisphenol A-induced DNA hypomethylation in early development.
Proc Natl Acad Sci USA. 2007;
104:13056- 13061

[11] FAUQUE P, JOUANNET P, LESAFFRE C, RIPOCHE MA, DANDOLO L, et coll. Assisted Reproductive Technology affects developmental kinetics, H19 Imprinting Control Region methylation and H19 gene expression in individual mouse embryos.
BMC Dev Biol. 2007;
7:116

[12] FRAGA MF, BALLESTAR E, PAZ MF, ROPERO S, SETIEN F, BALLESTAR ML, et coll. Epigenetic differences arise during the lifetime of monozygotic twins.
Proc Natl Acad Sci USA. 2005;
102:10604- 10609

[13] GALVANI A, BOURC’HIS D. Heritable epimutations: a case study in humans.
Med Sci. (Paris): 2008;
24:473474

[15] GUERRERO-BOSAGNA C, SETTLES M, LUCKER B, SKINNER MK. Epigenetic transgenerational actions of vinclozolin on promoter regions of the sperm epigenome.
PLoS One. 2010;
5:e13100

[16] HAJKOVA P, ERHARDT S, LANE N, HAAF T, EL-MAARRI O, REIK W, et coll. Epigenetic reprogramming in mouse primordial germ cells.
Mech Dev. 2002;
117:15- 23

[17] HOLLIDAY R. Mechanisms for the control of gene activity during development.
Biol Rev Camb Philos Soc. 1990;
65:431- 471

[18] KAMINSKY ZA, TANG T, WANG SC, PTAK C, OH GH, WONG AH, et coll. DNA methylation profiles in monozygotic and dizygotic twins.
Nat Genet. 2009;
41:240- 245

[20] LUCIFERO D, MANN MR, BARTOLOMEI MS, TRASLER JM. Gene-specific timing and epigenetic memory in oocyte imprinting.
Hum Mol Genet. 2004;
13:839- 849

[21] MATSUURA I, SAITOH T, ASHINA M, WAKO Y, IWATA H, et coll. Evaluation of a two-generation reproduction toxicity study adding endpoints to detect endocrine disrupting activity using vinclozolin.
J Toxicol Sci. 2005;
30 (no spec):163- 188

[22] MORGAN HD, SUTHERLAND HG, MARTIN DI, WHITELAW E. Epigenetic inheritance at the agouti locus in the mouse.
Nat Genet. 1999;
23:314- 318

[23] NEWBOLD RR, HANSON RB, JEFFERSON WN, BULLOCK BC, HASEMAN J, MCLACHLAN JA. Increased tumors but uncompromised fertility in the female descendants of mice exposed developmentally to diethylstilbœstrol.
Carcinogenesis. 1998;
19:1655- 1663

[24] NEWBOLD RR, HANSON RB, JEFFERSON WN, BULLOCK BC, HASEMAN J, MCLACHLAN JA. Proliferative lesions and reproductive tract tumors in male descendants of mice exposed developmentally to diethylstilbœstrol.
Carcinogenesis. 2000;
21:1355- 1363

[25] NEWBOLD RR, PADILLA-BANKS E, JEFFERSON WN. Adverse effects of the model environmental estrogen diethylstilbestrol are transmitted to subsequent generations.
Endocrinology. 2006;
147:S11- S17

[26] ORSTAVIK RE, TOMMERUP N, EIKLID K, ORSTAVIK KH. Non-random X chromosome inactivation in an affected twin in a monozygotic twin pair discordant for Wiedemann-Beckwith syndrome.
Am J Med Genet. 1995;
56:210- 214

[27] POPP C, DEAN W, FENG S, COKUS SJ, ANDREWS S, et coll. Genome-wide erasure of DNA methylation in mouse primordial germ cells is affected by AID deficiency.
Nature. 2010;
463:1101- 1105

[28] RAKYAN VK, CHONG S, CHAMP ME, CUTHBERT PC, MORGAN HD, et coll. Transgenerational inheritance of epigenetic states at the murine Axin(Fu) allele occurs after maternal and paternal transmission.
Proc Natl Acad Sci U S A. 2003;
100:2538- 2543

[29] SANDOVICI I, KASSOVSKA-BRATINOVA S, LOREDO-OSTI JC, LEPPERT M, SUAREZ A, et coll. Interindividual variability and parent of origin DNA methylation differences at specific human Alu elements.
Hum Mol Genet. 2005;
14:2135- 2143

[30] SCHAEFER CB, OOI SK, BESTOR TH, BOURC’HIS D. Epigenetic decisions in mammalian germ cells.
Science. 2007;
316:398- 399

[31] SCHNEIDER S, KAUFMANN W, BUESEN R, VAN RAVENZWAAY B. Vinclozolin-the lack of a transgenerational effect after oral maternal exposure during organogenesis.
Reprod Toxicol. 2008;
25:352- 360

[32] STOUDER C, PAOLONI-GIACOBINO A. Specific transgenerational imprinting effects of the endocrine disruptor methoxychlor on male gametes.
Reproduction. 2010;
Nov 9. (Epub ahead of print);


[33] TRASLER JM. Gamete imprinting: setting epigenetic patterns for the next generation.
Reprod Fertil Dev. 2006;
18:63- 69

[34] VAN VLIET J, OATES NA, WHITELAW E. Epigenetic mechanisms in the context of complex diseases.
Cell Mol Life Sci. 2007;
64:1531- 1538

[35] WATERLAND RA, DOLINOY DC, LIN JR, SMITH CA, SHI X, TAHILIANI KG. Maternal methyl supplements increase offspring DNA methylation at Axin Fused.
Genesis. 2006;
44:401- 406

[36] WOLFF GL, KODELL RL, MOORE SR, COONEY CA. Maternal epigenetics and methyl supplements affect agouti gene expression in Avy/a mice.
FASEB J. 1998;
12:949- 957

[37] XU GL, BESTOR TH, BOURC’HIS D, HSIEH CL, TOMMERUP N, et coll. Chromosome instability and immunodeficiency syndrome caused by mutations in a DNA methyltransferase gene.
Nature. 1999;
402:187- 191

[38] YOUNGSON NA, WHITELAW E. Transgenerational epigenetic effects.
Annu Rev Genomics Hum Genet. 2008;
9:233- 257

[39] ZAMA AM, UZUMCU M. Fetal and neonatal exposure to the endocrine disruptor methoxychlor causes epigenetic alterations in adult ovarian genes.
Endocrinology. 2009;
150:4681- 4691

→ Aller vers SYNTHESE