Bisphénol A
2011
| ANALYSE |
29-
Mécanismes d’action
Le bisphénol A (BPA) est un agoniste faible des œstrogènes pouvant se lier aux récepteurs nucléaires des œstrogènes α et β (ERα et β) et activer une réponse qui a été largement considérée comme la source de ses « effets » indésirables dans (certaines) études animales. Cependant, le BPA présente plusieurs milliers de fois moins d’affinité pour ERα et β que l’œstradiol. Certaines études in vitro ont montré également que le BPA a des effets anti-androgéniques et peut se lier au récepteur des androgènes (AR) (Sun et coll., 2006 ), mais les preuves d’effets antiandrogéniques in vivo chez l’animal sont rares ou absentes (Kobayashi et coll., 2002
), mais les preuves d’effets antiandrogéniques in vivo chez l’animal sont rares ou absentes (Kobayashi et coll., 2002 ; Tyl et coll., 2002
; Tyl et coll., 2002 ; Howdeshell et coll., 2008
; Howdeshell et coll., 2008 ). Plus récemment, des liaisons du BPA à d’autres récepteurs nucléaires ou membranaires ont été démontrées.
). Plus récemment, des liaisons du BPA à d’autres récepteurs nucléaires ou membranaires ont été démontrées.
 ), mais les preuves d’effets antiandrogéniques in vivo chez l’animal sont rares ou absentes (Kobayashi et coll., 2002
), mais les preuves d’effets antiandrogéniques in vivo chez l’animal sont rares ou absentes (Kobayashi et coll., 2002 ; Tyl et coll., 2002
; Tyl et coll., 2002 ; Howdeshell et coll., 2008
; Howdeshell et coll., 2008 ). Plus récemment, des liaisons du BPA à d’autres récepteurs nucléaires ou membranaires ont été démontrées.
). Plus récemment, des liaisons du BPA à d’autres récepteurs nucléaires ou membranaires ont été démontrées.Récepteurs nucléaires des œstrogènes alpha et bêta
Le BPA avec ses deux noyaux phénoliques a un mode de liaison à ERα et β similaire à celui de l’œstradiol (E2) (figure 29.1 ). Cependant son affinité est 10 000 fois plus faible que celle de l’œstradiol et est similaire pour les deux récepteurs (Kuiper et coll., 1998
). Cependant son affinité est 10 000 fois plus faible que celle de l’œstradiol et est similaire pour les deux récepteurs (Kuiper et coll., 1998 ).
).
 ). Cependant son affinité est 10 000 fois plus faible que celle de l’œstradiol et est similaire pour les deux récepteurs (Kuiper et coll., 1998
). Cependant son affinité est 10 000 fois plus faible que celle de l’œstradiol et est similaire pour les deux récepteurs (Kuiper et coll., 1998 ).
).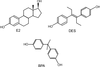 | Figure 29.1 Structures chimiques de l’œstradiol (E2), du diéthylstilbestrol (DES) et du bisphénol A (BPA) |
Le BPA est considéré comme un Selective Estrogen Receptor Modulator (SERM). Les SERM sont souvent des molécules à activité agoniste partielle. Cette activité varie selon le promoteur du gène étudié, selon le contexte cellulaire (in vitro) ou l’organe considéré (in vivo). Cet agonisme partiel a été étudié par Gould (Gould et coll., 1998 ) qui a par exemple montré qu’in vitro le BPA est moins actif que E2 sur ERα délété de son domaine d’activation constitutive AF-1. Les travaux de Sumpter (Routledge et coll., 2000
) qui a par exemple montré qu’in vitro le BPA est moins actif que E2 sur ERα délété de son domaine d’activation constitutive AF-1. Les travaux de Sumpter (Routledge et coll., 2000 ) ont montré que le recrutement de co-facteurs transcriptionnels différait entre E2 et BPA. Enfin, en lien avec cette activité d’agoniste partiel, certaines réponses in vivo de l’œstradiol dans l’utérus de souris ne sont pas observées avec le BPA comme l’augmentation du poids de l’utérus alors que d’autres sont maintenues comme une activité peroxydase ainsi qu’une augmentation de l’expression du récepteur de la progestérone (Gould et coll., 1998
) ont montré que le recrutement de co-facteurs transcriptionnels différait entre E2 et BPA. Enfin, en lien avec cette activité d’agoniste partiel, certaines réponses in vivo de l’œstradiol dans l’utérus de souris ne sont pas observées avec le BPA comme l’augmentation du poids de l’utérus alors que d’autres sont maintenues comme une activité peroxydase ainsi qu’une augmentation de l’expression du récepteur de la progestérone (Gould et coll., 1998 ). Ces résultats ont été confortés par les travaux de Nagel qui ont montré qu’un traitement au BPA augmentait peu la croissance utérine et en revanche activait l’expression d’un gène rapporteur (Nagel et coll., 2001
). Ces résultats ont été confortés par les travaux de Nagel qui ont montré qu’un traitement au BPA augmentait peu la croissance utérine et en revanche activait l’expression d’un gène rapporteur (Nagel et coll., 2001 ). Au contraire, d’autres SERM comme l’hydroxy-tamoxifène utilisé pour le traitement du cancer du sein est actif sur la croissance utérine et sans effet sur l’activation du gène rapporteur. Le fait que le BPA soit un SERM peut expliquer pourquoi certaines études n’ont pas pu montrer d’effets in vivo de ce composé. Ainsi, le BPA présente à peu près les mêmes effets que E2 au niveau de la prostate de fœtus murins (Timms et coll., 2005
). Au contraire, d’autres SERM comme l’hydroxy-tamoxifène utilisé pour le traitement du cancer du sein est actif sur la croissance utérine et sans effet sur l’activation du gène rapporteur. Le fait que le BPA soit un SERM peut expliquer pourquoi certaines études n’ont pas pu montrer d’effets in vivo de ce composé. Ainsi, le BPA présente à peu près les mêmes effets que E2 au niveau de la prostate de fœtus murins (Timms et coll., 2005 ). En revanche, ces effets diffèrent beaucoup de ceux de E2 dans l’utérus (Markey et coll., 2001
). En revanche, ces effets diffèrent beaucoup de ceux de E2 dans l’utérus (Markey et coll., 2001 ).
).
 ) qui a par exemple montré qu’in vitro le BPA est moins actif que E2 sur ERα délété de son domaine d’activation constitutive AF-1. Les travaux de Sumpter (Routledge et coll., 2000
) qui a par exemple montré qu’in vitro le BPA est moins actif que E2 sur ERα délété de son domaine d’activation constitutive AF-1. Les travaux de Sumpter (Routledge et coll., 2000 ) ont montré que le recrutement de co-facteurs transcriptionnels différait entre E2 et BPA. Enfin, en lien avec cette activité d’agoniste partiel, certaines réponses in vivo de l’œstradiol dans l’utérus de souris ne sont pas observées avec le BPA comme l’augmentation du poids de l’utérus alors que d’autres sont maintenues comme une activité peroxydase ainsi qu’une augmentation de l’expression du récepteur de la progestérone (Gould et coll., 1998
) ont montré que le recrutement de co-facteurs transcriptionnels différait entre E2 et BPA. Enfin, en lien avec cette activité d’agoniste partiel, certaines réponses in vivo de l’œstradiol dans l’utérus de souris ne sont pas observées avec le BPA comme l’augmentation du poids de l’utérus alors que d’autres sont maintenues comme une activité peroxydase ainsi qu’une augmentation de l’expression du récepteur de la progestérone (Gould et coll., 1998 ). Ces résultats ont été confortés par les travaux de Nagel qui ont montré qu’un traitement au BPA augmentait peu la croissance utérine et en revanche activait l’expression d’un gène rapporteur (Nagel et coll., 2001
). Ces résultats ont été confortés par les travaux de Nagel qui ont montré qu’un traitement au BPA augmentait peu la croissance utérine et en revanche activait l’expression d’un gène rapporteur (Nagel et coll., 2001 ). Au contraire, d’autres SERM comme l’hydroxy-tamoxifène utilisé pour le traitement du cancer du sein est actif sur la croissance utérine et sans effet sur l’activation du gène rapporteur. Le fait que le BPA soit un SERM peut expliquer pourquoi certaines études n’ont pas pu montrer d’effets in vivo de ce composé. Ainsi, le BPA présente à peu près les mêmes effets que E2 au niveau de la prostate de fœtus murins (Timms et coll., 2005
). Au contraire, d’autres SERM comme l’hydroxy-tamoxifène utilisé pour le traitement du cancer du sein est actif sur la croissance utérine et sans effet sur l’activation du gène rapporteur. Le fait que le BPA soit un SERM peut expliquer pourquoi certaines études n’ont pas pu montrer d’effets in vivo de ce composé. Ainsi, le BPA présente à peu près les mêmes effets que E2 au niveau de la prostate de fœtus murins (Timms et coll., 2005 ). En revanche, ces effets diffèrent beaucoup de ceux de E2 dans l’utérus (Markey et coll., 2001
). En revanche, ces effets diffèrent beaucoup de ceux de E2 dans l’utérus (Markey et coll., 2001 ).
).Enfin, la faible affinité du BPA pour ERα et β ne permet pas d’expliquer les effets observés à faible dose à la fois in vitro et in vivo. De plus, certaines études ont montré des réponses au BPA qui suivent des courbes non monotones et qui ne peuvent pas être expliquées par une action sur un seul type de récepteur. C’est pour ces raisons que plusieurs groupes de scientifiques ont cherché à identifier d’autres médiateurs des effets du BPA. La liaison du BPA avec des affinités variées à plusieurs récepteurs ayant des actions différentes pourrait expliquer d’une part des effets à faible dose (plus faible que celle permettant la liaison à ERα et β) et d’autre part des effets particuliers suivant la dose. Les différents récepteurs pouvant médier les effets du BPA sont décrits ci-dessous.
Récepteurs des œstrogènes membranaires
Des études récentes ont montré que le BPA pouvait d’une part avoir des effets à des concentrations plus faibles que celles auxquelles il se lie à ERα et β et d’autre part agir très rapidement (quelques minutes) ce qui exclut une action médiée par des récepteurs nucléaires. Des effets dits « non génomiques » pourraient faire intervenir des récepteurs localisés dans le cytoplasme, dans la mitochondrie ou dans la membrane cytoplasmique. Deux types de récepteurs ont été décrits.
Les premiers pourraient être des formes membranaires de ERα et β (mERα et β). La localisation à la membrane de ces récepteurs n’est pas clairement expliquée mais elle pourrait être due à des modifications post-traductionnelles comme la palmitoylation (Hammes et Levin, 2007 ). Le groupe de Watson a proposé que le BPA pourrait médier une partie des effets par ce type de récepteurs (Watson et coll., 2007a
). Le groupe de Watson a proposé que le BPA pourrait médier une partie des effets par ce type de récepteurs (Watson et coll., 2007a et b
et b , 2010
, 2010 ). Les auteurs ont montré que le BPA à des doses très faibles (1 picomolaire) induisait rapidement (en moins d’une minute) l’augmentation de calcium intracellulaire puis la sécrétion de prolactine dans la lignée pituitaire GH3/B6. Ces réponses ne peuvent pas être représentées par une courbe monotone. Egalement observés avec E2, ces effets sont inhibés par un co-traitement avec du fulvestrant (un anti-œstrogène). L’augmentation de calcium intracellulaire à des doses faibles de BPA (0,1-1 nM) a également été observée dans des cellules pancréatiques (Quesada et coll., 2002
). Les auteurs ont montré que le BPA à des doses très faibles (1 picomolaire) induisait rapidement (en moins d’une minute) l’augmentation de calcium intracellulaire puis la sécrétion de prolactine dans la lignée pituitaire GH3/B6. Ces réponses ne peuvent pas être représentées par une courbe monotone. Egalement observés avec E2, ces effets sont inhibés par un co-traitement avec du fulvestrant (un anti-œstrogène). L’augmentation de calcium intracellulaire à des doses faibles de BPA (0,1-1 nM) a également été observée dans des cellules pancréatiques (Quesada et coll., 2002 ) ainsi que dans la lignée de cancer du sein MCF-7 (Walsh et coll., 2005
) ainsi que dans la lignée de cancer du sein MCF-7 (Walsh et coll., 2005 ). La liaison à des récepteurs des œstrogènes membranaires permet d’expliquer certains des effets rapides (ou non génomiques) du BPA. En revanche, elle ne permet pas d’expliquer les effets à faible concentration. En effet, il est supposé que ces formes membranaires ont la même affinité pour le BPA que les formes nucléaires.
). La liaison à des récepteurs des œstrogènes membranaires permet d’expliquer certains des effets rapides (ou non génomiques) du BPA. En revanche, elle ne permet pas d’expliquer les effets à faible concentration. En effet, il est supposé que ces formes membranaires ont la même affinité pour le BPA que les formes nucléaires.
 ). Le groupe de Watson a proposé que le BPA pourrait médier une partie des effets par ce type de récepteurs (Watson et coll., 2007a
). Le groupe de Watson a proposé que le BPA pourrait médier une partie des effets par ce type de récepteurs (Watson et coll., 2007a et b
et b , 2010
, 2010 ). Les auteurs ont montré que le BPA à des doses très faibles (1 picomolaire) induisait rapidement (en moins d’une minute) l’augmentation de calcium intracellulaire puis la sécrétion de prolactine dans la lignée pituitaire GH3/B6. Ces réponses ne peuvent pas être représentées par une courbe monotone. Egalement observés avec E2, ces effets sont inhibés par un co-traitement avec du fulvestrant (un anti-œstrogène). L’augmentation de calcium intracellulaire à des doses faibles de BPA (0,1-1 nM) a également été observée dans des cellules pancréatiques (Quesada et coll., 2002
). Les auteurs ont montré que le BPA à des doses très faibles (1 picomolaire) induisait rapidement (en moins d’une minute) l’augmentation de calcium intracellulaire puis la sécrétion de prolactine dans la lignée pituitaire GH3/B6. Ces réponses ne peuvent pas être représentées par une courbe monotone. Egalement observés avec E2, ces effets sont inhibés par un co-traitement avec du fulvestrant (un anti-œstrogène). L’augmentation de calcium intracellulaire à des doses faibles de BPA (0,1-1 nM) a également été observée dans des cellules pancréatiques (Quesada et coll., 2002 ) ainsi que dans la lignée de cancer du sein MCF-7 (Walsh et coll., 2005
) ainsi que dans la lignée de cancer du sein MCF-7 (Walsh et coll., 2005 ). La liaison à des récepteurs des œstrogènes membranaires permet d’expliquer certains des effets rapides (ou non génomiques) du BPA. En revanche, elle ne permet pas d’expliquer les effets à faible concentration. En effet, il est supposé que ces formes membranaires ont la même affinité pour le BPA que les formes nucléaires.
). La liaison à des récepteurs des œstrogènes membranaires permet d’expliquer certains des effets rapides (ou non génomiques) du BPA. En revanche, elle ne permet pas d’expliquer les effets à faible concentration. En effet, il est supposé que ces formes membranaires ont la même affinité pour le BPA que les formes nucléaires. Un deuxième médiateur des effets non génomiques du BPA pourrait être le récepteur transmembranaire couplé aux protéines G, GPR30. Ce récepteur différent des récepteurs nucléaires des œstrogènes est localisé dans le réticulum endoplasmique et il pourrait lier le BPA à faible concentration. Les travaux du groupe de Fénichel (Bouskine et coll., 2008 et 2009
et 2009 ) ont montré que le BPA stimulait la prolifération des cellules testiculaires JKT-1. Cet effet est observable aux faibles doses (1 picomolaire) et s’atténue aux fortes doses (courbe en U inversé). Une augmentation de la prolifération des cellules testiculaires JKT-1 est également observée avec de l’œstradiol couplé à de la BSA (dans ce cas, l’œstradiol ne peut pas pénétrer dans la cellule) alors qu’une inhibition est observée avec l’œstradiol non couplé à la BSA. Les cellules testiculaires JKT-1 expriment GPR30 et le récepteur nucléaire des œstrogènes ERβ. ERβ contrairement au récepteur nucléaire ERα inhibe généralement la prolifération cellulaire (Hartmann et coll., 2006
) ont montré que le BPA stimulait la prolifération des cellules testiculaires JKT-1. Cet effet est observable aux faibles doses (1 picomolaire) et s’atténue aux fortes doses (courbe en U inversé). Une augmentation de la prolifération des cellules testiculaires JKT-1 est également observée avec de l’œstradiol couplé à de la BSA (dans ce cas, l’œstradiol ne peut pas pénétrer dans la cellule) alors qu’une inhibition est observée avec l’œstradiol non couplé à la BSA. Les cellules testiculaires JKT-1 expriment GPR30 et le récepteur nucléaire des œstrogènes ERβ. ERβ contrairement au récepteur nucléaire ERα inhibe généralement la prolifération cellulaire (Hartmann et coll., 2006 ; Williams et coll., 2008
; Williams et coll., 2008 ). Dans cette étude, les auteurs proposent que le BPA à faibles concentrations (inférieures au nM) active la prolifération à travers GPR30. En revanche, à fortes concentrations (>1 nM), le BPA se lie également à ERβ qui ayant une action antiproliférative bloquerait les effets activateurs de GPR30 sur la croissance cellulaire. Ainsi, E2 qui se lie avec une bonne affinité aux deux récepteurs (ERβ et GPR30) est plutôt antiprolifératif. Au contraire, l’œstradiol modifié ne pouvant pas pénétrer dans la cellule (couplé à la BSA) se lie uniquement à GPR30 et présente un effet prolifératif. Cette étude illustre bien comment le BPA peut exercer des effets différents en fonction de sa concentration. Il agirait sur au moins deux récepteurs (ici GPR30 et ERβ) en se liant avec des affinités différentes (fortes pour GPR30, faible pour ERβ) qui ont des actions opposées sur une même réponse cellulaire (ici la prolifération).
). Dans cette étude, les auteurs proposent que le BPA à faibles concentrations (inférieures au nM) active la prolifération à travers GPR30. En revanche, à fortes concentrations (>1 nM), le BPA se lie également à ERβ qui ayant une action antiproliférative bloquerait les effets activateurs de GPR30 sur la croissance cellulaire. Ainsi, E2 qui se lie avec une bonne affinité aux deux récepteurs (ERβ et GPR30) est plutôt antiprolifératif. Au contraire, l’œstradiol modifié ne pouvant pas pénétrer dans la cellule (couplé à la BSA) se lie uniquement à GPR30 et présente un effet prolifératif. Cette étude illustre bien comment le BPA peut exercer des effets différents en fonction de sa concentration. Il agirait sur au moins deux récepteurs (ici GPR30 et ERβ) en se liant avec des affinités différentes (fortes pour GPR30, faible pour ERβ) qui ont des actions opposées sur une même réponse cellulaire (ici la prolifération).
 et 2009
et 2009 ) ont montré que le BPA stimulait la prolifération des cellules testiculaires JKT-1. Cet effet est observable aux faibles doses (1 picomolaire) et s’atténue aux fortes doses (courbe en U inversé). Une augmentation de la prolifération des cellules testiculaires JKT-1 est également observée avec de l’œstradiol couplé à de la BSA (dans ce cas, l’œstradiol ne peut pas pénétrer dans la cellule) alors qu’une inhibition est observée avec l’œstradiol non couplé à la BSA. Les cellules testiculaires JKT-1 expriment GPR30 et le récepteur nucléaire des œstrogènes ERβ. ERβ contrairement au récepteur nucléaire ERα inhibe généralement la prolifération cellulaire (Hartmann et coll., 2006
) ont montré que le BPA stimulait la prolifération des cellules testiculaires JKT-1. Cet effet est observable aux faibles doses (1 picomolaire) et s’atténue aux fortes doses (courbe en U inversé). Une augmentation de la prolifération des cellules testiculaires JKT-1 est également observée avec de l’œstradiol couplé à de la BSA (dans ce cas, l’œstradiol ne peut pas pénétrer dans la cellule) alors qu’une inhibition est observée avec l’œstradiol non couplé à la BSA. Les cellules testiculaires JKT-1 expriment GPR30 et le récepteur nucléaire des œstrogènes ERβ. ERβ contrairement au récepteur nucléaire ERα inhibe généralement la prolifération cellulaire (Hartmann et coll., 2006 ; Williams et coll., 2008
; Williams et coll., 2008 ). Dans cette étude, les auteurs proposent que le BPA à faibles concentrations (inférieures au nM) active la prolifération à travers GPR30. En revanche, à fortes concentrations (>1 nM), le BPA se lie également à ERβ qui ayant une action antiproliférative bloquerait les effets activateurs de GPR30 sur la croissance cellulaire. Ainsi, E2 qui se lie avec une bonne affinité aux deux récepteurs (ERβ et GPR30) est plutôt antiprolifératif. Au contraire, l’œstradiol modifié ne pouvant pas pénétrer dans la cellule (couplé à la BSA) se lie uniquement à GPR30 et présente un effet prolifératif. Cette étude illustre bien comment le BPA peut exercer des effets différents en fonction de sa concentration. Il agirait sur au moins deux récepteurs (ici GPR30 et ERβ) en se liant avec des affinités différentes (fortes pour GPR30, faible pour ERβ) qui ont des actions opposées sur une même réponse cellulaire (ici la prolifération).
). Dans cette étude, les auteurs proposent que le BPA à faibles concentrations (inférieures au nM) active la prolifération à travers GPR30. En revanche, à fortes concentrations (>1 nM), le BPA se lie également à ERβ qui ayant une action antiproliférative bloquerait les effets activateurs de GPR30 sur la croissance cellulaire. Ainsi, E2 qui se lie avec une bonne affinité aux deux récepteurs (ERβ et GPR30) est plutôt antiprolifératif. Au contraire, l’œstradiol modifié ne pouvant pas pénétrer dans la cellule (couplé à la BSA) se lie uniquement à GPR30 et présente un effet prolifératif. Cette étude illustre bien comment le BPA peut exercer des effets différents en fonction de sa concentration. Il agirait sur au moins deux récepteurs (ici GPR30 et ERβ) en se liant avec des affinités différentes (fortes pour GPR30, faible pour ERβ) qui ont des actions opposées sur une même réponse cellulaire (ici la prolifération).Le rôle de GPR30 dans la prolifération cellulaire a été confirmé par d’autres études comme celles du groupe de Maggiolini (Albanito et coll., 2007 ; Sirianni et coll., 2008
; Sirianni et coll., 2008 ). Ces travaux ont montré dans la lignée spermatogonique GC-1 que E2 ou un ligand sélectif de GPR30 (ligand G1) activait la prolifération cellulaire par un mécanisme non génomique (Sirianni et coll., 2008
). Ces travaux ont montré dans la lignée spermatogonique GC-1 que E2 ou un ligand sélectif de GPR30 (ligand G1) activait la prolifération cellulaire par un mécanisme non génomique (Sirianni et coll., 2008 ). Cette équipe a également montré que GPR30 pouvait médier certains des effets de E2 dans des lignées de cancer de l’ovaire ou du sein ER alpha positives ou négatives (Albanito et coll., 2007
). Cette équipe a également montré que GPR30 pouvait médier certains des effets de E2 dans des lignées de cancer de l’ovaire ou du sein ER alpha positives ou négatives (Albanito et coll., 2007 ).
).
 ; Sirianni et coll., 2008
; Sirianni et coll., 2008 ). Ces travaux ont montré dans la lignée spermatogonique GC-1 que E2 ou un ligand sélectif de GPR30 (ligand G1) activait la prolifération cellulaire par un mécanisme non génomique (Sirianni et coll., 2008
). Ces travaux ont montré dans la lignée spermatogonique GC-1 que E2 ou un ligand sélectif de GPR30 (ligand G1) activait la prolifération cellulaire par un mécanisme non génomique (Sirianni et coll., 2008 ). Cette équipe a également montré que GPR30 pouvait médier certains des effets de E2 dans des lignées de cancer de l’ovaire ou du sein ER alpha positives ou négatives (Albanito et coll., 2007
). Cette équipe a également montré que GPR30 pouvait médier certains des effets de E2 dans des lignées de cancer de l’ovaire ou du sein ER alpha positives ou négatives (Albanito et coll., 2007 ).
).Le rôle de GPR30 dans l’effet de E2 ou du BPA n’est cependant pas admis par l’ensemble de la communauté scientifique. Les travaux d’Otto notamment s’opposent vivement à l’hypothèse que GPR30 puisse médier des effets œstrogéniques (Otto et coll., 2008 et 2009
et 2009 ; Langer et coll., 2010
; Langer et coll., 2010 ). Cette équipe a montré in vitro que GPR30 ne liait pas E2, que le ligand spécifique de GPR30, G-1 n’induisait pas de réponses œstrogéniques. De plus, leurs études in vivo ont montré que les souris déficientes en GPR30 (GPR30-/-) ne présentaient pas d’anomalies au niveau du développement des organes cibles de la reproduction (ovaires, utérus, glandes mammaires), de problèmes de fertilité ni de perturbation des réponses œstrogéniques dans l’utérus ou dans la glande mammaire.
). Cette équipe a montré in vitro que GPR30 ne liait pas E2, que le ligand spécifique de GPR30, G-1 n’induisait pas de réponses œstrogéniques. De plus, leurs études in vivo ont montré que les souris déficientes en GPR30 (GPR30-/-) ne présentaient pas d’anomalies au niveau du développement des organes cibles de la reproduction (ovaires, utérus, glandes mammaires), de problèmes de fertilité ni de perturbation des réponses œstrogéniques dans l’utérus ou dans la glande mammaire.
 et 2009
et 2009 ; Langer et coll., 2010
; Langer et coll., 2010 ). Cette équipe a montré in vitro que GPR30 ne liait pas E2, que le ligand spécifique de GPR30, G-1 n’induisait pas de réponses œstrogéniques. De plus, leurs études in vivo ont montré que les souris déficientes en GPR30 (GPR30-/-) ne présentaient pas d’anomalies au niveau du développement des organes cibles de la reproduction (ovaires, utérus, glandes mammaires), de problèmes de fertilité ni de perturbation des réponses œstrogéniques dans l’utérus ou dans la glande mammaire.
). Cette équipe a montré in vitro que GPR30 ne liait pas E2, que le ligand spécifique de GPR30, G-1 n’induisait pas de réponses œstrogéniques. De plus, leurs études in vivo ont montré que les souris déficientes en GPR30 (GPR30-/-) ne présentaient pas d’anomalies au niveau du développement des organes cibles de la reproduction (ovaires, utérus, glandes mammaires), de problèmes de fertilité ni de perturbation des réponses œstrogéniques dans l’utérus ou dans la glande mammaire.Malgré cette controverse, ces résultats indiquent que des effets rapides ou non génomiques du BPA pourraient être médiés par des formes membranaires de récepteurs aux œstrogènes. Le médiateur de ces effets pour les faibles concentrations n’est pas identifié de façon certaine. Les récepteurs membranaires ERα et β sont supposés avoir la même affinité que leurs équivalents nucléaires et l’interaction entre GPR30 et bisphénol A (ainsi qu’avec E2) n’a pas pu être démontré par des techniques biochimiques classiques. L’identification récente de ligands agonistes (Revankar et coll., 2005 ) et antagonistes (Dennis et coll., 2009
) et antagonistes (Dennis et coll., 2009 ) de GPR30 ne se liant pas aux récepteurs nucléaires des œstrogènes α et β et l’étude des effets de ces molécules dans davantage de modèles cellulaires (exprimant ou pas ERα, ERβ nucléaire et membranaire et GPR30) permettra certainement de répondre à ces questions.
) de GPR30 ne se liant pas aux récepteurs nucléaires des œstrogènes α et β et l’étude des effets de ces molécules dans davantage de modèles cellulaires (exprimant ou pas ERα, ERβ nucléaire et membranaire et GPR30) permettra certainement de répondre à ces questions.
 ) et antagonistes (Dennis et coll., 2009
) et antagonistes (Dennis et coll., 2009 ) de GPR30 ne se liant pas aux récepteurs nucléaires des œstrogènes α et β et l’étude des effets de ces molécules dans davantage de modèles cellulaires (exprimant ou pas ERα, ERβ nucléaire et membranaire et GPR30) permettra certainement de répondre à ces questions.
) de GPR30 ne se liant pas aux récepteurs nucléaires des œstrogènes α et β et l’étude des effets de ces molécules dans davantage de modèles cellulaires (exprimant ou pas ERα, ERβ nucléaire et membranaire et GPR30) permettra certainement de répondre à ces questions.Récepteur des androgènes (AR)
Les autres hypothèses pouvant expliquer les effets faibles doses ainsi que les effets non monotones du BPA sont sa liaison à d’autres types de récepteurs nucléaires. Plusieurs études ont montré que le BPA se liait au récepteur nucléaire des androgènes (AR) (Sohoni et Sumpter, 1998 ; Paris et coll., 2002
; Paris et coll., 2002 ; Lee et coll., 2003
; Lee et coll., 2003 ; Xu, 2005
; Xu, 2005 ; Li, 2010
; Li, 2010 ). Contrairement aux ERs, le BPA est un antagoniste pour AR et son affinité est de l’ordre du micromolaire. Les effets observés à faible dose pourraient en partie s’expliquer par des action synergiques à travers les récepteurs ER (action agoniste et féminisante) et le récepteur AR (action antagoniste donc antagoniste de l’effet masculinisant). D’autre part, il est à noter que le BPA a une activité agoniste à faibles concentrations (1 à 10 nanomolaire) sur une forme mutée de AR (AR-T877A) associée à des cancers de la prostate résistants aux anti-androgènes (Wetherill et coll., 2002
). Contrairement aux ERs, le BPA est un antagoniste pour AR et son affinité est de l’ordre du micromolaire. Les effets observés à faible dose pourraient en partie s’expliquer par des action synergiques à travers les récepteurs ER (action agoniste et féminisante) et le récepteur AR (action antagoniste donc antagoniste de l’effet masculinisant). D’autre part, il est à noter que le BPA a une activité agoniste à faibles concentrations (1 à 10 nanomolaire) sur une forme mutée de AR (AR-T877A) associée à des cancers de la prostate résistants aux anti-androgènes (Wetherill et coll., 2002 , 2005
, 2005 ).
).
 ; Paris et coll., 2002
; Paris et coll., 2002 ; Lee et coll., 2003
; Lee et coll., 2003 ; Xu, 2005
; Xu, 2005 ; Li, 2010
; Li, 2010 ). Contrairement aux ERs, le BPA est un antagoniste pour AR et son affinité est de l’ordre du micromolaire. Les effets observés à faible dose pourraient en partie s’expliquer par des action synergiques à travers les récepteurs ER (action agoniste et féminisante) et le récepteur AR (action antagoniste donc antagoniste de l’effet masculinisant). D’autre part, il est à noter que le BPA a une activité agoniste à faibles concentrations (1 à 10 nanomolaire) sur une forme mutée de AR (AR-T877A) associée à des cancers de la prostate résistants aux anti-androgènes (Wetherill et coll., 2002
). Contrairement aux ERs, le BPA est un antagoniste pour AR et son affinité est de l’ordre du micromolaire. Les effets observés à faible dose pourraient en partie s’expliquer par des action synergiques à travers les récepteurs ER (action agoniste et féminisante) et le récepteur AR (action antagoniste donc antagoniste de l’effet masculinisant). D’autre part, il est à noter que le BPA a une activité agoniste à faibles concentrations (1 à 10 nanomolaire) sur une forme mutée de AR (AR-T877A) associée à des cancers de la prostate résistants aux anti-androgènes (Wetherill et coll., 2002 , 2005
, 2005 ).
).Récepteur relié aux œstrogènes gamma (ERRγ)
Très récemment, le BPA a également été identifié comme un ligand du récepteur ERRγ (Abad et coll., 2008 ; Okada et coll., 2008
; Okada et coll., 2008 ; Li et coll., 2010
; Li et coll., 2010 ). Son affinité est de l’ordre de 5 nanomolaire. ERRγ est un récepteur constitutivement activé qui est légèrement activé par le BPA. Bien que les fonctions physiologiques de ERRγ ne soient pas bien connues, le fait que ERRγ puisse se lier sur les mêmes promoteurs de gènes que les récepteurs des œstrogènes (Vanacker et coll., 1999
). Son affinité est de l’ordre de 5 nanomolaire. ERRγ est un récepteur constitutivement activé qui est légèrement activé par le BPA. Bien que les fonctions physiologiques de ERRγ ne soient pas bien connues, le fait que ERRγ puisse se lier sur les mêmes promoteurs de gènes que les récepteurs des œstrogènes (Vanacker et coll., 1999 ) pourrait expliquer en partie les effets de perturbation endocrine du BPA.
) pourrait expliquer en partie les effets de perturbation endocrine du BPA.
 ; Okada et coll., 2008
; Okada et coll., 2008 ; Li et coll., 2010
; Li et coll., 2010 ). Son affinité est de l’ordre de 5 nanomolaire. ERRγ est un récepteur constitutivement activé qui est légèrement activé par le BPA. Bien que les fonctions physiologiques de ERRγ ne soient pas bien connues, le fait que ERRγ puisse se lier sur les mêmes promoteurs de gènes que les récepteurs des œstrogènes (Vanacker et coll., 1999
). Son affinité est de l’ordre de 5 nanomolaire. ERRγ est un récepteur constitutivement activé qui est légèrement activé par le BPA. Bien que les fonctions physiologiques de ERRγ ne soient pas bien connues, le fait que ERRγ puisse se lier sur les mêmes promoteurs de gènes que les récepteurs des œstrogènes (Vanacker et coll., 1999 ) pourrait expliquer en partie les effets de perturbation endocrine du BPA.
) pourrait expliquer en partie les effets de perturbation endocrine du BPA.Liaison à d’autres récepteurs nucléaires potentiellement non impliqués dans les effets reprotoxiques du BPA
Des études ont montré que des dérivés halogénés du BPA, le tétra bromo-BPA (TBBPA) et le tétra chloro-BPA (TCBPA) (mais pas le BPA) se liaient aux récepteurs des hormones thyroïdiennes (Kitamura et coll., 2002 ). Cette étude a également montré que comme l’hormone thyroïdienne T3, le TBBPA et le TCBPA avaient un effet activateur sur la prolifération des cellules pituitaires GH3. Curieusement, l’étude de Sun a plutôt classé ces dérivés comme ayant un effet antagoniste (Sun et coll., 2009
). Cette étude a également montré que comme l’hormone thyroïdienne T3, le TBBPA et le TCBPA avaient un effet activateur sur la prolifération des cellules pituitaires GH3. Curieusement, l’étude de Sun a plutôt classé ces dérivés comme ayant un effet antagoniste (Sun et coll., 2009 ) dans un test de gènes rapporteurs. Ces molécules qui semblent se lier aux TR mais avec des niveaux d’activation différents selon les types cellulaires ou les réponses étudiées pourraient être des molécules à activité agoniste partielle ou SnuRM (modulateurs sélectifs des récepteurs nucléaires). Il faut souligner que ces effets (anti)thyroïdiens ne sont observés qu’à fortes concentrations (de 1 à 10 mM).
) dans un test de gènes rapporteurs. Ces molécules qui semblent se lier aux TR mais avec des niveaux d’activation différents selon les types cellulaires ou les réponses étudiées pourraient être des molécules à activité agoniste partielle ou SnuRM (modulateurs sélectifs des récepteurs nucléaires). Il faut souligner que ces effets (anti)thyroïdiens ne sont observés qu’à fortes concentrations (de 1 à 10 mM).
 ). Cette étude a également montré que comme l’hormone thyroïdienne T3, le TBBPA et le TCBPA avaient un effet activateur sur la prolifération des cellules pituitaires GH3. Curieusement, l’étude de Sun a plutôt classé ces dérivés comme ayant un effet antagoniste (Sun et coll., 2009
). Cette étude a également montré que comme l’hormone thyroïdienne T3, le TBBPA et le TCBPA avaient un effet activateur sur la prolifération des cellules pituitaires GH3. Curieusement, l’étude de Sun a plutôt classé ces dérivés comme ayant un effet antagoniste (Sun et coll., 2009 ) dans un test de gènes rapporteurs. Ces molécules qui semblent se lier aux TR mais avec des niveaux d’activation différents selon les types cellulaires ou les réponses étudiées pourraient être des molécules à activité agoniste partielle ou SnuRM (modulateurs sélectifs des récepteurs nucléaires). Il faut souligner que ces effets (anti)thyroïdiens ne sont observés qu’à fortes concentrations (de 1 à 10 mM).
) dans un test de gènes rapporteurs. Ces molécules qui semblent se lier aux TR mais avec des niveaux d’activation différents selon les types cellulaires ou les réponses étudiées pourraient être des molécules à activité agoniste partielle ou SnuRM (modulateurs sélectifs des récepteurs nucléaires). Il faut souligner que ces effets (anti)thyroïdiens ne sont observés qu’à fortes concentrations (de 1 à 10 mM).Les mêmes dérivés halogénés du BPA (Balaguer communication personnelle) ainsi que le BADGE (Wright et coll., 2000 ; Seimandi et coll., 2005
; Seimandi et coll., 2005 ) sont des ligands du récepteur PPARγ (Balaguer, communication personnelle) avec une affinité de l’ordre du mM. De nombreuses études ont établi un lien entre exposition au BPA et obésité (Rubin et coll., 2001
) sont des ligands du récepteur PPARγ (Balaguer, communication personnelle) avec une affinité de l’ordre du mM. De nombreuses études ont établi un lien entre exposition au BPA et obésité (Rubin et coll., 2001 ; Masuno et coll., 2005
; Masuno et coll., 2005 ; Miyawaki et coll., 2007
; Miyawaki et coll., 2007 ; Somm et coll., 2009
; Somm et coll., 2009 ). Ces effets pourraient être médiés par PPARγ et être dus au BPA ou à un de ses métabolites. Dans l’étude de Kwintkiewicz et coll. (2010
). Ces effets pourraient être médiés par PPARγ et être dus au BPA ou à un de ses métabolites. Dans l’étude de Kwintkiewicz et coll. (2010 ), il est à noter que le BPA induit l’expression de PPARγ. PPARγ comme d’autres gènes impliqués dans la différenciation adipocytaire sont sous le contrôle de ce récepteur. Cependant, cet effet est observable uniquement à forte concentration (1 à 100 mM).
), il est à noter que le BPA induit l’expression de PPARγ. PPARγ comme d’autres gènes impliqués dans la différenciation adipocytaire sont sous le contrôle de ce récepteur. Cependant, cet effet est observable uniquement à forte concentration (1 à 100 mM).
 ; Seimandi et coll., 2005
; Seimandi et coll., 2005 ) sont des ligands du récepteur PPARγ (Balaguer, communication personnelle) avec une affinité de l’ordre du mM. De nombreuses études ont établi un lien entre exposition au BPA et obésité (Rubin et coll., 2001
) sont des ligands du récepteur PPARγ (Balaguer, communication personnelle) avec une affinité de l’ordre du mM. De nombreuses études ont établi un lien entre exposition au BPA et obésité (Rubin et coll., 2001 ; Masuno et coll., 2005
; Masuno et coll., 2005 ; Miyawaki et coll., 2007
; Miyawaki et coll., 2007 ; Somm et coll., 2009
; Somm et coll., 2009 ). Ces effets pourraient être médiés par PPARγ et être dus au BPA ou à un de ses métabolites. Dans l’étude de Kwintkiewicz et coll. (2010
). Ces effets pourraient être médiés par PPARγ et être dus au BPA ou à un de ses métabolites. Dans l’étude de Kwintkiewicz et coll. (2010 ), il est à noter que le BPA induit l’expression de PPARγ. PPARγ comme d’autres gènes impliqués dans la différenciation adipocytaire sont sous le contrôle de ce récepteur. Cependant, cet effet est observable uniquement à forte concentration (1 à 100 mM).
), il est à noter que le BPA induit l’expression de PPARγ. PPARγ comme d’autres gènes impliqués dans la différenciation adipocytaire sont sous le contrôle de ce récepteur. Cependant, cet effet est observable uniquement à forte concentration (1 à 100 mM).Enfin, le BPA a été identifié comme étant capable d’activer les récepteurs RXR dans un test de gène rapporteur incluant du métabolisme (Li et coll., 2008 ) et d’augmenter l’expression du récepteur nucléaire Nur77 (Song et coll., 2002
) et d’augmenter l’expression du récepteur nucléaire Nur77 (Song et coll., 2002 ; Ahn et coll., 2008
; Ahn et coll., 2008 ) qui est impliqué dans la stéroïdogénèse.
) qui est impliqué dans la stéroïdogénèse.
 ) et d’augmenter l’expression du récepteur nucléaire Nur77 (Song et coll., 2002
) et d’augmenter l’expression du récepteur nucléaire Nur77 (Song et coll., 2002 ; Ahn et coll., 2008
; Ahn et coll., 2008 ) qui est impliqué dans la stéroïdogénèse.
) qui est impliqué dans la stéroïdogénèse.
En conclusion, l’ensemble de ces résultats indiquent que le bisphénol A et/ou des molécules dérivées sont capables de se lier à différents récepteurs nucléaires ou membranaires. Les affinités de liaison ne sont pas très fortes (excepté pour GPR30 si l’interaction est confirmée) mais des synergies d’action entre récepteurs nucléaires (récepteurs ERα, ERβ et AR) peuvent expliquer des effets à faible dose. D’autre part, le fait que le BPA se lie à des formes membranaires des récepteurs des œstrogènes indique qu’il pourrait également se lier à des formes membranaires d’autres récepteurs nucléaires comme AR (Bonaccorsi et coll., 2008 ) ou TRα ou β (Iordanidou et coll., 2010
) ou TRα ou β (Iordanidou et coll., 2010 ).
).
 ) ou TRα ou β (Iordanidou et coll., 2010
) ou TRα ou β (Iordanidou et coll., 2010 ).
).Bibliographie
[1] ABAD MC, ASARI H, OʼNEILL J, KLINGER AL, MILLIGAN C, et coll. Structural determination of estrogen-related receptor gamma in the presence of phenol derivative compounds.
J Steroid Biochem Mol Biol. 2008;
108:44- 54

[2] AHN SW, NEDUMARAN B, XIE Y, KIM DK, KIM YD, CHOI HS. Bisphenol A bis(2,3-dihydroxypropyl) ether (BADGE.2H2O) induces orphan nuclear receptor Nur77 gene expression and increases steroidogenesis in mouse testicular Leydig cells.
Mol Cells. 2008;
26:74- 80

[3] ALBANITO L, MADEO A, LAPPANO R, VIVACQUA A, RAGO V, et coll. G protein-coupled receptor 30 (GPR30) mediates gene expression changes and growth response to 17beta-estradiol and selective GPR30 ligand G-1 in ovarian cancer cells.
Cancer Res. 2007;
67:1859- 1866

[4] BONACCORSI L, NOSI D, QUERCIOLI F, FORMIGLI L, ZECCHI S, et coll. Prostate cancer : a model of integration of genomic and non-genomic effects of the androgen receptor in cell lines model.
Steroids. 2008;
73:1030- 1037

[5] BOUSKINE A, NEBOUT M, MOGRABI B, BRÜCKER-DAVIS F, ROGER C, FENICHEL P. Estrogens promote human testicular germ cell cancer through a membrane-mediated activation of extracellular regulated kinase and protein kinase A.
Endocrinology. 2008;
149:565- 573

[6] BOUSKINE A, NEBOUT M, BRÜCKER-DAVIS F, BENAHMED M, FENICHEL P. Low doses of bisphenol A promote human seminoma cell proliferation by activating PKA and PKG via a membrane G-protein-coupled estrogen receptor.
Environ Health Perspect. 2009;
117:1053- 1058

[7] DENNIS MK, BURAI R, RAMESH C, PETRIE WK, ALCON SN, et coll. In vivo effects of a GPR30 antagonist.
Nat Chem Biol. 2009;
5:421- 427

[8] GOULD JC, LEONARD LS, MANESS SC, WAGNER BL, CONNER K, et coll. Bisphenol A interacts with the estrogen receptor alpha in a distinct manner from estradiol.
Mol Cell Endocrinol. 1998;
142:203- 14

[9] HAMMES S, LEVIN E. Extranuclear steroid receptors : nature and actions.
Endocr Rev. 2007;
28:726- 41

[10] HARTMAN J, LINDBERG K, MORANI A, INZUNZA J, STRÖM A, GUSTAFSSON J. Estrogen receptor beta inhibits angiogenesis and growth of T47D breast cancer xenografts.
Cancer Res. 2006;
66:11207- 11213

[11] HOWDESHELL KL, FURR J, LAMBRIGHT CR, WILSON VS, RYAN BC, et coll. Gestational and lactational exposure to ethinyl estradiol, but not bisphenol A, decreases androgen-dependent reproductive organ weights and epididymal sperm abundance in the male long evans hooded rat.
Toxicol Sci. 2008;
102:371- 382

[12] IORDANIDOU A, HADZOPOULOU-CLADARAS M, LAZOU A. Non-genomic effects of thyroid hormone in adult cardiac myocytes : relevance to gene expression and cell growth.
Mol Cell Biochem. 2010;
340:291- 300

[13] KITAMURA S, JINNO N, OHTA S, KUROKI H, FUJIMOTO N. Thyroid hormonal activity of the flame retardants tetrabromobisphenol A and tetrachlorobisphenol A.
Biochem Biophys Res Commun. 2002;
293:554- 559

[14] KOBAYASHI K, MIYAGAWA M, WANG RS, SEKIGUCHI S, SUDA M, et coll. Effects of in utero and lactational exposure to bisphenol A on somatic growth and anogenital distance in F1 rat offspring.
Ind Health. 2002;
40:375- 381

[15] KUIPER G, LEMMEN J, CARLSSON B, CORTON J, SAFE S, et coll. Interaction of estrogenic chemicals and phytœstrogens with estrogen receptor beta.
Endocrinology. 1998;
139:4252- 4263

[16] KWINTKIEWICZ J, NISHI Y, YANASE T, GIUDICE LC. Peroxisome proliferator-activated receptor gamma mediates the endocrine disrupter bisphenol a inhibition of fsh-stimulated igf-i, aromatase and estradiol in human granulosa cells.
Environ Health Perspect. 2010;
118:400- 406

[17] LANGER G, BADER B, MEOLI L, ISENSEE J, DELBECK M, et coll. A critical review of fundamental controversies in the field of GPR30 research.
Steroids. 2010;
75 (8-9):603- 610

[18] LEE HJ, CHATTOPADHYAY S, GONG EY, AHN RS, LEE K. Antiandrogenic effects of bisphenol A and nonylphenol on the function of androgen receptor.
Toxicol Sci. 2003;
75:40- 46

[19] LI J, MA M, WANG Z. A two-hybrid yeast assay to quantify the effects of xenobiotics on retinoid X receptor-mediated gene expression.
Toxicol Lett. 2008;
176:198- 206

[20] LI J, MA M, WANG Z. In vitro profiling of endocrine disrupting effects of phenols.
Toxicol In Vitro. 2010;
24:201- 207

[21] MARKEY CM, MICHAELSON CL, VESON EC, SONNENSCHEIN C, SOTO AM. The mouse uterotrophic assay : a reevaluation of its validity in assessing the estrogenicity of bisphenol A.
Environ Health Perspect. 2001;
109:55- 60

[22] MASUNO H, IWANAMI J, KIDANI T, SAKAYAMA K, HONDA K. Bisphenol A accelerates terminal differentiation of 3T3-L1 cells into adipocytes through the phosphatidylinositol 3-kinase pathway.
Toxicol Sci. 2005;
84:319- 327

[23] MIYAWAKI J, SAKAYAMA K, KATO H, YAMAMOTO H, MASUNO H. Perinatal and postnatal exposure to bisphenol a increases adipose tissue mass and serum cholesterol level in mice J.
Atheroscler Thromb. 2007;
14:245- 252

[24] NAGEL SC, HAGELBARGER JL, MCDONNELL DP. Development of an ER action indicator mouse for the study of estrogens, selective ER modulators (SERMs), and Xenobiotics.
Endocrinology. 2001;
142:4721- 4728

[25] OKADA H, TOKUNAGA T, LIU X, TAKAYANAGI S, MATSUSHIMA A, SHIMOHIGASHI Y. Direct evidence revealing structural elements essential for the high binding ability of bisphenol A to human estrogen-related receptor-gamma.
Environ Health Perspect. 2008;
116:32- 38

[26] OTTO C, ROHDE-SCHULZ B, SCHWARZ G, FUCHS I, KLEWER M, et coll. G protein-coupled receptor 30 localizes to the endoplasmic reticulum and is not activated by estradiol.
Endocrinology. 2008;
149:4846- 4856

[27] OTTO C, FUCHS I, KAUSELMANN G, KERN H, ZEVNIK B, et coll. GPR30 does not mediate estrogenic responses in reproductive organs in mice.
Biol Reprod. 2009;
80:34- 41

[28] PARIS F, BALAGUER P, TÉROUANNE B, SERVANT N, LACOSTE et coll. Phenylphenols, biphenols, bisphenol-A and 4-tert-octylphenol exhibit alpha and beta estrogen activities and antiandrogen activity in reporter cell lines.
Mol Cell Endocrinol. 2002;
193:43- 49

[29] QUESADA I, FUENTES E, VISO-LEON MC, SORIA B, RIPOLL C, et coll. Low doses of the endocrine disruptor bisphenol-A and the native hormone 17beta-estradiol rapidly activate transcription factor CREB.
FASEB J. 2002;
16:1671- 1673

[30] REVANKAR CM, CIMINO DF, SKLAR LA, ARTERBURN JB, PROSSNITZ ER. A transmembrane intracellular estrogen receptor mediates rapid cell signaling.
Science. 2005;
307:1625- 1630

[31] ROUTLEDGE EJ, WHITE R, PARKER MG, SUMPTER JP. Differential effects of xenœstrogens on coactivator recruitment by estrogen receptor (ER) alpha and ER beta.
J Biol Chem. 2000;
275:35986- 35993

[32] RUBIN BS, MURRAY MK, DAMASSA DA, KING JC, SOTO AM. Perinatal exposure to low doses of bisphenol A affects body weight, patterns of estrous cyclicity, and plasma LH levels.
Environ Health Perspect. 2001;
109:675- 680

[33] SEIMANDI M, LEMAIRE G, PILLON A, PERRIN A, CARLAVAN I, et coll. Differential responses of PPARalpha, PPARdelta, and PPARgamma reporter cell lines to selective PPAR synthetic ligands.
Anal Biochem. 2005;
344:8- 15

[34] SIRIANNI R, CHIMENTO A, RUGGIERO C, DE LUCA A, LAPPANO R, et coll. The novel estrogen receptor, G protein-coupled receptor 30, mediates the proliferative effects induced by 17beta-estradiol on mouse spermatogonial GC-1 cell line.
Endocrinology. 2008;
149:5043- 5051

[35] SOHONI P, SUMPTER JP. Several environmental estrogens are also anti-androgens.
J Endocrinol. 1998;
158:327- 339

[36] SOMME E, SCHWITZGEBEL VM, TOULOTTE A, CEDERROTH CR, COMBESCURE C, et coll. Perinatal exposure to bisphenol a alters early adipogenesis in the rat.
Environ Health Perspect. 2009;
117:1549- 1555

[37] SONG KH, LEE K, CHOI HS. Endocrine disrupter bisphenol a induces orphan nuclear receptor Nur77 gene expression and steroidogenesis in mouse testicular Leydig cells.
Endocrinology. 2002;
143:2208- 2215

[38] SUN H, XU LC, CHEN JF, SONG L, WANG XR. Effect of bisphenol A, tetrachlorobisphenol A and pentachlorophenol on the transcriptional activities of androgen receptor-mediated reporter gene.
Food Chem Toxicol. 2006;
44:1916- 1921

[39] SUN H, SHEN OX, WANG XR, ZHOU L, ZHEN SQ, CHEN XD. Anti-thyroid hormone activity of bisphenol A, tetrabromobisphenol A and tetrachlorobisphenol A in an improved reporter gene assay.
Toxicol In Vitro. 2009;
23:950- 954

[40] TIMMS BG, HOWDESHELL KL, BARTON L, BRADLEY S, RICHTER CA, VOM SAAL FS. Estrogenic chemicals in plastic and oral contraceptives disrupt development of the fetal mouse prostate and urethra.
Proc Natl Acad Sci U S A. 2005;
102:7014- 7019

[41] TYL RW, MYERS CB, MARR MC, THOMAS BF, KEIMOWITZ , , et coll. Three-generation reproductive toxicity study of dietary bisphenol A in CD Sprague-Dawley rats.
Toxicol Sci. 2002;
68:121- 146

[42] VANACKER JM, PETTERSSON K, GUSTAFSSON JA, LAUDET V. Transcriptional targets shared by estrogen receptor- related receptors (ERRs) and estrogen receptor (ER) alpha, but not by ER beta.
EMBO J. 1999;
18:4270- 4279

[43] VANDENBERG LN, WADIA PR, SCHAEBERLE CM, RUBIN BS, SONNENSCHEIN C, SOTO AM. The mammary gland response to estradiol : monotonic at the cellular level, non-monotonic at the tissue-level of organization?.
J Steroid Biochem Mol Biol. 2006;
101:263- 274

[44] WALSH DE, DOCKERY P, DOOLAN CM. Estrogen receptor independent rapid non-genomic effects of environmental estrogens on [Ca2+]i in human breast cancer cells.
Mol Cell Endocrinol. 2005;
230:23- 30

[45] WATSON CS, ALYEA RA, JENG YJ, KOCHUKOV MY. Nongenomic actions of low concentration estrogens and xenestrogens on multiple tissues.
Mol Cell Endocrinol. 2007a;
274:1- 7

[46] WATSON CS, BULAYEVA NN, WOZNIAK AL, ALYEA RA. Xenestrogens are potent activators of nongenomic estrogenic responses.
Steroids. 2007b;
72:124- 134

[47] WATSON CS, JENG YJ, KOCHUKOV MY. Nongenomic signaling pathways of estrogen toxicity.
Toxicol Sci. 2010;
115(1):1- 11

[48] WETHERILL YB, PETRE CE, MONK KR, PUGA A, KNUDSEN KE. The xenœstrogen bisphenol A induces inappropriate androgen receptor activation and mitogenesis in prostatic adenocarcinoma cells.
Mol Cancer Ther. 2002;
1:515- 524

[49] WETHERILL YB, FISHER NL, STAUBACH A, DANIELSEN M, DE VERE WHITE RW, KNUDSEN KE. Xenœstrogen action in prostate cancer : pleiotropic effects dependent on androgen receptor status.
Cancer Res. 2005;
65:54- 65

[50] WILLIAMS C, EDVARDSSON K, LEWANDOWSKI SA, STRÖM A, GUSTAFSSON JA. A genome-wide study of the repressive effects of estrogen receptor beta on estrogen receptor alpha signaling in breast cancer cells.
Oncogene. 2008;
27:1019- 1032

[51] WRIGHT HM, CLISH CB, MIKAMI T, HAUSER S, YANAGI K, et coll. A synthetic antagonist for the peroxisome proliferator-activated receptor gamma inhibits adipocyte differentiation.
J Biol Chem. 2000;
275:1873- 1877

[52] XU LC, SUN H, CHEN JF, BIAN Q, QIAN J, et coll. Evaluation of androgen receptor transcriptional activities of bisphenol A, octylphenol and nonylphenol in vitro.
Toxicology. 2005;
216:197- 203

→ Aller vers SYNTHESE