Phtalates
2011
33-
Exposition des populations
L’exposition humaine aux phtalates est importante et croît régulièrement en raison de la très large utilisation qui est faite de cette famille de composés et du fait de l’augmentation des niveaux de production au cours des trente dernières années.
On retrouve des phtalates dans plusieurs produits de consommation courante tels les adhésifs, les revêtements de sol en vinyle, les huiles lubrifiantes, les condensateurs électriques, les détergents, les solvants, les produits pharmaceutiques, les fils et les câbles électriques et les produits cosmétiques (parfums, déodorants, lotions après rasage, shampooings, aérosols pour cheveux, vernis à ongles...). La particularité des phtalates utilisés en plasturgie tient au fait qu’ils ne sont pas liés de manière covalente aux polymères auxquels ils confèrent leur souplesse. Ils peuvent donc facilement migrer dans les matériaux d’emballages et être relargués dans le milieu environnant, en particulier lorsque les plastiques qui en contiennent sont soumis à des températures élevées.
L’exposition environnementale aux phtalates peut provenir du contact direct avec l’air, l’eau ou encore la nourriture et résulte à la fois de l’inhalation, de l’ingestion ou encore de l’absorption percutanée de ces produits.
L’ingestion d’aliments ayant été en contact avec des emballages contenant des phtalates demeure la principale source d’exposition pour la population générale. L’alimentation est la principale voie d’exposition pour le DEHP, DBP et DIBP.
Les dispositifs médicaux (poches de sang, tubulures...) représentent pour certains sous-groupes de la population une source non négligeable d’exposition aux phtalates, en particulier au DEHP. L’exposition via les dispositifs médicaux touche principalement les hémodialysés, les donneurs et receveurs de plaquettes et les enfants prématurés (Calafat et coll., 2004

; Koch et coll., 2005

).
L’European Chemicals Bureau (ECB) estimait en 2008 que l’exposition pouvait atteindre 3,1 mg/kg pc/j, chez les hémodialysés adultes et 1,7 mg/kg pc/j chez les nouveau-nés transfusés.
Exposition des populations
Exposition en population générale
L’exposition aux phtalates, calculée sur la base des métabolites urinaires (Wittasek et coll., 2007a

) montre que les niveaux médians pour la population générale (60 sujets âgés de 20 à 28 ans) en 2003 atteignaient en Allemagne 2,4 μg/kg pc/j pour le DEHP, 1,9 μg/kg pc/j pour le DBP, 1,4 μg/kg pc/j pour le DIBP, 0,4 μg/kg pc/j pour le DINP et 0,2 μg/kg pc/j pour le BBP. Des valeurs similaires ont été trouvées par Wittassek et Angerer (2008

) chez 102 sujets allemands âgés de 6 à 80 ans. À partir de différents scénarios, Wormuth et coll. (2006

) ont comparé les expositions journalières aux 8 principaux phtalates en fonction de l’âge et du sexe (tableau 33.I

). Les valeurs obtenues font apparaître une exposition globalement plus élevée chez les enfants que chez les adultes (valeurs exprimées en fonction du poids corporel), mais peu de différences entre hommes et femmes.
En France, l’étude pilote « Elfe » (Étude longitudinale depuis l’enfance), réalisée sur les départements de Seine Saint-Denis, Ardèche, Loire, Isère et Savoie en octobre 2007 a permis de recueillir 279 échantillons d’urine chez les mères en salle de naissance. Les dosages de métabolites du DEHP, MEHP et ses dérivés (5-OH-MEHP et 5-oxo-MEHP) ont été réalisés à la suite d’une hydrolyse enzymatique par chromatographie liquide couplée à la spectrométrie de masse (LC/MS).
Les résultats ont montré une présence de phtalates chez 100 % des femmes. Les taux ont pu être quantifiés chez plus de 90 % des femmes. Les valeurs médianes des concentrations étaient de 41,9 μg/l en 5-OH-MEHP, de 28,3 μg/l en 5-oxo-MEHP, de 13,7 μg/l en MEHP. Les concentrations médianes urinaires en MEHP et ses métabolites (5-OH-MEHP et 5-oxo-MEHP) sont similaires à celles retrouvées dans d’autres études (Vandentorren et coll., 2011

).
Tableau 33.I Estimation de l’exposition journalière aux phtalates, exprimée en μg/kg pc/j, prenant en compte l’ensemble des voies d’exposition (d’après Wormuth et coll., 2006 )
)
| |
Enfants
0-12 mois
(5,5 kg)
|
Enfants
1-3 ans
(13 kg)
|
Enfants
4-10 ans
(27 kg)
|
Femme
18-80 ans
(60 kg)
|
Homme
18-80 ans
(70 kg)
|
| |
Moy
|
Max
|
Moy
|
Max
|
Moy
|
Max
|
Moy
|
Max
|
Moy
|
Max
|
|
DEHP
|
16,16
|
135,28
|
6,31
|
62,10
|
1,97
|
17,44
|
2,54
|
14,71
|
2,85
|
16,32
|
|
BBP
|
0,76
|
7,56
|
0,31
|
3,67
|
0,06
|
1,24
|
0,27
|
1,65
|
0,31
|
1,89
|
|
DINP
|
21,98
|
135,02
|
7,07
|
67,19
|
0,19
|
5,61
|
0,00
|
0,26
|
0,00
|
0,29
|
|
DIDP
|
1,43
|
8,99
|
0,51
|
4,24
|
0,02
|
0,47
|
0,00
|
0,08
|
0,00
|
0,09
|
|
DIBP
|
1,57
|
5,58
|
0,68
|
2,62
|
0,29
|
1,25
|
0,41
|
1,45
|
0,45
|
1,61
|
|
DEP
|
3,48
|
19,74
|
1,49
|
8,31
|
0,76
|
4,44
|
1,43
|
64,93
|
1,15
|
50,94
|
|
DBP
|
7,60
|
44,92
|
2,55
|
25,42
|
1,23
|
17,01
|
3,53
|
38,56
|
3,61
|
18,57
|
|
DMP
|
1,81
|
23,46
|
0,76
|
9,72
|
0,49
|
6,28
|
0,22
|
2,54
|
0,22
|
2,68
|
|
∑
|
54,80
|
380,57
|
19,68
|
183,28
|
5,00
|
53,73
|
8,42
|
124,17
|
8,59
|
92,38
|
Les évaluations de risque effectuées par l’EFSA sur le DEHP, le DBP, le DIDP, le BBP et le DINP ont abouti à une dose journalière tolérable (DJT) de respectivement 50, 10, 150, 500 et 150 μg/kg pc/j (EFSA 2005a

, b

, c

, d

).
En 2010, la
Consumer Product Safety Commission américaine (CPSC) déterminait une DJT de 5,8 μg/kg pc/j pour le DEHP et de respectivement 200, 1 000, et 120 μg/kg pc/j pour le DBP, le BBP et le DINP (tableau 33.II

). La principale différence entre ces deux évaluations du risque porte sur le DEHP et le DBP. Pour le DEHP, l’EFSA a basé son évaluation sur l’étude de Wolfe et Layton (2003

) mettant en évidence, sur une étude multigénérationnelle menée chez le rat, la toxicité du DEHP sur le testicule et les cellules germinales. À partir de cette étude, la dose sans effet est estimée à 5 mg/kg pc/j et un facteur de sécurité de 100 a été appliqué. La CPSC a considéré l’étude de toxicité chronique chez le rat de David et coll. (2000

) mettant en évidence un effet sur la spermatogenèse à partir de 5,8 mg/kg pc/j. Cette étude ne permettant pas de définir une dose sans effet, un facteur de sécurité de 1 000 a été appliqué. Pour ce qui concerne le DBP, la CPSC s’est fondée sur l’étude de reprotoxicité de Mahood et coll. (2007

) permettant de définir une dose sans effet de 20 mg/kg pc/j et un facteur de sécurité de 100 a été appliqué. L’EFSA a, pour sa part, pris en compte l’étude de Lee et coll. (2004

) qui montre un effet sur le développement chez le rat à partir de 2 mg/kg pc/j. L’application d’un facteur de sécurité de 200 a conduit à une DJT de 10 μg/kg pc/j.
Tableau 33.II DJT établies d’après les évaluations de risques
|
Phtalate
|
Évaluations
|
Étude de référence
|
NOAEL ou LOAEL (mg/kg/j)
|
DJT (μg/kg pc/j)
|
|
DEHP
|
EFSA
CPSC
|
Wolfe et Layton, 2003 
David et coll., 2000 
|
NOAEL : 5
LOAEL : 5,8
|
50
5,8
|
|
DBP
|
EFSA
CPSC
|
Lee et coll., 2004 
Mahood et coll., 2007 
|
LOAEL : 2
NOAEL : 20
|
10
200
|
|
BBP
|
EFSA
CPSC
|
Tyl et coll., 2001  et 2004 
Aso et coll., 2005 
|
NOAEL : 50
NOAEL : 100a
|
500
1 000
|
|
DINP
|
EFSA
CPSC
|
Exxon, 1986 
Lington et coll., 1997 
|
NOAEL : 15
NOAEL : 15a
|
150
120
|
|
DIDP
|
EFSA
|
Hazleton Laboratories, 1968 
|
NOAEL : 15a
|
150
|
a Effets sur le foie
Exposition des enfants, nourrissons et nouveau-nés
L’exposition des enfants a fait l’objet de plusieurs études qui montrent toutes que ces derniers sont davantage exposés que les adultes. Dans une étude fondée sur les taux urinaires mesurés chez 239 enfants âgés de 2 à 14 ans, Wittassek et coll. (2007b

) ont estimé les niveaux médians d’exposition au DEHP entre 4,3 et 7,8 μg/kg pc/j. L’EFSA estimait en 2005 que l’exposition au DEHP d’enfants de plus de 6 mois consommant des aliments pour bébés prêts à l’emploi était, dans les cas les plus défavorables, de 23,5 μg/kg pc/j (EFSA, 2005a

).
Une étude allemande (GerES IV) publiée en 2009 rapporte les concentrations urinaires en métabolites du DEHP ainsi que d’autres phtalates (DBP, DIBP, BBP, DINP) pour des enfants de 3 à 14 ans vivant en Allemagne (Becker et coll., 2009

). Les concentrations en métabolites diminuent avec l’âge. Comparés aux adultes, tous les enfants présentent des concentrations 3 à 5 fois plus élevées que les adultes analysés dans le même temps. Les auteurs indiquent que 1,5 % des enfants en Allemagne présentent une exposition au DEHP supérieure au niveau d’exposition pour lequel l’absence d’effet adverse n’est pas certaine.
Hormis la situation particulière des nouveau-nés, notamment des prématurés placés en soins intensifs, l’exposition des nourrissons et des jeunes enfants aux phtalates provient essentiellement de la voie alimentaire. Quelques publications font état des teneurs en phtalates dans le lait maternel (Main et coll., 2006

; Högberg et coll., 2008

; Latini et coll., 2009

). Elles montrent des différences interindividuelles importantes dont on ne peut exclure qu’elles puissent être dues en partie à des problèmes de contamination des échantillons avant ou pendant l’analyse. Ainsi, pour le DEHP, les teneurs rapportées par Högberg et coll. (2008

) chez 42 femmes suédoises primipares dont le lait a été prélevé entre la 2
e et la 3
e semaine qui a suivi l’accouchement, varient de 0,45 à 305 μg/l, avec une valeur médiane de 9 μg/l.
Les difficultés analytiques concernant la quantification des phtalates a conduit les équipes à rechercher les métabolites, en particulier les monoesters, plutôt que les composés parents. Ces monesters sont en effet suffisamment lipophiles pour être éliminés dans le lait, contrairement à une grande partie des métabolites hydroxylés. Les concentrations de MEHP, métabolite du DEHP, varient de 0,5 à 6,5 μg/l dans l’étude de Högberg et coll. (2008

) sur les femmes suédoises. Elles sont comprises entre 1,8 et 109 μg/l dans une étude conduite récemment sur 62 femmes italiennes (Latini et coll., 2009

).
La concentration en phtalates a été mesurée dans les aliments lactés pour nourrissons ainsi que dans les aliments pour bébés vendus sur le marché danois (Petersen et coll., 2000

). Les concentrations maximales retrouvées dans le lait maternisé étaient de 60 μg/kg pour le DEHP et de 10 μg/kg pour le BBP. Dans les aliments pour bébés, les teneurs en DEHP, DBP et BBP atteignaient au maximum respectivement 630, 40 et 5 μg/kg. Sur la base de ces valeurs, Müller et coll. (2003

) ont estimé que l’exposition des nourrissons aux phtalates était de 9,8 et 1,6 μg/kg pc/j respectivement pour le DEHP et le BBP, alors que la consommation d’aliments prêts à l’emploi chez les enfants de plus de 6 mois conduisait à une exposition de 19,6 μg/kg pc/j pour le DEHP, de 1,25 μg/kg pc/j pour le DBP et de 0,16 μg/kg pc/j pour le BBP.
Exposition in utero
Des études montrent que l’exposition commence
in utero. La présence de DEHP et de son métabolite le MEHP a été détectée dans le sang du cordon prélevé à la naissance chez 84 nouveau-nés dans le sud de l’Italie (Latini et coll., 2003

). Les concentrations moyennes de DEHP et MEHP étaient respectivement de 1,19±1,15 μg/ml et 0,52±0,61 μg/ml. Plus récemment, Wittassek et coll. (2009

) ont mesuré les concentrations de métabolites des principaux phtalates dans le liquide amniotique récupéré au cours de 11 naissances par césarienne ayant eu lieu à l’hôpital de Münster en Allemagne. Les métabolites les plus abondants sont le MBP (médiane=7,8 μg/l), le MIBP (médiane=4,2 μg/l), le MBzP (médiane=1,9 μg/l) et le MEHP (médiane=1,6 μg/l) qui correspondent respectivement au DBP, DIBP, BBP et DEHP. Ces valeurs sont 3 à 8 fois plus faibles que celles mesurées dans l’urine des mères prélevée au moment de l’accouchement.
Absorption, distribution, biotransformation, excrétion
Absorption
L’absorption des phtalates dépend de plusieurs facteurs parmi lesquels la dose et la voie d’exposition ainsi que la masse moléculaire du composé lui-même. Les mesures réalisées chez les rongeurs exposés par voie orale à de faibles doses de phtalates indiquent que l’absorption gastro-intestinale est rapide et que les niveaux observés sont proches de 100 % pour le DBP et le BBP, et d’environ 50 % pour le DIDP, le DINP et le DEHP. Les travaux menés par Koch et coll. (2004

, 2005

) sur un volontaire sain à qui une dose orale unique de DEHP marqué au deutérium a été administrée indiquent que, chez l’homme, l’absorption de ce phtalate est d’environ 75 %.
S’il n’existe pratiquement pas de donnée quantitative sur l’absorption des phtalates par inhalation (seule une étude identifiée chez le rat indique qu’environ 1,5 % d’une concentration de 100 mg de DEHP/m
3, sous forme d’aérosol, est absorbé en 6 h ; ECB, 2008

), quelques travaux ont permis d’établir les niveaux d’absorption cutanée des principaux phtalates chez le rat. Ces données sont résumées dans la figure 33.1

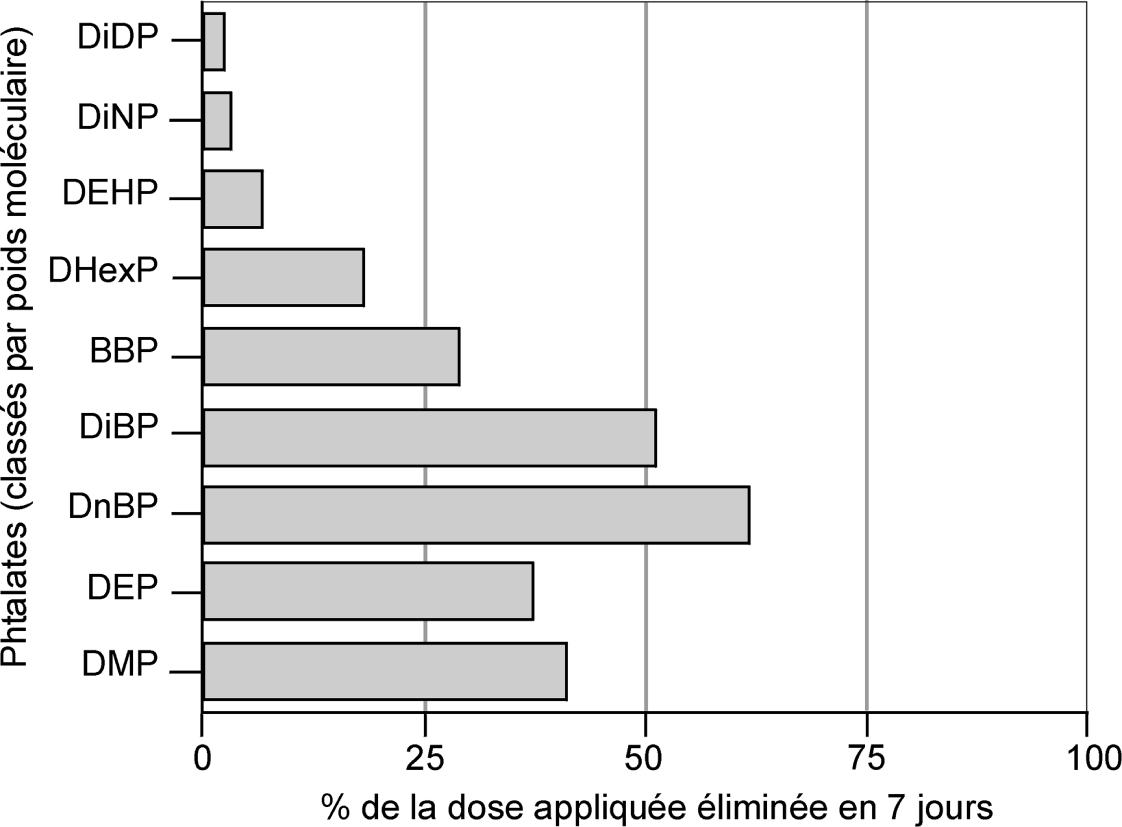
et montrent que si cette voie de passage est limitée pour les phtalates dont la masse moléculaire est proche de 400 ou supérieure à cette valeur, elle est loin d’être négligeable pour les molécules de plus faible encombrement stérique. Les études conduites chez l’homme avec du
14C-DEHP (Wester et coll., 1998

) font état d’un niveau d’absorption cutanée d’environ 1 %, estimé sur la base de la quantité de radioactivité retrouvée dans l’urine. Cette valeur ne tenant pas compte des autres voies d’élimination, en particulier biliaire, sous-estime probablement la réalité. De ce fait, l’ECB (2008

) propose de retenir une biodisponibilité de 5 % pour le DEHP appliqué sur la peau.
Distribution
Dans l’organisme, la distribution est rapide et dépend de la voie d’administration. Pour ce qui concerne le DEHP, les données expérimentales recueillies chez l’animal indiquent que les résidus (DEHP inchangé + métabolites) sont principalement localisés dans le foie, l’intestin, le tissu adipeux et le rein, sans que soit observé un écart important entre les différents tissus, ni une accumulation de la molécule (ATSDR, 2002

). Les concentrations retrouvées dans le cerveau et les testicules sont faibles. Des résidus de DEHP ont été détectés dans le foie des fœtus de rats dont la mère avait été traitée par gavage durant la gestation, démontrant la capacité du DEHP à traverser la barrière placentaire (Srivastava et coll., 1989

; Stroheker et coll., 2006

). Lors d’expositions par inhalation ou par injection intraveineuse, c’est généralement le poumon qui est le principal tissu cible, suivi par le foie et le rein.
Les études effectuées sur d’autres phtalates sont peu nombreuses. Elles indiquent néanmoins que la distribution se fait dans l’ensemble des tissus, sans véritable prééminence pour un organe particulier, ni rétention dans un tissu donné.
Biotransformation/métabolisme
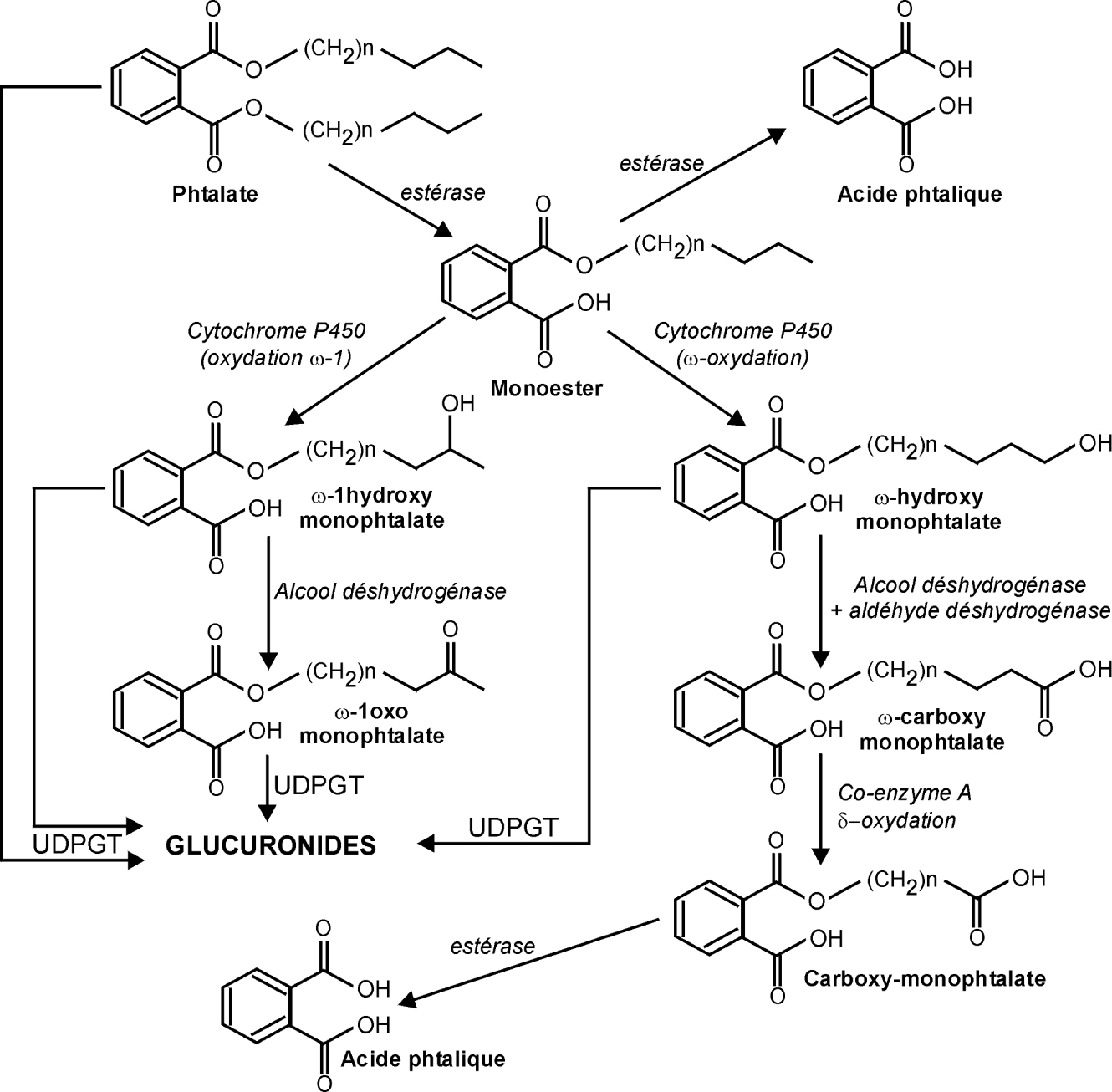
La biotransformation des phtalates, substances très lipophiles, en produits capables d’être éliminés rapidement requiert la mise en œuvre de plusieurs voies métaboliques qui sont, dans leurs grandes lignes, communes à l’ensemble des diesters de l’acide phtalique ayant des chaînes alkyles saturées (figure 33.2

). Ces voies se retrouvent exprimées de manière sensiblement analogue chez les espèces de mammifères, incluant l’homme, chez lesquelles elles ont été étudiées. Les différences observées sont davantage quantitatives que qualitatives. La première étape de ce métabolisme est l’hydrolyse du dialkyl phtalate en monoester sous l’action des estérases présentes notamment dans le tube digestif. Ainsi, sous l’action de la lipase pancréatique, le DEHP est hydrolysé en MEHP, libérant la chaîne alkyle sous la forme d’un alcool primaire. En revanche, la lipase n’est pas en mesure d’hydrolyser la seconde liaison ester et de produire l’acide phtalique. Cette deuxième hydrolyse ne peut se produire qu’en présence d’une estérase hépatique localisée dans le réticulum endoplasmique (Albro, 1986

). Cette première étape n’est pas véritablement une réaction de détoxication. En effet, les dérivés monoesters sont souvent plus toxiques que le phtalate de départ (Frederiksen et coll., 2007

). C’est en particulier le cas du MEHP, plus actif que le DEHP dont il est issu, notamment en matière de liaison au récepteur PPARα et de reprotoxicité (ECB, 2008

). Les monoesters subissent ensuite une oxydation sur la chaîne alkyle qui peut avoir lieu sur le carbone terminal (oxydation en ω) ou subterminal (ω-1), mais aussi en position ω-2 (non indiqué dans la figure 33.2

). Ces oxydations sont produites par l’action des monooxygénases cytochrome P450 dépendantes. D’autres étapes d’oxydation peuvent avoir lieu, catalysées principalement par les aldéhydes deshydrogénases, et conduire à la formation d’un dérivé oxo ou d’un aldéhyde ; ce dernier, pris en charge par l’aldéhyde deshydrogénase, donne lieu à un acide. Le métabolite carboxylé peut ensuite subir une série de β-oxydations ou de décarboxylations ce qui a pour effet de réduire la longueur de la chaîne carboxylée (Kato et coll., 2007

; CPSC, 2010

). Pour les phtalates ayant une chaîne alkyle ramifiée, comme c’est le cas pour le DEHP, le processus d’oxydation peut avoir lieu sur l’une ou l’autre des branches de la chaîne, ainsi que sur différents atomes de carbone, ce qui se traduit par un nombre important de métabolites différents (plus de 30 pour le DEHP). Les phtalates monoesters ainsi que les métabolites hydroxylés ou oxydés peuvent être éliminés sous cette forme ou après conjugaison à l’acide glucuronique.
Concernant le DEHP, la principale différence de métabolisme entre le rat et les primates tient au fait que le métabolisme oxydatif du MEHP conduisant à la formation d’acides dicarboxyliques est une voie majoritaire chez le rat, alors que chez les primates et chez l’homme, ce sont principalement le MEHP et les alcools secondaires correspondants que l’on retrouve de façon prépondérante (Kavlock et coll., 2002a

). Une autre différence interespèce concerne la conjugaison des métabolites primaires à l’acide glucuronique avant leur élimination urinaire. Alors qu’aucun glucuronide n’est présent dans l’urine chez le rat, ils représentent environ 60 % des métabolites urinaires chez la souris et 65 à 99 % chez les primates et chez l’homme (ECB, 2008

). Pourtant, comme l’a montré Albro (1986

) par des études
in vitro, les microsomes hépatiques de rat sont bien capables de réaliser la conjugaison. Cet auteur explique la différence de glucuronide urinaire chez les rongeurs par le fait que la β-glucuronidase hépatique, enzyme réalisant l’hydrolyse du glucuronide, est 3 fois plus active chez le rat que chez la souris. Pour mieux appréhender ces différences interespèces, Ito et ses collaborateurs (2005

) ont mesuré les activités des principales enzymes du métabolisme du DEHP (lipase, UDPGT, alcool deshydrogénase et aldéhyde deshydrogénase) dans plusieurs organes (foie, poumons, rein, intestin grêle) chez la souris CD1, le rat Sprague-Dawley et le singe marmouset. La lipase intestinale, principale responsable de la formation de MEHP, est environ 350 fois plus active chez la souris que chez le marmouset. Les résultats sur les autres enzymes font apparaître des différences bien plus limitées.
Excrétion
Les métabolites des phtalates sont rapidement éliminés. Leur demi-vie est généralement comprise entre 8 et 48 h selon le composé. Le tableau 33.III

présente les métabolites des principaux phtalates. Pour les phtalates qui ont un faible poids moléculaire, comme le DMP ou le DEP, chez le rat comme chez l’homme, l’essentiel de l’élimination se produit dans l’urine sous forme de métabolites monoesters non conjugués (Frederiksen et coll., 2007

). Le DBP est lui aussi principalement éliminé dans l’urine. Plus de 80 % d’une dose unique de DBP chez le rat est excrété dans l’urine en 48 h contre 5 % dans les fèces (Williams et Blanchfield, 1975

), le glucuronide du monobutylphtalate étant le principal métabolite urinaire du DBP. Le DIBP et le BBP ont des profils d’excrétion semblables à celui du DBP. Ainsi, seulement 7 % du MBP urinaire est sous forme non conjuguée chez l’homme (Silva et coll., 2003

). Pour les phtalates de poids moléculaire plus élevé comme le DINP, l’élimination est autant fécale qu’urinaire (McKee et coll., 2002

). Chez le rat, une partie substantielle de l’élimination fécale est due à l’excrétion de métabolites biliaires. En effet, le ratio urine/fèces est sensiblement le même, que le DINP soit administré par voie orale ou par voie cutanée (ECB, 2003

). Pour la plupart des phtalates, un cycle entérohépatique a été mis en évidence.
Pour ce qui concerne le DEHP, Koch et coll. (2004

, 2005

) ont observé que 2 jours après l’administration orale d’une dose unique de DEHP deutéré (0,35, 2,15 et 48,5 mg) à un volontaire sain, environ 75 % de la dose était éliminée dans l’urine, sous forme de 5 métabolites principaux : le mono(2-éthyl-5-hydroxyhexyl) phtalate (MEHHP ou 5OH-MEHP), le mono(2-éthyl-5-carboxypentyl phtalate (MECPP ou 5cx-MEPP), le mono(2-éthyl-5-oxohexyl) phtalate (MEOHP ou 5oxo-MEHP), le MEHP et le mono(2-carboxyméthylhexyl) phtalate (MCMHP ou 2cx-MMHP), représentant respectivement 24,7, 21,9, 14,9, 7,3 et 5,4 %. La dose, dans la gamme utilisée, a très peu d’incidence qualitative ou quantitative sur ce profil d’excrétion. Quelques métabolites mineurs tels que le mono(2-éthyl-3-carboxypropyl)-phtalate, le mono(2-éthyl-4-carboxybutyl)-phtalate et le mono[2-(1-oxoéthyl)hexyl] phtalate sont également présents. Dans les études populationnelles, les métabolites urinaires principaux sont le MECPP et le MEHHP (Frederiksen et coll., 2007

).
Tableau 33.III Métabolites urinaires majeurs des dialkyl orthophtalates (d’après Frederiksen, 2007  ; NRC, 2008
; NRC, 2008 et CPSC, 2010
et CPSC, 2010 )
)
|
Parents
|
Abréviation
|
Métabolites
|
Abréviation 1a
|
Abréviation 2
|
|
Diméthyl-phtalate
|
DMP
|
Monométhyl-phtalate
|
MMP
| |
|
Diéthyl-phtalate
|
DEP
|
Monoéthyl-phtalate
|
MEP
| |
|
Di-n-butyl-phtalate
|
DBP
|
Mono n-butyl-phtalate
|
MBP
| |
|
Diisobutyl-phtalate
|
DIBP
|
Monoisobutyl-phtalate
|
MIBP
| |
|
Butylbenzyl-phtalate
|
BBP
|
Monobenzyl-phtalate
Monobutyl-phtalateb
|
MBzP
MBP
| |
|
Dicyclohexyl-phtalate
|
DCHP
|
Monocyclohexyl-phtalate
|
MCHP
| |
|
Di(2-éthylhexyl)-phtalate
|
DEHP
|
Mono(2-éthylhexyl)-phtalate
Mono(2-éthyl-5-oxohexyl)-phtalate
Mono(2-éthyl-5-hydroxyhexyl)-phtalate
Mono(2-carboxyméthylhexyl)-phtalate
Mono(2-éthyl-5-carboxypentyl)-phtalate
|
MEHP
MEOHP
MEHHP
MCMHP
MECPP
|
5oxo-MEHP
5OH-MEHP
2cx-MMHP
5cx-MEPP
|
|
Di-n-octyl-phtalate
|
DNOP
|
Mono-n-octyl-phtalate
Mono(3-carboxypropyl)phtalate
|
MNOP
MCPP
|
3cx-MNOP
|
|
Diisononyl-phtalate
|
DINP
|
Monoisononyl-phtalate
Mono(carboxyisooctyl)-phtalate
Mono(hydroxyisononyl)-phtalate
Mono(oxoisononyl)-phtalate
|
MINP
MCIOP
MHINP
MOINP
|
cx-MINP
OH-MINP
oxo-MINP
|
|
Diisodecyl-phtalate
|
DIDP
|
Monoisodecyl-phtalate
Mono(carboxyisononyl)-phtalate
Mono(hydroxyisodecyl)-phtalate
Mono(oxoisodecyl)-phtalate
|
MIDP
MCINP
MHIDP
MOIDP
|
cx-MIDP
OH-MIDP
oxo-MIDP
|
|
Di(2-propylheptyl)-phtalate
|
DPHP
|
Mono(propylheptyl)-phtalate
Mono(carboxypropylheptyl)-phtalate
Mono(hydroxypropylheptyl)-phtalate
Mono(oxopropylheptyl)-phtalate
|
MPHP
MCPHP
MHPHP
MOPHP
|
cx-MPHP
OH- MPHP
oxo-MPHP
|
a Les abréviations des métabolites ne sont pas encore standardisées. L’abréviation 1 dérive de la nomenclature anglosaxonne et l’abréviation 2 est couramment utilisée dans les publications ; b BBP est préferentiellement hydrolysé en monobenzyl phtalate
Koch et Angerer (2007

) ont étudié l’excrétion urinaire du DINP chez un volontaire humain ayant reçu une dose orale unique (1,27 mg/kg pc) de DINP deutéré. Le métabolite majoritaire recueilli au cours des 2 jours suivant l’administration est le MHINP (OH-MINP), suivi du MCIOP (cx-MINP) et du MOINP (oxo-MINP). Le même type d’expérimentation menée avec du di(2-propylheptyl)-phtalate (DPHP) montre que les deux métabolites urinaires principaux de ce phtalate chez l’homme sont le MHPHP (OH-MPHP) et le MOPHP (oxo-MPHP) (Wittassek et Angerer, 2008

). Une étude réalisée chez une centaine de volontaires adultes (exposition aux phtalates non connue) a montré que trois métabolites oxydés du DIDP étaient éliminés dans l’urine : le mono(carboxyisononyl) phtalate (MCINP ou cx-MIDP), le mono(oxoisodecyl)-phtalate (MOIDP ou oxo-MIDP) et le mono(hydroxyisodecyl)-phtalate (MHIDP ou OH-MIDP) (Silva et coll., 2007

). La figure 33.3

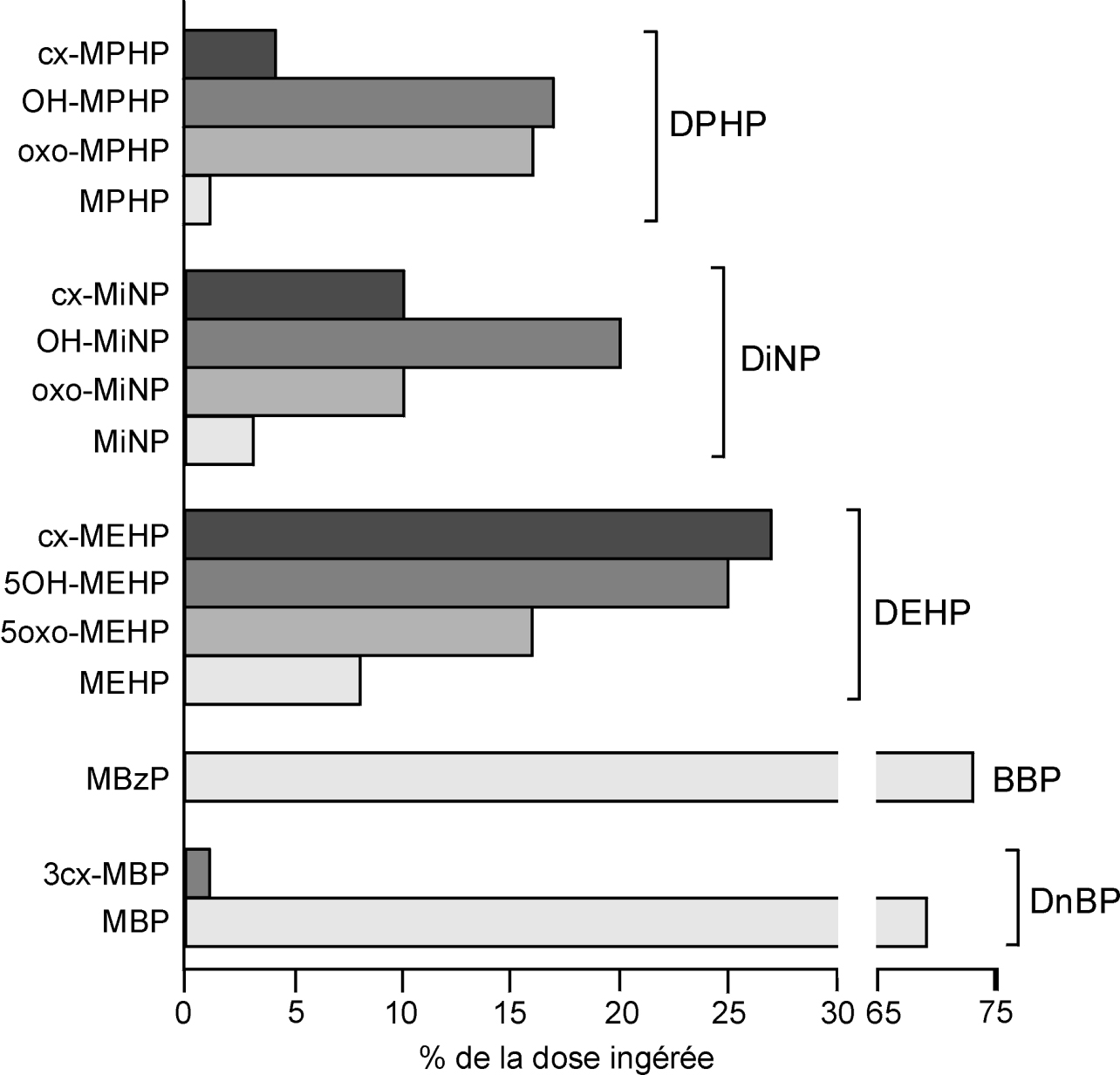
résume les données concernant l’élimination urinaire des métabolites des phtalates chez l’homme et permet de faire apparaître les principaux marqueurs d’exposition à ces contaminants.
Ces données indiquent que si les monoesters tels que le MBP ou le MBzP peuvent constituer des marqueurs urinaires pertinents de l’exposition humaine au DBP et au BBP, les monoesters de phtalates de masses moléculaires plus élevées ne suffisent pas à rendre compte d’une exposition aux phtalates dont ils sont issus. La mesure des métabolites oxydés comme biomarqueurs de l’exposition aux phtalates présente l’intérêt d’éviter les biais analytiques liés à la contamination des échantillons au cours du stockage, ou encore pendant les différentes étapes du processus d’analyse. En effet, contrairement aux monoesters qui peuvent se former, à partir des composés parents, par photolyse ou hydrolyse chimique, conduisant parfois à une surestimation de l’exposition, les produits d’oxydation sont uniquement issus du métabolisme par l’organisme et ne dépendent pas d’un facteur externe de contamination. Par ailleurs, ils ont généralement une demi-vie supérieure à celle des monoesters et peuvent donc mieux refléter un degré moyen d’exposition, tout au moins pour des phtalates disposant d’une chaîne ester d’au moins 5 atomes de carbone.
Dans la population générale, les concentrations médianes des métabolites mesurées par Angerer et ses collaborateurs sur un échantillon d’une centaine de personnes résidant dans le sud de l’Allemagne sont de 50,4 μg/l pour le MBP, 35,7 μg/l pour le MIBP, 5,4 μg/l pour le MBzP, 4,1 μg/l pour le MEHP, 13,8 μg/l pour le MEHHP, 12,2 μg/l pour le MEOHP, 21,6 μg/l pour le MECPP, 6,3 μg/l pour le MCMHP, 2,0 μg/l pour le MHINP, 1,3 μg/l pour le MOINP et 4,0 μg/l pour le MCIOP (Wittassek et Angerer, 2008

). Ces profils d’excrétion peuvent varier en fonction des zones géographiques, mais également de l’âge. Chez les enfants de 6-7 ans, le ratio des produits d’oxydation du DEHP/MEHP est environ 4 fois plus élevé que chez l’adulte (Becker et coll., 2009

). Chez les nouveau-nés, le MECPP est de loin le métabolite urinaire le plus abondant.
Plusieurs auteurs (David, 2000

; Koch et coll., 2003

; Suzuki et coll., 2009

) ont estimé les valeurs d’exposition journalières en se basant sur l’analyse quantitative des métabolites urinaires et en appliquant l’équation suivante :
Dose journalière (μg/kg/j) ME (μg/g) × CE(mg/kg/j) 1FUE × 1 000 (mg/g) × MWdMWm
dans laquelle ME est la concentration en monoester de phtalate ajustée au taux de créatinine, CE est le taux d’excrétion urinaire de créatinine normalisé en fonction du poids corporel et FUE est la fraction molaire de monoester éliminée dans l’urine par rapport au phtalate diester parent. MWd et MWm représentent la masse moléculaire respective des diesters et des monoesters de phtalates.
Une bonne corrélation est généralement observée entre certains dérivés monoesters des phtalates urinaires et ceux détectés dans le sérum (Silva et coll., 2003

; Högberg et coll., 2008

; Hines et coll., 2009

). Dans la plupart des cas cependant, les taux sériques sont trop faibles pour permettre une estimation correcte de l’exposition, expliquant la préférence de plusieurs équipes pour les marqueurs urinaires.
Outre l’urine, la bile constitue également une voie d’excrétion des phtalates. Les études de métabolisme réalisées chez les rongeurs à partir de DEHP, de BBP ou de DIDP radio-marqués (Kavlock et coll., 2002a

, b

, c

) montrent que cette voie est moins importante que l’excrétion urinaire, même si elle peut atteindre plus de 50 % de la dose administrée par voie intraveineuse pour le BBP. Chez le rat traité par du DEHP par voie orale (500 mg/kg), le taux d’élimination biliaire est d’environ 5 à 10 % et concerne principalement des conjugués à l’acide glucuronique (Daniel et Bratt, 1974

; Tanaka et coll., 1975

). Plusieurs études font état d’un cycle entérohépatique pour les phtalates, mais la plupart des travaux apportent des preuves indirectes du processus, sans fournir pour autant de véritables données quantitatives.
Le lait est également une voie d’élimination des phtalates. Plusieurs travaux expérimentaux font état du transfert dans le lait des métabolites de phtalates. Les données récentes recueillies chez des femmes européennes indiquent que les teneurs de plusieurs monoesters de phtalates dans le lait, bien que généralement faibles, sont parfaitement mesurables (Mortensen et coll., 2005

; Main et coll., 2006

; Högberg et coll., 2008

; Hines et coll., 2009

; Latini et coll., 2009

). Parmi les monoesters, les concentrations les plus élevées sont observées pour le MINP avec des valeurs médianes de l’ordre de 100 μg/l chez des femmes scandinaves (Mortensen et coll., 2005

; Main et coll., 2006

) alors que Latini et coll. (2009

) rapportent des valeurs médianes inférieures à 20 μg/l chez 62 femmes du sud de l’Italie. Les valeurs observées pour les métabolites oxydés sont souvent inférieures à la limite de détection.
Des modèles toxicocinétiques physiologiques (PBPK) ont été développés pour les phtalates les plus étudiés : le DBP et le DEHP. Keys et ses collaborateurs (1999

, 2000

) ont tout d’abord développé des modèles PBPK pour évaluer le rôle de différents processus de transport dans la clairance du MBP et du MEHP chez le rat mâle adulte. Ces modèles, basés sur les concentrations sanguines après administration orale ou intraveineuse des composés parents ou des monoesters, décrivent précisément la cinétique de répartition entre le compartiment sanguin et les différents tissus. Plus récemment, un modèle PBPK a été proposé pour déterminer l’exposition des tissus cibles au DBP et ses métabolites libre et conjugué chez des rates en gestation, prenant en compte l’exposition du fœtus (Clewell et coll., 2008

). Ce modèle décrit la clairance urinaire, plasmatique, biliaire et fécale du DBP, du MBP, ainsi que des métabolites oxydés libres et conjugués après des administrations unique (intraveineuse et orale) ou répétée (orale) de DBP à des doses de 50, 100 ou 500 mg/kg pc. Le modèle permet de déterminer l’exposition fœtale au MBP, le métabolite actif, à partir de données telles que la dose externe, les concentrations plasmatiques ou urinaires chez la mère, ou encore les teneurs mesurées dans le liquide amniotique. Ce modèle a également été extrapolé à l’homme en ajustant les paramètres physiologiques et en utilisant des approches allométriques pour estimer les changements d’échelle concernant la distribution des xénobiotiques (Campbell et coll., 2008

). Il permet, à partir des concentrations urinaires en MBP, de prédire l’exposition quotidienne en DBP, ce qui suggère que le métabolisme du DBP à faible dose chez le rat et chez l’homme présente peu de différences.
En conclusion, l’exposition de l’homme adulte au DEHP est estimée en moyenne à environ 2 μg/kg pc/j d’après les données de concentrations urinaires de ces phtalates ou des métabolites, recueillies dans les populations occidentales. Elle est légèrement plus faible pour les autres phtalates. On observe peu de différences entre les hommes et les femmes. Comparés dans le même temps aux adultes, tous les enfants (0-3 ans) présentent des concentrations 3 à 5 fois plus élevées. D’après des données allemandes, 1,5 % des enfants en Allemagne présentent une exposition au DEHP supérieure au niveau d’exposition pour lequel l’absence d’effet adverse n’est pas certaine. En 2010, la
Consumer Product Safety Commission américaine (CPSC)

déterminait une DJT de 5,8 μg/kg pc/j pour le DEHP.
L’exposition des nourrissons et des jeunes enfants aux phtalates provient essentiellement de la voie alimentaire. Sur la base des teneurs en DEHP dans les aliments pour bébés, les auteurs ont estimé que l’exposition des nourrissons de moins de 6 mois aux phtalates pouvait atteindre 10 μg/kg pc/j et près de 20 μg/kg pc/j chez les enfants de plus de 6 mois.
Depuis les interdictions et restriction d’usage, d’autres phtalates que le DEHP (notamment le DINP) sont plus souvent retrouvés en particulier chez les enfants. Par ailleurs, lors des hospitalisations, les dispositifs médicaux constituent des sources importantes d’exposition aux phtalates chez les enfants (prématurés...) et les adultes (dialysés).
Les phtalates sont très bien absorbés par la voie digestive, par inhalation et probablement par la voie cutanée et ne sont pas retenus dans l’organisme. Si on n’observe pas de bioaccumulation, il est tout de même important de signaler que l’exposition est continue en relation avec la diversité des sources de contamination (alimentaire, environnement, cosmétiques...). L’exposition chez l’homme peut être appréciée par la mesure de biomarqueurs dans les liquides biologiques. Des phtalates et leurs métabolites sont détectés dans le sang du cordon et dans le liquide amniotique à des concentrations néanmoins plus faibles que celles mesurées dans l’urine des mères prélevée au moment de l’accouchement.
Le métabolisme des phtalates est complexe et résulte parfois en la production de plusieurs métabolites. Les études chez l’animal montrent que le DEHP subit une hydrolyse enzymatique en mono(éthylhexyl) phtalate (MEHP), son métabolite principal et en métabolites oxydés. L’activité hydrolytique est assurée par des enzymes pancréatiques (lipases) et plasmatiques (estérases). Les lipases (foie, reins, intestin) sont plus actives chez les rongeurs que chez les primates. Des études récentes semblent indiquer que chez l’homme, les principaux métabolites dans les urines sont les métabolites oxydés. La mesure des métabolites oxydés dans les liquides biologiques permet de contourner les possibles contaminations liées au processus analytique de mesure.
Les différences de sensibilité aux effets des phtalates observées entre différentes espèces (rongeurs, primates non humains et humains) pourraient être associées aux différences dans l’absorption, la distribution, le métabolisme et l’excrétion. La concentration maximum sanguine en MEHP est 7,5 fois plus faible chez le primate non humain (marmouset) que chez le rat. Chez l’homme et le primate non humain, le MEHP est présent dans le sang et l’urine essentiellement comme glucuro-conjugué. Cependant, des métabolites de DEHP, avec des chaînes ester carboxylées, sont retrouvés sous formes conjuguées et libres dans les échantillons urinaires humains. Différents tissus peuvent être la cible de ses métabolites (testicule, ovaire...). Il apparaît important d’analyser les effets qui pourraient être associés aux métabolites oxydés et non oxydés.
Bibliographie
[1] ALBRO PW. Absorption, metabolism, and excretion of di(2-ethylhexyl) phthalate by rats and mice.
Environ Health Perspect. 1986;
65:293
-298

[2] ASO S, EHARA H, MIYATA K, HOSYUYAMA S, SHIRAISHI K, et coll. A two generation reproductive toxicity study of butyl benzyl phthalate in rats.
The Journal of Toxicological Sciences. 2005;
30:39
-58

[4] BECKER K, GUEN T, SEIWERT M, CONRAD A, PICK-FUSS H, et coll. GerES IV: Phthalate metabolites and bisphenol A in urine of German children.
Int J Hyg Environ Health. 2009;
212:685
-692

[5] CALAFAT AM, NEEDHAM LL, SILVA MJ, LAMBERT G. Exposure to di-(2-ethylhexyl) phthalate among premature neonates in a neonatal intensive care unit.
Pediatrics. 2004;
113:e429
-e434

[6] CLEWELL RA, KREMER JJ, WILLIAMS CC, CAMPBELL , JL JR, ANDERSEN ME, BORGHOFF SJ. Tissue exposures to free and glucuronidated monobutylyphthalate in the pregnant and fetal rat following exposure to di-n-butylphthalate: evaluation with a PBPK model.
Toxicol Sci. 2008;
103:241
-259

[7] CAMPBELL JL JR, CLEWELL RA, TAN Y, CLEWELL HJ III. Interpreting biomonitoring data for monobutyl phthalate in urine using a physiologically based pharmacokinetic model: estimation of in utero exposure.
Epidemiology. 2008;
19:
-S248

[9] DANIEL JW, BRATT H. The absorption, metabolism and tissue distribution of di(2-ethylhexyl)phthalate in rats.
Toxicology. 1974;
2:51
-65

[10] DAVID RM, MOORE MR, FINNEY DC, GUEST D. Chronic toxicity of di(2-ethylhexyl)phthalate in rats.
Toxicol Sci. 2000;
55:433
-443

[13]EUROPEAN FOOD SAFETY AUTHORITY (EFSA).Opinion of the Scientific Panel on food additives, flavourings, processing aids and materials in contact with food (AFC) related to Bis(2-ethylhexyl)phthalate (DEHP) for use in food contact materials. EFSA J. 2005a;
243:120(
http://www.efsa.europa.eu/en/scdocs/doc/243.pdf).

[14]EUROPEAN FOOD SAFETY AUTHORITY (EFSA).Opinion of the scientific panel on food additives, flavourings, processing aids and material in contact with food (AFC) on a request from the Commission related to di-butylphthalate (DBP) for use in food contact materials. Question No. EFSA-Q-2003-192, adopted on June 23, 2005. EFSA J. 2005b;
242:117(
http://www.efsa.europa.eu/en/scdocs/doc/242.pdf).

[15]EUROPEAN FOOD SAFETY AUTHORITY (EFSA).Avis du groupe scientifique sur les additifs alimentaires, les arômes, les auxiliaires technologiques et les matériaux en contact avec les aliments [AFC] concernant le phtalate de di-isodécyle (DIDP) utilisé dans les matériaux en contact avec les aliments. EFSA J. 2005c;
245:114(
http://www.efsa.europa.eu/fr/scdocs/doc/245.pdf).

[16]EUROPEAN FOOD SAFETY AUTHORITY (EFSA).Opinion of the Scientific Panel on food additives, flavourings, processing aids and materials in contact with food (AFC) related to Butylbenzylphthalate (BBP) for use in food contact materials. EFSA J. 2005d;
241:114(
http://www.efsa.europa.eu/en/scdocs/doc/241.pdf).

[17] EL SISI AE, CARTER DE, SIPES IG. Dermal absorption of phthalate diesters in rats.
Fundam Appl Toxicol. 1989;
12:70
-77

[18]EXXON BIOMEDICAL SCIENCES.Chronic Toxicity/Oncogenicity Study in F-344 Rats. Test Material: MRD-83-260. Project No 326075 performed at Exxon Biomedical Sciences, Inc.. Unpublished Laboratory Report;
January 13;
1986;

[19] FREDERIKSEN H, SKAKKEBAEK NE, ANDERSSON AM. Metabolism of phthalates in humans.
Mol Nutr Food Res. 2007;
51:899
-911

[20]HAZLETON LABORATORIES.13-Week Dietary Administration - Dogs Plasticiser (DIDP) submitted to WR Grace and Company. 1968;

[21] HINES CJ, NILSEN HOPF NB, DEDDENS JA, CALAFAT AM, SILVA MJ, et coll. Urinary phthalate metabolite concentrations among workers in selected industries: a pilot biomonitoring study.
Ann Occup Hyg. 2009;
53:1
-17

[22] HÖGBERG J, HANBERG A, BERGLUND M, SKERFVING S, REMBERGER M, et coll. Phthalate diesters and their metabolites in human breast milk, blood or serum, and urine as biomarkers of exposure in vulnerable populations.
Environ Health Perspect. 2008;
116:334
-339

[23] ITO Y, YOKOTA H, WANG R, YAMANOSHITA O, ICHIHARA G, et coll. Species differences in the metabolism of di(2-ethylhexyl) phthalate (DEHP) in several organs of mice, rats, and marmosets.
Arch Toxicol. 2005;
79:147
-154

[24] KATO K, SILVA MJ, WOLF C, GRAY LE, NEEDHAM LL, CALAFAT AM. Urinary metabolites of diisodecyl phthalate in rats.
Toxicology. 2007;
236:114
-122

[25] KAVLOCK R, BOEKELHEIDE K, CHAPIN R, CUNNINGHAM M, FAUSTMAN E, et coll. NTP Center for the Evaluation of Risks to Human Reproduction: phthalates expert panel report on the reproductive and developmental toxicity of di(2-ethylhexyl) phthalate.
Reprod Toxicol. 2002a;
16:529
-653

[26] KAVLOCK R, BOEKELHEIDE K, CHAPIN R, CUNNINGHAM M, FAUSTMAN E, et coll. NTP Center for the evaluation of risks to human reproduction: phthalates expert panel report on the reproductive and developmental toxicity of butyl benzyl phthalate.
Reprod Toxicol. 2002b;
16:453
-487

[27] KAVLOCK R, BOEKELHEIDE K, CHAPIN R, CUNNINGHAM M, FAUSTMAN E, et coll. NTP Center for the evaluation of risks to human reproduction: phthalates expert panel report on the reproductive and developmental toxicity of di-isodecyl phthalate.
Reprod Toxicol. 2002c;
16:655
-678

[28] KEYS DA, WALLACE DG, KEPLER TB, CONOLLY RB. Quantitative evaluation of alternative mechanisms of blood and testes disposition of di(2-ethylhexyl) phthalate and mono(2-ethylhexyl) phthalate in rats.
Toxicol Sci. 1999;
49:172
-185

[29] KEYS DA, WALLACE DG, KEPLER TB, CONOLLY RB. Quantitative evaluation of alternative mechanisms of blood disposition of di(n-butyl) phthalate and mono(n-butyl) phthalate in rats.
Toxicol Sci. 2000;
53:173
-184

[30] KOCH HM, ANGERER J. Di-iso-nonylphthalate (DINP) metabolites in human urine after a single oral dose of deuterium-labelled DINP.
Int J Hyg Environ Health. 2007;
210:9
-19

[31] KOCH HM, ROSSBACH B, DREXLER H, ANGERER J. Internal exposure of the general population to DEHP and other phthalates-determination of secondary and primary phthalate monoester metabolites in urine.
Environ Res. 2003;
93:177
-185

[32] KOCH HM, BOLT HM, ANGERER J. Di(2-ethylhexyl)phthalate (DEHP) metabolites in human urine and serum after a single oral dose of deuterium-labelled DEHP.
Arch Toxicol. 2004;
78:123
-130

[33] KOCH HM, BOLT HM, PREUSS R, ECKSTEIN R, WEISBACH V, ANGERER J. Intravenous exposure to di(2-ethylhexyl)phthalate (DEHP): metabolites of DEHP in urine after a voluntary platelet donation.
Arch Toxicol. 2005;
79:689
-693

[34] LATINI G, DE FELICE C, PRESTA G, DEL , VECCHIO A, PARIS I, RUGGIERI F, MAZZEO P. In utero exposure to di-(2-ethylhexyl)phthalate and duration of human pregnancy.
Environ Health Perspect. 2003;
111:1783
-1785

[35] LATINI G, WITTASSEK M, DEL VECCHIO A, PRESTA G, DE FELICE C, ANGERER J. Lactational exposure to phthalates in Southern Italy.
Environ Int. 2009;
35:236
-239

[36] LEE KY, SHIBUTANI M, TAKAGI H, KATO N, TAKIGAMI S, et coll. Diverse developmental toxicity of di-n-butyl phthalate in both sexes of rat offspring after maternal exposure during the period from late gestation through lactation.
Toxicology. 2004;
203:221
-238

[37] LINGTON AW, BIRD MG, PLUTNICK RT, STUBBLEFIELD WA, SCALA RA. Chronic toxicity and carcinogenic evaluation of diisononyl phthalate in rats.
Fundam Appl Toxicol. 1997;
36:79
-89

[38] MAHOOD IK, SCOTT HM, BROWN R, HALLMARK N, WALKER M, SHARPE RM. In utero exposure to di(n-butyl) phthalate and testicular dysgenesis: comparison of fetal and adult end points and their dose sensitivity.
Environ Health Perspect. 2007;
115:55
-61

[39] MAIN KM, MORTENSEN GK, KALEVA MM, BOISEN KA, DAMGAARD IN, et coll. Human breast milk contamination with phthalates and alterations of endogenous reproductive hormones in infants three months of age.
Environ Health Perspect. 2006;
114:270
-276

[41] MCKEE RH, EL-HAWARI M, STOLTZ M, PALLAS F, LINGTON AW. Absorption, disposition and metabolism of di-isononyl phthalate (DINP) in F-344 rats.
J Appl Toxicol. 2002;
22:293
-302

[42] MORTENSEN GK, MAIN KM, ANDERSSON AM, LEFFERS H, SKAKKEBAEK NE. Determination of phthalate monoesters in human milk, consumer milk, and infant formula by tandem mass spectrometry (LC-MS-MS).
Anal Bioanal Chem. 2005;
382:1084
-1092

[43]NATIONAL RESEARCH COUNCIL (NRC).Committee on the Health Risks of Phthalates. Phthalates and Cumulative Risk Assessment: The Task Ahead. National Academies Press. Washington, DC:2008;

[44]NATIONAL TOXICOLOGY PROGRAM (NTP).Benzyl Butyl Phthalate Feed Studies. 1997;

[45] PETERSEN JH, BREINDAHL T. Plasticizers in total diet samples, baby food and infant formulae.
Food Addit Contam. 2000;
17:133
-141

[46] SILVA MJ, MALEK NA, HODGE CC, REIDY JA, KATO K, et coll. Improved quantitative detection of 11 urinary phthalate metabolites in humans using liquid chromatography-atmospheric pressure chemical ionization tandem mass spectrometry.
J Chromatogr B Analyt Technol Biomed Life Sci. 2003;
789:393
-404

[47] SILVA MJ, REIDY JA, KATO K, PREAU JL JR, NEEDHAM LL, CALAFAT AM. Assessment of human exposure to di-isodecyl phthalate using oxidative metabolites as biomarkers.
Biomarkers. 2007;
12:133
-144

[48] SRIVASTAVA S, AWASTHI VK, SRIVASTAVA SP, SETH PK. Biochemical alterations in rat fetal liver following in utero exposure to di(2-ethylhexyl)phthalate (DEHP).
Indian J Exp Biol. 1989;
27:885
-888

[49] STROHEKER T, REGNIER JF, LASSURGUERE J, CHAGNON MC. Effect of in utero exposure to di-(2-ethylhexyl)phthalate: distribution in the rat fetus and testosterone production by rat fetal testis in culture.
Food Chem Toxicol. 2006;
44:2064
-2069

[50] SUZUKI Y, NIWA M, YOSHINAGA J, WATANABE C, MIZUMOTO Y, et coll. Exposure assessment of phthalate esters in Japanese pregnant women by using urinary metabolite analysis.
Environ Health Prev Med. 2009;
14:180
-187

[51] TANAKA A, ADACHI T, TAKAHASHI T, YAMAHA T. Biochemical studies on phthalic esters I. Elimination, distribution and metabolism of di-(2-ethylhexyl)phthalate in rats.
Toxicology. 1975;
4:253
-264

[52] TYL RW, MYERS CB, MARR MC. Two-generation reproductive toxicity evaluation of Butyl Benzyl Phthalate administered in the feed to CD (Sprague-Dawley) rats. RTI Project No. 65C-0726-200, RTI Protocol No. RTI-761.
2001;

[53] TYL RW, MYERS CB, MARR MC. Reproductive toxicity evaluation of Butyl Benzyl Phthalate in rats.
Reprod Toxicol. 2004;
18:241
-264

[54] VANDENTORREN S, ZEMAN F, MORIN L, SARTER H, BIDONDO ML, et coll. Bisphenol A and phtalates contamination of urine samples by catheters in the Elfe pilot study : implications for large scale biomonitoring and studies.
Environ Res. 2011 (sous presse);

[55] WESTER RC, MELENDRES J, SEDIK L, MAIBACH H, RIVIERE JE. Percutaneous absorption of salicylic acid, theophylline, 2, 4-dimethylamine, diethyl hexyl phthalic acid, and p-aminobenzoic acid in the isolated perfused porcine skin flap compared to man in vivo.
Toxicol Appl Pharmacol. 1998;
151:159
-165

[56] WILLIAMS DT, BLANCHFIELD BJ. The retention, distribution, excretion, and metabolism of dibutyl phthalate-7-14 C in the rat.
J Agric Food Chem. 1975;
23:854
-858

[57] WITTASSEK M, ANGERER J. Phthalates: metabolism and exposure.
Int J Androl. 2008;
31:131
-138

[58] WITTASSEK M, WIESMÜLLER GA, KOCH HM, ECKARD R, DOBLER L, et coll. Internal phthalate exposure over the last two decades--a retrospective human biomonitoring study.
Int J Hyg Environ Health. 2007a;
210:319
-333

[59] WITTASSEK M, HEGER W, KOCH HM, BECKER K, ANGERER J, KOLOSSA-GEHRING M. Daily intake of di(2-ethylhexyl)phthalate (DEHP) by German children A comparison of two estimation models based on urinary DEHP metabolite levels.
Int J Hyg Environ Health. 2007b;
210:35
-42

[60] WITTASSEK M, ANGERER J, KOLOSSA-GEHRING M, SCHÄFER SD, KLOCKENBUSCH W, et coll. Fetal exposure to phthalates--a pilot study.
Int J Hyg Environ Health. 2009;
212:492
-498

[61] WOLFE GW, LAYTON KA. Multigeneration reproduction toxicity study in rats: multigenerational reproductive assessment by continuous breeding when administered to Sprague-Dawley rats in the diet. TRC Study No. 7244-200.
2003;
TherImmune Research Corporation. Gaithersbury, Maryland:

[62] WORMUTH M, SCHERINGER M, VOLLENWEIDER M, HUNGERBÜHLER K. What are the sources of exposure to eight frequently used phthalic acid esters in Europeans?.
Risk Anal. 2006;
26:803
-824

→ Aller vers SYNTHESE
 ; Koch et coll., 2005
; Koch et coll., 2005 ). L’European Chemicals Bureau (ECB) estimait en 2008 que l’exposition pouvait atteindre 3,1 mg/kg pc/j, chez les hémodialysés adultes et 1,7 mg/kg pc/j chez les nouveau-nés transfusés.
). L’European Chemicals Bureau (ECB) estimait en 2008 que l’exposition pouvait atteindre 3,1 mg/kg pc/j, chez les hémodialysés adultes et 1,7 mg/kg pc/j chez les nouveau-nés transfusés. ) montre que les niveaux médians pour la population générale (60 sujets âgés de 20 à 28 ans) en 2003 atteignaient en Allemagne 2,4 μg/kg pc/j pour le DEHP, 1,9 μg/kg pc/j pour le DBP, 1,4 μg/kg pc/j pour le DIBP, 0,4 μg/kg pc/j pour le DINP et 0,2 μg/kg pc/j pour le BBP. Des valeurs similaires ont été trouvées par Wittassek et Angerer (2008
) montre que les niveaux médians pour la population générale (60 sujets âgés de 20 à 28 ans) en 2003 atteignaient en Allemagne 2,4 μg/kg pc/j pour le DEHP, 1,9 μg/kg pc/j pour le DBP, 1,4 μg/kg pc/j pour le DIBP, 0,4 μg/kg pc/j pour le DINP et 0,2 μg/kg pc/j pour le BBP. Des valeurs similaires ont été trouvées par Wittassek et Angerer (2008 ) chez 102 sujets allemands âgés de 6 à 80 ans. À partir de différents scénarios, Wormuth et coll. (2006
) chez 102 sujets allemands âgés de 6 à 80 ans. À partir de différents scénarios, Wormuth et coll. (2006 ) ont comparé les expositions journalières aux 8 principaux phtalates en fonction de l’âge et du sexe (tableau 33.I
) ont comparé les expositions journalières aux 8 principaux phtalates en fonction de l’âge et du sexe (tableau 33.I ). Les valeurs obtenues font apparaître une exposition globalement plus élevée chez les enfants que chez les adultes (valeurs exprimées en fonction du poids corporel), mais peu de différences entre hommes et femmes.
). Les valeurs obtenues font apparaître une exposition globalement plus élevée chez les enfants que chez les adultes (valeurs exprimées en fonction du poids corporel), mais peu de différences entre hommes et femmes. ).
). )
) , b
, b , c
, c , d
, d ).
). ). La principale différence entre ces deux évaluations du risque porte sur le DEHP et le DBP. Pour le DEHP, l’EFSA a basé son évaluation sur l’étude de Wolfe et Layton (2003
). La principale différence entre ces deux évaluations du risque porte sur le DEHP et le DBP. Pour le DEHP, l’EFSA a basé son évaluation sur l’étude de Wolfe et Layton (2003 ) mettant en évidence, sur une étude multigénérationnelle menée chez le rat, la toxicité du DEHP sur le testicule et les cellules germinales. À partir de cette étude, la dose sans effet est estimée à 5 mg/kg pc/j et un facteur de sécurité de 100 a été appliqué. La CPSC a considéré l’étude de toxicité chronique chez le rat de David et coll. (2000
) mettant en évidence, sur une étude multigénérationnelle menée chez le rat, la toxicité du DEHP sur le testicule et les cellules germinales. À partir de cette étude, la dose sans effet est estimée à 5 mg/kg pc/j et un facteur de sécurité de 100 a été appliqué. La CPSC a considéré l’étude de toxicité chronique chez le rat de David et coll. (2000 ) mettant en évidence un effet sur la spermatogenèse à partir de 5,8 mg/kg pc/j. Cette étude ne permettant pas de définir une dose sans effet, un facteur de sécurité de 1 000 a été appliqué. Pour ce qui concerne le DBP, la CPSC s’est fondée sur l’étude de reprotoxicité de Mahood et coll. (2007
) mettant en évidence un effet sur la spermatogenèse à partir de 5,8 mg/kg pc/j. Cette étude ne permettant pas de définir une dose sans effet, un facteur de sécurité de 1 000 a été appliqué. Pour ce qui concerne le DBP, la CPSC s’est fondée sur l’étude de reprotoxicité de Mahood et coll. (2007 ) permettant de définir une dose sans effet de 20 mg/kg pc/j et un facteur de sécurité de 100 a été appliqué. L’EFSA a, pour sa part, pris en compte l’étude de Lee et coll. (2004
) permettant de définir une dose sans effet de 20 mg/kg pc/j et un facteur de sécurité de 100 a été appliqué. L’EFSA a, pour sa part, pris en compte l’étude de Lee et coll. (2004 ) qui montre un effet sur le développement chez le rat à partir de 2 mg/kg pc/j. L’application d’un facteur de sécurité de 200 a conduit à une DJT de 10 μg/kg pc/j.
) qui montre un effet sur le développement chez le rat à partir de 2 mg/kg pc/j. L’application d’un facteur de sécurité de 200 a conduit à une DJT de 10 μg/kg pc/j. ) ont estimé les niveaux médians d’exposition au DEHP entre 4,3 et 7,8 μg/kg pc/j. L’EFSA estimait en 2005 que l’exposition au DEHP d’enfants de plus de 6 mois consommant des aliments pour bébés prêts à l’emploi était, dans les cas les plus défavorables, de 23,5 μg/kg pc/j (EFSA, 2005a
) ont estimé les niveaux médians d’exposition au DEHP entre 4,3 et 7,8 μg/kg pc/j. L’EFSA estimait en 2005 que l’exposition au DEHP d’enfants de plus de 6 mois consommant des aliments pour bébés prêts à l’emploi était, dans les cas les plus défavorables, de 23,5 μg/kg pc/j (EFSA, 2005a ).
). ). Les concentrations en métabolites diminuent avec l’âge. Comparés aux adultes, tous les enfants présentent des concentrations 3 à 5 fois plus élevées que les adultes analysés dans le même temps. Les auteurs indiquent que 1,5 % des enfants en Allemagne présentent une exposition au DEHP supérieure au niveau d’exposition pour lequel l’absence d’effet adverse n’est pas certaine.
). Les concentrations en métabolites diminuent avec l’âge. Comparés aux adultes, tous les enfants présentent des concentrations 3 à 5 fois plus élevées que les adultes analysés dans le même temps. Les auteurs indiquent que 1,5 % des enfants en Allemagne présentent une exposition au DEHP supérieure au niveau d’exposition pour lequel l’absence d’effet adverse n’est pas certaine. ; Högberg et coll., 2008
; Högberg et coll., 2008 ; Latini et coll., 2009
; Latini et coll., 2009 ). Elles montrent des différences interindividuelles importantes dont on ne peut exclure qu’elles puissent être dues en partie à des problèmes de contamination des échantillons avant ou pendant l’analyse. Ainsi, pour le DEHP, les teneurs rapportées par Högberg et coll. (2008
). Elles montrent des différences interindividuelles importantes dont on ne peut exclure qu’elles puissent être dues en partie à des problèmes de contamination des échantillons avant ou pendant l’analyse. Ainsi, pour le DEHP, les teneurs rapportées par Högberg et coll. (2008 ) chez 42 femmes suédoises primipares dont le lait a été prélevé entre la 2e et la 3e semaine qui a suivi l’accouchement, varient de 0,45 à 305 μg/l, avec une valeur médiane de 9 μg/l.
) chez 42 femmes suédoises primipares dont le lait a été prélevé entre la 2e et la 3e semaine qui a suivi l’accouchement, varient de 0,45 à 305 μg/l, avec une valeur médiane de 9 μg/l. ) sur les femmes suédoises. Elles sont comprises entre 1,8 et 109 μg/l dans une étude conduite récemment sur 62 femmes italiennes (Latini et coll., 2009
) sur les femmes suédoises. Elles sont comprises entre 1,8 et 109 μg/l dans une étude conduite récemment sur 62 femmes italiennes (Latini et coll., 2009 ).
). ). Les concentrations maximales retrouvées dans le lait maternisé étaient de 60 μg/kg pour le DEHP et de 10 μg/kg pour le BBP. Dans les aliments pour bébés, les teneurs en DEHP, DBP et BBP atteignaient au maximum respectivement 630, 40 et 5 μg/kg. Sur la base de ces valeurs, Müller et coll. (2003
). Les concentrations maximales retrouvées dans le lait maternisé étaient de 60 μg/kg pour le DEHP et de 10 μg/kg pour le BBP. Dans les aliments pour bébés, les teneurs en DEHP, DBP et BBP atteignaient au maximum respectivement 630, 40 et 5 μg/kg. Sur la base de ces valeurs, Müller et coll. (2003 ) ont estimé que l’exposition des nourrissons aux phtalates était de 9,8 et 1,6 μg/kg pc/j respectivement pour le DEHP et le BBP, alors que la consommation d’aliments prêts à l’emploi chez les enfants de plus de 6 mois conduisait à une exposition de 19,6 μg/kg pc/j pour le DEHP, de 1,25 μg/kg pc/j pour le DBP et de 0,16 μg/kg pc/j pour le BBP.
) ont estimé que l’exposition des nourrissons aux phtalates était de 9,8 et 1,6 μg/kg pc/j respectivement pour le DEHP et le BBP, alors que la consommation d’aliments prêts à l’emploi chez les enfants de plus de 6 mois conduisait à une exposition de 19,6 μg/kg pc/j pour le DEHP, de 1,25 μg/kg pc/j pour le DBP et de 0,16 μg/kg pc/j pour le BBP. ). Les concentrations moyennes de DEHP et MEHP étaient respectivement de 1,19±1,15 μg/ml et 0,52±0,61 μg/ml. Plus récemment, Wittassek et coll. (2009
). Les concentrations moyennes de DEHP et MEHP étaient respectivement de 1,19±1,15 μg/ml et 0,52±0,61 μg/ml. Plus récemment, Wittassek et coll. (2009 ) ont mesuré les concentrations de métabolites des principaux phtalates dans le liquide amniotique récupéré au cours de 11 naissances par césarienne ayant eu lieu à l’hôpital de Münster en Allemagne. Les métabolites les plus abondants sont le MBP (médiane=7,8 μg/l), le MIBP (médiane=4,2 μg/l), le MBzP (médiane=1,9 μg/l) et le MEHP (médiane=1,6 μg/l) qui correspondent respectivement au DBP, DIBP, BBP et DEHP. Ces valeurs sont 3 à 8 fois plus faibles que celles mesurées dans l’urine des mères prélevée au moment de l’accouchement.
) ont mesuré les concentrations de métabolites des principaux phtalates dans le liquide amniotique récupéré au cours de 11 naissances par césarienne ayant eu lieu à l’hôpital de Münster en Allemagne. Les métabolites les plus abondants sont le MBP (médiane=7,8 μg/l), le MIBP (médiane=4,2 μg/l), le MBzP (médiane=1,9 μg/l) et le MEHP (médiane=1,6 μg/l) qui correspondent respectivement au DBP, DIBP, BBP et DEHP. Ces valeurs sont 3 à 8 fois plus faibles que celles mesurées dans l’urine des mères prélevée au moment de l’accouchement. , 2005
, 2005 ) sur un volontaire sain à qui une dose orale unique de DEHP marqué au deutérium a été administrée indiquent que, chez l’homme, l’absorption de ce phtalate est d’environ 75 %.
) sur un volontaire sain à qui une dose orale unique de DEHP marqué au deutérium a été administrée indiquent que, chez l’homme, l’absorption de ce phtalate est d’environ 75 %. ), quelques travaux ont permis d’établir les niveaux d’absorption cutanée des principaux phtalates chez le rat. Ces données sont résumées dans la figure 33.1
), quelques travaux ont permis d’établir les niveaux d’absorption cutanée des principaux phtalates chez le rat. Ces données sont résumées dans la figure 33.1 et montrent que si cette voie de passage est limitée pour les phtalates dont la masse moléculaire est proche de 400 ou supérieure à cette valeur, elle est loin d’être négligeable pour les molécules de plus faible encombrement stérique. Les études conduites chez l’homme avec du 14C-DEHP (Wester et coll., 1998
et montrent que si cette voie de passage est limitée pour les phtalates dont la masse moléculaire est proche de 400 ou supérieure à cette valeur, elle est loin d’être négligeable pour les molécules de plus faible encombrement stérique. Les études conduites chez l’homme avec du 14C-DEHP (Wester et coll., 1998 ) font état d’un niveau d’absorption cutanée d’environ 1 %, estimé sur la base de la quantité de radioactivité retrouvée dans l’urine. Cette valeur ne tenant pas compte des autres voies d’élimination, en particulier biliaire, sous-estime probablement la réalité. De ce fait, l’ECB (2008
) font état d’un niveau d’absorption cutanée d’environ 1 %, estimé sur la base de la quantité de radioactivité retrouvée dans l’urine. Cette valeur ne tenant pas compte des autres voies d’élimination, en particulier biliaire, sous-estime probablement la réalité. De ce fait, l’ECB (2008 ) propose de retenir une biodisponibilité de 5 % pour le DEHP appliqué sur la peau.
) propose de retenir une biodisponibilité de 5 % pour le DEHP appliqué sur la peau. ). Les concentrations retrouvées dans le cerveau et les testicules sont faibles. Des résidus de DEHP ont été détectés dans le foie des fœtus de rats dont la mère avait été traitée par gavage durant la gestation, démontrant la capacité du DEHP à traverser la barrière placentaire (Srivastava et coll., 1989
). Les concentrations retrouvées dans le cerveau et les testicules sont faibles. Des résidus de DEHP ont été détectés dans le foie des fœtus de rats dont la mère avait été traitée par gavage durant la gestation, démontrant la capacité du DEHP à traverser la barrière placentaire (Srivastava et coll., 1989 ; Stroheker et coll., 2006
; Stroheker et coll., 2006 ). Lors d’expositions par inhalation ou par injection intraveineuse, c’est généralement le poumon qui est le principal tissu cible, suivi par le foie et le rein.
). Lors d’expositions par inhalation ou par injection intraveineuse, c’est généralement le poumon qui est le principal tissu cible, suivi par le foie et le rein.
 et McKee et coll., 2002
et McKee et coll., 2002 )
) ). Ces voies se retrouvent exprimées de manière sensiblement analogue chez les espèces de mammifères, incluant l’homme, chez lesquelles elles ont été étudiées. Les différences observées sont davantage quantitatives que qualitatives. La première étape de ce métabolisme est l’hydrolyse du dialkyl phtalate en monoester sous l’action des estérases présentes notamment dans le tube digestif. Ainsi, sous l’action de la lipase pancréatique, le DEHP est hydrolysé en MEHP, libérant la chaîne alkyle sous la forme d’un alcool primaire. En revanche, la lipase n’est pas en mesure d’hydrolyser la seconde liaison ester et de produire l’acide phtalique. Cette deuxième hydrolyse ne peut se produire qu’en présence d’une estérase hépatique localisée dans le réticulum endoplasmique (Albro, 1986
). Ces voies se retrouvent exprimées de manière sensiblement analogue chez les espèces de mammifères, incluant l’homme, chez lesquelles elles ont été étudiées. Les différences observées sont davantage quantitatives que qualitatives. La première étape de ce métabolisme est l’hydrolyse du dialkyl phtalate en monoester sous l’action des estérases présentes notamment dans le tube digestif. Ainsi, sous l’action de la lipase pancréatique, le DEHP est hydrolysé en MEHP, libérant la chaîne alkyle sous la forme d’un alcool primaire. En revanche, la lipase n’est pas en mesure d’hydrolyser la seconde liaison ester et de produire l’acide phtalique. Cette deuxième hydrolyse ne peut se produire qu’en présence d’une estérase hépatique localisée dans le réticulum endoplasmique (Albro, 1986 ). Cette première étape n’est pas véritablement une réaction de détoxication. En effet, les dérivés monoesters sont souvent plus toxiques que le phtalate de départ (Frederiksen et coll., 2007
). Cette première étape n’est pas véritablement une réaction de détoxication. En effet, les dérivés monoesters sont souvent plus toxiques que le phtalate de départ (Frederiksen et coll., 2007 ). C’est en particulier le cas du MEHP, plus actif que le DEHP dont il est issu, notamment en matière de liaison au récepteur PPARα et de reprotoxicité (ECB, 2008
). C’est en particulier le cas du MEHP, plus actif que le DEHP dont il est issu, notamment en matière de liaison au récepteur PPARα et de reprotoxicité (ECB, 2008 ). Les monoesters subissent ensuite une oxydation sur la chaîne alkyle qui peut avoir lieu sur le carbone terminal (oxydation en ω) ou subterminal (ω-1), mais aussi en position ω-2 (non indiqué dans la figure 33.2
). Les monoesters subissent ensuite une oxydation sur la chaîne alkyle qui peut avoir lieu sur le carbone terminal (oxydation en ω) ou subterminal (ω-1), mais aussi en position ω-2 (non indiqué dans la figure 33.2 ). Ces oxydations sont produites par l’action des monooxygénases cytochrome P450 dépendantes. D’autres étapes d’oxydation peuvent avoir lieu, catalysées principalement par les aldéhydes deshydrogénases, et conduire à la formation d’un dérivé oxo ou d’un aldéhyde ; ce dernier, pris en charge par l’aldéhyde deshydrogénase, donne lieu à un acide. Le métabolite carboxylé peut ensuite subir une série de β-oxydations ou de décarboxylations ce qui a pour effet de réduire la longueur de la chaîne carboxylée (Kato et coll., 2007
). Ces oxydations sont produites par l’action des monooxygénases cytochrome P450 dépendantes. D’autres étapes d’oxydation peuvent avoir lieu, catalysées principalement par les aldéhydes deshydrogénases, et conduire à la formation d’un dérivé oxo ou d’un aldéhyde ; ce dernier, pris en charge par l’aldéhyde deshydrogénase, donne lieu à un acide. Le métabolite carboxylé peut ensuite subir une série de β-oxydations ou de décarboxylations ce qui a pour effet de réduire la longueur de la chaîne carboxylée (Kato et coll., 2007 ; CPSC, 2010
; CPSC, 2010 ). Pour les phtalates ayant une chaîne alkyle ramifiée, comme c’est le cas pour le DEHP, le processus d’oxydation peut avoir lieu sur l’une ou l’autre des branches de la chaîne, ainsi que sur différents atomes de carbone, ce qui se traduit par un nombre important de métabolites différents (plus de 30 pour le DEHP). Les phtalates monoesters ainsi que les métabolites hydroxylés ou oxydés peuvent être éliminés sous cette forme ou après conjugaison à l’acide glucuronique.
). Pour les phtalates ayant une chaîne alkyle ramifiée, comme c’est le cas pour le DEHP, le processus d’oxydation peut avoir lieu sur l’une ou l’autre des branches de la chaîne, ainsi que sur différents atomes de carbone, ce qui se traduit par un nombre important de métabolites différents (plus de 30 pour le DEHP). Les phtalates monoesters ainsi que les métabolites hydroxylés ou oxydés peuvent être éliminés sous cette forme ou après conjugaison à l’acide glucuronique. ). Une autre différence interespèce concerne la conjugaison des métabolites primaires à l’acide glucuronique avant leur élimination urinaire. Alors qu’aucun glucuronide n’est présent dans l’urine chez le rat, ils représentent environ 60 % des métabolites urinaires chez la souris et 65 à 99 % chez les primates et chez l’homme (ECB, 2008
). Une autre différence interespèce concerne la conjugaison des métabolites primaires à l’acide glucuronique avant leur élimination urinaire. Alors qu’aucun glucuronide n’est présent dans l’urine chez le rat, ils représentent environ 60 % des métabolites urinaires chez la souris et 65 à 99 % chez les primates et chez l’homme (ECB, 2008 ). Pourtant, comme l’a montré Albro (1986
). Pourtant, comme l’a montré Albro (1986 ) par des études in vitro, les microsomes hépatiques de rat sont bien capables de réaliser la conjugaison. Cet auteur explique la différence de glucuronide urinaire chez les rongeurs par le fait que la β-glucuronidase hépatique, enzyme réalisant l’hydrolyse du glucuronide, est 3 fois plus active chez le rat que chez la souris. Pour mieux appréhender ces différences interespèces, Ito et ses collaborateurs (2005
) par des études in vitro, les microsomes hépatiques de rat sont bien capables de réaliser la conjugaison. Cet auteur explique la différence de glucuronide urinaire chez les rongeurs par le fait que la β-glucuronidase hépatique, enzyme réalisant l’hydrolyse du glucuronide, est 3 fois plus active chez le rat que chez la souris. Pour mieux appréhender ces différences interespèces, Ito et ses collaborateurs (2005 ) ont mesuré les activités des principales enzymes du métabolisme du DEHP (lipase, UDPGT, alcool deshydrogénase et aldéhyde deshydrogénase) dans plusieurs organes (foie, poumons, rein, intestin grêle) chez la souris CD1, le rat Sprague-Dawley et le singe marmouset. La lipase intestinale, principale responsable de la formation de MEHP, est environ 350 fois plus active chez la souris que chez le marmouset. Les résultats sur les autres enzymes font apparaître des différences bien plus limitées.
) ont mesuré les activités des principales enzymes du métabolisme du DEHP (lipase, UDPGT, alcool deshydrogénase et aldéhyde deshydrogénase) dans plusieurs organes (foie, poumons, rein, intestin grêle) chez la souris CD1, le rat Sprague-Dawley et le singe marmouset. La lipase intestinale, principale responsable de la formation de MEHP, est environ 350 fois plus active chez la souris que chez le marmouset. Les résultats sur les autres enzymes font apparaître des différences bien plus limitées.
 ; Silva et coll., 2003
; Silva et coll., 2003  ; Frederiksen et coll., 2007
; Frederiksen et coll., 2007 )
) présente les métabolites des principaux phtalates. Pour les phtalates qui ont un faible poids moléculaire, comme le DMP ou le DEP, chez le rat comme chez l’homme, l’essentiel de l’élimination se produit dans l’urine sous forme de métabolites monoesters non conjugués (Frederiksen et coll., 2007
présente les métabolites des principaux phtalates. Pour les phtalates qui ont un faible poids moléculaire, comme le DMP ou le DEP, chez le rat comme chez l’homme, l’essentiel de l’élimination se produit dans l’urine sous forme de métabolites monoesters non conjugués (Frederiksen et coll., 2007 ). Le DBP est lui aussi principalement éliminé dans l’urine. Plus de 80 % d’une dose unique de DBP chez le rat est excrété dans l’urine en 48 h contre 5 % dans les fèces (Williams et Blanchfield, 1975
). Le DBP est lui aussi principalement éliminé dans l’urine. Plus de 80 % d’une dose unique de DBP chez le rat est excrété dans l’urine en 48 h contre 5 % dans les fèces (Williams et Blanchfield, 1975 ), le glucuronide du monobutylphtalate étant le principal métabolite urinaire du DBP. Le DIBP et le BBP ont des profils d’excrétion semblables à celui du DBP. Ainsi, seulement 7 % du MBP urinaire est sous forme non conjuguée chez l’homme (Silva et coll., 2003
), le glucuronide du monobutylphtalate étant le principal métabolite urinaire du DBP. Le DIBP et le BBP ont des profils d’excrétion semblables à celui du DBP. Ainsi, seulement 7 % du MBP urinaire est sous forme non conjuguée chez l’homme (Silva et coll., 2003 ). Pour les phtalates de poids moléculaire plus élevé comme le DINP, l’élimination est autant fécale qu’urinaire (McKee et coll., 2002
). Pour les phtalates de poids moléculaire plus élevé comme le DINP, l’élimination est autant fécale qu’urinaire (McKee et coll., 2002 ). Chez le rat, une partie substantielle de l’élimination fécale est due à l’excrétion de métabolites biliaires. En effet, le ratio urine/fèces est sensiblement le même, que le DINP soit administré par voie orale ou par voie cutanée (ECB, 2003
). Chez le rat, une partie substantielle de l’élimination fécale est due à l’excrétion de métabolites biliaires. En effet, le ratio urine/fèces est sensiblement le même, que le DINP soit administré par voie orale ou par voie cutanée (ECB, 2003 ). Pour la plupart des phtalates, un cycle entérohépatique a été mis en évidence.
). Pour la plupart des phtalates, un cycle entérohépatique a été mis en évidence. , 2005
, 2005 ) ont observé que 2 jours après l’administration orale d’une dose unique de DEHP deutéré (0,35, 2,15 et 48,5 mg) à un volontaire sain, environ 75 % de la dose était éliminée dans l’urine, sous forme de 5 métabolites principaux : le mono(2-éthyl-5-hydroxyhexyl) phtalate (MEHHP ou 5OH-MEHP), le mono(2-éthyl-5-carboxypentyl phtalate (MECPP ou 5cx-MEPP), le mono(2-éthyl-5-oxohexyl) phtalate (MEOHP ou 5oxo-MEHP), le MEHP et le mono(2-carboxyméthylhexyl) phtalate (MCMHP ou 2cx-MMHP), représentant respectivement 24,7, 21,9, 14,9, 7,3 et 5,4 %. La dose, dans la gamme utilisée, a très peu d’incidence qualitative ou quantitative sur ce profil d’excrétion. Quelques métabolites mineurs tels que le mono(2-éthyl-3-carboxypropyl)-phtalate, le mono(2-éthyl-4-carboxybutyl)-phtalate et le mono[2-(1-oxoéthyl)hexyl] phtalate sont également présents. Dans les études populationnelles, les métabolites urinaires principaux sont le MECPP et le MEHHP (Frederiksen et coll., 2007
) ont observé que 2 jours après l’administration orale d’une dose unique de DEHP deutéré (0,35, 2,15 et 48,5 mg) à un volontaire sain, environ 75 % de la dose était éliminée dans l’urine, sous forme de 5 métabolites principaux : le mono(2-éthyl-5-hydroxyhexyl) phtalate (MEHHP ou 5OH-MEHP), le mono(2-éthyl-5-carboxypentyl phtalate (MECPP ou 5cx-MEPP), le mono(2-éthyl-5-oxohexyl) phtalate (MEOHP ou 5oxo-MEHP), le MEHP et le mono(2-carboxyméthylhexyl) phtalate (MCMHP ou 2cx-MMHP), représentant respectivement 24,7, 21,9, 14,9, 7,3 et 5,4 %. La dose, dans la gamme utilisée, a très peu d’incidence qualitative ou quantitative sur ce profil d’excrétion. Quelques métabolites mineurs tels que le mono(2-éthyl-3-carboxypropyl)-phtalate, le mono(2-éthyl-4-carboxybutyl)-phtalate et le mono[2-(1-oxoéthyl)hexyl] phtalate sont également présents. Dans les études populationnelles, les métabolites urinaires principaux sont le MECPP et le MEHHP (Frederiksen et coll., 2007 ).
). ; NRC, 2008
; NRC, 2008 et CPSC, 2010
et CPSC, 2010 )
) ) ont étudié l’excrétion urinaire du DINP chez un volontaire humain ayant reçu une dose orale unique (1,27 mg/kg pc) de DINP deutéré. Le métabolite majoritaire recueilli au cours des 2 jours suivant l’administration est le MHINP (OH-MINP), suivi du MCIOP (cx-MINP) et du MOINP (oxo-MINP). Le même type d’expérimentation menée avec du di(2-propylheptyl)-phtalate (DPHP) montre que les deux métabolites urinaires principaux de ce phtalate chez l’homme sont le MHPHP (OH-MPHP) et le MOPHP (oxo-MPHP) (Wittassek et Angerer, 2008
) ont étudié l’excrétion urinaire du DINP chez un volontaire humain ayant reçu une dose orale unique (1,27 mg/kg pc) de DINP deutéré. Le métabolite majoritaire recueilli au cours des 2 jours suivant l’administration est le MHINP (OH-MINP), suivi du MCIOP (cx-MINP) et du MOINP (oxo-MINP). Le même type d’expérimentation menée avec du di(2-propylheptyl)-phtalate (DPHP) montre que les deux métabolites urinaires principaux de ce phtalate chez l’homme sont le MHPHP (OH-MPHP) et le MOPHP (oxo-MPHP) (Wittassek et Angerer, 2008 ). Une étude réalisée chez une centaine de volontaires adultes (exposition aux phtalates non connue) a montré que trois métabolites oxydés du DIDP étaient éliminés dans l’urine : le mono(carboxyisononyl) phtalate (MCINP ou cx-MIDP), le mono(oxoisodecyl)-phtalate (MOIDP ou oxo-MIDP) et le mono(hydroxyisodecyl)-phtalate (MHIDP ou OH-MIDP) (Silva et coll., 2007
). Une étude réalisée chez une centaine de volontaires adultes (exposition aux phtalates non connue) a montré que trois métabolites oxydés du DIDP étaient éliminés dans l’urine : le mono(carboxyisononyl) phtalate (MCINP ou cx-MIDP), le mono(oxoisodecyl)-phtalate (MOIDP ou oxo-MIDP) et le mono(hydroxyisodecyl)-phtalate (MHIDP ou OH-MIDP) (Silva et coll., 2007 ). La figure 33.3
). La figure 33.3 résume les données concernant l’élimination urinaire des métabolites des phtalates chez l’homme et permet de faire apparaître les principaux marqueurs d’exposition à ces contaminants.
résume les données concernant l’élimination urinaire des métabolites des phtalates chez l’homme et permet de faire apparaître les principaux marqueurs d’exposition à ces contaminants.
 )
) ). Ces profils d’excrétion peuvent varier en fonction des zones géographiques, mais également de l’âge. Chez les enfants de 6-7 ans, le ratio des produits d’oxydation du DEHP/MEHP est environ 4 fois plus élevé que chez l’adulte (Becker et coll., 2009
). Ces profils d’excrétion peuvent varier en fonction des zones géographiques, mais également de l’âge. Chez les enfants de 6-7 ans, le ratio des produits d’oxydation du DEHP/MEHP est environ 4 fois plus élevé que chez l’adulte (Becker et coll., 2009 ). Chez les nouveau-nés, le MECPP est de loin le métabolite urinaire le plus abondant.
). Chez les nouveau-nés, le MECPP est de loin le métabolite urinaire le plus abondant. ; Koch et coll., 2003
; Koch et coll., 2003 ; Suzuki et coll., 2009
; Suzuki et coll., 2009 ) ont estimé les valeurs d’exposition journalières en se basant sur l’analyse quantitative des métabolites urinaires et en appliquant l’équation suivante :
) ont estimé les valeurs d’exposition journalières en se basant sur l’analyse quantitative des métabolites urinaires et en appliquant l’équation suivante : ; Högberg et coll., 2008
; Högberg et coll., 2008 ; Hines et coll., 2009
; Hines et coll., 2009 ). Dans la plupart des cas cependant, les taux sériques sont trop faibles pour permettre une estimation correcte de l’exposition, expliquant la préférence de plusieurs équipes pour les marqueurs urinaires.
). Dans la plupart des cas cependant, les taux sériques sont trop faibles pour permettre une estimation correcte de l’exposition, expliquant la préférence de plusieurs équipes pour les marqueurs urinaires. , b
, b , c
, c ) montrent que cette voie est moins importante que l’excrétion urinaire, même si elle peut atteindre plus de 50 % de la dose administrée par voie intraveineuse pour le BBP. Chez le rat traité par du DEHP par voie orale (500 mg/kg), le taux d’élimination biliaire est d’environ 5 à 10 % et concerne principalement des conjugués à l’acide glucuronique (Daniel et Bratt, 1974
) montrent que cette voie est moins importante que l’excrétion urinaire, même si elle peut atteindre plus de 50 % de la dose administrée par voie intraveineuse pour le BBP. Chez le rat traité par du DEHP par voie orale (500 mg/kg), le taux d’élimination biliaire est d’environ 5 à 10 % et concerne principalement des conjugués à l’acide glucuronique (Daniel et Bratt, 1974 ; Tanaka et coll., 1975
; Tanaka et coll., 1975 ). Plusieurs études font état d’un cycle entérohépatique pour les phtalates, mais la plupart des travaux apportent des preuves indirectes du processus, sans fournir pour autant de véritables données quantitatives.
). Plusieurs études font état d’un cycle entérohépatique pour les phtalates, mais la plupart des travaux apportent des preuves indirectes du processus, sans fournir pour autant de véritables données quantitatives. ; Main et coll., 2006
; Main et coll., 2006 ; Högberg et coll., 2008
; Högberg et coll., 2008 ; Hines et coll., 2009
; Hines et coll., 2009 ; Latini et coll., 2009
; Latini et coll., 2009 ). Parmi les monoesters, les concentrations les plus élevées sont observées pour le MINP avec des valeurs médianes de l’ordre de 100 μg/l chez des femmes scandinaves (Mortensen et coll., 2005
). Parmi les monoesters, les concentrations les plus élevées sont observées pour le MINP avec des valeurs médianes de l’ordre de 100 μg/l chez des femmes scandinaves (Mortensen et coll., 2005 ; Main et coll., 2006
; Main et coll., 2006 ) alors que Latini et coll. (2009
) alors que Latini et coll. (2009 ) rapportent des valeurs médianes inférieures à 20 μg/l chez 62 femmes du sud de l’Italie. Les valeurs observées pour les métabolites oxydés sont souvent inférieures à la limite de détection.
) rapportent des valeurs médianes inférieures à 20 μg/l chez 62 femmes du sud de l’Italie. Les valeurs observées pour les métabolites oxydés sont souvent inférieures à la limite de détection. , 2000
, 2000 ) ont tout d’abord développé des modèles PBPK pour évaluer le rôle de différents processus de transport dans la clairance du MBP et du MEHP chez le rat mâle adulte. Ces modèles, basés sur les concentrations sanguines après administration orale ou intraveineuse des composés parents ou des monoesters, décrivent précisément la cinétique de répartition entre le compartiment sanguin et les différents tissus. Plus récemment, un modèle PBPK a été proposé pour déterminer l’exposition des tissus cibles au DBP et ses métabolites libre et conjugué chez des rates en gestation, prenant en compte l’exposition du fœtus (Clewell et coll., 2008
) ont tout d’abord développé des modèles PBPK pour évaluer le rôle de différents processus de transport dans la clairance du MBP et du MEHP chez le rat mâle adulte. Ces modèles, basés sur les concentrations sanguines après administration orale ou intraveineuse des composés parents ou des monoesters, décrivent précisément la cinétique de répartition entre le compartiment sanguin et les différents tissus. Plus récemment, un modèle PBPK a été proposé pour déterminer l’exposition des tissus cibles au DBP et ses métabolites libre et conjugué chez des rates en gestation, prenant en compte l’exposition du fœtus (Clewell et coll., 2008 ). Ce modèle décrit la clairance urinaire, plasmatique, biliaire et fécale du DBP, du MBP, ainsi que des métabolites oxydés libres et conjugués après des administrations unique (intraveineuse et orale) ou répétée (orale) de DBP à des doses de 50, 100 ou 500 mg/kg pc. Le modèle permet de déterminer l’exposition fœtale au MBP, le métabolite actif, à partir de données telles que la dose externe, les concentrations plasmatiques ou urinaires chez la mère, ou encore les teneurs mesurées dans le liquide amniotique. Ce modèle a également été extrapolé à l’homme en ajustant les paramètres physiologiques et en utilisant des approches allométriques pour estimer les changements d’échelle concernant la distribution des xénobiotiques (Campbell et coll., 2008
). Ce modèle décrit la clairance urinaire, plasmatique, biliaire et fécale du DBP, du MBP, ainsi que des métabolites oxydés libres et conjugués après des administrations unique (intraveineuse et orale) ou répétée (orale) de DBP à des doses de 50, 100 ou 500 mg/kg pc. Le modèle permet de déterminer l’exposition fœtale au MBP, le métabolite actif, à partir de données telles que la dose externe, les concentrations plasmatiques ou urinaires chez la mère, ou encore les teneurs mesurées dans le liquide amniotique. Ce modèle a également été extrapolé à l’homme en ajustant les paramètres physiologiques et en utilisant des approches allométriques pour estimer les changements d’échelle concernant la distribution des xénobiotiques (Campbell et coll., 2008 ). Il permet, à partir des concentrations urinaires en MBP, de prédire l’exposition quotidienne en DBP, ce qui suggère que le métabolisme du DBP à faible dose chez le rat et chez l’homme présente peu de différences.
). Il permet, à partir des concentrations urinaires en MBP, de prédire l’exposition quotidienne en DBP, ce qui suggère que le métabolisme du DBP à faible dose chez le rat et chez l’homme présente peu de différences. déterminait une DJT de 5,8 μg/kg pc/j pour le DEHP.
déterminait une DJT de 5,8 μg/kg pc/j pour le DEHP.