Phtalates
2011
| ANALYSE |
36-
Études chez les animaux femelles
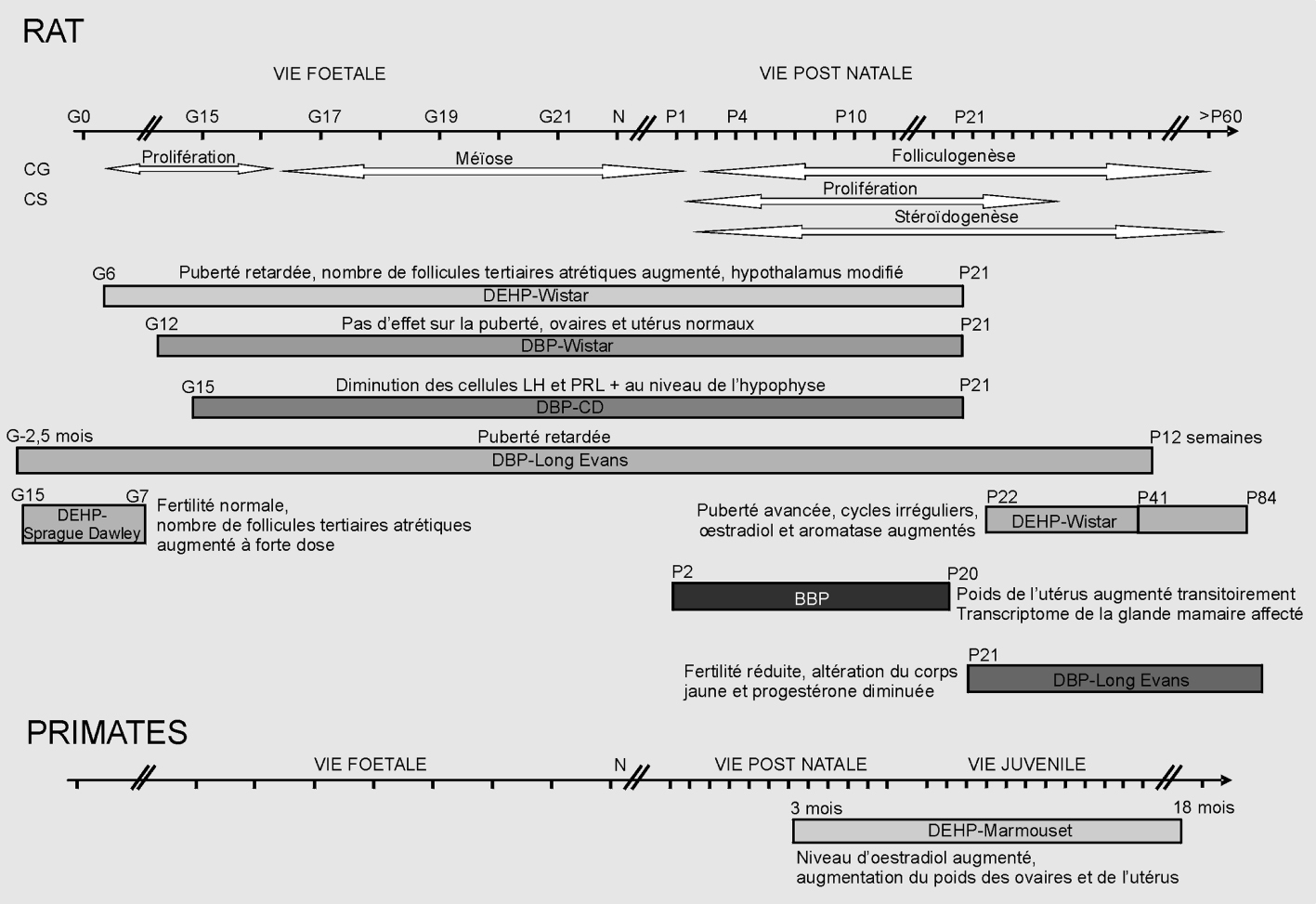
La plupart des études ont été menées chez les rongeurs et seule une publication relate des travaux conduits chez un primate non humain, le singe marmouset. Les études effectuées à des doses faibles sont peu nombreuses.
Étude toxicologique de référence pour la détermination de la DJT
L’étude toxicologique du DBP (di-n-butyl phtalate) chez le rat CD (SD) IGS, menée par Lee et coll. (2004 ), est fondée sur des pesées d’organes après autopsie des mères et des jeunes à différents âges et des analyses immunohistologiques. Elle rapporte peu d’effets sur les descendants femelles, et uniquement à fortes doses. Dans cette étude, des rates CD (SD) IGS sont exposées à des concentrations journalières de DBP (0, 20, 200, 2 000, et 10 000 mg/kg de nourriture) du jour 15 de gestation jusqu’au sevrage au jour 21 postnatal. Les descendants sont analysés au jour 21 puis à 11 et 20 semaines post sevrage. Parmi tous les paramètres analysés, on observe dans les hypophyses des descendantes femelles (21 jours après la naissance), une diminution du pourcentage de cellules FSH et prolactine positives à la dose de 10 000 mg/kg de DBP (Lee et coll., 2004
), est fondée sur des pesées d’organes après autopsie des mères et des jeunes à différents âges et des analyses immunohistologiques. Elle rapporte peu d’effets sur les descendants femelles, et uniquement à fortes doses. Dans cette étude, des rates CD (SD) IGS sont exposées à des concentrations journalières de DBP (0, 20, 200, 2 000, et 10 000 mg/kg de nourriture) du jour 15 de gestation jusqu’au sevrage au jour 21 postnatal. Les descendants sont analysés au jour 21 puis à 11 et 20 semaines post sevrage. Parmi tous les paramètres analysés, on observe dans les hypophyses des descendantes femelles (21 jours après la naissance), une diminution du pourcentage de cellules FSH et prolactine positives à la dose de 10 000 mg/kg de DBP (Lee et coll., 2004 ). Une tendance à un retard de l’âge à la puberté est mentionnée bien que non significative. Il ressort de cette analyse que le seul effet à long terme observé chez les descendantes est une diminution du poids de l’hypophyse lorsque les mères ont été exposées à de fortes doses (10 000 mg/kg de nourriture).
). Une tendance à un retard de l’âge à la puberté est mentionnée bien que non significative. Il ressort de cette analyse que le seul effet à long terme observé chez les descendantes est une diminution du poids de l’hypophyse lorsque les mères ont été exposées à de fortes doses (10 000 mg/kg de nourriture).
 ), est fondée sur des pesées d’organes après autopsie des mères et des jeunes à différents âges et des analyses immunohistologiques. Elle rapporte peu d’effets sur les descendants femelles, et uniquement à fortes doses. Dans cette étude, des rates CD (SD) IGS sont exposées à des concentrations journalières de DBP (0, 20, 200, 2 000, et 10 000 mg/kg de nourriture) du jour 15 de gestation jusqu’au sevrage au jour 21 postnatal. Les descendants sont analysés au jour 21 puis à 11 et 20 semaines post sevrage. Parmi tous les paramètres analysés, on observe dans les hypophyses des descendantes femelles (21 jours après la naissance), une diminution du pourcentage de cellules FSH et prolactine positives à la dose de 10 000 mg/kg de DBP (Lee et coll., 2004
), est fondée sur des pesées d’organes après autopsie des mères et des jeunes à différents âges et des analyses immunohistologiques. Elle rapporte peu d’effets sur les descendants femelles, et uniquement à fortes doses. Dans cette étude, des rates CD (SD) IGS sont exposées à des concentrations journalières de DBP (0, 20, 200, 2 000, et 10 000 mg/kg de nourriture) du jour 15 de gestation jusqu’au sevrage au jour 21 postnatal. Les descendants sont analysés au jour 21 puis à 11 et 20 semaines post sevrage. Parmi tous les paramètres analysés, on observe dans les hypophyses des descendantes femelles (21 jours après la naissance), une diminution du pourcentage de cellules FSH et prolactine positives à la dose de 10 000 mg/kg de DBP (Lee et coll., 2004 ). Une tendance à un retard de l’âge à la puberté est mentionnée bien que non significative. Il ressort de cette analyse que le seul effet à long terme observé chez les descendantes est une diminution du poids de l’hypophyse lorsque les mères ont été exposées à de fortes doses (10 000 mg/kg de nourriture).
). Une tendance à un retard de l’âge à la puberté est mentionnée bien que non significative. Il ressort de cette analyse que le seul effet à long terme observé chez les descendantes est une diminution du poids de l’hypophyse lorsque les mères ont été exposées à de fortes doses (10 000 mg/kg de nourriture).Exposition in utero et pendant la lactation
Afin d’évaluer les effets potentiellement néfastes des phtalates au cours du développement, plusieurs études menées chez les rongeurs ont soumis les mères à des doses faibles (ou fortes) pendant la gestation, ou chez le jeune jusqu’au sevrage, ou les deux.
Une étude a été publiée en 2007 sur l’effet de faibles (0,015 ; 0,045 ; 0,135 ; 0,405 et 1,215 mg/kg de poids corporel/jour) et fortes (5 ; 15 ; 45 ; 135 et 405 mg/kg/jour) doses de DEHP chez les rates Wistar exposées par gavage du jour 6 de gestation au jour 21 postnatal (sevrage). Quelle que soit la dose, aucun effet n’est observable sur le poids des différents organes analysés (foie, rein, rate, thymus, thyroïde, ovaire et utérus). Les descendantes femelles présentaient une cyclicité normale sans altération des profils hormonaux (œstradiol et progestérone). La seule différence avec les témoins concerne le nombre de follicules tertiaires atrétiques présents dans les ovaires des descendantes exposées à la plus forte dose (405 mg/kg/jour). L’utérus et le vagin ne présentaient pas d’altérations histologiques (Grande et coll., 2007 ).
).
 ).
).La même équipe avait également montré en 2006, que l’activité aromatase mesurée sur des coupes de cerveau dans l’aire préoptique de l’hypothalamus de descendants mâles et femelles était modifiée. Cependant, il est à noter que le profil de réponse varie avec la dose, le sexe et l’âge étudié (1 ou 22 jours postnatals). Par exemple au jour 22, l’activité aromatase est plus affectée chez la femelle que chez le mâle alors que c’est l’inverse au jour 1. Ces résultats rappellent que les mâles et les femelles répondent différemment au DEHP, non seulement en fonction de l’âge mais également en fonction des doses (Andrade et coll., 2006 ).
).
 ).
).Enfin, cette équipe a montré l’existence d’un délai de 2 jours dans l’âge à la puberté (mesuré par l’ouverture vaginale) chez les femelles exposées à 15 mg DEHP/kg/j et au-dessus ainsi qu’une tendance au retard pour l’âge du premier œstrus lors d’exposition à 135 et 405 mg DEHP/kg/j (approximativement 2 jours) (Grande et coll., 2006 ).
).
 ).
).Une étude récente a évalué les effets d’une exposition par gavage à 100 mg/kg/j de DBP du jour 12 de gestation au jour 21 postnatal sur des rates Wistar. Elle montre qu’à cette dose il n’y a pas d’effet sur l’âge à la puberté. L’histologie des ovaires et utérus ne montre aucune différence significative entre les animaux traités et les témoins (Guerra et coll., 2010 ).
).
 ).
).Ces résultats sont différents de ceux publiés en 2004 sur des rats Long-Evans exposés au DBP aux doses de 12 et 50 mg/kg/j pendant 2,5 mois avant l’accouplement et pendant toute la gestation et lactation puis jusqu’à l’âge de 12 semaines des descendants. Dans cette étude, il avait été montré un retard de l’ouverture vaginale et de l’apparition du premier œstrus (Salazar et coll., 2004 ). Mais là encore, les lignées de rats, les durées d’administration et les doses diffèrent entre les études ce qui rend leurs résultats difficilement comparables.
). Mais là encore, les lignées de rats, les durées d’administration et les doses diffèrent entre les études ce qui rend leurs résultats difficilement comparables.
 ). Mais là encore, les lignées de rats, les durées d’administration et les doses diffèrent entre les études ce qui rend leurs résultats difficilement comparables.
). Mais là encore, les lignées de rats, les durées d’administration et les doses diffèrent entre les études ce qui rend leurs résultats difficilement comparables.En 2009, une équipe japonaise a utilisé des rats Sprague-Dawley ayant reçu oralement 300, 1 000, et 3 000 mg/kg/j de DEHP, deux semaines avant l’accouplement jusqu’au jour 7 de gestation pour évaluer l’histologie des ovaires et l’effet sur la fertilité et le début du développement. Ils ont montré que seule la forte dose de 3 000 mg/kg/j induisait un retard à concevoir. Les doses inférieures n’entraînent aucun effet sur la fertilité ou le développement embryonnaire. Les ovaires présentent une augmentation du nombre des gros follicules atrétiques à partir des doses de 1 000 mg/kg/j (Takai et coll., 2009 ).
).
 ).
).Enfin, on peut mentionner une étude visant à déterminer les effets du di-2-éthylhexyl-terephtalate (DEHT) chez le rat et la souris et qui ne mentionne aucun effet clinique après autopsie des descendants à l’exception d’une augmentation du poids du foie chez les rates et les souris dont les mères ont été exposées à de fortes doses (Faber et coll., 2007 ).
).
 ).
).En résumé, l’âge à la puberté semble le paramètre physiologique le plus fréquemment perturbé. Cependant, la modification peut être une avancée ou un retard sans que l’on puisse trouver une explication cohérente à cela au vue des protocoles utilisés. Au niveau ovarien, peu d’effets si ce n’est une augmentation du nombre de follicules pré-ovulatoires en atrésie observée pour les doses d’exposition les plus fortes.
Exposition postnatale
Les études concernent le rat, la souris et le marmouset après exposition au DBP, MEHP et BBP.
Chez les rongeurs
Chez le rat femelle Long-Evans, l’exposition par gavage à 250, 500 et 1 000 mg/kg/j de DBP depuis le sevrage (21 jours postnatals) jusqu’à l’âge adulte, induit une réduction de la fertilité de ces animaux (Gray et coll., 2006 ). Le pourcentage de femelles donnant naissance à des petits vivants est réduit de plus de 50 % à 500 mg/kg/j et de 90 % à 1 000 mg/kg/j. Les autres paramètres mesurés comme l’âge de l’ouverture vaginale et du premier œstrus, la cyclicité et l’indice de conception (nombre de femelles saillies/ nombre de femelles accouplées et nombre de femelles gestantes/nombre de femelles saillies) ne sont pas significativement affectés par l’exposition au DBP. Les dosages de progestérone dans le sérum des femelles en gestation ainsi que ceux des hormones produites par les ovaires des femelles au 13e jour de gestation révèlent une altération fonctionnelle du corps jaune et de la synthèse de progestérone. Ceci est en accord avec la présence de corps jaunes hémorragiques sur les ovaires. Il est fait l’hypothèse que l’administration de 500 et 1 000 mg/kg/j à des rats femelles entraîne une production insuffisante de progestérone ovarienne à la mi-gestation pour maintenir une gestation pendant cette phase critique.
). Le pourcentage de femelles donnant naissance à des petits vivants est réduit de plus de 50 % à 500 mg/kg/j et de 90 % à 1 000 mg/kg/j. Les autres paramètres mesurés comme l’âge de l’ouverture vaginale et du premier œstrus, la cyclicité et l’indice de conception (nombre de femelles saillies/ nombre de femelles accouplées et nombre de femelles gestantes/nombre de femelles saillies) ne sont pas significativement affectés par l’exposition au DBP. Les dosages de progestérone dans le sérum des femelles en gestation ainsi que ceux des hormones produites par les ovaires des femelles au 13e jour de gestation révèlent une altération fonctionnelle du corps jaune et de la synthèse de progestérone. Ceci est en accord avec la présence de corps jaunes hémorragiques sur les ovaires. Il est fait l’hypothèse que l’administration de 500 et 1 000 mg/kg/j à des rats femelles entraîne une production insuffisante de progestérone ovarienne à la mi-gestation pour maintenir une gestation pendant cette phase critique.
 ). Le pourcentage de femelles donnant naissance à des petits vivants est réduit de plus de 50 % à 500 mg/kg/j et de 90 % à 1 000 mg/kg/j. Les autres paramètres mesurés comme l’âge de l’ouverture vaginale et du premier œstrus, la cyclicité et l’indice de conception (nombre de femelles saillies/ nombre de femelles accouplées et nombre de femelles gestantes/nombre de femelles saillies) ne sont pas significativement affectés par l’exposition au DBP. Les dosages de progestérone dans le sérum des femelles en gestation ainsi que ceux des hormones produites par les ovaires des femelles au 13e jour de gestation révèlent une altération fonctionnelle du corps jaune et de la synthèse de progestérone. Ceci est en accord avec la présence de corps jaunes hémorragiques sur les ovaires. Il est fait l’hypothèse que l’administration de 500 et 1 000 mg/kg/j à des rats femelles entraîne une production insuffisante de progestérone ovarienne à la mi-gestation pour maintenir une gestation pendant cette phase critique.
). Le pourcentage de femelles donnant naissance à des petits vivants est réduit de plus de 50 % à 500 mg/kg/j et de 90 % à 1 000 mg/kg/j. Les autres paramètres mesurés comme l’âge de l’ouverture vaginale et du premier œstrus, la cyclicité et l’indice de conception (nombre de femelles saillies/ nombre de femelles accouplées et nombre de femelles gestantes/nombre de femelles saillies) ne sont pas significativement affectés par l’exposition au DBP. Les dosages de progestérone dans le sérum des femelles en gestation ainsi que ceux des hormones produites par les ovaires des femelles au 13e jour de gestation révèlent une altération fonctionnelle du corps jaune et de la synthèse de progestérone. Ceci est en accord avec la présence de corps jaunes hémorragiques sur les ovaires. Il est fait l’hypothèse que l’administration de 500 et 1 000 mg/kg/j à des rats femelles entraîne une production insuffisante de progestérone ovarienne à la mi-gestation pour maintenir une gestation pendant cette phase critique.L’effet de l’exposition postnatale au BBP a été analysé chez le rat par administration de 500 mg/kg/j aux mères en lactation du jour 2 à 20 postnatal. L’effet sur les descendants a été étudié à différents stades de développement (21, 35, 50 et 100 jours postnatals). Il a été observé une augmentation du poids de l’utérus au jour 21 qui ne se retrouve pas au-delà de ce stade. Cette étude longitudinale montre également des résultats intéressants concernant l’étude du transcriptome des glandes mammaires. En effet, à 21 jours, juste après l’exposition au BBP via le lait maternel, le nombre de gènes dérégulés dans ce tissu est de 516, puis il est de 39 à 50 jours et enfin de 3 à 100 jours. Cette analyse montre que les altérations ne sont pas forcément permanentes, que les réponses peuvent évoluer avec le temps et qu’il est toujours intéressant d’étudier les effets à court et long terme (Moral et coll., 2007 ).
).
 ).
).Enfin, il convient de citer la seule étude ayant analysé les effets du DEHP administré à des rates Wistar-Imamichi par inhalation (doses de 0, 5 et 25 mg/m3) 6 h/jour, 5 jours/semaine du jour 22 aux jours 41 et 84 postnatal. La fonction de reproduction des femelles a été évaluée en observant la survenue de la puberté (ouverture vaginale) et du premier cycle œstrien, puis la cyclicité a été observée du jour 49 à 84. Dans ces expériences, l’exposition au DEHP avance l’âge de l’ouverture vaginale et du 1er cycle, et les niveaux sériques de cholestérol, hormone lutéinisante (LH), et d’œstradiol sont significativement plus élevés pour les animaux traités avec 25 mg/m3 de DEHP. Des cycles irréguliers sont observés plus fréquemment chez les rates exposées au DEHP, et l’analyse de l’expression de l’aromatase (enzyme qui synthétise l’œstradiol à partir de la testostérone) par RT-PCR a montré que le niveau d’ARNm de cette enzyme, est plus élevé dans le groupe d’animaux soumis à 25 mg/m3 de DEHP. Ces résultats suggèrent que le DEHP inhalé peut perturber la fonction de reproduction des femelles en avançant le début de la puberté et en modifiant les équilibres hormonaux (Ma et coll., 2006 ).
).
 ).
).Il faut signaler que d’autres études ont recherché les effets potentiels sur le développement. L’effet potentiel des phtalates sur le développement embryonnaire a été testé par l’administration de deux molécules, le di-n-hexylphtalate (DnHP) et le dicyclohexyl-phtalate (DCHP) aux doses de 250, 500 et 750 mg/kg/j, à des rates Sprague-Dawley du jour 6 au jour 20 de gestation. Il a été rapporté une importante mortalité embryonnaire à 750 mg/kg/j et une diminution significative du poids des fœtus portés par des mères ayant reçu 500 et 750 mg/kg/j. Le DCHP produit un retard de croissance fœtale à 750 mg/kg/j (Saillenfait et coll., 2009 ). Les mêmes auteurs ont également montré que le poids corporel des fœtus était significativement réduit lorsque les mères étaient traitées avec 200 et 250 mg/kg/j de diallylphtalate (DAP) (Saillenfait et coll., 2008
). Les mêmes auteurs ont également montré que le poids corporel des fœtus était significativement réduit lorsque les mères étaient traitées avec 200 et 250 mg/kg/j de diallylphtalate (DAP) (Saillenfait et coll., 2008 ).
).
 ). Les mêmes auteurs ont également montré que le poids corporel des fœtus était significativement réduit lorsque les mères étaient traitées avec 200 et 250 mg/kg/j de diallylphtalate (DAP) (Saillenfait et coll., 2008
). Les mêmes auteurs ont également montré que le poids corporel des fœtus était significativement réduit lorsque les mères étaient traitées avec 200 et 250 mg/kg/j de diallylphtalate (DAP) (Saillenfait et coll., 2008 ).
).D’après ces différentes études, quelques paramètres phénotypiques sont affectés par le DEHP et le DBP (tableaux 36.I et 36.II
et 36.II ).
).
 et 36.II
et 36.II ).
).Tableau 36.I Paramètres phénotypiques affectés dans les études avec le DEHP
|
Paramètres phénotypiques
|
Espèces/Lignée
|
Doses (mg/kg/j)/Périodes
|
Références
|
|---|---|---|---|
|
Modifications des paramètres morphologiques
Poids ovaires, poids utérus
|
Marmouset
|
500-2 500
3 mois-18 mois
| |
|
Modification des follicules
|
Rate Sprague-Dawley
Rate Wistar
|
400-1 000
Gestation/postnatal
| |
|
Puberté
Ouverture vaginale
|
Rate Wistar
|
Inhalation: 5-25 mg/m3
Gavage : 15
Gestation/postnatal
| |
|
Altérations des taux hormonaux
Œstradiol progestérone,
|
Marmouset
Rate Wistar
|
Orale : 100-2 500
Inhalation : 5-25 mg/m3
Postnatal
|
Tableau 36.II Paramètres phénotypiques affectés dans les études avec le DBP
|
Paramètres phénotypiques
|
Espèces/Lignée
|
Doses (mg/kg)/Périodes
|
Références
|
|---|---|---|---|
|
Puberté
Ouverture vaginale
|
Rate Long-Evans
|
Gavage : 12-50
Gestation/postnatal
| |
|
Altérations des taux hormonaux
Progestérone
|
Rate Long-Evans
|
500-1 000
Postnatal-âge adulte
|
Chez le marmouset
Les femelles marmouset ont été exposées au DEHP juste après le sevrage (3 mois) et jusqu’à la maturité sexuelle (18 mois). Elles ont été traitées journellement par voie orale avec des doses de 100, 500, ou 2 500 mg/kg. Les analyses morphologiques du tractus génital femelle révèlent une augmentation du poids des ovaires et de l’utérus aux doses de 500 et 2 500 mg/kg. De plus, les niveaux d’œstradiol circulant sont élevés chez les femelles de ces deux groupes. En revanche, aucun changement significatif n’est observé en histologie dans les utérus et ovaires, si ce n’est un nombre un peu plus élevé de corps jaunes que dans les témoins (Tomonari et coll., 2006 ).
).
 ).
).
En conclusion, l’analyse de la littérature indique qu’il existe des effets délétères des phtalates sur la fonction de reproduction femelle (figure 36.1 , tableaux 36.I
, tableaux 36.I et 36.II
et 36.II ). Ces effets concernent principalement la puberté dont l’apparition peut être avancée ou retardée selon le composé et le moment d’administration de celui-ci. Rappelons que la gestation est la période où les niveaux de phtalates sont les plus élevés au cours de la vie, comme le montre une étude chez le mouton (Herreros et coll., 2010
). Ces effets concernent principalement la puberté dont l’apparition peut être avancée ou retardée selon le composé et le moment d’administration de celui-ci. Rappelons que la gestation est la période où les niveaux de phtalates sont les plus élevés au cours de la vie, comme le montre une étude chez le mouton (Herreros et coll., 2010 ). La production d’œstradiol est affectée par le DEHP et son principal métabolite le MEHP. Les deux études menées avec le DEHP chez le rat et le marmouset, l’une par inhalation chez le rat, l’autre par voie orale, indiquent dans les deux cas, une augmentation des niveaux d’œstradiol. Cette augmentation pourrait être à l’origine de l’atrésie folliculaire observée dans l’ovaire. Il est à noter que les différents phtalates ne produisent pas les mêmes effets et que ceux-ci peuvent différer d’une espèce à l’autre. Il est également intéressant de noter que les quelques études qui ont effectué des analyses à différents temps après l’exposition ont mis en évidence une certaine réversibilité des effets sur le long terme et il est important à l’avenir de procéder à des études longitudinales, voire multi- et transgénérationnelles.
). La production d’œstradiol est affectée par le DEHP et son principal métabolite le MEHP. Les deux études menées avec le DEHP chez le rat et le marmouset, l’une par inhalation chez le rat, l’autre par voie orale, indiquent dans les deux cas, une augmentation des niveaux d’œstradiol. Cette augmentation pourrait être à l’origine de l’atrésie folliculaire observée dans l’ovaire. Il est à noter que les différents phtalates ne produisent pas les mêmes effets et que ceux-ci peuvent différer d’une espèce à l’autre. Il est également intéressant de noter que les quelques études qui ont effectué des analyses à différents temps après l’exposition ont mis en évidence une certaine réversibilité des effets sur le long terme et il est important à l’avenir de procéder à des études longitudinales, voire multi- et transgénérationnelles.
 , tableaux 36.I
, tableaux 36.I et 36.II
et 36.II ). Ces effets concernent principalement la puberté dont l’apparition peut être avancée ou retardée selon le composé et le moment d’administration de celui-ci. Rappelons que la gestation est la période où les niveaux de phtalates sont les plus élevés au cours de la vie, comme le montre une étude chez le mouton (Herreros et coll., 2010
). Ces effets concernent principalement la puberté dont l’apparition peut être avancée ou retardée selon le composé et le moment d’administration de celui-ci. Rappelons que la gestation est la période où les niveaux de phtalates sont les plus élevés au cours de la vie, comme le montre une étude chez le mouton (Herreros et coll., 2010 ). La production d’œstradiol est affectée par le DEHP et son principal métabolite le MEHP. Les deux études menées avec le DEHP chez le rat et le marmouset, l’une par inhalation chez le rat, l’autre par voie orale, indiquent dans les deux cas, une augmentation des niveaux d’œstradiol. Cette augmentation pourrait être à l’origine de l’atrésie folliculaire observée dans l’ovaire. Il est à noter que les différents phtalates ne produisent pas les mêmes effets et que ceux-ci peuvent différer d’une espèce à l’autre. Il est également intéressant de noter que les quelques études qui ont effectué des analyses à différents temps après l’exposition ont mis en évidence une certaine réversibilité des effets sur le long terme et il est important à l’avenir de procéder à des études longitudinales, voire multi- et transgénérationnelles.
). La production d’œstradiol est affectée par le DEHP et son principal métabolite le MEHP. Les deux études menées avec le DEHP chez le rat et le marmouset, l’une par inhalation chez le rat, l’autre par voie orale, indiquent dans les deux cas, une augmentation des niveaux d’œstradiol. Cette augmentation pourrait être à l’origine de l’atrésie folliculaire observée dans l’ovaire. Il est à noter que les différents phtalates ne produisent pas les mêmes effets et que ceux-ci peuvent différer d’une espèce à l’autre. Il est également intéressant de noter que les quelques études qui ont effectué des analyses à différents temps après l’exposition ont mis en évidence une certaine réversibilité des effets sur le long terme et il est important à l’avenir de procéder à des études longitudinales, voire multi- et transgénérationnelles.Bibliographie
[1] ANDRADE AJ, GRANDE SW, TALSNESS CE, GROTE K, CHAHOUD I. A dose-response study following in utero and lactational exposure to di-(2-ethylhexyl)-phthalate (DEHP): non-monotonic dose-response and low dose effects on rat brain aromatase activity.
Toxicology. 2006;
227:185- 192

[2] FABER WD, DEYO JA, STUMP DG, NAVARRO L, RUBLE K, KNAPP J. Developmental toxicity and uterotrophic studies with di-2-ethylhexyl terephthalate.
Birth Defects Res B Dev Reprod Toxicol. 2007;
80:396- 405

[3] GRANDE SW, ANDRADE AJ, TALSNESS CE, GROTE K, CHAHOUD I. A dose-response study following in utero and lactational exposure to di(2-ethylhexyl)phthalate: effects on female rat reproductive development.
Toxicol Sci. 2006;
91:247- 254

[4] GRANDE SW, ANDRADE AJ, TALSNESS CE, GROTE K, GOLOMBIEWSKI A, et coll. A dose-response study following in utero and lactational exposure to di-(2-ethylhexyl) phthalate (DEHP): reproductive effects on adult female offspring rats.
Toxicology. 2007;
229:14- 22

[5] GRAY LE JR, LASKEY J, OSTBY J. Chronic di-n-butyl phthalate exposure in rats reduces fertility and alters ovarian function during pregnancy in female Long Evans hooded rats.
Toxicol Sci. 2006;
93:189- 95

[6] GUERRA MT, SCARANO WR, DE TOLEDO FC, FRANCI JA, KEMPINAS WDE G. Reproductive development and function of female rats exposed to di-eta-butyl-phthalate (DBP) in utero and during lactation.
Reprod Toxicol. 2010;
29:99- 105

[7] HERREROS MA, GONZALEZ-BULNES A, INIGO-NUNEZ S, LETELIER C, CONTRERAS-SOLIS I, et coll. Pregnancy-associated changes in plasma concentration of the endocrine disruptor di(2-ethylhexyl) phthalate in a sheep model.
Theriogenology. 2010;
73:141- 146

[8] LEE KY, SHIBUTANI M, TAKAGI H, KATO N, TAKIGAMI S, et coll. Diverse developmental toxicity of di-n-butyl phthalate in both sexes of rat offspring after maternal exposure during the period from late gestation through lactation.
Toxicology. 2004;
203:221- 238

[9] MA M, KONDO T, BAN S, UMEMURA T, KURAHASHI N, et coll. Exposure of prepubertal female rats to inhaled di(2-ethylhexyl)phthalate affects the onset of puberty and postpubertal reproductive functions.
Toxicol Sci. 2006;
93:164- 171

[10] MORAL R, WANG R, RUSSO IH, MAILO DA, LAMARTINIERE CA, RUSSO J. The plasticizer butyl benzyl phthalate induces genomic changes in rat mammary gland after neonatal/prepubertal exposure.
BMC Genomics. 2007;
8:- 453

[11] SAILLENFAIT AM, GALLISSOT F, SABATÉ JP. Evaluation of the developmental toxicity of diallyl phthalate administered orally to rats.
Food Chem Toxicol. 2008;
46:2150- 2156

[12] SAILLENFAIT AM, GALLISSOT F, SABATE JP. Differential developmental toxicities of di-n-hexyl phthalate and dicyclohexyl phthalate administered orally to rats.
J Appl Toxicol. 2009;
29:510- 521

[13] SALAZAR V, CASTILLO C, ARIZNAVARRETA C, CAMPÓN R, TRESGUERRES JA. Effect of oral intake of dibutyl phthalate on reproductive parameters of Long Evans rats and pre-pubertal development of their offspring.
Toxicology. 2004;
205:131- 137

[14] TAKAI R, HAYASHI S, KIYOKAWA J, IWATA Y, MATSUO S, et coll. Collaborative work on evaluation of ovarian toxicity. 10) Two- or four-week repeated dose studies and fertility study of di-(2-ethylhexyl) phthalate (DEHP) in female rats.
J Toxicol Sci. 2009;
34 (suppl 1):SP111- 119

[15] TOMONARI Y, KURATA Y, DAVID RM, GANS G, KAWASUSO T, KATOH M. Effect of di(2-ethylhexyl) phthalate (DEHP) on genital organs from juvenile common marmosets: I. Morphological and biochemical investigation in 65-week toxicity study.
J Toxicol Environ Health A. 2006;
69:1651- 1672

→ Aller vers SYNTHESE