Retardateurs de flamme polybromés (RFB)
2011
| ANALYSE |
48-
Mécanismes d’action
Les cibles des retardateurs de flamme bromés (RFB) au niveau des récepteurs nucléaires ne sont pas encore complètement identifiées. Les études in vitro les plus pertinentes ont été réalisées dans le cadre du programme européen FIRE1
et essentiellement publiées par l’équipe de T. Hamers (Hamers et coll., 2006 ).
).
 ).
).Récepteurs nucléaires
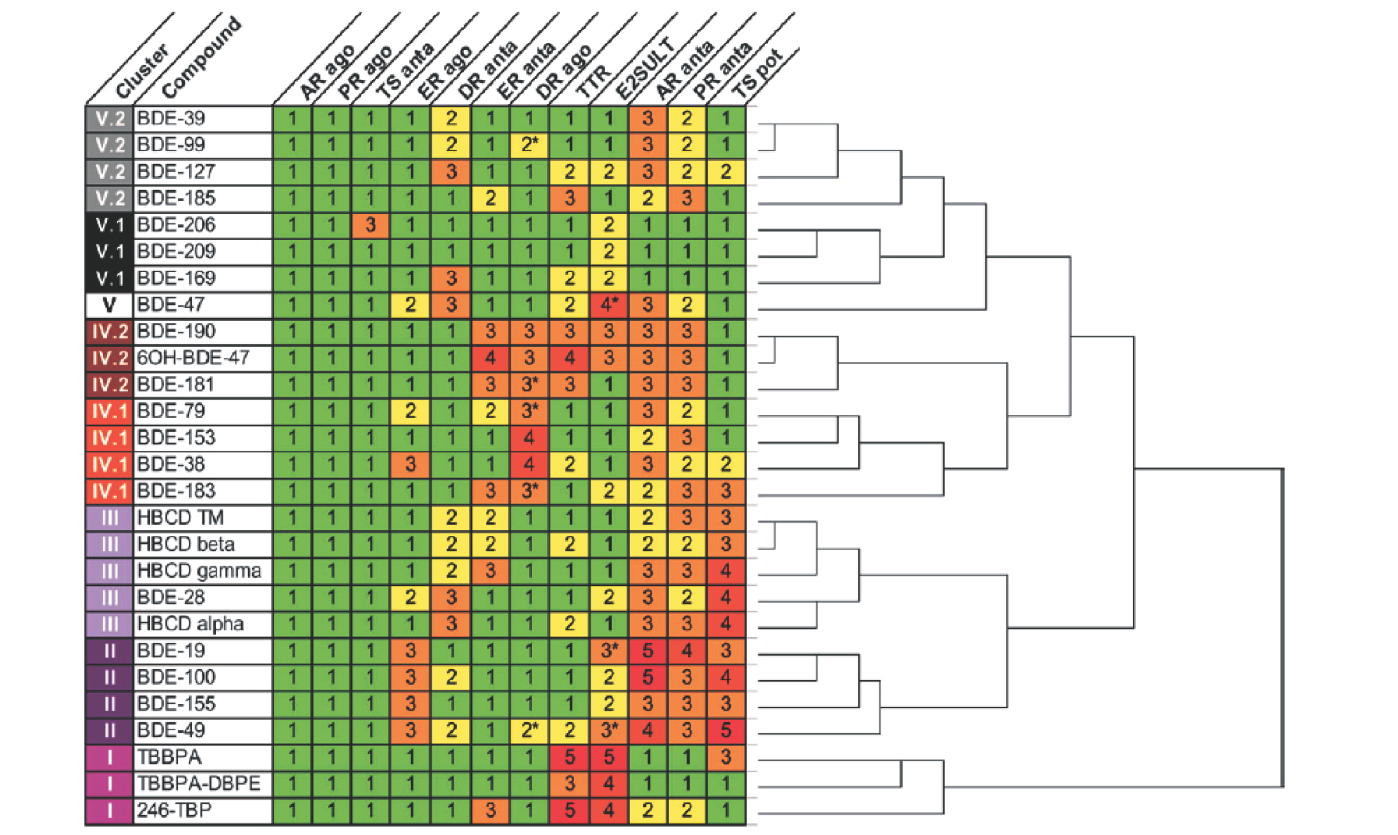
Hamers et coll. (2006 ) ont étudié 27 RFB pour leurs effets sur les récepteurs des œstrogènes alpha (ERα), des androgènes (AR), de la progestérone (PR), des hormones thyroïdiennes alpha (TRα) et de la dioxine (AhR) ainsi que sur l’enzyme en charge de la sulfatation de l’œstradiol (œstradiol sulfo-transférase : E2SULT) et la protéine de transport de l’hormone thyroïdienne (transthyrétrine). Parmi les différentes molécules étudiées, le BDE 19 s’est avéré être une molécule à activité œstrogénique agoniste et le 6-hydroxyl BDE 47 un anti-œstrogène. Cette étude a également montré que le BDE 19 et le BDE 100 avaient une activité anti-androgénique (Hamers et coll., 2006
) ont étudié 27 RFB pour leurs effets sur les récepteurs des œstrogènes alpha (ERα), des androgènes (AR), de la progestérone (PR), des hormones thyroïdiennes alpha (TRα) et de la dioxine (AhR) ainsi que sur l’enzyme en charge de la sulfatation de l’œstradiol (œstradiol sulfo-transférase : E2SULT) et la protéine de transport de l’hormone thyroïdienne (transthyrétrine). Parmi les différentes molécules étudiées, le BDE 19 s’est avéré être une molécule à activité œstrogénique agoniste et le 6-hydroxyl BDE 47 un anti-œstrogène. Cette étude a également montré que le BDE 19 et le BDE 100 avaient une activité anti-androgénique (Hamers et coll., 2006 ; Harju et coll., 2007
; Harju et coll., 2007 ).
).
 ) ont étudié 27 RFB pour leurs effets sur les récepteurs des œstrogènes alpha (ERα), des androgènes (AR), de la progestérone (PR), des hormones thyroïdiennes alpha (TRα) et de la dioxine (AhR) ainsi que sur l’enzyme en charge de la sulfatation de l’œstradiol (œstradiol sulfo-transférase : E2SULT) et la protéine de transport de l’hormone thyroïdienne (transthyrétrine). Parmi les différentes molécules étudiées, le BDE 19 s’est avéré être une molécule à activité œstrogénique agoniste et le 6-hydroxyl BDE 47 un anti-œstrogène. Cette étude a également montré que le BDE 19 et le BDE 100 avaient une activité anti-androgénique (Hamers et coll., 2006
) ont étudié 27 RFB pour leurs effets sur les récepteurs des œstrogènes alpha (ERα), des androgènes (AR), de la progestérone (PR), des hormones thyroïdiennes alpha (TRα) et de la dioxine (AhR) ainsi que sur l’enzyme en charge de la sulfatation de l’œstradiol (œstradiol sulfo-transférase : E2SULT) et la protéine de transport de l’hormone thyroïdienne (transthyrétrine). Parmi les différentes molécules étudiées, le BDE 19 s’est avéré être une molécule à activité œstrogénique agoniste et le 6-hydroxyl BDE 47 un anti-œstrogène. Cette étude a également montré que le BDE 19 et le BDE 100 avaient une activité anti-androgénique (Hamers et coll., 2006 ; Harju et coll., 2007
; Harju et coll., 2007 ).
).D’autres RFB comme le BDE 28, BDE 47, BDE 100 et surtout le 4OH-BDE 17 sont œstrogéniques (Kojima et coll., 2009 ) de même que le 4OH-BDE 49 et le BDE 17 (Mercado-Feliciano et coll., 2008
) de même que le 4OH-BDE 49 et le BDE 17 (Mercado-Feliciano et coll., 2008 ). Ces résultats ont été confirmés pour le BDE 100 (Stoker et coll., 2005
). Ces résultats ont été confirmés pour le BDE 100 (Stoker et coll., 2005 ; Kojima et coll., 2009
; Kojima et coll., 2009 ). Le 4OH-BDE 17 (Kojima et coll., 2009
). Le 4OH-BDE 17 (Kojima et coll., 2009 ) et le BDE 47 (Stoker et coll., 2005
) et le BDE 47 (Stoker et coll., 2005 ) ont également une activité anti-androgénique.
) ont également une activité anti-androgénique.
 ) de même que le 4OH-BDE 49 et le BDE 17 (Mercado-Feliciano et coll., 2008
) de même que le 4OH-BDE 49 et le BDE 17 (Mercado-Feliciano et coll., 2008 ). Ces résultats ont été confirmés pour le BDE 100 (Stoker et coll., 2005
). Ces résultats ont été confirmés pour le BDE 100 (Stoker et coll., 2005 ; Kojima et coll., 2009
; Kojima et coll., 2009 ). Le 4OH-BDE 17 (Kojima et coll., 2009
). Le 4OH-BDE 17 (Kojima et coll., 2009 ) et le BDE 47 (Stoker et coll., 2005
) et le BDE 47 (Stoker et coll., 2005 ) ont également une activité anti-androgénique.
) ont également une activité anti-androgénique.Parmi les différents RFB testés, seul le 1,2-dibromoéthyl cyclohexane (BCH) s’est avéré être un androgène à activité agoniste (Larsson et coll., 2006 ; Khalaf et coll., 2009
; Khalaf et coll., 2009 ).
).
 ; Khalaf et coll., 2009
; Khalaf et coll., 2009 ).
).D’après les travaux de Hamers et coll. (2006 ), le BDE 38 et le BDE 153 ont des effets agonistes pour le récepteur AhR alors que le BDE 47 et l’octa-BDE sont antagonistes.
), le BDE 38 et le BDE 153 ont des effets agonistes pour le récepteur AhR alors que le BDE 47 et l’octa-BDE sont antagonistes.
 ), le BDE 38 et le BDE 153 ont des effets agonistes pour le récepteur AhR alors que le BDE 47 et l’octa-BDE sont antagonistes.
), le BDE 38 et le BDE 153 ont des effets agonistes pour le récepteur AhR alors que le BDE 47 et l’octa-BDE sont antagonistes.Selon des études récentes, le BDE 47, 99, 209, le penta-BDE et le HBCD sont des ligands activateurs du récepteur PXR (Pacyniak et coll., 2007 ; Fery et coll., 2009
; Fery et coll., 2009 ). D’autre part, le TBBPA et le TCBPA sont des ligands agonistes de PPARγ (Patrick Balaguer, communication personnelle).
). D’autre part, le TBBPA et le TCBPA sont des ligands agonistes de PPARγ (Patrick Balaguer, communication personnelle).
 ; Fery et coll., 2009
; Fery et coll., 2009 ). D’autre part, le TBBPA et le TCBPA sont des ligands agonistes de PPARγ (Patrick Balaguer, communication personnelle).
). D’autre part, le TBBPA et le TCBPA sont des ligands agonistes de PPARγ (Patrick Balaguer, communication personnelle).Enfin, plusieurs effets ont été observés sur la modulation de l’activité de TRα. Le TBBPA et le TCBPA sont des antagonistes de TRα (Sun et coll., 2009 ; Patrick Balaguer, communication personnelle), le TBBPA et le 2,4,6-TBP sont capables de se lier à TR.
De même, l’activité E2-sulfotransférase est inhibée par le TBBPA, le PCP, le 6OH-BDE 47 et dans une moindre mesure par le BDE 47 (Hamers et coll., 2006 ).
).
 ).
).Tableau 48.I Activité des principaux PBDE, TBBPA, HBCD
|
Récepteur nucléaire
|
Activité
|
Polybromés
|
|---|---|---|
|
ER
|
Agoniste
|
BDE 17, 4OH-BDE 17, BDE 19, BDE 28, BDE 47, 4OH-BDE 49, BDE 100, BDE 38
BDE 49, BDE 79, BDE 155
|
|
ER
|
Antagoniste
|
6OH-BDE 47, BDE 181, BDE 183, BDE 185, BDE 190
|
|
AR
|
Agoniste
|
BCH
|
|
AR
|
Antagoniste
|
BDE 19, BDE 100, 4OH-BDE 17
BDE 47, BDE 17, BDE 66, BDE 85
BDE 154
|
|
AhR
|
Agoniste
|
BDE 38, BDE 153
|
|
AhR
|
Antagoniste
|
BDE 47, Octa-BDE
|
|
PXR
|
Agoniste
|
BDE 47, BDE 99, BDE 209, Penta-BDE
HBCD
|
|
PPARg
|
Agoniste
|
TBBPA, TCBPA
|
|
TR
|
Antagoniste
|
TBBPA, TCBPA
|
Finalement, des effets des RFB sur la stéroïdogenèse et plus particulièrement sur l’activité aromatase ont également été décrits. Ainsi, Canton et coll. (2008 ) ont montré que plusieurs RFB inhibaient l’activité de cette enzyme à des concentrations comprises entre 1 et 10 mM. Ces effets ont été confirmés par les travaux de He et coll. (2008
) ont montré que plusieurs RFB inhibaient l’activité de cette enzyme à des concentrations comprises entre 1 et 10 mM. Ces effets ont été confirmés par les travaux de He et coll. (2008 ) dans la lignée cellulaire H295R.
) dans la lignée cellulaire H295R.
 ) ont montré que plusieurs RFB inhibaient l’activité de cette enzyme à des concentrations comprises entre 1 et 10 mM. Ces effets ont été confirmés par les travaux de He et coll. (2008
) ont montré que plusieurs RFB inhibaient l’activité de cette enzyme à des concentrations comprises entre 1 et 10 mM. Ces effets ont été confirmés par les travaux de He et coll. (2008 ) dans la lignée cellulaire H295R.
) dans la lignée cellulaire H295R.Effets sur la voie de signalisation AhR ?
Parce qu’il existe une parenté chimique entre des retardateurs de flammes et des ligands du récepteur de la dioxine, AhR, plusieurs études ont suggéré en effet que AhR pourrait être une cible de ces molécules. Ainsi, certains auteurs ont observé après exposition à différents PBDE une altération des niveaux d’expression de CYP1A1, une enzyme hépatique qui est régulée par AhR dans le foie. C’est le cas de Raldua et coll. (2008 ) sur des barbeaux du bassin de l’Ebre exposés dans leur milieu de vie à des mélanges de PBDE pour lesquels ces auteurs notent une diminution de l’expression de CYP1A1 et des altérations histologiques dans le foie. De même, Ronisz et coll. (2004
) sur des barbeaux du bassin de l’Ebre exposés dans leur milieu de vie à des mélanges de PBDE pour lesquels ces auteurs notent une diminution de l’expression de CYP1A1 et des altérations histologiques dans le foie. De même, Ronisz et coll. (2004 ) montrent une diminution de CYP1A1 après traitement de truites arc en ciel juvéniles avec du TBBPA (effet à partir de 10 mg/kg en intrapéritonéal) et du HBCD à forte dose (500 mg/kg). Une augmentation concomitante de la taille du foie a été observée. Des anomalies dans l’expression d’enzymes ou de molécules liées au stress oxydatif (SOD, HSP70) dans le foie ont également été observées avec le TBBPA mais pas avec le HBCD sur des zebrafish traités à 0,75 mg/l dans l’eau (Hu et coll., 2009
) montrent une diminution de CYP1A1 après traitement de truites arc en ciel juvéniles avec du TBBPA (effet à partir de 10 mg/kg en intrapéritonéal) et du HBCD à forte dose (500 mg/kg). Une augmentation concomitante de la taille du foie a été observée. Des anomalies dans l’expression d’enzymes ou de molécules liées au stress oxydatif (SOD, HSP70) dans le foie ont également été observées avec le TBBPA mais pas avec le HBCD sur des zebrafish traités à 0,75 mg/l dans l’eau (Hu et coll., 2009 ). Il a été montré en outre que des mélanges de retardateurs de flamme (Firemaster 550 et BZ-54) pouvaient induire des dommages sur l’ADN extrait du foie de vairons traités oralement par ces composés (Bearr et coll., 2010
). Il a été montré en outre que des mélanges de retardateurs de flamme (Firemaster 550 et BZ-54) pouvaient induire des dommages sur l’ADN extrait du foie de vairons traités oralement par ces composés (Bearr et coll., 2010 ). En revanche, Chen et coll. (2010
). En revanche, Chen et coll. (2010 ) observent une augmentation légère de l’activité CYP1A1 après traitement de zebrafish juvéniles au BDE 47 (de 20 à 60 jours post-éclosion ; 68,8 ng/g dans les poissons traités).
) observent une augmentation légère de l’activité CYP1A1 après traitement de zebrafish juvéniles au BDE 47 (de 20 à 60 jours post-éclosion ; 68,8 ng/g dans les poissons traités).
 ) sur des barbeaux du bassin de l’Ebre exposés dans leur milieu de vie à des mélanges de PBDE pour lesquels ces auteurs notent une diminution de l’expression de CYP1A1 et des altérations histologiques dans le foie. De même, Ronisz et coll. (2004
) sur des barbeaux du bassin de l’Ebre exposés dans leur milieu de vie à des mélanges de PBDE pour lesquels ces auteurs notent une diminution de l’expression de CYP1A1 et des altérations histologiques dans le foie. De même, Ronisz et coll. (2004 ) montrent une diminution de CYP1A1 après traitement de truites arc en ciel juvéniles avec du TBBPA (effet à partir de 10 mg/kg en intrapéritonéal) et du HBCD à forte dose (500 mg/kg). Une augmentation concomitante de la taille du foie a été observée. Des anomalies dans l’expression d’enzymes ou de molécules liées au stress oxydatif (SOD, HSP70) dans le foie ont également été observées avec le TBBPA mais pas avec le HBCD sur des zebrafish traités à 0,75 mg/l dans l’eau (Hu et coll., 2009
) montrent une diminution de CYP1A1 après traitement de truites arc en ciel juvéniles avec du TBBPA (effet à partir de 10 mg/kg en intrapéritonéal) et du HBCD à forte dose (500 mg/kg). Une augmentation concomitante de la taille du foie a été observée. Des anomalies dans l’expression d’enzymes ou de molécules liées au stress oxydatif (SOD, HSP70) dans le foie ont également été observées avec le TBBPA mais pas avec le HBCD sur des zebrafish traités à 0,75 mg/l dans l’eau (Hu et coll., 2009 ). Il a été montré en outre que des mélanges de retardateurs de flamme (Firemaster 550 et BZ-54) pouvaient induire des dommages sur l’ADN extrait du foie de vairons traités oralement par ces composés (Bearr et coll., 2010
). Il a été montré en outre que des mélanges de retardateurs de flamme (Firemaster 550 et BZ-54) pouvaient induire des dommages sur l’ADN extrait du foie de vairons traités oralement par ces composés (Bearr et coll., 2010 ). En revanche, Chen et coll. (2010
). En revanche, Chen et coll. (2010 ) observent une augmentation légère de l’activité CYP1A1 après traitement de zebrafish juvéniles au BDE 47 (de 20 à 60 jours post-éclosion ; 68,8 ng/g dans les poissons traités).
) observent une augmentation légère de l’activité CYP1A1 après traitement de zebrafish juvéniles au BDE 47 (de 20 à 60 jours post-éclosion ; 68,8 ng/g dans les poissons traités).Des résultats similaires sont retrouvés dans une autre étude où le BDE 47 à 10 μM induit une induction de l’expression de CYP1A1 chez le zebrafish et une activation de AhR dans un test de transactivation dans des cellules de mammifères (Wahl et coll., 2008 ). Les mêmes auteurs attribuent cependant ces effets non pas au PBDE 47 mais à du TBDF (2,3,7,8-tétrabromo-dibenzodioxin) contaminant la préparation de BDE 47. La même conclusion a été obtenue par Kuiper et coll. (2006
). Les mêmes auteurs attribuent cependant ces effets non pas au PBDE 47 mais à du TBDF (2,3,7,8-tétrabromo-dibenzodioxin) contaminant la préparation de BDE 47. La même conclusion a été obtenue par Kuiper et coll. (2006 ) sur du DE-71 qui induit l’expression de CYP1A1 et une activation transcriptionelle de AhR : là encore, l’effet a été relié à une impureté contaminant la préparation industrielle de DE-71. Il faut donc se méfier des conclusions hâtives obtenues avec des préparations de faible grade de pureté.
) sur du DE-71 qui induit l’expression de CYP1A1 et une activation transcriptionelle de AhR : là encore, l’effet a été relié à une impureté contaminant la préparation industrielle de DE-71. Il faut donc se méfier des conclusions hâtives obtenues avec des préparations de faible grade de pureté.
 ). Les mêmes auteurs attribuent cependant ces effets non pas au PBDE 47 mais à du TBDF (2,3,7,8-tétrabromo-dibenzodioxin) contaminant la préparation de BDE 47. La même conclusion a été obtenue par Kuiper et coll. (2006
). Les mêmes auteurs attribuent cependant ces effets non pas au PBDE 47 mais à du TBDF (2,3,7,8-tétrabromo-dibenzodioxin) contaminant la préparation de BDE 47. La même conclusion a été obtenue par Kuiper et coll. (2006 ) sur du DE-71 qui induit l’expression de CYP1A1 et une activation transcriptionelle de AhR : là encore, l’effet a été relié à une impureté contaminant la préparation industrielle de DE-71. Il faut donc se méfier des conclusions hâtives obtenues avec des préparations de faible grade de pureté.
) sur du DE-71 qui induit l’expression de CYP1A1 et une activation transcriptionelle de AhR : là encore, l’effet a été relié à une impureté contaminant la préparation industrielle de DE-71. Il faut donc se méfier des conclusions hâtives obtenues avec des préparations de faible grade de pureté.Ces doutes sur un effet direct des PBDE sur la voie AhR ont été renforcés par une étude où les effets activateurs sur le récepteur AhR ont été couplés à une analyse transcriptomique (Wahl et coll., 2010). Ce travail montre en effet clairement que le BDE 47, 99, 153 ou 209 n’activent pas mais inhibent plutôt la voie de signalisation AhR. Des études de microarrays menées sur des cellules de rat suggèrent en outre que la signature transcriptionnelle induite par les PBDE dans le foie est bien distincte de celle de ligands classiques de AhR. L’ensemble de ces résultats suggère donc que la voie AhR n’est pas, contrairement à ce que l’on pensait au départ, une cible pertinente pour les retardateurs de flammes.
Modèles QSAR
La disponibilité de données fiables concernant l’affinité des PBDE avec le récepteur aryle hydrocarboné (AhR) (Chen et coll., 2001 ) a favorisé le développement de modèles QSAR fiables (Zheng et coll., 2005
) a favorisé le développement de modèles QSAR fiables (Zheng et coll., 2005 ; Wang et coll., 2005
; Wang et coll., 2005 et 2006
et 2006 ; Xu et coll., 2007
; Xu et coll., 2007 ; Wu et coll., 2009
; Wu et coll., 2009 ; Gu et coll., 2010
; Gu et coll., 2010 ). Néanmoins, on retrouve en littérature quelques études spécifiques aux relations structure/propriétés reliées à l’activité de perturbateur endocrinien des PBDE (Meerts et coll., 2001
). Néanmoins, on retrouve en littérature quelques études spécifiques aux relations structure/propriétés reliées à l’activité de perturbateur endocrinien des PBDE (Meerts et coll., 2001 ; Liu et coll., 2007
; Liu et coll., 2007 ; Kojima et coll., 2009
; Kojima et coll., 2009 ; Yang et coll., 2009
; Yang et coll., 2009 ). Le « endpoint » communément utilisé est l’activité envers le récepteur des androgènes (AR) ou des œstrogènes (ER). Cette activité est évaluée en termes de dose-réponse avec le test AR- et ER-CALUX (Hamers et coll., 2006
). Le « endpoint » communément utilisé est l’activité envers le récepteur des androgènes (AR) ou des œstrogènes (ER). Cette activité est évaluée en termes de dose-réponse avec le test AR- et ER-CALUX (Hamers et coll., 2006 ), qui fait appel à une lignée de cellules humaines présentant des récepteurs des androgènes ou des œstrogènes modifiés à l’aide d’un gène rapporteur luminescent. L’intensité de l’émission de lumière est proportionnelle à la quantité de substance liée au récepteur et permet de définir le logarithme de la moitié de la concentration maximale inhibitrice (logCI50). Ce logarithme est l’endpoint final normalement considéré dans les études QSAR.
), qui fait appel à une lignée de cellules humaines présentant des récepteurs des androgènes ou des œstrogènes modifiés à l’aide d’un gène rapporteur luminescent. L’intensité de l’émission de lumière est proportionnelle à la quantité de substance liée au récepteur et permet de définir le logarithme de la moitié de la concentration maximale inhibitrice (logCI50). Ce logarithme est l’endpoint final normalement considéré dans les études QSAR.
 ) a favorisé le développement de modèles QSAR fiables (Zheng et coll., 2005
) a favorisé le développement de modèles QSAR fiables (Zheng et coll., 2005 ; Wang et coll., 2005
; Wang et coll., 2005 et 2006
et 2006 ; Xu et coll., 2007
; Xu et coll., 2007 ; Wu et coll., 2009
; Wu et coll., 2009 ; Gu et coll., 2010
; Gu et coll., 2010 ). Néanmoins, on retrouve en littérature quelques études spécifiques aux relations structure/propriétés reliées à l’activité de perturbateur endocrinien des PBDE (Meerts et coll., 2001
). Néanmoins, on retrouve en littérature quelques études spécifiques aux relations structure/propriétés reliées à l’activité de perturbateur endocrinien des PBDE (Meerts et coll., 2001 ; Liu et coll., 2007
; Liu et coll., 2007 ; Kojima et coll., 2009
; Kojima et coll., 2009 ; Yang et coll., 2009
; Yang et coll., 2009 ). Le « endpoint » communément utilisé est l’activité envers le récepteur des androgènes (AR) ou des œstrogènes (ER). Cette activité est évaluée en termes de dose-réponse avec le test AR- et ER-CALUX (Hamers et coll., 2006
). Le « endpoint » communément utilisé est l’activité envers le récepteur des androgènes (AR) ou des œstrogènes (ER). Cette activité est évaluée en termes de dose-réponse avec le test AR- et ER-CALUX (Hamers et coll., 2006 ), qui fait appel à une lignée de cellules humaines présentant des récepteurs des androgènes ou des œstrogènes modifiés à l’aide d’un gène rapporteur luminescent. L’intensité de l’émission de lumière est proportionnelle à la quantité de substance liée au récepteur et permet de définir le logarithme de la moitié de la concentration maximale inhibitrice (logCI50). Ce logarithme est l’endpoint final normalement considéré dans les études QSAR.
), qui fait appel à une lignée de cellules humaines présentant des récepteurs des androgènes ou des œstrogènes modifiés à l’aide d’un gène rapporteur luminescent. L’intensité de l’émission de lumière est proportionnelle à la quantité de substance liée au récepteur et permet de définir le logarithme de la moitié de la concentration maximale inhibitrice (logCI50). Ce logarithme est l’endpoint final normalement considéré dans les études QSAR.Grâce à ces tests, une réponse ER-agoniste a été mise en évidence pour plusieurs BDE ainsi que pour un mélange de octa-BDE (tableau 48.I et Hamers et coll., 2006
et Hamers et coll., 2006 ). Ces résultats suggèrent d’une part, que l’activité œstrogénique est associée à une faible bromation des PBDE et, d’autre part, que l’activité anti-œstrogénique est déterminée par un degré élevé de bromation (Meerts et coll., 2001
). Ces résultats suggèrent d’une part, que l’activité œstrogénique est associée à une faible bromation des PBDE et, d’autre part, que l’activité anti-œstrogénique est déterminée par un degré élevé de bromation (Meerts et coll., 2001 ). En termes de structure, les molécules substituées aux positions [2,2’,6] ou [2,2’,4] (figure 48.1
). En termes de structure, les molécules substituées aux positions [2,2’,6] ou [2,2’,4] (figure 48.1 ) ont une activité ER-agoniste. Le BDE 30, substitué en positions 3, 4 et 5, représente une exception. Les mêmes caractéristiques sont observées pour les AR-antagonistes.
) ont une activité ER-agoniste. Le BDE 30, substitué en positions 3, 4 et 5, représente une exception. Les mêmes caractéristiques sont observées pour les AR-antagonistes.
 et Hamers et coll., 2006
et Hamers et coll., 2006 ). Ces résultats suggèrent d’une part, que l’activité œstrogénique est associée à une faible bromation des PBDE et, d’autre part, que l’activité anti-œstrogénique est déterminée par un degré élevé de bromation (Meerts et coll., 2001
). Ces résultats suggèrent d’une part, que l’activité œstrogénique est associée à une faible bromation des PBDE et, d’autre part, que l’activité anti-œstrogénique est déterminée par un degré élevé de bromation (Meerts et coll., 2001 ). En termes de structure, les molécules substituées aux positions [2,2’,6] ou [2,2’,4] (figure 48.1
). En termes de structure, les molécules substituées aux positions [2,2’,6] ou [2,2’,4] (figure 48.1 ) ont une activité ER-agoniste. Le BDE 30, substitué en positions 3, 4 et 5, représente une exception. Les mêmes caractéristiques sont observées pour les AR-antagonistes.
) ont une activité ER-agoniste. Le BDE 30, substitué en positions 3, 4 et 5, représente une exception. Les mêmes caractéristiques sont observées pour les AR-antagonistes.Un modèle QSAR a ensuite été déterminé pour l’AR-antagonisme, en utilisant ces résultats AR-CALUX comme endpoints. Ce modèle a une bonne corrélation avec l’expérience (r2=0,90) (Harju et coll., 2007 ) et prévoit une activité AR-antagoniste pour les BDE 17, BDE 66, BDE 85, et BDE 154, des penta-BDE non testés dans l’étude précédente.
) et prévoit une activité AR-antagoniste pour les BDE 17, BDE 66, BDE 85, et BDE 154, des penta-BDE non testés dans l’étude précédente.
 ) et prévoit une activité AR-antagoniste pour les BDE 17, BDE 66, BDE 85, et BDE 154, des penta-BDE non testés dans l’étude précédente.
) et prévoit une activité AR-antagoniste pour les BDE 17, BDE 66, BDE 85, et BDE 154, des penta-BDE non testés dans l’étude précédente.Plus généralement, ce modèle QSAR lie l’activité AR-antagoniste à un bas degré de bromation et aux substitutions en ortho- (positions 2, 2’, 6 et 6’) ou ortho- et para- (positions 4 et 4’). À noter que les PBDE ne peuvent pas former des liaisons hydrogène comme d’autres perturbateurs endocriniens (le BPA, par exemple) (Harju et coll., 2007 ).
).
 ).
).Un travail plus récent sur 8 PBDE et 8 dérivés hydroxylés a confirmé ces résultats (Kojima et coll., 2009 ). De plus, il a été suggéré qu’un groupe hydroxylique en position para- (positions 4 et 4’) augmente l’activité œstrogénique, qui peut également être modulée (réduite) par des atomes de brome dans les positions proches de la position para- (3, 3’, 5 et 5’). Ce dernier effet a également été remarqué pour le BPA (Liu et coll., 2007
). De plus, il a été suggéré qu’un groupe hydroxylique en position para- (positions 4 et 4’) augmente l’activité œstrogénique, qui peut également être modulée (réduite) par des atomes de brome dans les positions proches de la position para- (3, 3’, 5 et 5’). Ce dernier effet a également été remarqué pour le BPA (Liu et coll., 2007 ).
).
 ). De plus, il a été suggéré qu’un groupe hydroxylique en position para- (positions 4 et 4’) augmente l’activité œstrogénique, qui peut également être modulée (réduite) par des atomes de brome dans les positions proches de la position para- (3, 3’, 5 et 5’). Ce dernier effet a également été remarqué pour le BPA (Liu et coll., 2007
). De plus, il a été suggéré qu’un groupe hydroxylique en position para- (positions 4 et 4’) augmente l’activité œstrogénique, qui peut également être modulée (réduite) par des atomes de brome dans les positions proches de la position para- (3, 3’, 5 et 5’). Ce dernier effet a également été remarqué pour le BPA (Liu et coll., 2007 ).
). | Figure 48.1 Classification hiérarchique des profils de toxicité de 27 retardateurs de flamme bromés (d’après Hamers et coll., 2006 ) ) |
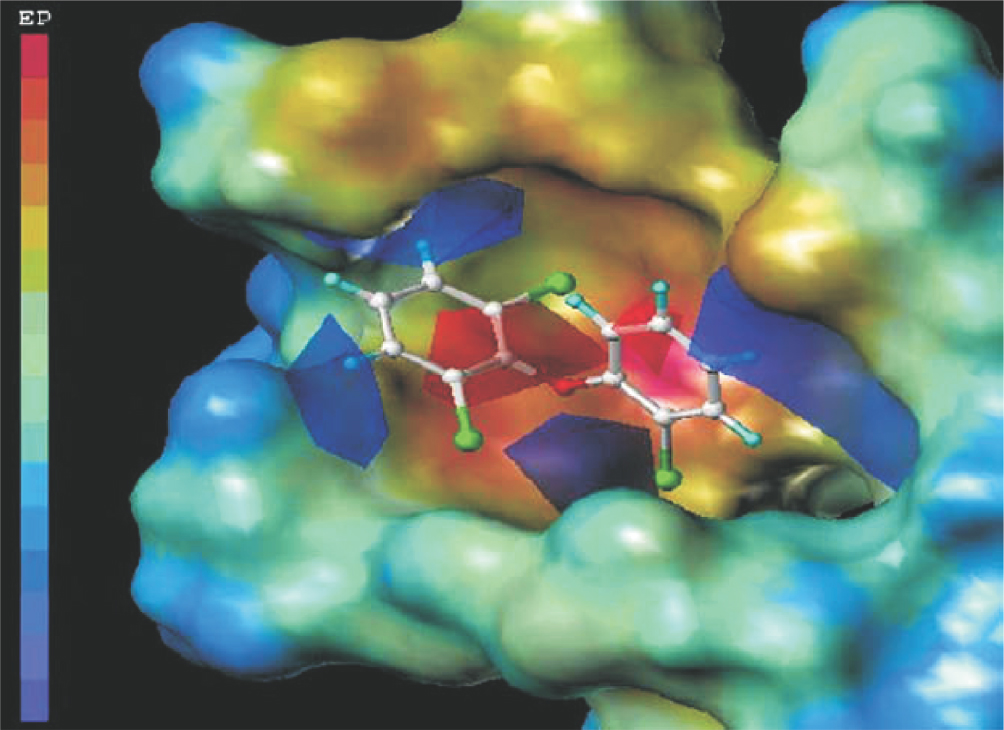
Des informations plus détaillées sur les interactions ligand/récepteur ont été obtenues ces dernières années, grâce à des modèles 3D-QSAR (type CoMSIA) (Yang et coll., 2009 ). Ces analyses ont mis en évidence que le champ électrostatique représente la plus grande contribution à l’activité anti-androgénique de PBDE, avec un poids de 61 % dans le modèle QSAR. De plus, une analyse des résultats théoriques met en évidence une réduction de l’activité anti-androgène (accumulation de charges positives) due aux substituants bromés en position para-, en accord avec l’expérience. Par exemple, le 2,2’,4,4’,6-penta-BDE (BDE 100, CI50=0,097 μM) a une activité plus basse que le 2,2’,6-tri-BDE 19 (CI50=0,060 μM). Les oxygènes carboxyliques des acides aminés Leu701 et Asn705 peuvent être impliqués dans l’interaction avec le ligand PBDE (figure 48.2
). Ces analyses ont mis en évidence que le champ électrostatique représente la plus grande contribution à l’activité anti-androgénique de PBDE, avec un poids de 61 % dans le modèle QSAR. De plus, une analyse des résultats théoriques met en évidence une réduction de l’activité anti-androgène (accumulation de charges positives) due aux substituants bromés en position para-, en accord avec l’expérience. Par exemple, le 2,2’,4,4’,6-penta-BDE (BDE 100, CI50=0,097 μM) a une activité plus basse que le 2,2’,6-tri-BDE 19 (CI50=0,060 μM). Les oxygènes carboxyliques des acides aminés Leu701 et Asn705 peuvent être impliqués dans l’interaction avec le ligand PBDE (figure 48.2 ).
).
 ). Ces analyses ont mis en évidence que le champ électrostatique représente la plus grande contribution à l’activité anti-androgénique de PBDE, avec un poids de 61 % dans le modèle QSAR. De plus, une analyse des résultats théoriques met en évidence une réduction de l’activité anti-androgène (accumulation de charges positives) due aux substituants bromés en position para-, en accord avec l’expérience. Par exemple, le 2,2’,4,4’,6-penta-BDE (BDE 100, CI50=0,097 μM) a une activité plus basse que le 2,2’,6-tri-BDE 19 (CI50=0,060 μM). Les oxygènes carboxyliques des acides aminés Leu701 et Asn705 peuvent être impliqués dans l’interaction avec le ligand PBDE (figure 48.2
). Ces analyses ont mis en évidence que le champ électrostatique représente la plus grande contribution à l’activité anti-androgénique de PBDE, avec un poids de 61 % dans le modèle QSAR. De plus, une analyse des résultats théoriques met en évidence une réduction de l’activité anti-androgène (accumulation de charges positives) due aux substituants bromés en position para-, en accord avec l’expérience. Par exemple, le 2,2’,4,4’,6-penta-BDE (BDE 100, CI50=0,097 μM) a une activité plus basse que le 2,2’,6-tri-BDE 19 (CI50=0,060 μM). Les oxygènes carboxyliques des acides aminés Leu701 et Asn705 peuvent être impliqués dans l’interaction avec le ligand PBDE (figure 48.2 ).
).Une autre région positive est localisée autour de la position 3 et 5 et, en effet, le 3,3’,4,5,5’-penta-BDE (BDE 27) a une activité plus faible que le 3,3’,4,5’-tetra-BDE (BDE 79, CI 50=5,1 et 2,0 μM respectivement). Dans ce cas, les atomes d’oxygène (négatifs) des résidus Val746, Phe764 et Gln711 peuvent être impliqués dans l’interaction ligand/substrat.
En revanche, deux régions favorisant les charges négatives sont présentes dans le centre de poche, donc la substitution en ortho- est favorable pour l’antagonisme-AR, tandis que celles en méta- et para- sont défavorisées.
 | Figure 48.2 Structure du BDE 19 dans le site actif de l’AR, représenté par son potentiel électrostatique (bleu : négatif ; rouge : positif ; d’après Yang et coll., 2009 ) ) |
La contribution hydrophobique est un autre facteur important dans l’activité AR-antagoniste des PBDE et représente 26 % de la variation en activité dans la série de PBDE. En effet, la présence des groupes hydrophobes en position ortho- provoque une augmentation de l’activité anti-androgénique. En croisant les informations théoriques du champ électrique et du champ hydrophobe, il a été suggéré que la présence d’un groupe électro-attracteur avec des propriétés hydrophobes en position ortho- maximise l’activité AR-antagoniste. Cette hypothèse est en accord avec l’ordre expérimental d’activité : 2,2’,4,4’,6-penta-BDE (CI50=0,097 μM) > 2,20,4,40-tétra-BDE (CI50=1,0 μM) > 2,4,40-tri-BDE (CI50=3,1 μM) (Hamers et coll., 2006 ). L’effet hydrophobe peut être lié à des interactions avec les résidus Leu707, Leu704, Met742 et Met745.
). L’effet hydrophobe peut être lié à des interactions avec les résidus Leu707, Leu704, Met742 et Met745.
 ). L’effet hydrophobe peut être lié à des interactions avec les résidus Leu707, Leu704, Met742 et Met745.
). L’effet hydrophobe peut être lié à des interactions avec les résidus Leu707, Leu704, Met742 et Met745.Deux autres articles récents (Papa et coll., 2010 ; Yang et coll., 2010
; Yang et coll., 2010 ) ont pris en considération non seulement les PBDE, mais également d’autres retardateurs de flamme, comme le HBCD et le TBBPA. Yang et coll. (2010
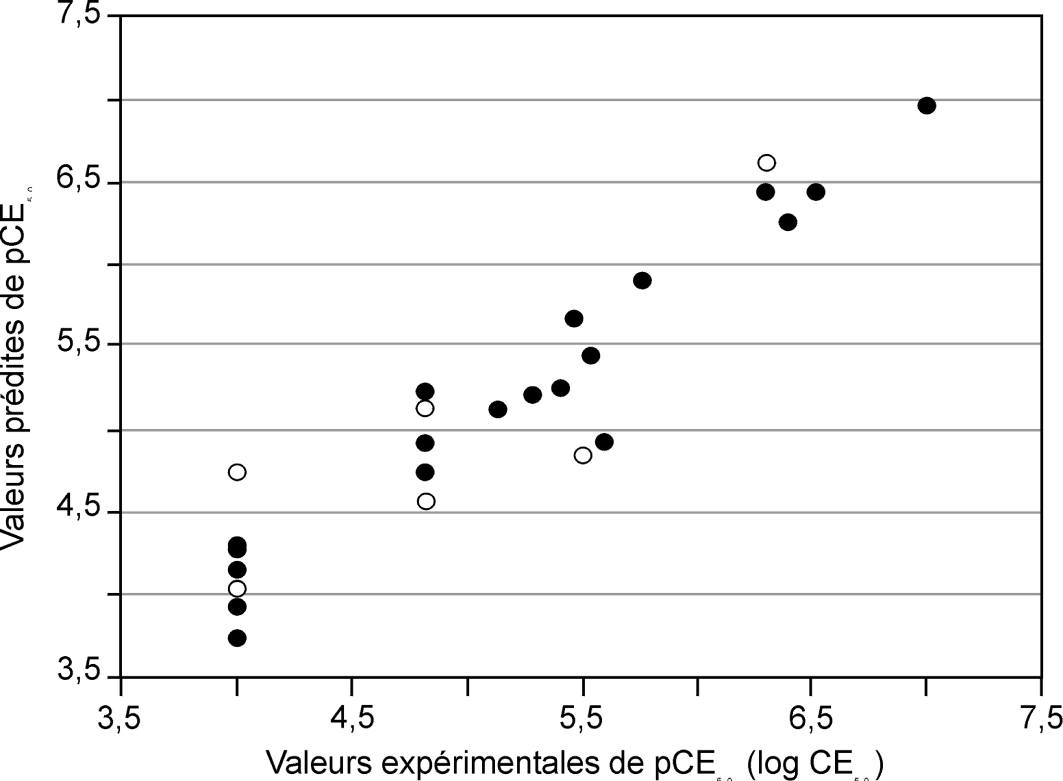
) ont pris en considération non seulement les PBDE, mais également d’autres retardateurs de flamme, comme le HBCD et le TBBPA. Yang et coll. (2010 ) proposent des modèles 3D-QSAR (ComSIA) corrects, avec de bons pouvoirs prédictifs (q2>0,8) et relativement bien corrélés aux données expérimentales (R2>0,9, voir figure 48.3
) proposent des modèles 3D-QSAR (ComSIA) corrects, avec de bons pouvoirs prédictifs (q2>0,8) et relativement bien corrélés aux données expérimentales (R2>0,9, voir figure 48.3 ). Ces modèles ont été obtenus à partir de 26 RFB, dont 17 PBDE. Aucune vérification sur l’ensemble extérieur à celui de préparation du modèle n’a été effectuée.
). Ces modèles ont été obtenus à partir de 26 RFB, dont 17 PBDE. Aucune vérification sur l’ensemble extérieur à celui de préparation du modèle n’a été effectuée.
 ; Yang et coll., 2010
; Yang et coll., 2010 ) ont pris en considération non seulement les PBDE, mais également d’autres retardateurs de flamme, comme le HBCD et le TBBPA. Yang et coll. (2010
) ont pris en considération non seulement les PBDE, mais également d’autres retardateurs de flamme, comme le HBCD et le TBBPA. Yang et coll. (2010 ) proposent des modèles 3D-QSAR (ComSIA) corrects, avec de bons pouvoirs prédictifs (q2>0,8) et relativement bien corrélés aux données expérimentales (R2>0,9, voir figure 48.3
) proposent des modèles 3D-QSAR (ComSIA) corrects, avec de bons pouvoirs prédictifs (q2>0,8) et relativement bien corrélés aux données expérimentales (R2>0,9, voir figure 48.3 ). Ces modèles ont été obtenus à partir de 26 RFB, dont 17 PBDE. Aucune vérification sur l’ensemble extérieur à celui de préparation du modèle n’a été effectuée.
). Ces modèles ont été obtenus à partir de 26 RFB, dont 17 PBDE. Aucune vérification sur l’ensemble extérieur à celui de préparation du modèle n’a été effectuée.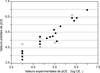 | Figure 48.3 Corrélation entre les activités œstrogéniques expérimentales et prédites des PBDE, des PBDE para-hydroxylés et des dérives bromés du BPA (d’après Yang et coll., 2010 ) ) |
Dans l’article de Papa et coll. (2010 ), plusieurs modèles QSAR, caractérisés par une bonne précision et un bon pouvoir prédictif interne et externe (Qext entre 0,8 et 0,9), ont été proposés pour le BDE 209 et 34. Les modèles pour l’activité ER-agoniste suggèrent qu’aucun composé des familles considérées ne présente une activité élevée. En revanche, des activités modérées (100 nM<EC50<1 000 nM) ont été associées aux substitutions en ortho- de PBDE, en l’absence de bromes en position para-4,4’. Les BDE 100 et BDE 155, avec, respectivement des bromes en positions 2,2’,6 et 2,2’,6 et 6’, présentant une activité modérée, représentent une exception. Ainsi, tous les PBDE avec des bromes en position 3,3’,4 et 2’ ont une activité œstrogénique faible (EC50>1 000 nM). Enfin, les modèles proposés prévoient aussi des activités ER-agonistes significatives pour les mono-, tri-, et penta-bromophénols, l’hexabromobenzène, le HBCD et les mono-, di- et tri-bromobisphénol A.
), plusieurs modèles QSAR, caractérisés par une bonne précision et un bon pouvoir prédictif interne et externe (Qext entre 0,8 et 0,9), ont été proposés pour le BDE 209 et 34. Les modèles pour l’activité ER-agoniste suggèrent qu’aucun composé des familles considérées ne présente une activité élevée. En revanche, des activités modérées (100 nM<EC50<1 000 nM) ont été associées aux substitutions en ortho- de PBDE, en l’absence de bromes en position para-4,4’. Les BDE 100 et BDE 155, avec, respectivement des bromes en positions 2,2’,6 et 2,2’,6 et 6’, présentant une activité modérée, représentent une exception. Ainsi, tous les PBDE avec des bromes en position 3,3’,4 et 2’ ont une activité œstrogénique faible (EC50>1 000 nM). Enfin, les modèles proposés prévoient aussi des activités ER-agonistes significatives pour les mono-, tri-, et penta-bromophénols, l’hexabromobenzène, le HBCD et les mono-, di- et tri-bromobisphénol A.
 ), plusieurs modèles QSAR, caractérisés par une bonne précision et un bon pouvoir prédictif interne et externe (Qext entre 0,8 et 0,9), ont été proposés pour le BDE 209 et 34. Les modèles pour l’activité ER-agoniste suggèrent qu’aucun composé des familles considérées ne présente une activité élevée. En revanche, des activités modérées (100 nM<EC50<1 000 nM) ont été associées aux substitutions en ortho- de PBDE, en l’absence de bromes en position para-4,4’. Les BDE 100 et BDE 155, avec, respectivement des bromes en positions 2,2’,6 et 2,2’,6 et 6’, présentant une activité modérée, représentent une exception. Ainsi, tous les PBDE avec des bromes en position 3,3’,4 et 2’ ont une activité œstrogénique faible (EC50>1 000 nM). Enfin, les modèles proposés prévoient aussi des activités ER-agonistes significatives pour les mono-, tri-, et penta-bromophénols, l’hexabromobenzène, le HBCD et les mono-, di- et tri-bromobisphénol A.
), plusieurs modèles QSAR, caractérisés par une bonne précision et un bon pouvoir prédictif interne et externe (Qext entre 0,8 et 0,9), ont été proposés pour le BDE 209 et 34. Les modèles pour l’activité ER-agoniste suggèrent qu’aucun composé des familles considérées ne présente une activité élevée. En revanche, des activités modérées (100 nM<EC50<1 000 nM) ont été associées aux substitutions en ortho- de PBDE, en l’absence de bromes en position para-4,4’. Les BDE 100 et BDE 155, avec, respectivement des bromes en positions 2,2’,6 et 2,2’,6 et 6’, présentant une activité modérée, représentent une exception. Ainsi, tous les PBDE avec des bromes en position 3,3’,4 et 2’ ont une activité œstrogénique faible (EC50>1 000 nM). Enfin, les modèles proposés prévoient aussi des activités ER-agonistes significatives pour les mono-, tri-, et penta-bromophénols, l’hexabromobenzène, le HBCD et les mono-, di- et tri-bromobisphénol A.Modèles in silico
Aucune étude détaillée sur l’interaction PBDE-récepteur n’a été recensée dans la littérature examinée. En revanche, les propriétés chimico-physiques (structure moléculaire, affinité électronique...) des PBDE ont fait l’objet de deux études atomistiques qui ont montré qu’elles peuvent être prévues par des méthodes propres à la chimie quantique (Hu et coll., 2005 ; Zhao et coll., 2008
; Zhao et coll., 2008 ).
).
 ; Zhao et coll., 2008
; Zhao et coll., 2008 ).
).
En conclusion, l’équipe de T. Hamers a étudié 27 composés polybromés pour leurs effets sur les récepteurs des œstrogènes alpha (ERα), des androgènes (AR), de la progestérone (PR), des hormones thyroïdiennes alpha (TRα) et de la dioxine (AhR) ainsi que sur l’enzyme en charge de la sulfatation de l’œstradiol et la protéine de transport de l’hormone thyroïdienne (transthyrétrine) sans montrer un effet de classe mais plutôt des effets variables selon les composés. Par ailleurs, plusieurs études ont suggéré que AhR pourrait être une cible de ces molécules, mais des études plus récentes montrent que la voie AhR n’est pas une cible pertinente pour les retardateurs de flamme.
Les études transcriptomiques ou protéomiques qui ont été menées avec des retardateurs de flamme sur des modèles poissons confirment qu’il est difficile de généraliser les effets et les modes d’action à l’échelle de l’ensemble des congénères de PBDE.
Les résultats de plusieurs travaux de criblage in vitro suggèrent que l’activité œstrogénique est associée à une faible bromation des PBDE alors que l’activité anti-œstrogénique est déterminée par un degré élevé de bromation. Les molécules substituées aux positions [2,2’,6] ou [2,2’,4]) ont une activité ER-agoniste. De même, le modèle QSAR lie l’activité AR-antagoniste à un bas degré de bromation et aux substitutions en ortho- (positions 2, 2’, 6 et 6’) ou ortho- et para- (positions 4 et 4’). Un groupe hydroxylique en position para- (positions 4 et 4’) augmente l’activité œstrogénique. La réduction de l’activité anti-androgène (accumulation de charges positives) est due aux substituants bromés en position para. En revanche, la présence des groupes hydrophobes en position ortho- provoque une augmentation de l’activité anti-androgénique. En croisant les informations théoriques du champ électrique et du champ hydrophobe, il a été suggéré que la présence d’un groupe électro-attracteur avec des propriétés hydrophobes en position ortho- maximise l’activité AR-antagoniste.
Bibliographie
[1] BEARR JS, STAPLETON HM, MITCHELMORE CL. Accumulation and DNA damage in fathead minnows (Pimephales promelas) exposed to 2 brominated flame-retardant mixtures, Firemaster 550 and Firemaster BZ-54.
Environ Toxicol Chem. 2010;
29:722- 729

[2] CANTÓN RF, SCHOLTEN DE, MARSH G, DE JONG PC, VAN DEN BERG M. Inhibition of human placental aromatase activity by hydroxylated polybrominated diphenyl ethers (OH-PBDEs).
Toxicol Appl Pharmacol. 2008;
227:68- 75

[3] CHEN GS, KONSTANTINOV AD, CHITTIM BG, JOYCE EM, BOLS NC, BUNCE NJ. Synthesis of polybrominated diphenyl and their capacity to induce CYPA1 by the Ah receptor mediated pathway.
Environ Science Technology. 2001;
35:3749- 3756

[4] CHEN TH, CHENG YM, CHENG JO, CHOU CT, HSIAO YC, KO FC. Growth and transcriptional effect of dietary 2,2’,4,4’-tetrabromodiphenyl ether (PBDE-47) exposure in developing zebrafish (Danio rerio).
Ecotoxicol Environ Saf. 2010;
73:377- 383

[5] FERY Y, BUSCHAUER I, SALZIG C, LANG P, SCHRENK D. Technical pentabromodiphenyl ether and hexabromocyclododecane as activators of the pregnane-X-receptor (PXR).
Toxicology. 2009;
264:45- 51

[6] GU C, JU X, JIANG X, YU K, YANG S, SUN C. Improved 3D-QSAR analyzes for the predictive toxicology of polybrominated diphenyl ethers with CoMFA/CoMSIA and DFT.
Ecotoxicol Environ Saf. 2010;
73:1470- 1479

[7] HAMERS T, KAMSTRA JH, SONNEVELD E, MURK AJ, KESTER MH, coll. In vitro profiling of the endocrine-disrupting potency of brominated flame retardants.
Toxicol Sci. 2006;
92:157- 173

[8] HARJU M, HAMERS T, KAMSTRA JH, SONNEVELD E, BOON JP, coll. Quantitative structure-activity relationship modeling on in vitro endocrine effects and metabolic stability involving 26 selected brominated flame retardants.
Environ Toxicol Chem. 2007;
26:816- 826

[9] HARJU M, HAMERS T, KAMSTRA JH, SONNEVELD E, BOON JP, coll. Quantitative structure-activity relationship modeling on in vitro endocrine effects and metabolic stability involving 26 selected brominated flame retardants.
Environ Toxicol Chem. 2007;
26:816- 826

[10] HE Y, MURPHY MB, YU RM, LAM MH, HECKER M, coll. Effects of 20 PBDE metabolites on steroidogenesis in the H295R cell line.
Toxicol Lett. 2008;
176:230- 238

[11] HU J, ERIKSSON L, BERGMAN A, JAKOBSSON E, KOLEHMAINEN E, coll. Molecular orbital studies on brominated diphenyl ethers. Part II--reactivity and quantitative structure-activity (property) relationships.
Chemosphere. 2005;
59:1043- 1057

[12] HU J, LIANG Y, CHEN M, WANG X. Assessing the toxicity of TBBPA and HBCD by zebrafish embryo toxicity assay and biomarker analysis.
Environ Toxicol. 2009;
24:334- 342

[13] KHALAF H, LARSSON A, BERG H, MCCRINDLE R, ARSENAULT G, OLSSON PE. Diastereomers of the Brominated Flame Retardant 1,2-Dibromo-4-(1,2 dibromo ethyl)cyclohexane Induce Androgen Receptor Activation in the HepG2 Hepatocellular Carcinoma Cell Line and the LNCaP Prostate Cancer Cell Line.
Env Health Perspect. 2009;
117:1853- 1859

[14] KOJIMA H, TAKEUCHI S, URAMARU N, SUGIHARA S, YOSHIDA T, KITAMURA S. Nuclear hormone receptor activity of polybrominated diphenyl ethers and their hydroxylated and methoxylated metabolites in transactivation assays using Chinese hamster ovary cells.
Environ Health Perspect. 2009;
117:1210- 1218

[15] KUIPER RV, MURK AJ, LEONARDS PE, GRINWIS GC, VAN DEN BERG M, VOS JG. In vivo and in vitro Ah-receptor activation by commercial and fractionated pentabromodiphenylether using zebrafish (Danio rerio) and the DR-CALUX assay.
Aquat Toxicol. 2006;
79:366- 875

[16] LARSSON A, ERIKSSON LA, ANDERSSON PL, IVARSON P, OLSSON PE. Identification of the brominated flame retardant 1,2-dibromo-4-(1,2-dibromoethyl)cyclohexane as an androgen agonist.
J Med Chem. 2006;
49:7366- 7372

[17] LIU H, PAPA E, WALKER JD, GRAMATICA P. In silico screening of estrogen-like chemicals based on different nonlinear classification models.
J Mol Grap Mod. 2007;
26:135- 144

[18] MEERTS I, LETCHER RJ, HOVING S, MARSH G, BERGMAN A, coll. In vitro estrogenicity of polybrominated diphenyl ethers, hydroxylated PBDEs, and polybrominated bisphenol A compounds.
Environ Health Perspect. 2001;
109:399- 407

[19] MERCADO-FELICIANO M, BIGSBY RM. Hydroxylated metabolites of the polybrominated diphenyl ether mixture DE-71 are weak estrogen receptor-alpha ligands.
Environ Health Perspect. 2008;
116:1315- 1321

[20] PACYNIAK EK, CHENG X, CUNNINGHAM ML, CROFTON K, KLAASSEN CD, GUO GL. The flame retardants, polybrominated diphenyl ethers, are pregnane X receptor activators.
Toxicol Sci. 2007;
97:94- 102

[21] PAPA E, KOVARICH S, GRAMATICA P. QSAR modeling and prediction of the endocrine-disrupting potencies of brominated flame retardants.
Chem Res Toxicol. 2010;
23:946- 954

[22] RALDÚA D, PADRÓS F, SOLÉ M, ELJARRAT E, BARCELÓ D, RIVA MC, BARATA C. First evidence of polybrominated diphenyl ether (flame retardants) effects in feral barbel from the Ebro River basin (NE, Spain).
Chemosphere. 2008;
73:56- 64

[23] RONISZ D, FINNE EF, KARLSSON H, FÖRLIN L. Effects of the brominated flame retardants hexabromocyclododecane (HBCDD), and tetrabromobisphenol A (TBBPA), on hepatic enzymes and other biomarkers in juvenile rainbow trout and feral eelpout.
Aquat Toxicol. 2004;
69:229- 245

[24] STOKER TE, COOPER RL, LAMBRIGHT CS, WILSON VS, FURR J, GRAY LE. In vivo and in vitro anti-androgenic effects of DE-71, a commercial polybrominated diphenyl ether (PBDE) mixture.
Toxicol Appl Pharmacol. 2005;
207:78- 88

[25] WAHL M, LAHNI B, GUENTHER R, KUCH B, YANG L, coll. A technical mixture of 2,2’,4,4’-tetrabromo diphenyl ether (BDE47) and brominated furans triggers aryl hydrocarbon receptor (AhR) mediated gene expression and toxicity.
Chemosphere. 2008;
73:209- 215

[26] WANG Y, LIU H, ZHAO C, LIU H, CAI Z, coll. Quantitative structure-activity relationship models for prediction of the toxicity of polybrominated diphenyl ether congeners.
Environ Science Technol. 2005;
39:4961- 4966

[27] WANG Y, ZHAO C, MA W, LIU H, WANG T, JIANG G. Quantitative structure-activity relationship for prediction of the toxicity of polybrominated diphenyl ether (PBDE) congeners.
Chemosphere. 2006;
64:515- 524

[28] WU B, ZHANG Y, KONG J, ZHANG X, CHENG S. In silico predication of nuclear hormone receptors for organic pollutants by homology modeling and molecular docking.
Toxicology Letters. 2009;
191:69- 73

[29] XU HY, ZOU JIW, YU QS, WANG YH, ZHANG JY, JIN HX. QSPR/QSAR models for prediction of the physicochemical properties and biological activity of polybrominated diphenyl ethers.
Chemosphere. 2007;
66:1998- 2010

[30] YANG W, MU Y, GIESY JP, ZHANG A, YU H. Anti-androgen activity of polybrominated diphenyl ethers determined by comparative molecular similarity indices and molecular docking.
Chemosphere. 2009;
75:1159- 1164

[31] YANG W, LIU X, LIU H, WU Y, GIESY JP, YU H. Molecular docking and comparative molecular similarity indices analysis of estrogenicity of polybrominated diphenyl ethers and their analogues.
Environ Toxicol Chem. 2010;
29:660- 668

[32] ZHAO Y, TAO F, ZENG E. Theoretical study on the chemical properties of polybrominated diphenyl ethers.
Chemosphere. 2008;
70:901- 907

[33] ZHENG G, XIAO M, LU X. QSAR study on the Ah receptor-binding affinities of polyhalogenated dibenzo- p -dioxins using net atomic-charge descriptors and a radial basis neural network.
Anal Bioanal Chem. 2005;
383:810- 816

→ Aller vers SYNTHESE