Évolutions temporelles des altérations de la fonction de reproduction humaine
2011
| ANALYSE |
5-
Cancers du testicule, de la prostate, du sein et de l’ovaire
On assiste depuis une vingtaine d’années à une augmentation de l’incidence de certains cancers, en particulier les cancers du testicule, de la prostate, du sein et de l’ovaire. Cette augmentation, observée au niveau mondial mais avec des variations géographiques, pose la question d’un lien entre la survenue de ces cancers et des facteurs environnementaux à identifier. Ce chapitre reprend les données de l’expertise « Cancer et environnement » (Inserm, 2008 ), réactualisées selon les projections de l’InVS pour l’année 2010 (Hospices civils de Lyon et coll., 2010
), réactualisées selon les projections de l’InVS pour l’année 2010 (Hospices civils de Lyon et coll., 2010 ).
).
 ), réactualisées selon les projections de l’InVS pour l’année 2010 (Hospices civils de Lyon et coll., 2010
), réactualisées selon les projections de l’InVS pour l’année 2010 (Hospices civils de Lyon et coll., 2010 ).
).Cancer du testicule
Les tumeurs du testicule sont dans l’ensemble des tumeurs relativement rares. Cependant, leur incidence est en augmentation depuis plus de 50 ans dans la plupart des pays industrialisés. Il s’agit des tumeurs les plus fréquentes chez l’homme âgé de 20 à 35 ans. Les progrès thérapeutiques majeurs réalisés au cours des 30 dernières années ont permis de diminuer considérablement la mortalité.
Le pic d’incidence se situe entre 25 et 35 ans. Il est très rare avant 15 ans comme après 50 ans. L’âge de survenue présente cependant des variations en fonction du type histologique. Les tumeurs germinales du testicule non séminomateuses sont pratiquement toujours des tumeurs de l’adulte jeune (âge médian au diagnostic, 30 ans), alors que les tumeurs germinales du testicule séminomateuses peuvent parfois s’observer après la cinquantaine (âge médian au diagnostic, 38 ans).
La plupart des cancers du testicule ont pour origine les cellules germinales. Les tumeurs séminomateuses représentent 30 à 40 % des tumeurs germinales du testicule. Les tumeurs non séminomateuses représentent 60 à 70 % des tumeurs germinales du testicule. Il existe de nombreuses formes de tumeurs non germinales. Les deux principales sont le lymphome testiculaire et la tumeur à cellules de Leydig.
Incidence dans le monde
L’incidence des cancers du testicule n’est pas la même dans les différentes régions du monde, elle varie aussi en fonction de l’origine ethnique des populations. L’Australie, l’Amérique du Nord et surtout l’Europe présentent les taux les plus élevés (généralement supérieurs à 4/100 000, standardisés sur la population mondiale) (Parkin et coll., 2002 ). En Asie, Amérique du sud et Afrique, les taux sont généralement inférieurs à 2/100 000. Lorsque l’origine ethnique des populations est prise en compte, on observe les taux les plus élevés dans les populations blanches. Aux États-Unis, l’incidence est 3 à 4 fois plus faible chez les noirs et les asiatiques que chez les blancs et 2 fois plus faible chez les hispaniques (Ries et coll., 2007
). En Asie, Amérique du sud et Afrique, les taux sont généralement inférieurs à 2/100 000. Lorsque l’origine ethnique des populations est prise en compte, on observe les taux les plus élevés dans les populations blanches. Aux États-Unis, l’incidence est 3 à 4 fois plus faible chez les noirs et les asiatiques que chez les blancs et 2 fois plus faible chez les hispaniques (Ries et coll., 2007 ).
).
 ). En Asie, Amérique du sud et Afrique, les taux sont généralement inférieurs à 2/100 000. Lorsque l’origine ethnique des populations est prise en compte, on observe les taux les plus élevés dans les populations blanches. Aux États-Unis, l’incidence est 3 à 4 fois plus faible chez les noirs et les asiatiques que chez les blancs et 2 fois plus faible chez les hispaniques (Ries et coll., 2007
). En Asie, Amérique du sud et Afrique, les taux sont généralement inférieurs à 2/100 000. Lorsque l’origine ethnique des populations est prise en compte, on observe les taux les plus élevés dans les populations blanches. Aux États-Unis, l’incidence est 3 à 4 fois plus faible chez les noirs et les asiatiques que chez les blancs et 2 fois plus faible chez les hispaniques (Ries et coll., 2007 ).
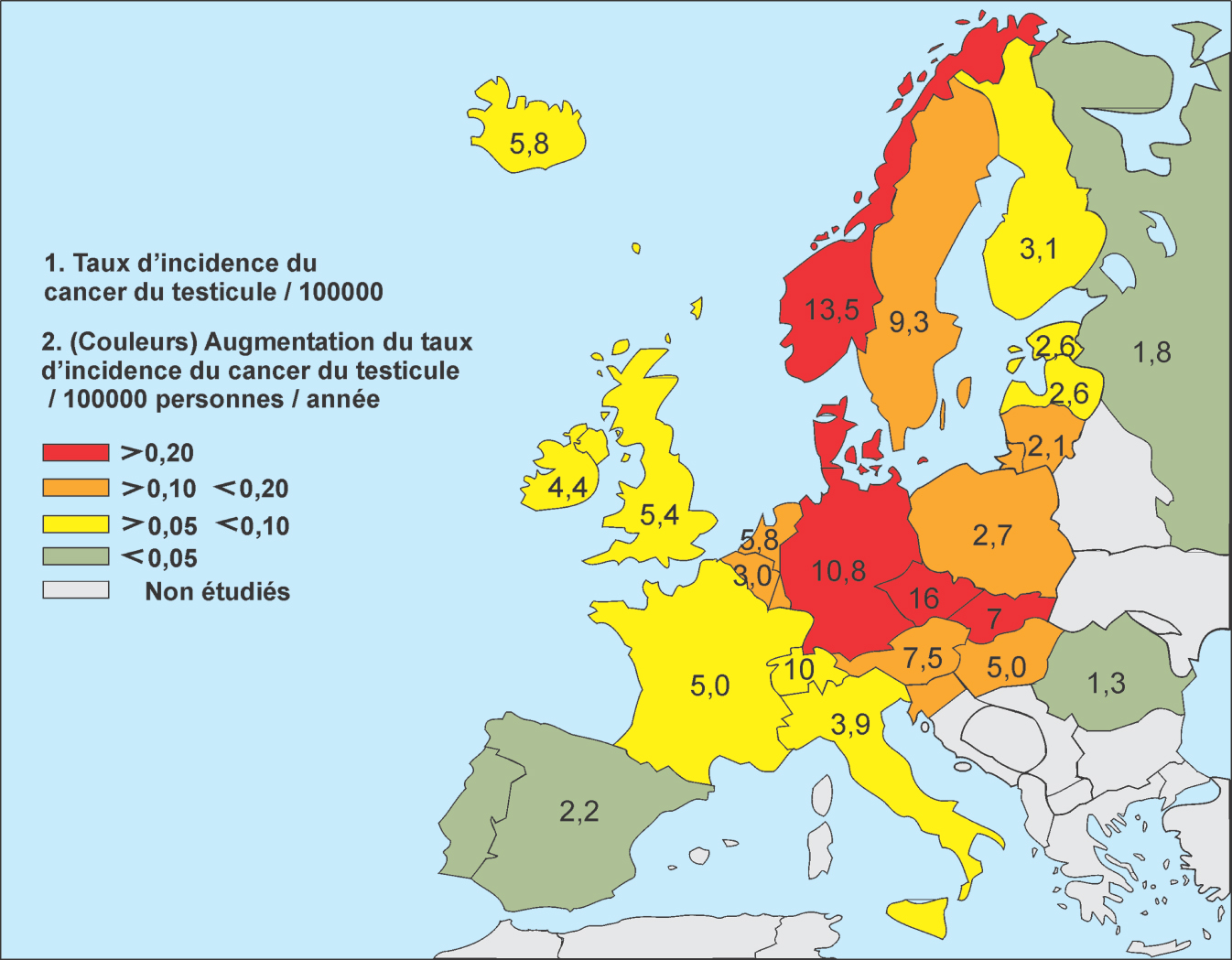
).La carte de l’Europe (figure 5.1 ; Huyghe et coll., 2007
; Huyghe et coll., 2007 ) permet de mettre en avant la grande disparité dans les taux d’incidence du cancer du testicule entre les pays européens ainsi que les différences dans l’augmentation de l’incidence. D’après les données les plus récentes de Globocan 20081
, l’incidence atteint 12,1 pour 100 000 en Norvège, 10,3 au Danemark, 6,1 en Suède et 5,1 en Finlande, montrant des différences importantes entre pays voisins.
) permet de mettre en avant la grande disparité dans les taux d’incidence du cancer du testicule entre les pays européens ainsi que les différences dans l’augmentation de l’incidence. D’après les données les plus récentes de Globocan 20081
, l’incidence atteint 12,1 pour 100 000 en Norvège, 10,3 au Danemark, 6,1 en Suède et 5,1 en Finlande, montrant des différences importantes entre pays voisins.
 ; Huyghe et coll., 2007
; Huyghe et coll., 2007 ) permet de mettre en avant la grande disparité dans les taux d’incidence du cancer du testicule entre les pays européens ainsi que les différences dans l’augmentation de l’incidence. D’après les données les plus récentes de Globocan 20081
, l’incidence atteint 12,1 pour 100 000 en Norvège, 10,3 au Danemark, 6,1 en Suède et 5,1 en Finlande, montrant des différences importantes entre pays voisins.
) permet de mettre en avant la grande disparité dans les taux d’incidence du cancer du testicule entre les pays européens ainsi que les différences dans l’augmentation de l’incidence. D’après les données les plus récentes de Globocan 20081
, l’incidence atteint 12,1 pour 100 000 en Norvège, 10,3 au Danemark, 6,1 en Suède et 5,1 en Finlande, montrant des différences importantes entre pays voisins. | Figure 5.1 Carte de l’Europe montrant les taux d’incidence du cancer du testicule et leur augmentation moyenne annuelle (d’après Huyghe et coll., 2007 ) ) |
Incidence en France
En France, en 2005, le taux d’incidence pour l’ensemble des cancers du testicule était de 6,4 pour 100 000 (Belot et coll., 2008 ).
).
 ).
).Les estimations les plus récentes (Hospice civils de Lyon et coll., 2010 ) sont des projections pour 2010, calculées à partir des données de 2005 et qui font l’hypothèse que la tendance récente à l’augmentation se prolonge (les 5 dernières années). Le taux d’incidence en 2010 est estimé à 7,0 cas pour 100 000 personnes-années (soit 2 220 nouveaux cas)2
.
) sont des projections pour 2010, calculées à partir des données de 2005 et qui font l’hypothèse que la tendance récente à l’augmentation se prolonge (les 5 dernières années). Le taux d’incidence en 2010 est estimé à 7,0 cas pour 100 000 personnes-années (soit 2 220 nouveaux cas)2
.
 ) sont des projections pour 2010, calculées à partir des données de 2005 et qui font l’hypothèse que la tendance récente à l’augmentation se prolonge (les 5 dernières années). Le taux d’incidence en 2010 est estimé à 7,0 cas pour 100 000 personnes-années (soit 2 220 nouveaux cas)2
.
) sont des projections pour 2010, calculées à partir des données de 2005 et qui font l’hypothèse que la tendance récente à l’augmentation se prolonge (les 5 dernières années). Le taux d’incidence en 2010 est estimé à 7,0 cas pour 100 000 personnes-années (soit 2 220 nouveaux cas)2
.Concernant le taux d’incidence du cancer du testicule par type histologique, une récente étude menée dans le sud de la France montre que le taux pour les tumeurs séminomateuses était de 1,24 pour 100 000 et de 1,80 pour 100 000 pour les tumeurs non séminomateuses, pour la période 1995-1999 (Walschaerts et coll., 2008 ).
).
 ).
).Les taux d’incidence observés dans les registres français sont très différents d’un département à l’autre. Il existe un gradient nord-sud et est-ouest, les taux les plus hauts se trouvant en Alsace (Haut-Rhin et Bas-Rhin). Ces taux varient du simple au double et le Bas-Rhin avec un taux d’incidence de 8,7/100 000 personnes-année3
, approche les taux très élevés que l’on trouve en Europe du Nord.
Actuellement, la mortalité par cancer du testicule est très faible : le taux standardisé sur la population mondiale est de 0,25 pour 100 000 (Remontet et coll., 2003a et b
et b ).
).
 et b
et b ).
).Tendances de l’incidence
L’incidence du cancer du testicule est en augmentation depuis plus de 50 ans dans la plupart des pays industrialisés. Cette augmentation varie d’un pays à l’autre, tout en étant moins hétérogène que les taux d’incidence eux-mêmes d’une région à l’autre. En Roumanie, on observe une augmentation annuelle pour 100 000 qui est inférieur à 0,05 alors qu’elle atteint plus de 0,20 en Norvège. Mais l’augmentation de l’incidence pour la majorité des pays européens se situe entre 0,10 et 0,20 pour 100 000 par an, conduisant à un doublement de l’incidence depuis 1970.
Toutefois, plusieurs auteurs en conduisant des analyses par cohorte sur des données de registres d’Europe du Nord observent une baisse du risque pour les sujets nés autour de la seconde guerre mondiale (Møller, 1993 ; Bergström et coll., 1996
; Bergström et coll., 1996 ).
).
 ; Bergström et coll., 1996
; Bergström et coll., 1996 ).
).L’analyse des données du registre du Connecticut et plus largement de l’ensemble des registres du SEER Program (Surveillance, Epidemiology, and End Results)4
montre une augmentation nette chez les blancs alors qu’il n’existe pas d’augmentation significative chez les noirs américains (Zheng et coll., 1996 ; Ries et coll., 2007
; Ries et coll., 2007 ).
).
 ; Ries et coll., 2007
; Ries et coll., 2007 ).
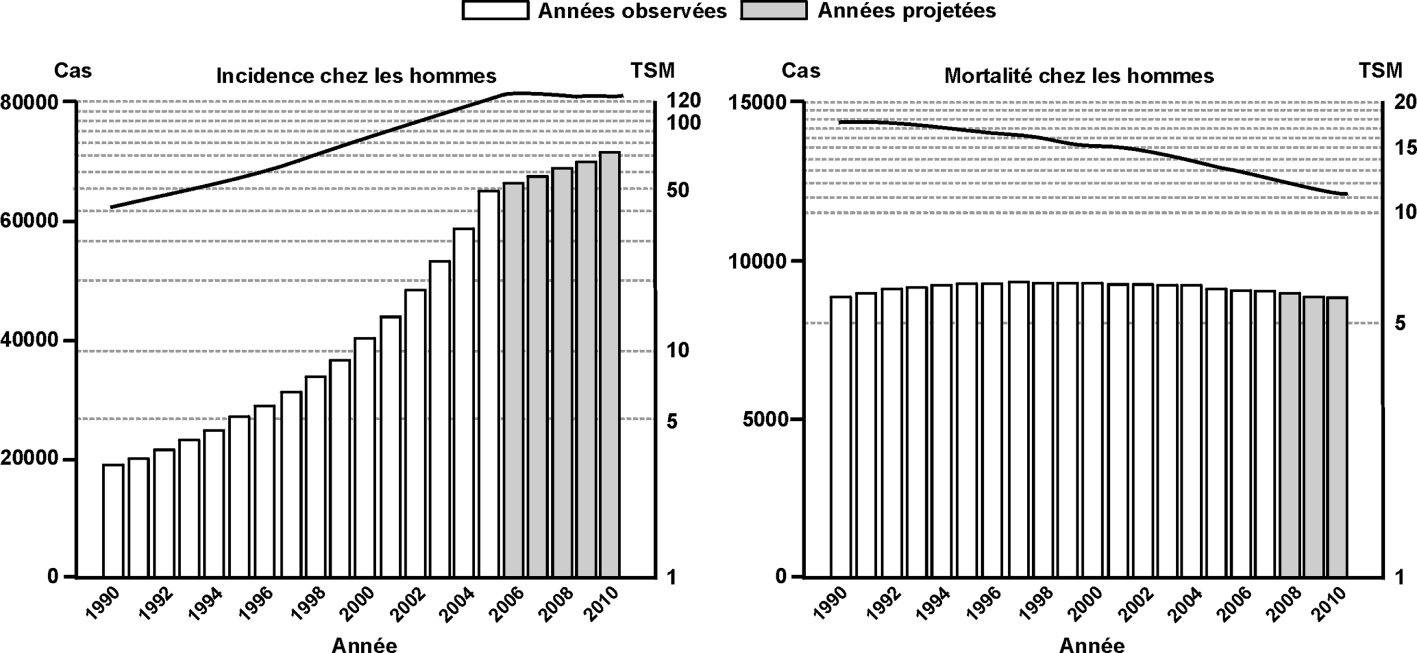
).Comme pour le reste du monde, l’incidence du cancer du testicule est en très forte augmentation en France. En France, l’incidence est passée de 3,17 en 1978 à 4,82 pour 100 000 en 2000, à 6,4 pour 100 000 en 2005, soit une augmentation de 2,5 % sur la période 1980-2005 (3,4 cas pour 100 000 personnes-années en 1980 contre 6,4 cas en 2005). Cette augmentation est relativement constante sur l’ensemble de la période (figure 5.2 ).
).
 ).
). | Figure 5.2 Évolution de l’incidence (taux standardisés monde) et de la mortalité du cancer du testicule chez l’homme de 1990 à 2010 en France (d’après Hospices civils de Lyon et coll., 2010 ) ) |
Cependant si les séminomes n’ont cessé d’augmenter pour toutes les cohortes de naissances, l’évolution des tumeurs non séminomateuses est moins régulière.
Entre 1978 et 2000, le taux pour les séminomes est passé de 1,50 à 2,46 pour 100 000, soit une augmentation par an de 2,4 %, et de 1,18 à 1,95 pour 100 000 pour les tumeurs non séminomateuses, soit 2,4 % d’augmentation annuelle (Hedelin et Remontet, 2002 ). Une étude plus récente a montré que le taux pour les séminomes est passé de 0,66 à 1,24 pour 100 000, et pour les non séminomes, de 0,66 à 1,80 pour 100 000 entre 1980-84 et 1995-99 (Walschaerts et coll., 2008
). Une étude plus récente a montré que le taux pour les séminomes est passé de 0,66 à 1,24 pour 100 000, et pour les non séminomes, de 0,66 à 1,80 pour 100 000 entre 1980-84 et 1995-99 (Walschaerts et coll., 2008 ). Toutefois, les fluctuations dans les incidences au cours du temps ne permettent pas de conclure à une disparité selon le type histologique. C’est également le cas pour d’autres pays. Par exemple, aux États-Unis, dans la population blanche, bien que le taux d’incidence pour les séminomes augmente plus vite durant les 3 premiers intervalles de temps, il atteint un plateau, et aucune différence n’est observée entre les types histologiques pour la population noire (McGlynn et coll., 2003
). Toutefois, les fluctuations dans les incidences au cours du temps ne permettent pas de conclure à une disparité selon le type histologique. C’est également le cas pour d’autres pays. Par exemple, aux États-Unis, dans la population blanche, bien que le taux d’incidence pour les séminomes augmente plus vite durant les 3 premiers intervalles de temps, il atteint un plateau, et aucune différence n’est observée entre les types histologiques pour la population noire (McGlynn et coll., 2003 ).
).
 ). Une étude plus récente a montré que le taux pour les séminomes est passé de 0,66 à 1,24 pour 100 000, et pour les non séminomes, de 0,66 à 1,80 pour 100 000 entre 1980-84 et 1995-99 (Walschaerts et coll., 2008
). Une étude plus récente a montré que le taux pour les séminomes est passé de 0,66 à 1,24 pour 100 000, et pour les non séminomes, de 0,66 à 1,80 pour 100 000 entre 1980-84 et 1995-99 (Walschaerts et coll., 2008 ). Toutefois, les fluctuations dans les incidences au cours du temps ne permettent pas de conclure à une disparité selon le type histologique. C’est également le cas pour d’autres pays. Par exemple, aux États-Unis, dans la population blanche, bien que le taux d’incidence pour les séminomes augmente plus vite durant les 3 premiers intervalles de temps, il atteint un plateau, et aucune différence n’est observée entre les types histologiques pour la population noire (McGlynn et coll., 2003
). Toutefois, les fluctuations dans les incidences au cours du temps ne permettent pas de conclure à une disparité selon le type histologique. C’est également le cas pour d’autres pays. Par exemple, aux États-Unis, dans la population blanche, bien que le taux d’incidence pour les séminomes augmente plus vite durant les 3 premiers intervalles de temps, il atteint un plateau, et aucune différence n’est observée entre les types histologiques pour la population noire (McGlynn et coll., 2003 ).
).Concernant les tendances de l’incidence pour l’ensemble des tumeurs, bien que les taux observés dans les différents registres soient hétérogènes, il existe un même phénomène : un doublement de l’augmentation de tous ces taux, que ce soit en France ou dans les pays européens, sur les 20 dernières années.
Dans le sud de la France, le taux d’incidence du cancer du testicule est passé de 1,27 à 3,04 pour 100 000 entre 1980 et 1999 (Walschaerts et coll., 2008 ). En Italie, le taux d’incidence a augmenté de 2,3 à 3,9 pour 100 000 entre 1976 et 1995 dans la région de Varèse, et de 2,6 à 4,0 pour 100 000 dans la région de Turin entre 1985 et 1995 (Purdue et coll., 2005
). En Italie, le taux d’incidence a augmenté de 2,3 à 3,9 pour 100 000 entre 1976 et 1995 dans la région de Varèse, et de 2,6 à 4,0 pour 100 000 dans la région de Turin entre 1985 et 1995 (Purdue et coll., 2005 ). En Finlande, l’incidence est passée d’environ 2,1 à 4,2 pour 100 000 entre 1975 et 1995 (Bray et coll., 2006
). En Finlande, l’incidence est passée d’environ 2,1 à 4,2 pour 100 000 entre 1975 et 1995 (Bray et coll., 2006 ).
).
 ). En Italie, le taux d’incidence a augmenté de 2,3 à 3,9 pour 100 000 entre 1976 et 1995 dans la région de Varèse, et de 2,6 à 4,0 pour 100 000 dans la région de Turin entre 1985 et 1995 (Purdue et coll., 2005
). En Italie, le taux d’incidence a augmenté de 2,3 à 3,9 pour 100 000 entre 1976 et 1995 dans la région de Varèse, et de 2,6 à 4,0 pour 100 000 dans la région de Turin entre 1985 et 1995 (Purdue et coll., 2005 ). En Finlande, l’incidence est passée d’environ 2,1 à 4,2 pour 100 000 entre 1975 et 1995 (Bray et coll., 2006
). En Finlande, l’incidence est passée d’environ 2,1 à 4,2 pour 100 000 entre 1975 et 1995 (Bray et coll., 2006 ).
).Ces observations suggèrent une grande hétérogénéité géographique dans l’incidence mais une relative homogénéité dans les tendances temporelles d’une région à l’autre.
L’incidence a diminué pour les cohortes nées entre les deux guerres mondiales avant d’augmenter en se superposant à celle des séminomes. Cette évolution qui n’est pas expliquée, ne semble pas être un artefact d’enregistrement ou de codage des tumeurs testiculaires (Hedelin et Remontet, 2002 ).
).
 ).
).En étudiant la tendance de l’incidence par un modèle âge-période-cohorte, l’effet cohorte de naissance révèle une diminution du taux d’incidence du cancer du testicule pour les cohortes nées dans les années 1930 et au cours de la seconde guerre mondiale à l’opposé de ce qui est décrit pour les autres périodes de naissance (Walschaerts et coll., 2008 ). Ce phénomène, également observable dans de nombreux pays européens (Danemark, Suède, Finlande...) ne peut s’expliquer par une meilleure détection des cancers du testicule, ou un meilleur enregistrement car il n’existe pas d’effet période.
). Ce phénomène, également observable dans de nombreux pays européens (Danemark, Suède, Finlande...) ne peut s’expliquer par une meilleure détection des cancers du testicule, ou un meilleur enregistrement car il n’existe pas d’effet période.
 ). Ce phénomène, également observable dans de nombreux pays européens (Danemark, Suède, Finlande...) ne peut s’expliquer par une meilleure détection des cancers du testicule, ou un meilleur enregistrement car il n’existe pas d’effet période.
). Ce phénomène, également observable dans de nombreux pays européens (Danemark, Suède, Finlande...) ne peut s’expliquer par une meilleure détection des cancers du testicule, ou un meilleur enregistrement car il n’existe pas d’effet période.Cet « effet de cohorte de naissance » souligne un effet générationnel, c’est-à-dire un changement temporel dans les expositions qui pourraient être à l’origine de la maladie. Etant donné que le pic d’incidence du cancer du testicule survient entre les 20-35 ans, et en considérant qu’il est probable que le cancer du testicule est souvent précédé d’un carcinome in situ, qui lui-même aurait son origine dès la vie utérine, il est raisonnable de supposer que ces changements se sont produits au cours de deux fenêtres d’expositions clés : in utero et durant la puberté.
Causes possibles des tendances de l’incidence du cancer du testicule
L’augmentation de l’incidence ne peut être due à des évolutions démographiques (il s’agit d’un cancer de l’homme jeune, et les évolutions sont standardisées en supposant que la structure d’âge de la population ne varie pas) ; elle ne peut non plus être due à des modifications des pratiques de dépistage car il n’existe pas de campagne ou de pratique de dépistage de ce cancer, et les jeunes adultes ne subissent d’examen du testicule qu’en cas de symptômes. Une piste purement génétique semble elle aussi peu probable (malgré l’existence d’un lien dans certaines études entre cancer dans la famille et cancer du testicule) en raison de la rapidité des évolutions temporelles (doublement du risque de développer la maladie entre les hommes nés en France à la fin des années 1930 et ceux nés au début des années 1970 (Slama et coll., 2004 ). Pour ces raisons, l’exposition à des facteurs environnementaux à l’âge adulte, dans l’enfance ou la vie intra-utérine, est soupçonnée par défaut comme pouvant expliquer ces tendances temporelles en totalité ou partie.
). Pour ces raisons, l’exposition à des facteurs environnementaux à l’âge adulte, dans l’enfance ou la vie intra-utérine, est soupçonnée par défaut comme pouvant expliquer ces tendances temporelles en totalité ou partie.
 ). Pour ces raisons, l’exposition à des facteurs environnementaux à l’âge adulte, dans l’enfance ou la vie intra-utérine, est soupçonnée par défaut comme pouvant expliquer ces tendances temporelles en totalité ou partie.
). Pour ces raisons, l’exposition à des facteurs environnementaux à l’âge adulte, dans l’enfance ou la vie intra-utérine, est soupçonnée par défaut comme pouvant expliquer ces tendances temporelles en totalité ou partie.Des études réalisées en milieu professionnel n’ont pas permis, à ce jour, d’identifier des facteurs de risque patents parmi les expositions subies à l’âge adulte (Inserm, 2008 ). Très peu d’études ont été réalisées sur les expositions durant la période fœtale chez l’homme (Hardell et coll., 2003
). Très peu d’études ont été réalisées sur les expositions durant la période fœtale chez l’homme (Hardell et coll., 2003 ).
).
 ). Très peu d’études ont été réalisées sur les expositions durant la période fœtale chez l’homme (Hardell et coll., 2003
). Très peu d’études ont été réalisées sur les expositions durant la période fœtale chez l’homme (Hardell et coll., 2003 ).
).Cependant, l’analyse de la littérature montre que les divers facteurs d’expositions professionnelles, même s’ils peuvent jouer un rôle dans la survenue du cancer du testicule, ne peuvent aucunement expliquer l’augmentation récente et majeure de l’incidence. Si plusieurs hypothèses peuvent être évoquées (modifications de l’alimentation, du mode de vie...), le seul élément tangible et bien documenté à notre disposition reste la relation forte qui existe entre cryptorchidie et cancer du testicule (Mieusset, 1994 ; Mc Glynn, 2001
; Mc Glynn, 2001 ; Cook et coll., 2010
; Cook et coll., 2010 ).
).
 ; Mc Glynn, 2001
; Mc Glynn, 2001 ; Cook et coll., 2010
; Cook et coll., 2010 ).
).De nombreuses études internationales montrent que cette pathologie malformative est en augmentation suivant en cela une courbe d’incidence assez parallèle à celle du cancer du testicule. La cryptorchidie pourrait contribuer à expliquer une partie des nouveaux cas de cancer du testicule.
Cette hypothèse étiopathogénique amène à concevoir des études plus « en amont » sur le suivi de l’incidence de la cryptorchidie et aussi sur l’identification des facteurs de risque de survenue de cette pathologie malformative. La cryptorchidie est un modèle intéressant dans la mesure où la survenue de l’événement « présence d’une cryptorchidie à la naissance » est très vraisemblablement liée à une modification/perturbation dans la mise en place des divers éléments constitutifs de l’appareil reproductif masculin.
De plus, dans un contexte d’inter-relations probables entre environnements (personnel, domestique ou professionnel) et déroulement de la grossesse, l’identification et la mesure des diverses expositions per-gravidiques (survenues au cours des 9 mois de gestation) pourraient/devraient constituer un champ de recherche pour la cryptorchidie et le cancer du testicule.
Le cancer du testicule, premier cancer de l’homme jeune avec des conséquences majeures en termes de morbidité (infertilité, impact psychologique), constitue un problème émergent de santé publique et un axe de recherche majeur en santé de la reproduction.
Cancer de la prostate
Le cancer de la prostate touche l’homme de plus de 50 ans. C’est le premier cancer urologique et également le premier cancer chez l’homme en termes d’incidence devant le cancer du poumon dans les pays développés. Il s’agit presque toujours d’un adénocarcinome développé aux dépens des acini. Les autres formes sont rares, de l’ordre de 3 % (Mostofi et coll., 1993 ).
).
 ).
).De multiples altérations sont responsables d’un dérèglement progressif des fonctions cellulaires corrélées au stade, au grade et à l’évolution tumorale. L’expression des gènes androgénodépendants est modifiée.
Incidence dans le monde
Les variations géographiques de l’incidence du cancer de la prostate sont à la fois liées à l’origine ethnique des populations et au niveau économique des pays, qui joue lui-même par plusieurs voies. L’élévation du niveau de vie est associée : à des changements des habitudes de vie qui sont probablement des facteurs de risque (alimentation, exercice physique), à l’allongement de la durée de vie, et surtout à une évolution des moyens diagnostiques qui favorise la mise en évidence de cancers de la prostate de petite taille. On retrouve donc des taux élevés dans les pays développés. À niveau de vie égal, les populations noires d’origine africaine semblent avoir un risque très élevé, les asiatiques un risque faible. En Amérique du Nord, les valeurs moyennes des taux standardisés sont autour de 180/100 000 dans les populations noires et 100/100 000 dans les populations blanches. En Australie, les valeurs moyennes sont autour de 90/100 000. En Europe, les valeurs vont de 100/100 000 dans certaines régions d’Autriche, notamment le Tyrol, à 20/100 000 dans le sud et dans l’est. En Europe du Nord, les taux sont généralement élevés (autour de 75/100 000), mais le Danemark fait exception avec une incidence faible (40/100 000). C’est en Asie que les taux sont les plus bas (valeurs moyennes autour de 15/100 000) (Curado et coll., 2007 ).
).
 ).
).Incidence en France
Avec un peu plus de 40 000 nouveaux cas estimés en 2000, le cancer de la prostate par sa fréquence se situe maintenant au 2e rang de l’ensemble des cancers et au 1er rang pour l’homme chez lequel il représente 25 % de l’ensemble des nouveaux cas (Remontet et coll., 2003a et b
et b ). Le taux d’incidence standardisé sur la population mondiale est de 75,3 pour 100 000 en 2000 et est estimé à 121,2/100 000 en 2005.
). Le taux d’incidence standardisé sur la population mondiale est de 75,3 pour 100 000 en 2000 et est estimé à 121,2/100 000 en 2005.
 et b
et b ). Le taux d’incidence standardisé sur la population mondiale est de 75,3 pour 100 000 en 2000 et est estimé à 121,2/100 000 en 2005.
). Le taux d’incidence standardisé sur la population mondiale est de 75,3 pour 100 000 en 2000 et est estimé à 121,2/100 000 en 2005.Les estimations les plus récentes publiées par l’InVS sont des projections pour 2010, calculées à partir des données de 2005 et qui font l’hypothèse d’une stabilisation voire d’une inversion de l’évolution entre 2005 et 2010. Le taux d’incidence en 2010 est estimé à 128,8 cas pour 100 000 personnes-années (soit 71 577 nouveaux cas)5
.
L’incidence augmente très rapidement avec l’âge, pour les sujets âgés de 75 ans et plus en 2000, l’incidence dépasse 1 000 pour 100 000. Sur la courbe transversale des taux calculés pour l’année 2000, on observe une légère diminution de l’incidence chez les sujets de plus de 80 ans, correspondant probablement au plus faible risque des sujets appartenant aux cohortes les plus anciennes (Remontet et coll., 2003a et b
et b ).
).
 et b
et b ).
).L’incidence du cancer de la prostate en Guadeloupe, et en Martinique (Registre du cancer de Martinique), est plus élevée qu’en France métropolitaine (Mallik et coll., 2005 ). En effet, la Guadeloupe a une incidence de cancer de la prostate de 168,7 pour 100 000 en 2003 (taux standardisé sur la population mondiale) et la Martinique de 155 pour 100 000 sur la période 1998-20026
. Ces chiffres se situent à des niveaux légèrement inférieurs à ceux observés chez les noirs américains (179 pour 100 000 sur la même période dans les 14 registres du SEER Program) (Curado et coll., 2007
). En effet, la Guadeloupe a une incidence de cancer de la prostate de 168,7 pour 100 000 en 2003 (taux standardisé sur la population mondiale) et la Martinique de 155 pour 100 000 sur la période 1998-20026
. Ces chiffres se situent à des niveaux légèrement inférieurs à ceux observés chez les noirs américains (179 pour 100 000 sur la même période dans les 14 registres du SEER Program) (Curado et coll., 2007 ).
).
 ). En effet, la Guadeloupe a une incidence de cancer de la prostate de 168,7 pour 100 000 en 2003 (taux standardisé sur la population mondiale) et la Martinique de 155 pour 100 000 sur la période 1998-20026
. Ces chiffres se situent à des niveaux légèrement inférieurs à ceux observés chez les noirs américains (179 pour 100 000 sur la même période dans les 14 registres du SEER Program) (Curado et coll., 2007
). En effet, la Guadeloupe a une incidence de cancer de la prostate de 168,7 pour 100 000 en 2003 (taux standardisé sur la population mondiale) et la Martinique de 155 pour 100 000 sur la période 1998-20026
. Ces chiffres se situent à des niveaux légèrement inférieurs à ceux observés chez les noirs américains (179 pour 100 000 sur la même période dans les 14 registres du SEER Program) (Curado et coll., 2007 ).
).Tendances de l’incidence dans le monde
L’évolution de l’incidence du cancer de la prostate est indissociable de l’évolution des techniques diagnostiques et en particulier de la diffusion du dosage de l’antigène prostatique spécifique (PSA). La politique adoptée par un pays vis-à-vis de l’utilisation du PSA et plus généralement par rapport à la prise en charge des cancers prostatiques, retentit directement sur le taux d’incidence de ces cancers. La stratégie très attentiste adoptée par les médecins danois explique la faible incidence observée dans ce pays. Les cas diagnostiqués y sont probablement plus évolués car c’est le pays où l’on observe la survie la plus faible d’Europe de l’Ouest (Post et coll., 1998 ). Aux États-Unis où le dépistage est recommandé, les résultats du SEER Program7 montrent une augmentation majeure de l’incidence entre 1986 et 1992 (Ries et coll., 2007
). Aux États-Unis où le dépistage est recommandé, les résultats du SEER Program7 montrent une augmentation majeure de l’incidence entre 1986 et 1992 (Ries et coll., 2007 ). Cette augmentation s’observe dans toutes les tranches d’âges. Après 1992, l’incidence a chuté brusquement, de façon très nette chez les plus de 75 ans, moins fortement dans la tranche d’âge 65-74 ans et assez peu chez les moins de 65 ans. La même observation est faite au Canada (Meyer et coll., 1999
). Cette augmentation s’observe dans toutes les tranches d’âges. Après 1992, l’incidence a chuté brusquement, de façon très nette chez les plus de 75 ans, moins fortement dans la tranche d’âge 65-74 ans et assez peu chez les moins de 65 ans. La même observation est faite au Canada (Meyer et coll., 1999 ).
).
 ). Aux États-Unis où le dépistage est recommandé, les résultats du SEER Program7 montrent une augmentation majeure de l’incidence entre 1986 et 1992 (Ries et coll., 2007
). Aux États-Unis où le dépistage est recommandé, les résultats du SEER Program7 montrent une augmentation majeure de l’incidence entre 1986 et 1992 (Ries et coll., 2007 ). Cette augmentation s’observe dans toutes les tranches d’âges. Après 1992, l’incidence a chuté brusquement, de façon très nette chez les plus de 75 ans, moins fortement dans la tranche d’âge 65-74 ans et assez peu chez les moins de 65 ans. La même observation est faite au Canada (Meyer et coll., 1999
). Cette augmentation s’observe dans toutes les tranches d’âges. Après 1992, l’incidence a chuté brusquement, de façon très nette chez les plus de 75 ans, moins fortement dans la tranche d’âge 65-74 ans et assez peu chez les moins de 65 ans. La même observation est faite au Canada (Meyer et coll., 1999 ).
).Tendances de l’incidence en France
Pour la France, on observe également une très forte augmentation mais on ne voit pas apparaître de diminution jusqu’en 2004. L’incidence a très fortement augmenté au cours des deux dernières décennies (figure 5.3 ). Entre 1975 et 2000, l’augmentation annuelle moyenne du taux est de 5,33 % par an. Le nombre de nouveaux cas diagnostiqués était de 10 856 en 1980, atteignait 40 300 en 2000 et d’après les dernières estimations, 71 577 en 2010.
). Entre 1975 et 2000, l’augmentation annuelle moyenne du taux est de 5,33 % par an. Le nombre de nouveaux cas diagnostiqués était de 10 856 en 1980, atteignait 40 300 en 2000 et d’après les dernières estimations, 71 577 en 2010.
 ). Entre 1975 et 2000, l’augmentation annuelle moyenne du taux est de 5,33 % par an. Le nombre de nouveaux cas diagnostiqués était de 10 856 en 1980, atteignait 40 300 en 2000 et d’après les dernières estimations, 71 577 en 2010.
). Entre 1975 et 2000, l’augmentation annuelle moyenne du taux est de 5,33 % par an. Le nombre de nouveaux cas diagnostiqués était de 10 856 en 1980, atteignait 40 300 en 2000 et d’après les dernières estimations, 71 577 en 2010.Il est peu raisonnable d’imaginer que l’augmentation de l’incidence de ces vingt dernières années puisse se poursuivre au même rythme car l’effet de la mise en place du dépistage par le PSA devrait s’atténuer. Il semble au vu des observations faites sur les données d’ALD fournies par les caisses d’assurance maladie que le décrochage ait lieu vers 2005. Une stabilisation voire une inversion de l’évolution entre 2005 et 2010 a été retenue pour réaliser les projections 2010. Pour la mortalité, la baisse récente, confirmée dans de très nombreux pays, a été prise en considération pour les projections (figure 5.3 , Hospices civils de Lyon et coll., 2010
, Hospices civils de Lyon et coll., 2010 ).
).
 , Hospices civils de Lyon et coll., 2010
, Hospices civils de Lyon et coll., 2010 ).
). | Figure 5.3 Évolution de l’incidence (taux standardisés monde) et de la mortalité du cancer de la prostate chez l’homme de 1990 à 2010 en France (d’après Hospices civils de Lyon et coll., 2010 ) ) |
L’augmentation d’incidence du cancer de la prostate est multifactorielle, en lien probable avec l’âge, l’ethnie et l’alimentation. Le lien avec les expositions professionnelles est difficile à mettre en évidence car il est nécessaire de tenir compte du produit, mais également de la dose utilisée et du temps d’exposition, données de recueil très aléatoire. Des études montrent en Guadeloupe, un risque augmenté de cancer de la prostate en lien avec l’exposition à la chlordécone (Multigner et coll., 2010 ).
).
 ).
).Cancer du sein
Le cancer du sein est le plus fréquent des cancers chez la femme au niveau mondial, dans les pays d’Europe occidentale et d’Amérique du Nord (Parkin et coll., 2002 ), ainsi qu’au Japon depuis peu (Minami et coll., 2004
), ainsi qu’au Japon depuis peu (Minami et coll., 2004 ). En France, le taux d’incidence de cancer du sein standardisé sur la structure d’âge mondiale est le plus élevé d’Europe. Ce nombre a doublé en 20 ans, partant de 21 000 nouveaux cas en 1980 (Remontet et coll., 2003
). En France, le taux d’incidence de cancer du sein standardisé sur la structure d’âge mondiale est le plus élevé d’Europe. Ce nombre a doublé en 20 ans, partant de 21 000 nouveaux cas en 1980 (Remontet et coll., 2003 et b
et b ). Comparativement, le cancer du sein chez l’homme est extrêmement rare.
). Comparativement, le cancer du sein chez l’homme est extrêmement rare.
 ), ainsi qu’au Japon depuis peu (Minami et coll., 2004
), ainsi qu’au Japon depuis peu (Minami et coll., 2004 ). En France, le taux d’incidence de cancer du sein standardisé sur la structure d’âge mondiale est le plus élevé d’Europe. Ce nombre a doublé en 20 ans, partant de 21 000 nouveaux cas en 1980 (Remontet et coll., 2003
). En France, le taux d’incidence de cancer du sein standardisé sur la structure d’âge mondiale est le plus élevé d’Europe. Ce nombre a doublé en 20 ans, partant de 21 000 nouveaux cas en 1980 (Remontet et coll., 2003 et b
et b ). Comparativement, le cancer du sein chez l’homme est extrêmement rare.
). Comparativement, le cancer du sein chez l’homme est extrêmement rare.Le taux d’incidence standardisé sur l’âge est passé de 56,8 à 101,5 pour 100 000 femmes. Si l’augmentation observée au cours des dernières décennies peut être en partie attribuée au développement du dépistage dans les pays industrialisés, la part liée à chacun des facteurs de risque connus ou suspectés est mal définie.
Classiquement on distingue les cancers in situ et les cancers infiltrants. Les cancers in situ correspondent à une prolifération de cellules malignes sans rupture de la membrane basale, donc ne comportant pas de risque théorique d’envahissement ganglionnaire. Les carcinomes canalaires in situ sont les plus fréquents, représentant 15 à 20 % des cancers du sein. Dans les carcinomes infiltrants, la prolifération tumorale dépasse la membrane basale et envahit le conjonctif palléal. La grande majorité des cancers infiltrants sont de type canalaire. Plus récemment, l’utilisation de techniques génomiques à haut débit comme les puces à ADN a permis d’ajouter une caractérisation moléculaire et de confirmer à ce niveau l’hétérogénéité de la maladie. Cinq sous-types majeurs exclusifs de cancers du sein ont été identifiés sur la base de l’expression transcriptionnelle d’environ 500 gènes : luminal A, luminal B, basal, ERBB2 et normal. Elle permet de dégager des groupes de pronostic différent. Les avancées moléculaires et cellulaires, conjointes et cohérentes, font progresser notre connaissance de l’oncogenèse mammaire.
Incidence dans le monde
L’incidence du cancer du sein augmente régulièrement. Le nombre de nouveaux cancers du sein diagnostiqués en 2000 était estimé à plus d’un million, représentant 22 % des cancers de la femme (Parkin et coll., 2001 ; Althuis et coll., 2005
; Althuis et coll., 2005 ). L’incidence de ce cancer varie fortement selon les régions du monde avec un rapport de 1 à 5 entre les pays industrialisés à forte incidence et les pays en voie de développement à faible incidence. Le Centre international de recherche sur le cancer dispose des données d’incidence observée des cancers sur la période 1993-1997 (Parkin et coll., 2002
). L’incidence de ce cancer varie fortement selon les régions du monde avec un rapport de 1 à 5 entre les pays industrialisés à forte incidence et les pays en voie de développement à faible incidence. Le Centre international de recherche sur le cancer dispose des données d’incidence observée des cancers sur la période 1993-1997 (Parkin et coll., 2002 ). Les taux d’incidence les plus élevés sont observés aux États-Unis avec 100 cas pour 100 000 femmes, et en Europe de l’Ouest et du Nord. Les taux sont intermédiaires en Europe de l’Est, dans certains pays d’Europe du Sud comme l’Espagne et en Amérique du Sud. Les taux les plus bas se situent en Afrique et en Asie (ils peuvent être inférieurs à 20 pour 100 000) y compris au Japon, pays industrialisé.
). Les taux d’incidence les plus élevés sont observés aux États-Unis avec 100 cas pour 100 000 femmes, et en Europe de l’Ouest et du Nord. Les taux sont intermédiaires en Europe de l’Est, dans certains pays d’Europe du Sud comme l’Espagne et en Amérique du Sud. Les taux les plus bas se situent en Afrique et en Asie (ils peuvent être inférieurs à 20 pour 100 000) y compris au Japon, pays industrialisé.
 ; Althuis et coll., 2005
; Althuis et coll., 2005 ). L’incidence de ce cancer varie fortement selon les régions du monde avec un rapport de 1 à 5 entre les pays industrialisés à forte incidence et les pays en voie de développement à faible incidence. Le Centre international de recherche sur le cancer dispose des données d’incidence observée des cancers sur la période 1993-1997 (Parkin et coll., 2002
). L’incidence de ce cancer varie fortement selon les régions du monde avec un rapport de 1 à 5 entre les pays industrialisés à forte incidence et les pays en voie de développement à faible incidence. Le Centre international de recherche sur le cancer dispose des données d’incidence observée des cancers sur la période 1993-1997 (Parkin et coll., 2002 ). Les taux d’incidence les plus élevés sont observés aux États-Unis avec 100 cas pour 100 000 femmes, et en Europe de l’Ouest et du Nord. Les taux sont intermédiaires en Europe de l’Est, dans certains pays d’Europe du Sud comme l’Espagne et en Amérique du Sud. Les taux les plus bas se situent en Afrique et en Asie (ils peuvent être inférieurs à 20 pour 100 000) y compris au Japon, pays industrialisé.
). Les taux d’incidence les plus élevés sont observés aux États-Unis avec 100 cas pour 100 000 femmes, et en Europe de l’Ouest et du Nord. Les taux sont intermédiaires en Europe de l’Est, dans certains pays d’Europe du Sud comme l’Espagne et en Amérique du Sud. Les taux les plus bas se situent en Afrique et en Asie (ils peuvent être inférieurs à 20 pour 100 000) y compris au Japon, pays industrialisé.Les taux d’incidence, entre 60 et 80/100 000 parmi les populations asiatique, hispanique et noire aux État-Unis, sont intermédiaires entre l’incidence observée dans la population des femmes blanches, qui présentent souvent des taux supérieurs à 100/100 000, et l’incidence peu élevée observée en Asie ou en Afrique.
Incidence en France
En France, le Réseau français des registres de cancers (Francim) estime à 49 814 le nombre de nouveaux cas diagnostiqués en 2005 (www.invs.fr). Comme au niveau mondial et européen, le cancer du sein se situe au 1er rang de tous les cancers féminins. Le taux d’incidence standardisé de 101,5 pour 100 000 femmes est parmi les plus élevés en Europe. Il représente 36 % de l’ensemble des nouveaux cas de cancers chez la femme en France.
Les estimations les plus récentes sont des projections pour 2010, calculées à partir des données de 2005 (Hospice civils de Lyons et coll., 2010 ). Le taux d’incidence en 2010 est estimé à 100,0 cas pour 100 000 personnes-années (52 588 nouveaux cas)8
.
). Le taux d’incidence en 2010 est estimé à 100,0 cas pour 100 000 personnes-années (52 588 nouveaux cas)8
.
 ). Le taux d’incidence en 2010 est estimé à 100,0 cas pour 100 000 personnes-années (52 588 nouveaux cas)8
.
). Le taux d’incidence en 2010 est estimé à 100,0 cas pour 100 000 personnes-années (52 588 nouveaux cas)8
.La forme de la courbe d’incidence du cancer du sein en fonction de l’âge diffère selon les populations et au cours du temps. Dans la plupart des populations occidentales, l’incidence augmente fortement avec l’âge jusqu’à la survenue de la ménopause qui est alors suivie d’une augmentation de moindre pente (Henderson et coll., 1996 ). La courbe d’incidence en France pour une même cohorte de naissance (1928) est conforme à cette description. En transversal, c’est-à-dire pour toutes les cohortes de naissance observées à une date donnée (2000), un pic d’incidence est observé entre 60 et 69 ans, suivi d’une diminution du taux d’incidence. Cette diminution résulte d’un risque moindre de cancer du sein dans les cohortes de naissance les plus anciennes.
). La courbe d’incidence en France pour une même cohorte de naissance (1928) est conforme à cette description. En transversal, c’est-à-dire pour toutes les cohortes de naissance observées à une date donnée (2000), un pic d’incidence est observé entre 60 et 69 ans, suivi d’une diminution du taux d’incidence. Cette diminution résulte d’un risque moindre de cancer du sein dans les cohortes de naissance les plus anciennes.
 ). La courbe d’incidence en France pour une même cohorte de naissance (1928) est conforme à cette description. En transversal, c’est-à-dire pour toutes les cohortes de naissance observées à une date donnée (2000), un pic d’incidence est observé entre 60 et 69 ans, suivi d’une diminution du taux d’incidence. Cette diminution résulte d’un risque moindre de cancer du sein dans les cohortes de naissance les plus anciennes.
). La courbe d’incidence en France pour une même cohorte de naissance (1928) est conforme à cette description. En transversal, c’est-à-dire pour toutes les cohortes de naissance observées à une date donnée (2000), un pic d’incidence est observé entre 60 et 69 ans, suivi d’une diminution du taux d’incidence. Cette diminution résulte d’un risque moindre de cancer du sein dans les cohortes de naissance les plus anciennes.Ces chiffres d’incidence n’incluent pas les cancers in situ qui peuvent représenter entre 5 et 15 % de l’ensemble des cancers du sein selon les départements en France.
Le carcinome canalaire représente la grande majorité (85 %) des formes histologiques du cancer du sein en France.
Évolution de l’incidence dans le monde
L’incidence a augmenté régulièrement dans la plupart des régions du monde (Bray et coll., 2004). L’évolution de l’incidence en fonction de l’âge est complexe à décrire.
La hausse, en moyenne de 20 à 40 % entre 1973-1977 et 1993-1997, a été plus marquée notamment dans les pays avec un taux d’incidence initial plus bas comme au Japon, en Finlande ou dans les pays en voie de développement (Althuis et coll., 2005 ). En Europe, tous les pays ont présenté une augmentation d’incidence, les taux moyens de variation étaient compris entre 1,2 % par an en Suisse et 3 % en République Tchèque sur la période 1985-1997 (Botha et coll., 2003
). En Europe, tous les pays ont présenté une augmentation d’incidence, les taux moyens de variation étaient compris entre 1,2 % par an en Suisse et 3 % en République Tchèque sur la période 1985-1997 (Botha et coll., 2003 ). Les taux d’évolution étaient plus élevés dans la tranche d’âge des femmes soumises à un dépistage. Un fait récent marquant est l’inversion de tendance aux États-Unis, où une diminution de l’incidence est observée depuis le début des années 2000 parmi les femmes de plus de 45-50 ans (Jemal et coll., 2007
). Les taux d’évolution étaient plus élevés dans la tranche d’âge des femmes soumises à un dépistage. Un fait récent marquant est l’inversion de tendance aux États-Unis, où une diminution de l’incidence est observée depuis le début des années 2000 parmi les femmes de plus de 45-50 ans (Jemal et coll., 2007 ; Ravdin et coll., 2007
; Ravdin et coll., 2007 ; Ries et coll., 2007
; Ries et coll., 2007 ).
).
 ). En Europe, tous les pays ont présenté une augmentation d’incidence, les taux moyens de variation étaient compris entre 1,2 % par an en Suisse et 3 % en République Tchèque sur la période 1985-1997 (Botha et coll., 2003
). En Europe, tous les pays ont présenté une augmentation d’incidence, les taux moyens de variation étaient compris entre 1,2 % par an en Suisse et 3 % en République Tchèque sur la période 1985-1997 (Botha et coll., 2003 ). Les taux d’évolution étaient plus élevés dans la tranche d’âge des femmes soumises à un dépistage. Un fait récent marquant est l’inversion de tendance aux États-Unis, où une diminution de l’incidence est observée depuis le début des années 2000 parmi les femmes de plus de 45-50 ans (Jemal et coll., 2007
). Les taux d’évolution étaient plus élevés dans la tranche d’âge des femmes soumises à un dépistage. Un fait récent marquant est l’inversion de tendance aux États-Unis, où une diminution de l’incidence est observée depuis le début des années 2000 parmi les femmes de plus de 45-50 ans (Jemal et coll., 2007 ; Ravdin et coll., 2007
; Ravdin et coll., 2007 ; Ries et coll., 2007
; Ries et coll., 2007 ).
).L’évolution de l’incidence en fonction de l’âge dépend simultanément de l’effet de la cohorte de naissance, lié aux évolutions du mode de vie des femmes, et de l’effet de la période, lié notamment aux modifications des modalités de découverte des cancers. Un effet cohorte est mis en évidence systématiquement mais à des périodes différentes selon les pays (Estève, 2007 ). Après une hausse importante, une diminution du risque de développer un cancer du sein s’est manifestée dans certains pays (État-Unis, Canada, Écosse) pour les femmes nées après 1945 (Tarone, 2006
). Après une hausse importante, une diminution du risque de développer un cancer du sein s’est manifestée dans certains pays (État-Unis, Canada, Écosse) pour les femmes nées après 1945 (Tarone, 2006 ). Les effets périodes se présentent sous différentes formes : des ruptures de tendance ont été observées, notamment aux États-Unis avec une hausse importante de l’incidence chez les femmes de plus de 45 ans entre 1980 et 2000 en relation avec des changements rapides de pratiques. Au contraire, d’autres pays comme la France connaissaient un effet période plus régulier sans doute lié au développement progressif des pratiques de dépistage individuel et organisé.
). Les effets périodes se présentent sous différentes formes : des ruptures de tendance ont été observées, notamment aux États-Unis avec une hausse importante de l’incidence chez les femmes de plus de 45 ans entre 1980 et 2000 en relation avec des changements rapides de pratiques. Au contraire, d’autres pays comme la France connaissaient un effet période plus régulier sans doute lié au développement progressif des pratiques de dépistage individuel et organisé.
 ). Après une hausse importante, une diminution du risque de développer un cancer du sein s’est manifestée dans certains pays (État-Unis, Canada, Écosse) pour les femmes nées après 1945 (Tarone, 2006
). Après une hausse importante, une diminution du risque de développer un cancer du sein s’est manifestée dans certains pays (État-Unis, Canada, Écosse) pour les femmes nées après 1945 (Tarone, 2006 ). Les effets périodes se présentent sous différentes formes : des ruptures de tendance ont été observées, notamment aux États-Unis avec une hausse importante de l’incidence chez les femmes de plus de 45 ans entre 1980 et 2000 en relation avec des changements rapides de pratiques. Au contraire, d’autres pays comme la France connaissaient un effet période plus régulier sans doute lié au développement progressif des pratiques de dépistage individuel et organisé.
). Les effets périodes se présentent sous différentes formes : des ruptures de tendance ont été observées, notamment aux États-Unis avec une hausse importante de l’incidence chez les femmes de plus de 45 ans entre 1980 et 2000 en relation avec des changements rapides de pratiques. Au contraire, d’autres pays comme la France connaissaient un effet période plus régulier sans doute lié au développement progressif des pratiques de dépistage individuel et organisé.Il est donc difficile de distinguer les effets combinés des multiples facteurs susceptibles d’intervenir dans l’évolution de l’incidence du cancer du sein. Schématiquement, l’augmentation observée au cours des dernières décennies est en grande partie attribuée au développement du dépistage dans les pays industrialisés. Cependant, la part liée à l’augmentation des facteurs de risque est encore mal connue.
Évolution de l’incidence en France
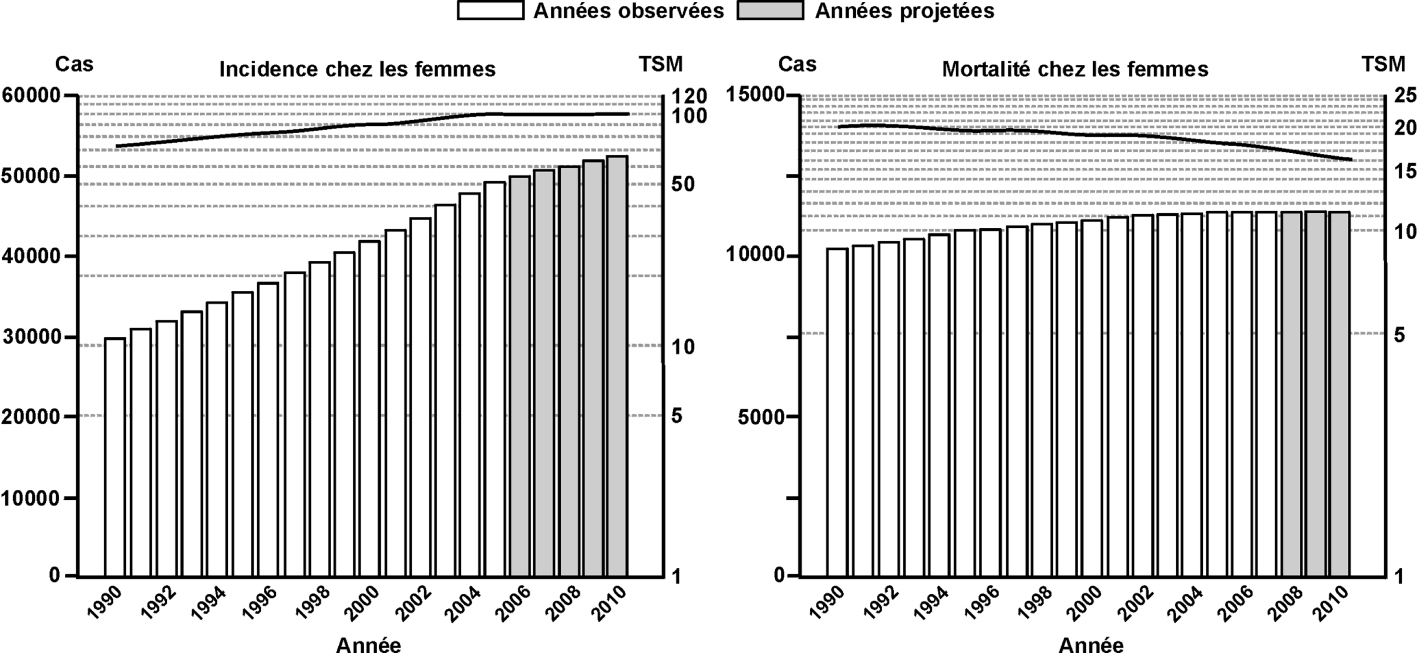
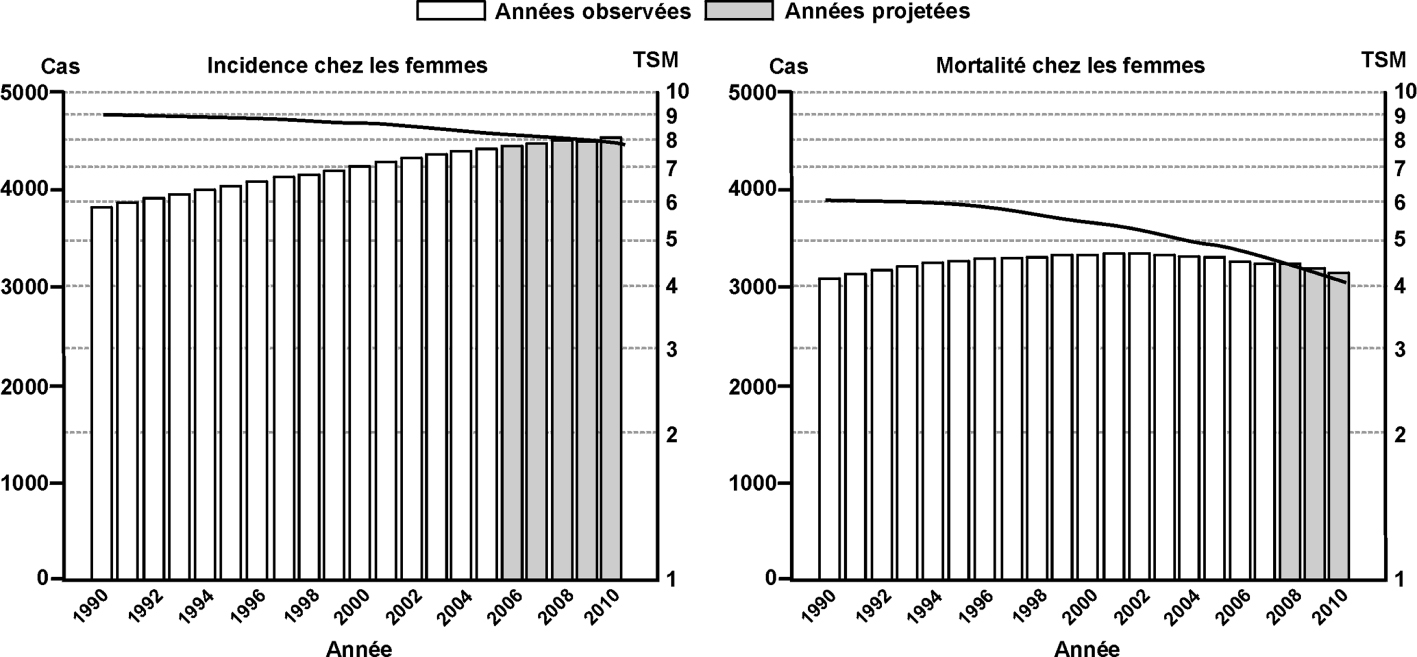
L’incidence du cancer du sein est en hausse constante depuis 25 ans : le nombre de nouveaux cas a plus que doublé passant de 21 704 à 49 814 entre 1989 et 2005 et le taux d’incidence standardisé, éliminant l’effet de l’âge, a presque doublé sur cette période passant de 56,8 à 101,5 pour 100 000 femmes. D’après les dernières estimations (pour 2010), le taux d’incidence serait de 100,0 pour 100 000 (figure 5.4 ).
).
 ).
).Il semble qu’une diminution de l’incidence du cancer du sein s’amorce après 2004, décrite en France à partir des données de mise en affection longue durée (Allemand et coll., 2008). La cause de cette évolution pourrait être une diminution massive de la prescription des traitements hormonaux substitutifs (THS) de la ménopause. Compte tenu de ces éléments, l’hypothèse retenue pour réaliser les projections 2010 est un ralentissement de la croissance de l’incidence (figure 5.4 , Hospice civils de Lyon et coll., 2010
, Hospice civils de Lyon et coll., 2010 ).
).
 , Hospice civils de Lyon et coll., 2010
, Hospice civils de Lyon et coll., 2010 ).
).Un travail complémentaire de Francim (Colonna et coll., 2008 ) a permis de montrer que l’augmentation concerne toutes les tranches d’âge mais qu’elle est plus marquée chez les femmes de 50 à 75 ans. Cette tranche d’âge représente les femmes chez lesquelles le pic d’incidence des cancers du sein est observé mais également les femmes pour lesquelles un dépistage mammographique systématique est préconisé.
) a permis de montrer que l’augmentation concerne toutes les tranches d’âge mais qu’elle est plus marquée chez les femmes de 50 à 75 ans. Cette tranche d’âge représente les femmes chez lesquelles le pic d’incidence des cancers du sein est observé mais également les femmes pour lesquelles un dépistage mammographique systématique est préconisé.
 ) a permis de montrer que l’augmentation concerne toutes les tranches d’âge mais qu’elle est plus marquée chez les femmes de 50 à 75 ans. Cette tranche d’âge représente les femmes chez lesquelles le pic d’incidence des cancers du sein est observé mais également les femmes pour lesquelles un dépistage mammographique systématique est préconisé.
) a permis de montrer que l’augmentation concerne toutes les tranches d’âge mais qu’elle est plus marquée chez les femmes de 50 à 75 ans. Cette tranche d’âge représente les femmes chez lesquelles le pic d’incidence des cancers du sein est observé mais également les femmes pour lesquelles un dépistage mammographique systématique est préconisé. | Figure 5.4 Évolution de l’incidence (taux standardisés monde) et de la mortalité du cancer du sein chez la femme de 1990 à 2010 en France (d’après Hospices civils de Lyon et coll., 2010 ) ) |
Le risque de développer un cancer du sein avant 75 ans a considérablement augmenté de 4,9 % pour les femmes nées en 1910 à 12,1 % pour les femmes nées en 1950. Cependant, après une augmentation particulièrement marquée de ce risque pour les femmes nées entre 1925 et 1945, on observe un infléchissement de l’augmentation pour la génération des femmes nées après 1945. Ce ralentissement observé chez les femmes des générations les plus récentes pourrait annoncer un infléchissement de l’augmentation de l’incidence, comme le laisse également présager le taux d’évolution plus faible entre 2000 et 2005.
Les mutations sur les gènes BCRA1 et BRCA2, qui entraînent des risques extrêmement élevés de cancer du sein, sont rares et ne permettent d’expliquer qu’une faible proportion des cancers du sein d’origine familiale. Certains polymorphismes génétiques (appelés SNP pour Single Nucleotide Polymorphism) sont à l’inverse relativement fréquents dans la population (>1 %) et pourraient être associés à un risque accru de cancer. Toutefois, le risque de cancer du sein associé à chacun de ces SNP, s’il existe, est faible, et leur rôle est difficile à mettre en évidence lorsqu’ils sont étudiés séparément.
Les principales causes environnementales suspectées dans le cancer du sein chez la femme incluent les composés chimiques ayant des effets œstrogéno-mimétiques connus sous le nom de perturbateurs endocriniens ou xéno-œstrogènes (pesticides organochlorés, PCB, dioxines...), différents composés chimiques reconnus comme des cancérogènes mammaires chez l’animal, ou certains agents physiques. Cependant, les données épidémiologiques actuelles sur les perturbateurs endocriniens d’origine environnementale sont insuffisantes pour permettre une conclusion (Inserm, 2008 ).
).
 ).
).L’insuffisance des méthodes d’évaluation des expositions aux facteurs environnementaux constitue un problème majeur pour l’interprétation des résultats, notamment lorsque ceux-ci sont négatifs, car les erreurs de classement non différentiels (c’est-à-dire celles affectant de la même manière les cas et les témoins) sont vraisemblablement à l’origine d’un biais tendant généralement à ramener l’estimation du risque relatif vers l’unité (absence d’effet apparent). Les mesures d’exposition effectuées à des périodes non pertinentes sur le plan étiologique, constituent l’une des difficultés majeures pour la recherche des facteurs de risque des cancers du sein.
Cancer de l’ovaire
Le cancer de l’ovaire est une tumeur maligne qui atteint un ou les deux ovaires. Les tumeurs ovariennes les plus fréquentes sont les tumeurs stromales-épithéliales. Elles proviennent de l’épithélium de surface de l’ovaire ou de ses dérivés. Il existe une forme intermédiaire entre tumeur bénigne et cancer nommée « borderline » représentant 10 à 15 % des tumeurs ovariennes, qui survient à un âge plus précoce que le cancer de l’ovaire. Elle est beaucoup moins agressive et son pronostic est bon, quoique incertain.
La complexité des tumeurs ovariennes tient à la multiplicité des types lésionnels rencontrés, conséquences d’une embryogenèse complexe. Les tumeurs épithéliales sont les plus fréquentes (2/3) des tumeurs ovariennes primitives. Macroscopiquement, il s’agit de tumeurs kystiques et papillaires, volontiers bilatérales. Outre les tumeurs épithéliales, on distingue les tumeurs du mésenchyme et des cordons sexuels et les tumeurs germinales. Les cancers de l’ovaire représentent environ 30 % des cancers du tractus génital féminin (Seidman et Kurman, 2003 ).
).
 ).
).Incidence dans le monde
L’incidence des cancers de l’ovaire varie fortement avec un rapport de 1 à 6 selon les régions du monde. Les taux d’incidence standardisés les plus élevés, souvent supérieurs à 10 pour 100 000 femmes, sont observés en Amérique du Nord, en Europe et en Australie (Parkin et coll., 2002 ).
).
 ).
).Incidence en France
Le réseau français des registres de cancers (Francim) estime à 4 411 le nombre de nouveaux cas diagnostiqués en 2005. Le taux d’incidence standardisé est de 8,2/100 000 personnes années (ce chiffre ne prend pas en compte les tumeurs borderline).
Les estimations les plus récentes (figure 5.5 , Hospice civils de Lyon et coll., 2010
, Hospice civils de Lyon et coll., 2010 ) sont des projections pour 2010, calculées à partir des données de 2005 et qui font l’hypothèse que la tendance récente de diminution se prolonge (les 5 dernières années). Le taux d’incidence en 2010 est estimé à 7,8 cas pour 100 000 personnes-années (4 532 nouveaux cas)9
.
) sont des projections pour 2010, calculées à partir des données de 2005 et qui font l’hypothèse que la tendance récente de diminution se prolonge (les 5 dernières années). Le taux d’incidence en 2010 est estimé à 7,8 cas pour 100 000 personnes-années (4 532 nouveaux cas)9
.
 , Hospice civils de Lyon et coll., 2010
, Hospice civils de Lyon et coll., 2010 ) sont des projections pour 2010, calculées à partir des données de 2005 et qui font l’hypothèse que la tendance récente de diminution se prolonge (les 5 dernières années). Le taux d’incidence en 2010 est estimé à 7,8 cas pour 100 000 personnes-années (4 532 nouveaux cas)9
.
) sont des projections pour 2010, calculées à partir des données de 2005 et qui font l’hypothèse que la tendance récente de diminution se prolonge (les 5 dernières années). Le taux d’incidence en 2010 est estimé à 7,8 cas pour 100 000 personnes-années (4 532 nouveaux cas)9
.Le taux d’incidence augmente régulièrement jusqu’à 75 ans puis décroît lentement après 85 ans. On estime annuellement à 200 les cancers de l’ovaire qui seraient liés à une prédisposition génétique constitutionnelle en France.
Une augmentation d’incidence a été observée jusque dans les années 1980 pour la France. Depuis 1980, l’incidence de ce cancer est en baisse. Le taux d’incidence (standardisé monde) a diminué en moyenne de 0,4 % par an entre 1980 et 2005, avec une baisse plus marquée sur la dernière période (– 0,9 % par an entre 2000 et 2005) (figure 5.5 ).
).
 ).
). | Figure 5.5 Évolution de l’incidence (taux standardisés monde) et de la mortalité du cancer de l’ovaire de 1990 à 2010 en France (d’après Hospices civils de Lyon et coll., 2010 ) ) |
Les facteurs de risque du cancer de l’ovaire sont assez mal connus. Les variations internationales des taux d’incidence de ce cancer indiquent que le mode de vie, ou des facteurs environnementaux jouent un rôle dans l’étiologie de la maladie.
Le risque de cancer de l’ovaire serait plus élevé pour les femmes n’ayant pas eu d’enfant ou qui ont eu leur premier enfant à un âge tardif, pour les femmes ayant une puberté précoce ou une ménopause tardive. À l’inverse, les femmes qui ont utilisé des contraceptifs oraux et les multipares ont un risque réduit de cancer de l’ovaire (Chiaffarino et coll., 2001 ; Tung et coll., 2003
; Tung et coll., 2003 ; Whiteman et coll., 2003
; Whiteman et coll., 2003 ; Rossing et coll., 2004
; Rossing et coll., 2004 ; La Vecchia, 2006
; La Vecchia, 2006 ; Soegaard et coll., 2007
; Soegaard et coll., 2007 ). La forte corpulence augmenterait le risque (Schouten et coll., 2003
). La forte corpulence augmenterait le risque (Schouten et coll., 2003 ; Rossing et coll., 2006
; Rossing et coll., 2006 ) et l’activité physique le diminuerait (Hannan, 2004
) et l’activité physique le diminuerait (Hannan, 2004 ) de même que la consommation de fruits ou de légumes, mais dans ces différentes études, l’effet sur le risque reste à confirmer (Koushik et coll., 2005
) de même que la consommation de fruits ou de légumes, mais dans ces différentes études, l’effet sur le risque reste à confirmer (Koushik et coll., 2005 ).
).
 ; Tung et coll., 2003
; Tung et coll., 2003 ; Whiteman et coll., 2003
; Whiteman et coll., 2003 ; Rossing et coll., 2004
; Rossing et coll., 2004 ; La Vecchia, 2006
; La Vecchia, 2006 ; Soegaard et coll., 2007
; Soegaard et coll., 2007 ). La forte corpulence augmenterait le risque (Schouten et coll., 2003
). La forte corpulence augmenterait le risque (Schouten et coll., 2003 ; Rossing et coll., 2006
; Rossing et coll., 2006 ) et l’activité physique le diminuerait (Hannan, 2004
) et l’activité physique le diminuerait (Hannan, 2004 ) de même que la consommation de fruits ou de légumes, mais dans ces différentes études, l’effet sur le risque reste à confirmer (Koushik et coll., 2005
) de même que la consommation de fruits ou de légumes, mais dans ces différentes études, l’effet sur le risque reste à confirmer (Koushik et coll., 2005 ).
).En dépit d’une abondante littérature, les facteurs de risque professionnels et environnementaux du cancer de l’ovaire ne sont pas clairement établis en raison de l’existence de biais et du manque presque complet de données quantitatives de type exposition-réponse (Inserm, 2008 ).
).
 ).
).La littérature épidémiologique publiée à partir de 1970 fait état de la relation entre risque de cancer de l’ovaire et de nombreuses professions (infirmières, professeurs, employées de nettoyage à sec, femmes du monde agricole, femmes dans l’industrie pharmaceutique, pharmaciennes, serveuses cuisinières...). Les études montrent très peu d’évidence d’excès de risque. Les coiffeuses, esthéticiennes, et les femmes employées dans l’imprimerie, peuvent présenter un excès de risque mais les données sont encore insuffisantes pour conclure de façon ferme. Peu d’agents chimiques ont été étudiés de manière approfondie (Inserm, 2008 ).
).
 ).
).Bibliographie
[1] ALLEMAND H, SERADOUR B, WEILL A, RICORDEAU P. Decline in breast cancer incidence in 2005 and 2006 in France: a paradoxical trend.
Bull Cancer. 2008;
95:11- 15

[2] ALTHUIS MD, DOZIER JM, ANDERSON WF, DEVESA SS, BRINTON LA. Global trends in breast cancer incidence and mortality 1973-1997.
Int J Epidemiology. 2005;
34:405- 412

[3] BELOT A, GROSCLAUDE P, BOSSARD N, JOUGLA E, BENHAMOU E, et coll. Cancer incidence and mortality in France over the period 1980-2005.
Rev Epidemiol Sante Publique. 2008;
5:159- 175

[4] BERGSTRÖM R, ADAMI HO, MÖHNER M, ZATONSKI W, STORM H, et coll. Increase in testicular cancer incidence in six european coutries : a birth cohort phenomenon.
J Natl Cancer Inst. 1996;
88:727- 733

[5] BOTHA JL, BRAY F, SANKILA R, PARKIN DM. Breast cancer incidence and mortality trends in 16 European countries.
Eur J Cancer. 2003;
39:1718- 1729

[6] BRAY F, MCCARRON P, PARKIN DM. The changing global patterns of female breast cancer incidence and mortality.
Breast Cancer Res. 2004;
6:229- 239

[7] BRAY F, RICHIARDI L, EKBOM A, PUKKALA E, CUNINKOVA M, MØLLER H. Trends in testicular cancer incidence and mortality in 22 European countries : continuing increases in incidence and declines in mortality.
Int J Cancer. 2006;
118:3099- 3111

[8] CHIAFFARINO F, PELUCCHI C, PARAZZINI F, NEGRI E, FRANCESCHI S, et coll. Reproductive and hormonal factors and ovarian cancer.
Ann Oncol. 2001;
12:337- 341

[9] COLONNA M, DELAFOSSE P, UHRY Z, PONCET F, ARVEUX P, et coll. Is breast cancer incidence increasing among young women? An analysis of the trend in France for the period 1983-2002.
Breast. 2008;
17:289- 292

[10] COOK MB, AKRE O, FORMAN D, MADIGAN MP, RICHIARDI L, MCGLYNN KA. A systematic review and meta-analysis of perinatal variables in relation to the risk of testicular cancer--experiences of the son.
Int J Epidemiol. 2010;
39:1605- 1618

[11] CURADO MP, EDWARDS B, SHIN HR, STORM H, FERLAY J, et coll. Cancer incidence in five continents, vol. IX Iarc scientific publications no. 160.
Lyon:IARC;
2007;


[12] ESTÈVE J. Incidence du cancer du sein en France et dans les pays développés.
Presse Med. 2007;
36:315- 321

[13] HANNAN LM, LEITZMANN MF, LACEY JVJR, COLBERT LH, ALBANES D, et coll. Physical activity and risk of ovarian cancer: a prospective cohort study in the United States.
Cancer Epidemiol Biomarkers Prev. 2004;
13:765- 770

[14] HARDELL L, VAN BAVEL B, LINDSTROM G, CARLBERG M, DREIFALDT AC, WIJKSTRÖM H, et coll. Increased concentrations of polychlorinated biphenyls, hexachlorobenzene, and chlordanes in mothers of men with testicular cancer.
Environ Health Perspect. 2003;
111:930- 934

[15] HEDELIN G, REMONTET L. Évolution du cancer du testicule en France.
Andrologie. 2002;
12:264- 273

[16] HENDERSON BE, PIKE MC, BERNSTEIN L, ROSS RK. Breast Cancer.
In: Cancer Epidemiology and Prevention. In: SCHOTTENFELD D, FRAUMENI JF (eds), editors.
Oxford University Press;
New York:1996;


[17]HOSPICES CIVILS DE LYON, INSTITUT DE VEILLE SANITAIRE, INSTITUT NATIONAL DU CANCER, FRANCIM, INSTITUT NATIONAL DE LA SANTÉ ET DE LA RECHERCHE MÉDICALE. Projections de l’incidence et de la mortalité par cancer en France en 2010. Rapport technique. Avril 2010. (http://www.invs.sante.fr/surveillance/cancers). 

[18] HUYGHE E, PLANTE P, THONNEAU PF. Testicular cancer variations in time and space in Europe.
Eur Urol. 2007;
51:621- 628

[20] JEMAL A, WARD E, THUN MJ. Recent trends in breast cancer incidence rates by age and tumor characteristics among US women.
Breast Cancer Res. 2007;
9:R28

[21] KOUSHIK A, HUNTER DJ, SPIEGELMAN D, ANDERSON KE, ARSLAN AA, et coll. Fruits and vegetables and ovarian cancer risk in a pooled analysis of 12 cohort studies.
Cancer Epidemiol Biomarkers Prev. 2005;
14:2160- 2167

[22] LA VECCHIA C. Oral contraceptives and ovarian cancer: an update, 1998-2004.
Eur J Cancer Prev. 2006;
15:117- 124

[23] MALLICK S, BLANCHET P, MULTIGNER L. Prostate cancer incidence in Guadeloupe, a French Caribbean archipelago.
Eur Urol. 2005;
47:769- 772

[24] MCGLYNN KA. Environmental and host factors in testicular germ cell tumors.
Cancer Invest. 2001;
19:842- 853

[25] MCGLYNN KA, DEVESA SS, SIGURDSON AJ, BROWN LM, TSAO L, TARONE RE. Trends in the incidence of testicular germ cell tumors in the United States.
Cancer. 2003;
97:63- 70

[26] MEYER F, MOORE L, BAIRATI I, FRADETY . Downward trend in prostate cancer mortality in Quebec and Canada.
J Urol. 1999;
161:1189- 1191

[28] MINAMI Y, TSUBONO Y, NISHINO Y, OHUCHI N, SHIBUYA D, HISAMICHI S. The increase of female breast cancer incidence in Japan: emergence of birth cohort effect.
Int J Cancer. 2004;
108:901- 906

[29] MØLLER H. Clue to the aetiology of testicular germ cell tumors from descriptive epidemiology.
Eur Urol. 1993;
23:8- 15

[30] MOSTOFI FK, SESTERHENN IA, DAVIS CJJ. A pathologist’s view of prostatic carcinoma.
Cancer. 1993;
71:906- 932

[31] MULTIGNER L, NDONG JR, GIUSTI A, ROMANA M, DELACROIX-MAILLARD H, et coll. Chlordecone exposure and risk of prostate cancer.
J Clin Oncol. 2010;
28:3457- 3462

[32] PARKIN DM, BRAY FI, DEVESA SS. Cancer burden in the year 2000. The global picture.
Eur J Cancer. 2001;
37:S4- S66

[33]PARKIN DM, INTERNATIONAL AGENCY FOR RESEARCH ON CANCER, INTERNATIONAL ASSOCIATION OF CANCER REGISTRIES.Cancer incidence in Five Continents. Vol VIII. IARC Sc. Publ. N° 155;
Lyon: France.
2002;


[34] POST P, DAMHUIS R, VAN DER MEYDEN A. Variation in survival of patients with prostate cancer in Europe since 1978.
EUROCARE Working Group;
Eur J Cancer. 1998;
34:22262231

[35] PURDUE MP, DEVESA SS, SIGURDSON AJ, MCGLYNN KA. International patterns and trends in testis cancer incidence.
Int J Cancer. 2005;
115:822- 827

[36] RAVDIN P, KATHLEEN A, CRONIN K, HOWLADER N, BERG CD, et coll. The decrease in breast-cancer incidence in 2003 in the United States.
N Engl J Med. 2007;
356:1670- 1674

[37] REMONTET L, BUEMI A, VELTEN M, JOUGLA E, ESTÈVE J. Evolution de l’incidence et de la mortalité par cancer en France de 1978 à 2000.
Institut de Veille Sanitaire. Saint-Maurice:2003a;
(http://www.invs.sante.fr/publications/2003/rapport cancer 2003). 

[38] REMONTET L, ESTEVE J, BOUVIER AM, GROSCLAUDE P, LAUNOY G, et coll. Cancer incidence and mortality in France over the period 1978-2000.
Rev Epidemiol Sante Publ. 2003b;
51:3- 30

[39] RIES LAG, MELBERT D, KRAPCHO M, MARIOTTO A, MILLER BA, et coll. SEER Cancer Statistics Review, 1975-2004.
National Cancer Institute. Bethesda, MD, (http://seer.cancer.gov/csr/1975_2004/) based on November 2006 SEER data submission, posted to the SEER web site, 2007. 

[40] ROSSING MA, TANG MT, FLAGG EW, WEISS LK, WICKLUND KG. A case-control study of ovarian cancer in relation to infertility and the use of ovulation-inducing drugs.
Am J Epidemiol. 2004;
160:1070- 1078

[41] ROSSING MA, TANG MT, FLAGG EW, WEISS LK, WICKLUND KG, WEISS NS. Body size and risk of epithelial ovarian cancer (United States).
Cancer Causes Control. 2006;
17:713- 720

[42] SCHOUTEN LJ, GOLDBOHM RA, VAN DEN BRANDT PA. Height, weight, weight change, and ovarian cancer risk in the Netherlands cohort study on diet and cancer.
Am J Epidemiol. 2003;
157:424

[43] SEIDMAN JD, KURMAN RJ. Pathology of ovarian carcinoma.
Hematol Oncol Clin North Am. 2003;
17:909- 925, vii

[44] SLAMA R, BOUYER J, REMONTET L, SPIRA A. Epidemiology of Male Reproductive Function: a Field Searching for Tools.
Rev Epidemiol Sante Publique. 2004;
52:221- 242

[45] SOEGAARD M, JENSEN A, HOGDALL E, CHRISTENSEN L, HOGDALL C, et coll. Different risk factor profiles for mucinous and nonmucinous ovarian cancer: results from the Danish MALOVA study.
Cancer Epidemiol Biomarkers Prev. 2007;
16:1160- 1166

[46] TARONE RE. Breast cancer trends among young women in the United States.
Epidemiology. 2006;
17:588- 590

[47] TUNG KH, GOODMAN MT, WU AH, MCDUFFIE K, WILKENS LR, et coll. Reproductive factors and epithelial ovarian cancer risk by histologic type: a multiethnic case-control study.
Am J Epidemiol. 2003;
158:629- 638

[48] WALSCHAERTS M, HUYGHE E, MULLER A, BACHAUD JM, BUJAN L, THONNEAU P. Doubling of testicular cancer incidence over the last 20 years in southern France.
CACO. 2008;
19:155- 161

[49] WHITEMAN DC, SISKIND V, PURDIE DM, GREEN AC. Timing of pregnancy and the risk of epithelial ovarian cancer.
Cancer Epidemiol Biomarkers Prev. 2003;
12:42- 46

[50] ZHENG T, HOLFORD TR, MA Z, WARD BA, FLANNERY J, BOYLE P. Continuing increase in incidence of germ-cell testis cancer in young adults : experience from Connecticut, USA 1935-1992.
Cancer. 1996;
65:723- 729

→ Aller vers SYNTHESE