Parabènes
2011
| ANALYSE |
56-
Exposition des populations
Du fait de leur emploi comme conservateurs dans plus de 80 % des produits cosmétiques (shampooings, crèmes hydratantes, mousses à raser...) et dans de nombreuses spécialités pharmaceutiques, l’être humain est régulièrement exposé aux parabènes. De même, on peut retrouver dans l’alimentation, en tant qu’additifs alimentaires, le méthyl ou l’éthyl parabène.
Sources d’exposition et imprégnation des populations
Les données d’exposition aux parabènes sont limitées. Soni et coll. (2005 ) ont testé l’exposition aux parabènes de la population américaine. L’exposition toutes sources confondues a été estimée à 75,78 mg/j (ou 1,26 mg/kg/j pour un individu de 60 kg). Les cosmétiques représentaient environ 50 mg (basé sur une estimation de consommation de 5 g de produits contenant 10 g/kg de parabènes) et les produits pharmaceutiques pour 25 mg (basé sur une estimation de consommation de 5 g de médicaments contenant 5 g/kg de parabènes). Une estimation d’exposition par la voie alimentaire de 2,5 mg/personne était fondée sur la production industrielle, avec une forte marge d’incertitude. D’autres estimations ont été fournies par les auteurs (Soni et coll., 2005
) ont testé l’exposition aux parabènes de la population américaine. L’exposition toutes sources confondues a été estimée à 75,78 mg/j (ou 1,26 mg/kg/j pour un individu de 60 kg). Les cosmétiques représentaient environ 50 mg (basé sur une estimation de consommation de 5 g de produits contenant 10 g/kg de parabènes) et les produits pharmaceutiques pour 25 mg (basé sur une estimation de consommation de 5 g de médicaments contenant 5 g/kg de parabènes). Une estimation d’exposition par la voie alimentaire de 2,5 mg/personne était fondée sur la production industrielle, avec une forte marge d’incertitude. D’autres estimations ont été fournies par les auteurs (Soni et coll., 2005 ), basées sur la présence permanente des parabènes selon les catégories d’aliments, donnant des expositions potentielles aux États-Unis de 222 à 466 mg/j (soit moins de 8 mg/kg pour un individu de 60 kg).
), basées sur la présence permanente des parabènes selon les catégories d’aliments, donnant des expositions potentielles aux États-Unis de 222 à 466 mg/j (soit moins de 8 mg/kg pour un individu de 60 kg).
 ) ont testé l’exposition aux parabènes de la population américaine. L’exposition toutes sources confondues a été estimée à 75,78 mg/j (ou 1,26 mg/kg/j pour un individu de 60 kg). Les cosmétiques représentaient environ 50 mg (basé sur une estimation de consommation de 5 g de produits contenant 10 g/kg de parabènes) et les produits pharmaceutiques pour 25 mg (basé sur une estimation de consommation de 5 g de médicaments contenant 5 g/kg de parabènes). Une estimation d’exposition par la voie alimentaire de 2,5 mg/personne était fondée sur la production industrielle, avec une forte marge d’incertitude. D’autres estimations ont été fournies par les auteurs (Soni et coll., 2005
) ont testé l’exposition aux parabènes de la population américaine. L’exposition toutes sources confondues a été estimée à 75,78 mg/j (ou 1,26 mg/kg/j pour un individu de 60 kg). Les cosmétiques représentaient environ 50 mg (basé sur une estimation de consommation de 5 g de produits contenant 10 g/kg de parabènes) et les produits pharmaceutiques pour 25 mg (basé sur une estimation de consommation de 5 g de médicaments contenant 5 g/kg de parabènes). Une estimation d’exposition par la voie alimentaire de 2,5 mg/personne était fondée sur la production industrielle, avec une forte marge d’incertitude. D’autres estimations ont été fournies par les auteurs (Soni et coll., 2005 ), basées sur la présence permanente des parabènes selon les catégories d’aliments, donnant des expositions potentielles aux États-Unis de 222 à 466 mg/j (soit moins de 8 mg/kg pour un individu de 60 kg).
), basées sur la présence permanente des parabènes selon les catégories d’aliments, donnant des expositions potentielles aux États-Unis de 222 à 466 mg/j (soit moins de 8 mg/kg pour un individu de 60 kg).La présence (mais non la gamme de concentrations) du méthyl parabène dans le sang de cordon et le lait maternel a été rapportée (Makino, 2003 ).
).
 ).
).En 2004, la mise en évidence des cinq parabènes les plus utilisés (méthyl, éthyl, n-propyl, n-butyl et isobutyl parabènes) dans la graisse de carcinomes mammaires (Darbre et coll., 2004 ), a stimulé une discussion internationale (Flower, 2004
), a stimulé une discussion internationale (Flower, 2004 ; Harvey et Everett, 2004
; Harvey et Everett, 2004 ).
).
 ), a stimulé une discussion internationale (Flower, 2004
), a stimulé une discussion internationale (Flower, 2004 ; Harvey et Everett, 2004
; Harvey et Everett, 2004 ).
).La quantification urinaire des parabènes (libres ou conjugués) a été proposée comme biomarqueur spécifique de leur exposition (Ye et coll., 2006 ). Calafat et coll. (2010
). Calafat et coll. (2010 ) ont étudié l’exposition au méthyl, éthyl, propyl, et butyl parabènes dans un échantillon représentatif de la population générale des États-Unis (personnes âgées de 6 ans et plus) entre 2005 et 2006. L’analyse a porté sur 2 548 échantillons urinaires. Le méthyl parabène et le propyl parabène ont été détectés dans 99,1 % et 92,7 % des échantillons respectivement, l’éthyl dans 42,4 % et le butyl dans 47 %. La concentration médiane du méthyl parabène était de 63,5 μg/l et celle du propyl parabène de 8,7 μg/l. Les adolescentes et les femmes adultes avaient des concentrations significativement plus fortes que les adolescents et hommes adultes.
) ont étudié l’exposition au méthyl, éthyl, propyl, et butyl parabènes dans un échantillon représentatif de la population générale des États-Unis (personnes âgées de 6 ans et plus) entre 2005 et 2006. L’analyse a porté sur 2 548 échantillons urinaires. Le méthyl parabène et le propyl parabène ont été détectés dans 99,1 % et 92,7 % des échantillons respectivement, l’éthyl dans 42,4 % et le butyl dans 47 %. La concentration médiane du méthyl parabène était de 63,5 μg/l et celle du propyl parabène de 8,7 μg/l. Les adolescentes et les femmes adultes avaient des concentrations significativement plus fortes que les adolescents et hommes adultes.
 ). Calafat et coll. (2010
). Calafat et coll. (2010 ) ont étudié l’exposition au méthyl, éthyl, propyl, et butyl parabènes dans un échantillon représentatif de la population générale des États-Unis (personnes âgées de 6 ans et plus) entre 2005 et 2006. L’analyse a porté sur 2 548 échantillons urinaires. Le méthyl parabène et le propyl parabène ont été détectés dans 99,1 % et 92,7 % des échantillons respectivement, l’éthyl dans 42,4 % et le butyl dans 47 %. La concentration médiane du méthyl parabène était de 63,5 μg/l et celle du propyl parabène de 8,7 μg/l. Les adolescentes et les femmes adultes avaient des concentrations significativement plus fortes que les adolescents et hommes adultes.
) ont étudié l’exposition au méthyl, éthyl, propyl, et butyl parabènes dans un échantillon représentatif de la population générale des États-Unis (personnes âgées de 6 ans et plus) entre 2005 et 2006. L’analyse a porté sur 2 548 échantillons urinaires. Le méthyl parabène et le propyl parabène ont été détectés dans 99,1 % et 92,7 % des échantillons respectivement, l’éthyl dans 42,4 % et le butyl dans 47 %. La concentration médiane du méthyl parabène était de 63,5 μg/l et celle du propyl parabène de 8,7 μg/l. Les adolescentes et les femmes adultes avaient des concentrations significativement plus fortes que les adolescents et hommes adultes.Récemment, Frederiksen et coll. (2010 ) ont mesuré les concentrations de 5 parabènes (méthyl, éthyl, propyl, butyl et benzyl parabènes) dans l’urine, le plasma et le liquide séminal de 60 hommes danois en bonne santé. Ils ont mis en évidence la présence du méthyl, éthyl, propyl et butyl parabène respectivement dans 98, 80, 98 et 83 % des échantillons urinaires (médianes respectivement 17,7 ; 1,98 ; 3,60 ; 0,19 μg/l) ; le benzyl parabène n’était détecté que dans 7 % des échantillons. Le méthyl et le propyl parabènes étaient détectés dans la majorité des échantillons de plasma et de liquide séminal (médianes dans le plasma : 1,53 et 0,32 μg/l ; dans le liquide séminal : 1,99 et 0,68 μg/l, respectivement pour ces 2 parabènes).
) ont mesuré les concentrations de 5 parabènes (méthyl, éthyl, propyl, butyl et benzyl parabènes) dans l’urine, le plasma et le liquide séminal de 60 hommes danois en bonne santé. Ils ont mis en évidence la présence du méthyl, éthyl, propyl et butyl parabène respectivement dans 98, 80, 98 et 83 % des échantillons urinaires (médianes respectivement 17,7 ; 1,98 ; 3,60 ; 0,19 μg/l) ; le benzyl parabène n’était détecté que dans 7 % des échantillons. Le méthyl et le propyl parabènes étaient détectés dans la majorité des échantillons de plasma et de liquide séminal (médianes dans le plasma : 1,53 et 0,32 μg/l ; dans le liquide séminal : 1,99 et 0,68 μg/l, respectivement pour ces 2 parabènes).
 ) ont mesuré les concentrations de 5 parabènes (méthyl, éthyl, propyl, butyl et benzyl parabènes) dans l’urine, le plasma et le liquide séminal de 60 hommes danois en bonne santé. Ils ont mis en évidence la présence du méthyl, éthyl, propyl et butyl parabène respectivement dans 98, 80, 98 et 83 % des échantillons urinaires (médianes respectivement 17,7 ; 1,98 ; 3,60 ; 0,19 μg/l) ; le benzyl parabène n’était détecté que dans 7 % des échantillons. Le méthyl et le propyl parabènes étaient détectés dans la majorité des échantillons de plasma et de liquide séminal (médianes dans le plasma : 1,53 et 0,32 μg/l ; dans le liquide séminal : 1,99 et 0,68 μg/l, respectivement pour ces 2 parabènes).
) ont mesuré les concentrations de 5 parabènes (méthyl, éthyl, propyl, butyl et benzyl parabènes) dans l’urine, le plasma et le liquide séminal de 60 hommes danois en bonne santé. Ils ont mis en évidence la présence du méthyl, éthyl, propyl et butyl parabène respectivement dans 98, 80, 98 et 83 % des échantillons urinaires (médianes respectivement 17,7 ; 1,98 ; 3,60 ; 0,19 μg/l) ; le benzyl parabène n’était détecté que dans 7 % des échantillons. Le méthyl et le propyl parabènes étaient détectés dans la majorité des échantillons de plasma et de liquide séminal (médianes dans le plasma : 1,53 et 0,32 μg/l ; dans le liquide séminal : 1,99 et 0,68 μg/l, respectivement pour ces 2 parabènes).Les concentrations urinaires du butyl, éthyl, méthyl et propyl parabènes ont été mesurées dans les échantillons urinaires de 191 femmes enceintes de la cohorte Eden (Etude du Developpement des Nouveau-nés) recrutées en 2002-2006 à Nancy et Poitiers (Rémy Slama, communication personnelle). Les résultats sont présentés dans le tableau 56.I .
.
 .
.Tableau 56.I Concentrations urinaires de quelques parabènes chez 191 femmes enceintes de la cohorte Eden en France
|
Concentrations brutes (μg/l)
|
Concentrations divisées par la créatinine (μg/g cr)
|
|||||
|---|---|---|---|---|---|---|
|
Parabène
|
Médiane
|
25th
|
75th
|
Médiane
|
25th
|
75th
|
|
Butyl parabène
|
1,7
|
0,20
|
8,3
|
1,4
|
0,28
|
8,0
|
|
Éthyl parabène
|
4,1
|
0,71
|
13,9
|
3,5
|
0,81
|
13,3
|
|
Méthyl parabène
|
97,8
|
34,70
|
280,0
|
102,9
|
33,20
|
279,6
|
|
Propyl parabène
|
12,5
|
3,50
|
46,5
|
11,7
|
3,00
|
51,1
|
Schlumpf et coll. (2010 ) ont recherché la présence de parabènes dans le lait maternel pour 3 cohortes (2004, 2005, 2006) d’un total de 54 couples mères-enfants. Le méthyl, éthyl et propyl parabènes non conjugués ont été détectés dans 15 à 34 % des échantillons de lait dégraissé (moyenne respectivement : 2,18, 1,26 et 1,42 μg/l). Le butyl parabène était non détectable. Les auteurs suggèrent que les parabènes les plus lipophiles comme le butyl parabène sont associés principalement aux lipides du lait.
) ont recherché la présence de parabènes dans le lait maternel pour 3 cohortes (2004, 2005, 2006) d’un total de 54 couples mères-enfants. Le méthyl, éthyl et propyl parabènes non conjugués ont été détectés dans 15 à 34 % des échantillons de lait dégraissé (moyenne respectivement : 2,18, 1,26 et 1,42 μg/l). Le butyl parabène était non détectable. Les auteurs suggèrent que les parabènes les plus lipophiles comme le butyl parabène sont associés principalement aux lipides du lait.
 ) ont recherché la présence de parabènes dans le lait maternel pour 3 cohortes (2004, 2005, 2006) d’un total de 54 couples mères-enfants. Le méthyl, éthyl et propyl parabènes non conjugués ont été détectés dans 15 à 34 % des échantillons de lait dégraissé (moyenne respectivement : 2,18, 1,26 et 1,42 μg/l). Le butyl parabène était non détectable. Les auteurs suggèrent que les parabènes les plus lipophiles comme le butyl parabène sont associés principalement aux lipides du lait.
) ont recherché la présence de parabènes dans le lait maternel pour 3 cohortes (2004, 2005, 2006) d’un total de 54 couples mères-enfants. Le méthyl, éthyl et propyl parabènes non conjugués ont été détectés dans 15 à 34 % des échantillons de lait dégraissé (moyenne respectivement : 2,18, 1,26 et 1,42 μg/l). Le butyl parabène était non détectable. Les auteurs suggèrent que les parabènes les plus lipophiles comme le butyl parabène sont associés principalement aux lipides du lait.L’estimation de l’exposition via les cosmétiques n’a pas été finalisée, à ce jour, par le comité scientifique SCCS (Scientific Committee on Consumer Products). La méthodologie classique d’estimation par la somme des expositions possibles par type de produits est discutée par Cowan-Ellsberry et Robison (2009 ). Les auteurs ont estimé l’exposition via les cosmétiques à 1,26 mg/kg pc/j, en considérant l’ensemble des parabènes et les fréquences d’utilisation des produits.
). Les auteurs ont estimé l’exposition via les cosmétiques à 1,26 mg/kg pc/j, en considérant l’ensemble des parabènes et les fréquences d’utilisation des produits.
 ). Les auteurs ont estimé l’exposition via les cosmétiques à 1,26 mg/kg pc/j, en considérant l’ensemble des parabènes et les fréquences d’utilisation des produits.
). Les auteurs ont estimé l’exposition via les cosmétiques à 1,26 mg/kg pc/j, en considérant l’ensemble des parabènes et les fréquences d’utilisation des produits.Toxicocinétique
La plupart des résultats des études citées ci-dessous ont été analysés dans les rapports du JECFA, Comité mixte FAO/OMS d’experts des additifs alimentaires (JEFCA, 1966 ), du SCF (Comité scientifique de l’alimentation humaine) (SCF, 1994
), du SCF (Comité scientifique de l’alimentation humaine) (SCF, 1994 ), de l’EFSA (Autorité européenne de sécurité des aliments) (EFSA, 2004
), de l’EFSA (Autorité européenne de sécurité des aliments) (EFSA, 2004 ), du NTP (Programme National de Toxicologie américain) (NTP, 2005
), du NTP (Programme National de Toxicologie américain) (NTP, 2005 ), et du CIR (Cosmetic Ingredient Review, le Comité d’examen des ingrédients cosmétiques américain) (CIR, 2008
), et du CIR (Cosmetic Ingredient Review, le Comité d’examen des ingrédients cosmétiques américain) (CIR, 2008 ). La revue de Darbre et Harvey (2008
). La revue de Darbre et Harvey (2008 ) met également en lumière certains aspects de la pénétration cutanée des parabènes.
) met également en lumière certains aspects de la pénétration cutanée des parabènes.
 ), du SCF (Comité scientifique de l’alimentation humaine) (SCF, 1994
), du SCF (Comité scientifique de l’alimentation humaine) (SCF, 1994 ), de l’EFSA (Autorité européenne de sécurité des aliments) (EFSA, 2004
), de l’EFSA (Autorité européenne de sécurité des aliments) (EFSA, 2004 ), du NTP (Programme National de Toxicologie américain) (NTP, 2005
), du NTP (Programme National de Toxicologie américain) (NTP, 2005 ), et du CIR (Cosmetic Ingredient Review, le Comité d’examen des ingrédients cosmétiques américain) (CIR, 2008
), et du CIR (Cosmetic Ingredient Review, le Comité d’examen des ingrédients cosmétiques américain) (CIR, 2008 ). La revue de Darbre et Harvey (2008
). La revue de Darbre et Harvey (2008 ) met également en lumière certains aspects de la pénétration cutanée des parabènes.
) met également en lumière certains aspects de la pénétration cutanée des parabènes.Administration par voie orale
Études chez l’animal
Dans la littérature, quatre espèces animales ont servi à l’étude toxicocinétique (ADME1
) des parabènes (rat, chien, chat et lapin). Par voie orale, l’absorption des parabènes est rapide et importante (jusqu’à 94 % de la dose est excrétée dans l’urine). Ils sont très rapidement métabolisés puisque les composés parents se retrouvent à des niveaux négligeables dans le sang et que divers métabolites sont présents dans l’urine dans l’heure suivant l’administration.
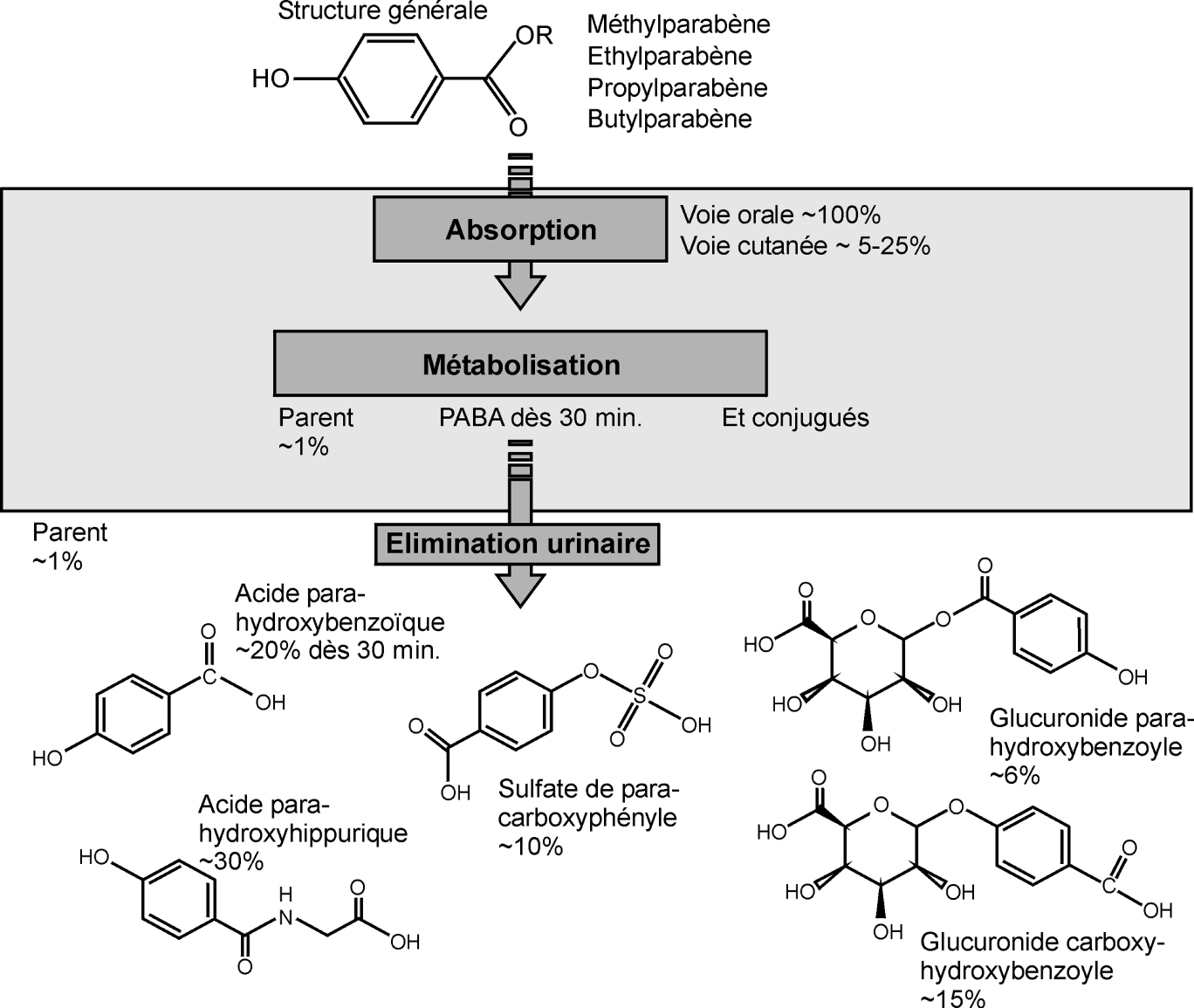
Quelle que soit l’espèce étudiée, la métabolisation des parabènes aboutit à l’hydrolyse de ces derniers en acide para-hydroxybenzoïque (PABA) qui est le métabolite principal (figure 56.1 ). Ce métabolite peut être ensuite conjugué notamment avec la glycine, l’acide glucuronique ou le sulfate pour former l’acide para-hydroxyhippurique, le glucuronide para-hydroxybenzoïque ou le sulfate para-carboxyphényle.
). Ce métabolite peut être ensuite conjugué notamment avec la glycine, l’acide glucuronique ou le sulfate pour former l’acide para-hydroxyhippurique, le glucuronide para-hydroxybenzoïque ou le sulfate para-carboxyphényle.
 ). Ce métabolite peut être ensuite conjugué notamment avec la glycine, l’acide glucuronique ou le sulfate pour former l’acide para-hydroxyhippurique, le glucuronide para-hydroxybenzoïque ou le sulfate para-carboxyphényle.
). Ce métabolite peut être ensuite conjugué notamment avec la glycine, l’acide glucuronique ou le sulfate pour former l’acide para-hydroxyhippurique, le glucuronide para-hydroxybenzoïque ou le sulfate para-carboxyphényle.La métabolisation des parabènes ainsi que leur élimination sont rapides et quasiment totales par voie orale. Chez la femelle gestante, l’éthyl et le butyl parabènes peuvent se concentrer (jusqu’à 10 fois) dans le liquide amniotique (Frederiksen et coll., 2008 ).
).
 ).
).Études chez l’Homme
Le faible nombre d’études réalisées chez l’Homme par voie orale (Jones et coll., 1956 ; Heim et coll., 1960
; Heim et coll., 1960 ) montre des résultats similaires à ceux observés chez les animaux de laboratoire. L’administration par voie orale de méthyl parabène ou d’éthyl parabène donne lieu à une absorption rapide, une métabolisation importante et rapide et une forte excrétion. En effet, le parent est retrouvé à des niveaux négligeables dans le sang et le métabolite principal est détecté 3 minutes après l’absorption. Parmi les métabolites urinaires (>50 % de la dose après 12 h), l’acide para-hydroxybenzoïque est majoritaire.
) montre des résultats similaires à ceux observés chez les animaux de laboratoire. L’administration par voie orale de méthyl parabène ou d’éthyl parabène donne lieu à une absorption rapide, une métabolisation importante et rapide et une forte excrétion. En effet, le parent est retrouvé à des niveaux négligeables dans le sang et le métabolite principal est détecté 3 minutes après l’absorption. Parmi les métabolites urinaires (>50 % de la dose après 12 h), l’acide para-hydroxybenzoïque est majoritaire.
 ; Heim et coll., 1960
; Heim et coll., 1960 ) montre des résultats similaires à ceux observés chez les animaux de laboratoire. L’administration par voie orale de méthyl parabène ou d’éthyl parabène donne lieu à une absorption rapide, une métabolisation importante et rapide et une forte excrétion. En effet, le parent est retrouvé à des niveaux négligeables dans le sang et le métabolite principal est détecté 3 minutes après l’absorption. Parmi les métabolites urinaires (>50 % de la dose après 12 h), l’acide para-hydroxybenzoïque est majoritaire.
) montre des résultats similaires à ceux observés chez les animaux de laboratoire. L’administration par voie orale de méthyl parabène ou d’éthyl parabène donne lieu à une absorption rapide, une métabolisation importante et rapide et une forte excrétion. En effet, le parent est retrouvé à des niveaux négligeables dans le sang et le métabolite principal est détecté 3 minutes après l’absorption. Parmi les métabolites urinaires (>50 % de la dose après 12 h), l’acide para-hydroxybenzoïque est majoritaire.Administration par voie cutanée
Études chez l’animal
La plupart des études d’ADME ont utilisé le rat comme modèle. Or, de récentes données ont montré des différences dans les capacités métaboliques des peaux d’homme et de rat, qui remettraient en cause ce modèle dans l’étude de l’absorption des parabènes par voie cutanée. Le mini-porc apparaît comme une alternative plus pertinente. Jewell et coll. (2007 ) ont comparé le métabolisme cutané de la peau humaine à celui de la peau de mini-porc. Les auteurs ont montré que malgré certaines différences physiologiques, notamment au niveau des carboxylestérases, l’hydrolyse des parabènes était similaire entre la peau humaine et celle du mini-porc. Les estérases de la peau hydrolysent les parabènes en acide para-hydroxybenzoïque.
) ont comparé le métabolisme cutané de la peau humaine à celui de la peau de mini-porc. Les auteurs ont montré que malgré certaines différences physiologiques, notamment au niveau des carboxylestérases, l’hydrolyse des parabènes était similaire entre la peau humaine et celle du mini-porc. Les estérases de la peau hydrolysent les parabènes en acide para-hydroxybenzoïque.
 ) ont comparé le métabolisme cutané de la peau humaine à celui de la peau de mini-porc. Les auteurs ont montré que malgré certaines différences physiologiques, notamment au niveau des carboxylestérases, l’hydrolyse des parabènes était similaire entre la peau humaine et celle du mini-porc. Les estérases de la peau hydrolysent les parabènes en acide para-hydroxybenzoïque.
) ont comparé le métabolisme cutané de la peau humaine à celui de la peau de mini-porc. Les auteurs ont montré que malgré certaines différences physiologiques, notamment au niveau des carboxylestérases, l’hydrolyse des parabènes était similaire entre la peau humaine et celle du mini-porc. Les estérases de la peau hydrolysent les parabènes en acide para-hydroxybenzoïque.Ishiwatari et coll. (2007 ) ont étudié l’absorption cutanée du méthyl parabène à travers la peau de mini-porc Yucatan (où les couches de graisse ont été retirées) montée sur une cellule de diffusion. Une solution contenant le méthyl parabène a été déposée sur chaque échantillon de peau ; des prélèvements ont été réalisés 15, 60 et 120 minutes après l’application cutanée. Les concentrations de méthyl parabène augmentent au cours du temps dans le stratum corneum ; ces concentrations augmentent globalement dans l’épiderme de 15 à 60 minutes après l’application puis diminuent à 120 minutes. En revanche, dans le derme, les concentrations de méthyl parabène augmentent très légèrement à 15 et 60 minutes, et restent constantes entre 60 et 120 minutes.
) ont étudié l’absorption cutanée du méthyl parabène à travers la peau de mini-porc Yucatan (où les couches de graisse ont été retirées) montée sur une cellule de diffusion. Une solution contenant le méthyl parabène a été déposée sur chaque échantillon de peau ; des prélèvements ont été réalisés 15, 60 et 120 minutes après l’application cutanée. Les concentrations de méthyl parabène augmentent au cours du temps dans le stratum corneum ; ces concentrations augmentent globalement dans l’épiderme de 15 à 60 minutes après l’application puis diminuent à 120 minutes. En revanche, dans le derme, les concentrations de méthyl parabène augmentent très légèrement à 15 et 60 minutes, et restent constantes entre 60 et 120 minutes.
 ) ont étudié l’absorption cutanée du méthyl parabène à travers la peau de mini-porc Yucatan (où les couches de graisse ont été retirées) montée sur une cellule de diffusion. Une solution contenant le méthyl parabène a été déposée sur chaque échantillon de peau ; des prélèvements ont été réalisés 15, 60 et 120 minutes après l’application cutanée. Les concentrations de méthyl parabène augmentent au cours du temps dans le stratum corneum ; ces concentrations augmentent globalement dans l’épiderme de 15 à 60 minutes après l’application puis diminuent à 120 minutes. En revanche, dans le derme, les concentrations de méthyl parabène augmentent très légèrement à 15 et 60 minutes, et restent constantes entre 60 et 120 minutes.
) ont étudié l’absorption cutanée du méthyl parabène à travers la peau de mini-porc Yucatan (où les couches de graisse ont été retirées) montée sur une cellule de diffusion. Une solution contenant le méthyl parabène a été déposée sur chaque échantillon de peau ; des prélèvements ont été réalisés 15, 60 et 120 minutes après l’application cutanée. Les concentrations de méthyl parabène augmentent au cours du temps dans le stratum corneum ; ces concentrations augmentent globalement dans l’épiderme de 15 à 60 minutes après l’application puis diminuent à 120 minutes. En revanche, dans le derme, les concentrations de méthyl parabène augmentent très légèrement à 15 et 60 minutes, et restent constantes entre 60 et 120 minutes.Études chez l’Homme
Fischmeister et coll. (1975 ) ont étudié l’absorption des parabènes après application cutanée d’une crème chez 3 volontaires. Une heure après l’application, les parabènes ont été détectés au niveau cutané mais 8 heures après l’application, ils ne l’étaient plus.
) ont étudié l’absorption des parabènes après application cutanée d’une crème chez 3 volontaires. Une heure après l’application, les parabènes ont été détectés au niveau cutané mais 8 heures après l’application, ils ne l’étaient plus.
 ) ont étudié l’absorption des parabènes après application cutanée d’une crème chez 3 volontaires. Une heure après l’application, les parabènes ont été détectés au niveau cutané mais 8 heures après l’application, ils ne l’étaient plus.
) ont étudié l’absorption des parabènes après application cutanée d’une crème chez 3 volontaires. Une heure après l’application, les parabènes ont été détectés au niveau cutané mais 8 heures après l’application, ils ne l’étaient plus.Ishiwatari et coll. (2007 ) ont mené une étude chez des volontaires japonais (hommes et femmes) où les niveaux de méthyl parabène ont été dosés dans le stratum corneum à différents temps (1, 2, 5 et 12 heures), soit après application unique d’une crème contenant 0,15 %, 0,25 % ou 0,5 % de méthyl parabène, soit après application d’une crème deux fois par jour pendant un mois. Après une seule application, le méthyl parabène a été retrouvé dans le stratum corneum une à deux heures après l’application ; aucune trace de méthyl parabène n’a été détectée 12 heures après l’application. Deux applications par jour pendant un mois ont résulté en une augmentation de la concentration de méthyl parabène dans le stratum corneum.
) ont mené une étude chez des volontaires japonais (hommes et femmes) où les niveaux de méthyl parabène ont été dosés dans le stratum corneum à différents temps (1, 2, 5 et 12 heures), soit après application unique d’une crème contenant 0,15 %, 0,25 % ou 0,5 % de méthyl parabène, soit après application d’une crème deux fois par jour pendant un mois. Après une seule application, le méthyl parabène a été retrouvé dans le stratum corneum une à deux heures après l’application ; aucune trace de méthyl parabène n’a été détectée 12 heures après l’application. Deux applications par jour pendant un mois ont résulté en une augmentation de la concentration de méthyl parabène dans le stratum corneum.
 ) ont mené une étude chez des volontaires japonais (hommes et femmes) où les niveaux de méthyl parabène ont été dosés dans le stratum corneum à différents temps (1, 2, 5 et 12 heures), soit après application unique d’une crème contenant 0,15 %, 0,25 % ou 0,5 % de méthyl parabène, soit après application d’une crème deux fois par jour pendant un mois. Après une seule application, le méthyl parabène a été retrouvé dans le stratum corneum une à deux heures après l’application ; aucune trace de méthyl parabène n’a été détectée 12 heures après l’application. Deux applications par jour pendant un mois ont résulté en une augmentation de la concentration de méthyl parabène dans le stratum corneum.
) ont mené une étude chez des volontaires japonais (hommes et femmes) où les niveaux de méthyl parabène ont été dosés dans le stratum corneum à différents temps (1, 2, 5 et 12 heures), soit après application unique d’une crème contenant 0,15 %, 0,25 % ou 0,5 % de méthyl parabène, soit après application d’une crème deux fois par jour pendant un mois. Après une seule application, le méthyl parabène a été retrouvé dans le stratum corneum une à deux heures après l’application ; aucune trace de méthyl parabène n’a été détectée 12 heures après l’application. Deux applications par jour pendant un mois ont résulté en une augmentation de la concentration de méthyl parabène dans le stratum corneum.El Hussein et coll. (2007 ) ont étudié l’absorption des méthyl, éthyl, propyl et butyl parabènes in vitro sur peau humaine. Une lotion commerciale (contenant les quatre parabènes à différentes concentrations) a été appliquée pendant 24 h. Les quatre parabènes diffusent d’autant mieux dans le fluide récepteur qu’ils sont peu lipophiles, et que la chaîne est courte (méthyl, éthyl, propyl, butyl parabènes : 18 %, 14 %, 9 %, 2 %). En outre, l’absorption augmente avec des doses répétées.
) ont étudié l’absorption des méthyl, éthyl, propyl et butyl parabènes in vitro sur peau humaine. Une lotion commerciale (contenant les quatre parabènes à différentes concentrations) a été appliquée pendant 24 h. Les quatre parabènes diffusent d’autant mieux dans le fluide récepteur qu’ils sont peu lipophiles, et que la chaîne est courte (méthyl, éthyl, propyl, butyl parabènes : 18 %, 14 %, 9 %, 2 %). En outre, l’absorption augmente avec des doses répétées.
 ) ont étudié l’absorption des méthyl, éthyl, propyl et butyl parabènes in vitro sur peau humaine. Une lotion commerciale (contenant les quatre parabènes à différentes concentrations) a été appliquée pendant 24 h. Les quatre parabènes diffusent d’autant mieux dans le fluide récepteur qu’ils sont peu lipophiles, et que la chaîne est courte (méthyl, éthyl, propyl, butyl parabènes : 18 %, 14 %, 9 %, 2 %). En outre, l’absorption augmente avec des doses répétées.
) ont étudié l’absorption des méthyl, éthyl, propyl et butyl parabènes in vitro sur peau humaine. Une lotion commerciale (contenant les quatre parabènes à différentes concentrations) a été appliquée pendant 24 h. Les quatre parabènes diffusent d’autant mieux dans le fluide récepteur qu’ils sont peu lipophiles, et que la chaîne est courte (méthyl, éthyl, propyl, butyl parabènes : 18 %, 14 %, 9 %, 2 %). En outre, l’absorption augmente avec des doses répétées.La confirmation de la capacité des parabènes d’être absorbés systématiquement à partir d’applications topiques a été démontrée récemment (Janjua et coll., 2008 ) : après application topique d’une crème cosmétique contenant 2 % de butyl parabène, chez 26 hommes jeunes, les taux ont augmenté dans le sang et l’urine : le n-butyl parabène était détecté dans le sérum en 1 h et dans l’urine avec un pic à 8-12 h, dont la majorité conjuguée sous forme de glucuronide.
) : après application topique d’une crème cosmétique contenant 2 % de butyl parabène, chez 26 hommes jeunes, les taux ont augmenté dans le sang et l’urine : le n-butyl parabène était détecté dans le sérum en 1 h et dans l’urine avec un pic à 8-12 h, dont la majorité conjuguée sous forme de glucuronide.
 ) : après application topique d’une crème cosmétique contenant 2 % de butyl parabène, chez 26 hommes jeunes, les taux ont augmenté dans le sang et l’urine : le n-butyl parabène était détecté dans le sérum en 1 h et dans l’urine avec un pic à 8-12 h, dont la majorité conjuguée sous forme de glucuronide.
) : après application topique d’une crème cosmétique contenant 2 % de butyl parabène, chez 26 hommes jeunes, les taux ont augmenté dans le sang et l’urine : le n-butyl parabène était détecté dans le sérum en 1 h et dans l’urine avec un pic à 8-12 h, dont la majorité conjuguée sous forme de glucuronide.Lobemeier et coll. (1996 ) ont étudié l’hydrolyse des parabènes en acide para-hydroxybenzoïque par des extraits provenant de différentes couches de la peau. Des extraits ont été préparés à partir de peau humaine (abdominale) en séparant l’épiderme, la graisse sous-cutanée, et la couche basale. Des kératinocytes en culture ont servi également à préparer un extrait. Dans l’extrait de la graisse sous-cutanée, la plus forte hydrolyse des 4 parabènes a été observée, l’activité diminuant avec l’augmentation de la longueur de la chaîne carbonée. En revanche, pour les kératinocytes, l’activité d’hydrolyse augmentait avec la longueur de la chaîne carbonée. Les auteurs ont ensuite isolé l’activité enzymatique de chaque extrait. Dans la graisse sous-cutanée, l’activité de la carboxylestérase de type B est différente selon le type de parabène. L’activité est maximale avec le méthyl parabène et elle diminue avec l’augmentation de la chaîne carbonée jusqu’au butyl parabène. Une seconde carboxylestérase de type B dans la graisse sous-cutanée et une troisième au niveau des kératinocytes ont été identifiées, plus active avec le butyl parabène. Cette étude suggère que les carboxylestérases des kératinocytes sont suffisantes pour hydrolyser complètement les traces de parabènes qui pourraient entrer dans la peau à partir de crèmes.
) ont étudié l’hydrolyse des parabènes en acide para-hydroxybenzoïque par des extraits provenant de différentes couches de la peau. Des extraits ont été préparés à partir de peau humaine (abdominale) en séparant l’épiderme, la graisse sous-cutanée, et la couche basale. Des kératinocytes en culture ont servi également à préparer un extrait. Dans l’extrait de la graisse sous-cutanée, la plus forte hydrolyse des 4 parabènes a été observée, l’activité diminuant avec l’augmentation de la longueur de la chaîne carbonée. En revanche, pour les kératinocytes, l’activité d’hydrolyse augmentait avec la longueur de la chaîne carbonée. Les auteurs ont ensuite isolé l’activité enzymatique de chaque extrait. Dans la graisse sous-cutanée, l’activité de la carboxylestérase de type B est différente selon le type de parabène. L’activité est maximale avec le méthyl parabène et elle diminue avec l’augmentation de la chaîne carbonée jusqu’au butyl parabène. Une seconde carboxylestérase de type B dans la graisse sous-cutanée et une troisième au niveau des kératinocytes ont été identifiées, plus active avec le butyl parabène. Cette étude suggère que les carboxylestérases des kératinocytes sont suffisantes pour hydrolyser complètement les traces de parabènes qui pourraient entrer dans la peau à partir de crèmes.
 ) ont étudié l’hydrolyse des parabènes en acide para-hydroxybenzoïque par des extraits provenant de différentes couches de la peau. Des extraits ont été préparés à partir de peau humaine (abdominale) en séparant l’épiderme, la graisse sous-cutanée, et la couche basale. Des kératinocytes en culture ont servi également à préparer un extrait. Dans l’extrait de la graisse sous-cutanée, la plus forte hydrolyse des 4 parabènes a été observée, l’activité diminuant avec l’augmentation de la longueur de la chaîne carbonée. En revanche, pour les kératinocytes, l’activité d’hydrolyse augmentait avec la longueur de la chaîne carbonée. Les auteurs ont ensuite isolé l’activité enzymatique de chaque extrait. Dans la graisse sous-cutanée, l’activité de la carboxylestérase de type B est différente selon le type de parabène. L’activité est maximale avec le méthyl parabène et elle diminue avec l’augmentation de la chaîne carbonée jusqu’au butyl parabène. Une seconde carboxylestérase de type B dans la graisse sous-cutanée et une troisième au niveau des kératinocytes ont été identifiées, plus active avec le butyl parabène. Cette étude suggère que les carboxylestérases des kératinocytes sont suffisantes pour hydrolyser complètement les traces de parabènes qui pourraient entrer dans la peau à partir de crèmes.
) ont étudié l’hydrolyse des parabènes en acide para-hydroxybenzoïque par des extraits provenant de différentes couches de la peau. Des extraits ont été préparés à partir de peau humaine (abdominale) en séparant l’épiderme, la graisse sous-cutanée, et la couche basale. Des kératinocytes en culture ont servi également à préparer un extrait. Dans l’extrait de la graisse sous-cutanée, la plus forte hydrolyse des 4 parabènes a été observée, l’activité diminuant avec l’augmentation de la longueur de la chaîne carbonée. En revanche, pour les kératinocytes, l’activité d’hydrolyse augmentait avec la longueur de la chaîne carbonée. Les auteurs ont ensuite isolé l’activité enzymatique de chaque extrait. Dans la graisse sous-cutanée, l’activité de la carboxylestérase de type B est différente selon le type de parabène. L’activité est maximale avec le méthyl parabène et elle diminue avec l’augmentation de la chaîne carbonée jusqu’au butyl parabène. Une seconde carboxylestérase de type B dans la graisse sous-cutanée et une troisième au niveau des kératinocytes ont été identifiées, plus active avec le butyl parabène. Cette étude suggère que les carboxylestérases des kératinocytes sont suffisantes pour hydrolyser complètement les traces de parabènes qui pourraient entrer dans la peau à partir de crèmes.Les résultats obtenus sur peau humaine sont très différents de ceux trouvés chez le rat ; seuls 35 % (méthyl parabène) et 33 % (butyl parabène) sont métabolisés. La dose absorbable représente 85±15 % et 81±11 % (respectivement) de la dose appliquée. Ces résultats suggèrent d’une part une plus forte absorption par la peau humaine, et d’autre part une plus forte métabolisation dans la peau de rat, suggérant davantage de composé parent biodisponible chez l’Homme.
Harville et coll. (2007 ) ont obtenu des conclusions similaires. In vitro, les profils d’hydrolyse des 4 parabènes étudiés ont été fort différents entre une suspension cellulaire provenant de peau humaine et une suspension cellulaire de peau de rat. L’hydrolyse au niveau la peau humaine est 3 à 4 fois moins efficace que celle réalisée au niveau de la peau de rat, posant ainsi la question de la pertinence de l’extrapolation à l’homme de résultats obtenus sur la peau de rat. Par ailleurs, les estérases des deux espèces semblent avoir des spécificités de substrat différentes : les préparations de peaux de rat hydrolysent d’autant mieux les parabènes que la chaîne de l’ester est longue, alors que l’hydrolyse par la peau humaine est meilleure sur les parabènes à chaîne courte. Ce fait a été confirmé par Prusakiewicz et coll. (2006
) ont obtenu des conclusions similaires. In vitro, les profils d’hydrolyse des 4 parabènes étudiés ont été fort différents entre une suspension cellulaire provenant de peau humaine et une suspension cellulaire de peau de rat. L’hydrolyse au niveau la peau humaine est 3 à 4 fois moins efficace que celle réalisée au niveau de la peau de rat, posant ainsi la question de la pertinence de l’extrapolation à l’homme de résultats obtenus sur la peau de rat. Par ailleurs, les estérases des deux espèces semblent avoir des spécificités de substrat différentes : les préparations de peaux de rat hydrolysent d’autant mieux les parabènes que la chaîne de l’ester est longue, alors que l’hydrolyse par la peau humaine est meilleure sur les parabènes à chaîne courte. Ce fait a été confirmé par Prusakiewicz et coll. (2006 ) qui ont observé de très grandes différences d’activité des estérases entre la peau de rat et la peau humaine.
) qui ont observé de très grandes différences d’activité des estérases entre la peau de rat et la peau humaine.
 ) ont obtenu des conclusions similaires. In vitro, les profils d’hydrolyse des 4 parabènes étudiés ont été fort différents entre une suspension cellulaire provenant de peau humaine et une suspension cellulaire de peau de rat. L’hydrolyse au niveau la peau humaine est 3 à 4 fois moins efficace que celle réalisée au niveau de la peau de rat, posant ainsi la question de la pertinence de l’extrapolation à l’homme de résultats obtenus sur la peau de rat. Par ailleurs, les estérases des deux espèces semblent avoir des spécificités de substrat différentes : les préparations de peaux de rat hydrolysent d’autant mieux les parabènes que la chaîne de l’ester est longue, alors que l’hydrolyse par la peau humaine est meilleure sur les parabènes à chaîne courte. Ce fait a été confirmé par Prusakiewicz et coll. (2006
) ont obtenu des conclusions similaires. In vitro, les profils d’hydrolyse des 4 parabènes étudiés ont été fort différents entre une suspension cellulaire provenant de peau humaine et une suspension cellulaire de peau de rat. L’hydrolyse au niveau la peau humaine est 3 à 4 fois moins efficace que celle réalisée au niveau de la peau de rat, posant ainsi la question de la pertinence de l’extrapolation à l’homme de résultats obtenus sur la peau de rat. Par ailleurs, les estérases des deux espèces semblent avoir des spécificités de substrat différentes : les préparations de peaux de rat hydrolysent d’autant mieux les parabènes que la chaîne de l’ester est longue, alors que l’hydrolyse par la peau humaine est meilleure sur les parabènes à chaîne courte. Ce fait a été confirmé par Prusakiewicz et coll. (2006 ) qui ont observé de très grandes différences d’activité des estérases entre la peau de rat et la peau humaine.
) qui ont observé de très grandes différences d’activité des estérases entre la peau de rat et la peau humaine.L’influence des autres composants des cosmétiques doit également être mentionnée : ainsi, l’éthanol peut inhiber l’activité des estérases in vitro, augmenter la pénétration du méthyl parabène dans la peau de cobaye et induire la conversion par transestérification du méthyl parabène en butyl parabène. Enfin, les parabènes sont souvent utilisés en association en raison de leur effet synergique antibactérien (par exemple méthyl+propyl). Caon et coll. (2010 ) ont étudié le flux dermique de ces combinaisons dans un modèle in vitro d’oreille de porc : individuellement, la solubilité et la lipophilicité des molécules rendent compte de l’absorption transcutanée (méthyl parabène>éthyl parabène>propyl parabène>butyl parabène). La combinaison du propyl avec les autres parabènes réduit leur flux (environ 2 fois pour le méthyl et le butyl, et 8 fois pour l’éthyl) peut-être en relation avec une rétention dans l’épiderme et le derme.
) ont étudié le flux dermique de ces combinaisons dans un modèle in vitro d’oreille de porc : individuellement, la solubilité et la lipophilicité des molécules rendent compte de l’absorption transcutanée (méthyl parabène>éthyl parabène>propyl parabène>butyl parabène). La combinaison du propyl avec les autres parabènes réduit leur flux (environ 2 fois pour le méthyl et le butyl, et 8 fois pour l’éthyl) peut-être en relation avec une rétention dans l’épiderme et le derme.
 ) ont étudié le flux dermique de ces combinaisons dans un modèle in vitro d’oreille de porc : individuellement, la solubilité et la lipophilicité des molécules rendent compte de l’absorption transcutanée (méthyl parabène>éthyl parabène>propyl parabène>butyl parabène). La combinaison du propyl avec les autres parabènes réduit leur flux (environ 2 fois pour le méthyl et le butyl, et 8 fois pour l’éthyl) peut-être en relation avec une rétention dans l’épiderme et le derme.
) ont étudié le flux dermique de ces combinaisons dans un modèle in vitro d’oreille de porc : individuellement, la solubilité et la lipophilicité des molécules rendent compte de l’absorption transcutanée (méthyl parabène>éthyl parabène>propyl parabène>butyl parabène). La combinaison du propyl avec les autres parabènes réduit leur flux (environ 2 fois pour le méthyl et le butyl, et 8 fois pour l’éthyl) peut-être en relation avec une rétention dans l’épiderme et le derme.
En conclusion, les données d’exposition humaine aux parabènes sont limitées ; une étude récente (2010) menée chez les hommes danois montre la présence des 4 parabènes (méthyl, éthyl, propyl, butyl parabènes) dans le plasma et le liquide séminal. De même, une étude française dans une cohorte de femmes enceintes révèle la présence de méthyl, éthyl, propyl, butyl parabènes dans l’urine et des taux urinaires de méthyl parabène proches de 100 μg/l.
La plupart des études toxicocinétiques par voie cutanée ont utilisé le rat comme modèle. Les données sont à utiliser avec précaution, en raison de la différence de métabolisme mise en évidence : les estérases de la peau hydrolysent les parabènes en acide para-hydroxybenzoïque, avec une efficacité et une spécificité de substrat différentes dans l’espèce humaine qui laisserait davantage de composés parents biodisponibles.
Bibliographie
[1] CALAFAT AM, YE X, WONG LY, BISHOP AM, NEEDHAM LL. Urinary concentrations of four parabens in the U.S. population: NHANES 2005-2006.
Environ Health Perspect. 2010;
118:679- 685

[2] CAON T, COSTA AC, DE OLIVEIRA MA, MICKE GA, SIMÕES CM. Evaluation of the transdermal permeation of different paraben combinations through a pig ear skin model.
Int J Pharm. 2010;
391:1- 6

[3]CIR. Final amended report on the safety assessment of Methylparaben, Ethylparaben, Propylparaben, Isopropylparaben, Butylparaben, Isobutylparaben, and Benzylparaben as used in cosmetic products.
Int J Toxico. 2008;
27 (Suppl 4):1- 82

[4] COWAN-ELLSBERRY CE, ROBISON SH. Refining aggregate exposure: example using parabens.
Regul Toxicol Pharmacol. 2009;
55:321- 329

[5] DARBRE PD, ALJARRAH A, MILLER WR, COLDHAM NG, SAUER MJ, et coll. Concentrations of parabens in human breast tumours.
J Appl Toxicol. 2004;
24:5- 13

[6] DARBRE PD, HARVEY PW. Paraben esters: review of recent studies of endocrine toxicity, absorption, esterase and human exposure, and discussion of potential human health risks.
J Appl Toxicol. 2008;
28:561- 578

[7]EFSA. Opinion of the Scientific Panel on Food Additives, Flavourings, Processing Aids and Materials in Contact with Food on a Request from the Commission related to para hydroxybenzoates (E 214-219).
EFSA Journal. 2004;
83:1- 26

[8] EL HUSSEIN S, MURET P, BERARD M, MAKKI S, HUMBERT P. Assessment of principal parabens used in cosmetics after their passage through human epidermis-dermis layers (ex-vivo study).
Exp Dermatol. 2007;
16:830- 836

[9] FISCHMEISTER I, HELLGREN L, VINCENT J. Infrared spectroscopy for tracing of topically applied ointment vehicles and active substances on healthy skin.
Arch Dermatol Res. 1975;
253:63- 69

[10] FLOWER C. Observations on the paper by Darbre et coll. (2204).
J Appl Toxicol. 2004;
24:304- 305

[11] FREDERIKSEN H, TAXVIG C, HASS U, VINGGAARD AM, NELLEMANN C. Higher levels of ethyl paraben and butyl paraben in rat amniotic fluid than in maternal plasma after subcutaneous administration.
Toxicol Sci. 2008;
106:376- 383

[12] FREDERIKSEN H, JØRGENSEN N, ANDERSSON AM. Parabens in urine, serum and seminal plasma from healthy Danish men determined by liquid chromatography-tandem mass spectrometry (LC-MS/MS).
J Expo Sci Environ Epidemiol. 2010, Mar 10;


[13] HARVEY PW, EVERETT DJ. Significance of the detection of esters of p-hydroxybenzoic acid (parabens) in human breast tumours.
J Appl Toxicol. 2004;
24:1- 4

[14] HARVILLE HM, VOORMAN R, PRUSAKIEWICZ JJ. Comparison of paraben stability in human and rat skin.
Drug Metab Lett. 2007;
1:17- 21

[15] HEIM F. Die pharmakologisch-toxikologische PrÜfung von chemischen Zusatzsoffen zur Nahrung.
Physik-Med/ Soz Erlangen. 1960;
81:14- 18

[16] ISHIWATARI S, SUZUKI T, HITOMI T, YOSHINO T, MATSUKUMA S, TSUJI T. Effects of methyl paraben on skin keratinocytes.
J Appl Toxicol. 2007;
27:1- 9

[17] JANJUA NR, FREDERIKSEN H, SKAKKEBAEK NE, WULF HC, ANDERSSON AM. Urinary excretion of phthalates and paraben after repeated whole-body topical application in humans.
Int J Androl. 2008;
31:118- 130

[18]JECFA.Benzoate, methyl, ethyl, propylbutyl hydroxy, p- (FAO Nutrition Meetings Report Series 40abc). 1966;


[19] JEWELL C, PRUSAKIEWICZ JJ, ACKERMANN C, PAYNE NA, FATE G, et coll. Hydrolysis of a series of parabens by skin microsomes and cytosol from human and minipigs and in whole skin in short-term culture.
Toxicol Appl Pharmacol. 2007;
225:221- 228

[20] JONES PS, THIGPEN D, MORRISON JL, RICHARDSON AP. p-Hydroxybenzoic acid esters as preservatives. III. The physiological disposition of p-hydroxybenzoic acid and its esters.
J Am Pharm Assoc Sci Ed. 1956;
45:265- 273

[21] LOBEMEIER C, TSCHOETSCHEL C, WESTIE S, HEYMANN E. Hydrolysis of parabenes by extracts from differing layers of human skin.
Biol Chem. 1996;
377:647- -651

[22] MAKINO T. Female reproductive tract and mammary disorders caused by endocrine disruptor.
Jpn Med Assoc J. 2003;
46:93- 96

[24] PRUSAKIEWICZ JJ, ACKERMANN C, VOORMAN R. Comparison of skin esterase activities from different species.
Pharm Res. 2006;
23:1517- 1524

[26] SCHLUMPF M, KYPKE K, WITTASSEK M, ANGERER J, MASCHER H, MASCHER D, VÖKT C, BIRCHLER M, LICHTENSTEIGER W. Exposure patterns of UV filters, fragrances, parabens, phthalates, organochlor pesticides, PBDEs, and PCBs in human milk: Correlation of UV filters with use of cosmetics.
Chemosphere. 2010;
81:1171- 1183

[27] SONI MG, CARABIN IG, BURDOCK GA. Safety assessment of esters of p-hydroxybenzoic acid (parabens).
Food Chem Toxicol. 2005;
43:985- 1015

[28] YE X, BISHOP AM, REIDY JA, NEEDHAM LL, CALAFAT AM. Parabens as Urinary Biomarkers of Exposure in Humans.
Environ Health Perspect. 2006;
114:1843- 1846

→ Aller vers SYNTHESE