Fonction de reproduction et différences entre espèces
2011
7-
Développement des organes sexuels
Les organes sexuels (ovaires, testicules, organes génitaux internes et externes, glandes mammaires) ainsi que le système endocrine qui les régulent se développent pendant la vie fœtale au cours de périodes de développement précises et spécifiques de chaque espèce. Le concept de programmation fœtale initiée par David Barker dans les années 1980, a mis en évidence que des perturbations survenues précocement au cours de la vie fœtale dans l’alimentation maternelle pouvaient être à l’origine de maladies survenant à l’âge adulte. Il est donc important de connaître et de prendre en compte la chronologie de ces événements de différenciation précoce pour estimer les impacts que pourront avoir les perturbateurs endocriniens sur ces organes et les fonctions qui en découlent. Les grandes étapes du développement de ces organes seront décrites dans ce chapitre.
Facteurs génétiques de la détermination et différenciation du sexe
Chez tous les vertébrés, le testicule et l’ovaire se développent à partir d’une ébauche embryonnaire qui est initialement bipotentielle. À différents moments de son développement, variables en fonction des espèces, ce primordium s’engage dans la différenciation mâle ou femelle en fonction de son patrimoine génétique (mammifères, oiseaux) ou de facteurs environnementaux comme la température ou le comportement (reptiles, poissons). On distingue donc deux types de détermination du sexe, la détermination du sexe génétique (Genetic Sex Determination-GSD) ou la détermination du sexe environnementale (Environmental Sex Determination-ESD).
Il sera important de prendre en compte ces différents modes de détermination sexuelle pour évaluer les effets de facteurs environnementaux comme les perturbateurs endocriniens sur cette détermination sexuelle. En effet, les espèces à ESD sont beaucoup plus sensibles à ces facteurs que les espèces à GSD. Une modification du milieu chez les poissons pourra donc avoir des conséquences plus importantes que chez d’autres espèces de vertébrés.
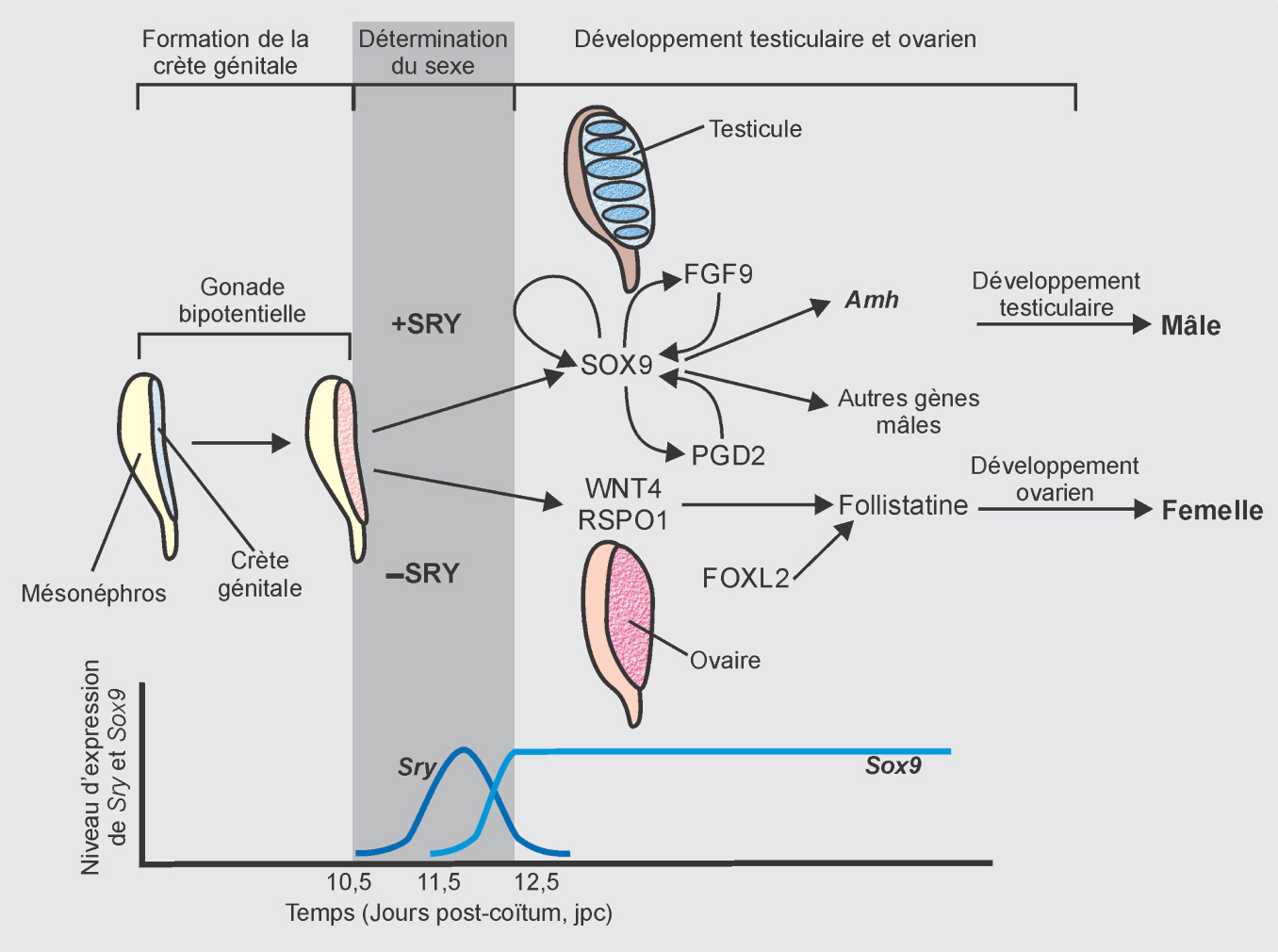
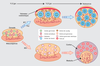
Chez les mammifères, le sexe est déterminé génétiquement à la fécondation selon que le spermatozoïde est porteur ou non du chromosome Y (XX pour la femelle et XY pour le mâle). Le gène
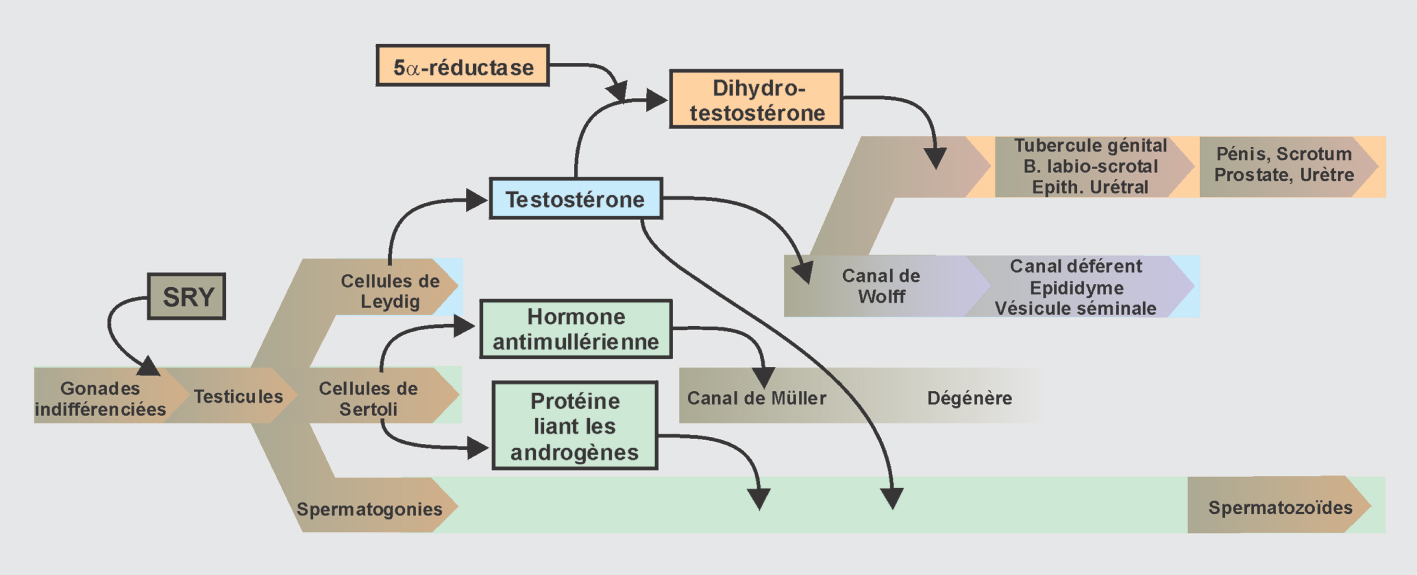
SRY présent sur le chromosome Y induit la différenciation mâle des cellules somatiques en cellules de Sertoli suite à une cascade de gènes (Kashimada et Koopman, 2010

). Chez la femelle, l’absence d’Y est nécessaire à la différenciation d’un ovaire. Cependant, la cascade génétique est moins bien connue chez la femelle. Cette étape précoce de différenciation des cellules somatiques de la gonade est cruciale pour le devenir du testicule ou de l’ovaire (figure 7.1

).
Il a été montré par des expériences d’inactivation de gènes chez la souris que l’altération de l’expression de gènes actifs à cette période très précoce de la vie avait des répercussions sur la fonction de reproduction des animaux à l’âge adulte : infertilité ou inversion sexuelle (Chaboissier et coll., 2004

; Parma et coll., 2006

; Pannetier et coll., 2010

). Toute substance chimique capable de perturber ces étapes précoces aura des effets néfastes sur la fonction de reproduction.
En fonction du sexe génétique, l’appareil génital se différencie pour produire des gamètes (gamétogenèse des cellules germinales) et synthétiser des hormones (stéroïdogenèse) sous l’effet desquelles les tractus interne et externe vont évoluer pour permettre la reproduction de l’individu.
L’appareil génital comprend les gonades (ovaires ou testicules) qui engendrent les cellules germinales, les voies internes qui évacuent les produits génitaux (avec des glandes qui peuvent être annexées aux conduits vecteurs) et les organes génitaux externes qui servent à l’accouplement.
Différenciation des gonades
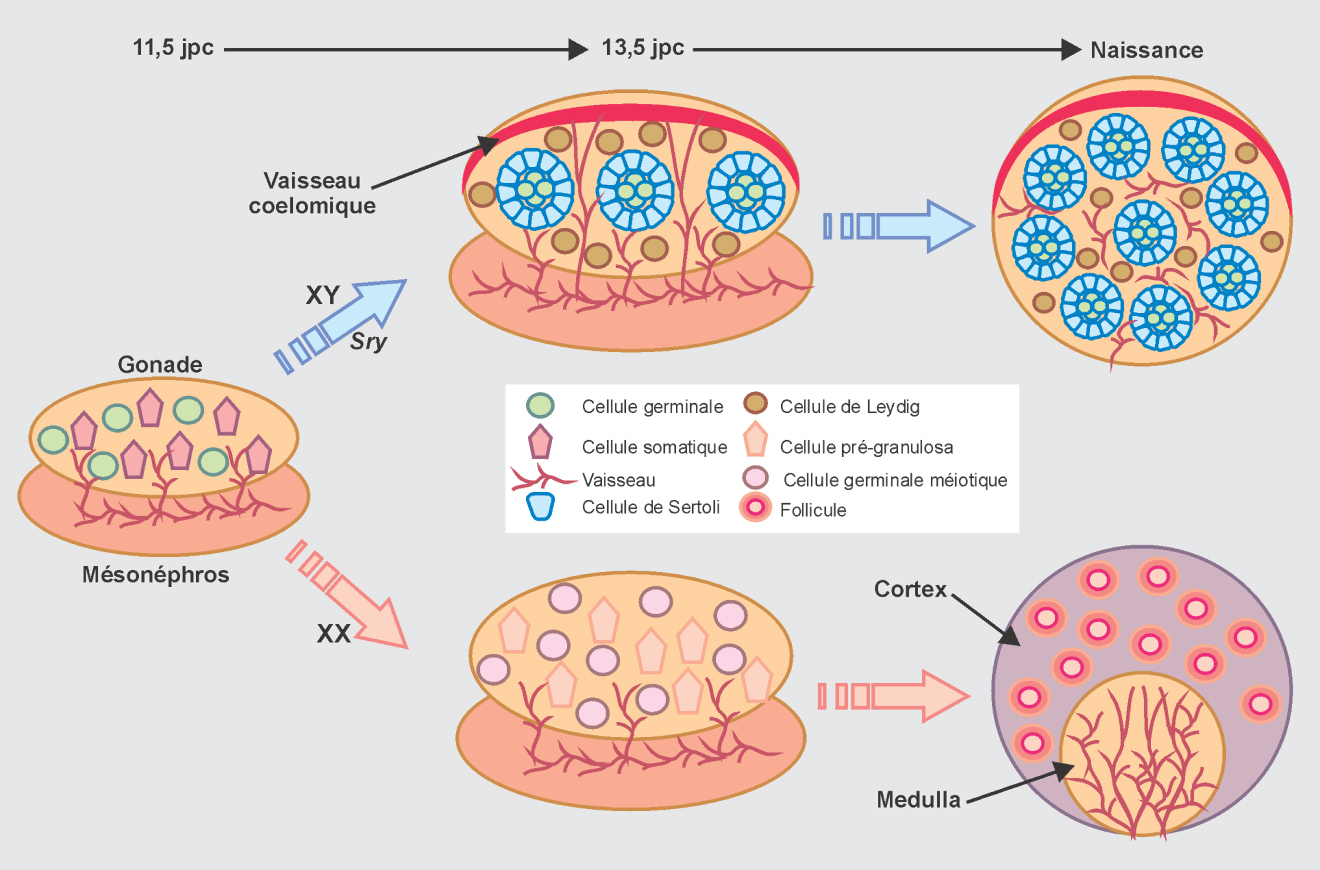
Chez les mammifères, les gonades se forment pendant la vie intra-utérine au cours du premier tiers de la gestation selon les espèces (9,5-10 jours post-conception chez la souris; 24 jours chez la brebis et 30 jours chez l’homme). Les gonades se différencient sur la face ventrale du mésonéphros et sont colonisées par les cellules germinales primordiales (Primordial Germ Cell-PGC) qui ont une origine extra-embryonnaire.
Les PGC, une fois arrivées dans les ébauches gonadiques (10,5-11,5 jpc chez la souris), vont proliférer intensivement. Elles se localisent différemment en fonction du sexe, en périphérie chez les femelles et dans toute la gonade chez le mâle.
Le testicule est organisé en cordons séminifères dans lesquels les cellules somatiques (cellules de Sertoli) entourent les cellules germinales (spermatogonies). Les cellules stéroïdogènes (cellules de Leydig), sources de testostérone, sont localisées à l’extérieur des tubes.
Les ovaires ont une structure caractéristique en cortex-médulla. Les ovogonies se développent dans le cortex, entourées de cellules de granulosa et des cellules steroïdogènes (figure 7.2

).
Les gonades mâles et femelles n’ont pas la même dépendance vis-à-vis des cellules germinales. En effet, les cellules germinales mâles ne sont pas nécessaires à la différenciation et à la maintenance du testicule alors que les PGC femelles le sont pour l’ovaire. Chez la souris, la perte des cellules germinales dans l’ovaire périnatal cause la désorganisation de l’ovaire postnatal et l’interruption de la folliculogenèse (Guigon et coll., 2005

; Mazaud Guittot et coll., 2006

). Dans l’espèce humaine, les individus femelles XO (un seul chromosome X) qui ont perdu leur PGC avant l’âge adulte (syndrome de Turner) ont des bandelettes fibreuses à la place des ovaires. Il en est de même pour les jeunes femmes XX ayant perdu leurs cellules germinales précocement (chimiothérapie). Les cellules germinales femelles auraient également comme rôle d’empêcher la différenciation d’un testicule dans la gonade femelle. Le stade auquel les cellules germinales sont perdues peut avoir un impact sur la sévérité du dysfonctionnement qui peut aller jusqu’à l’inversion sexuelle, comme cela est montré chez la souris (Guigon et Magre, 2006

).
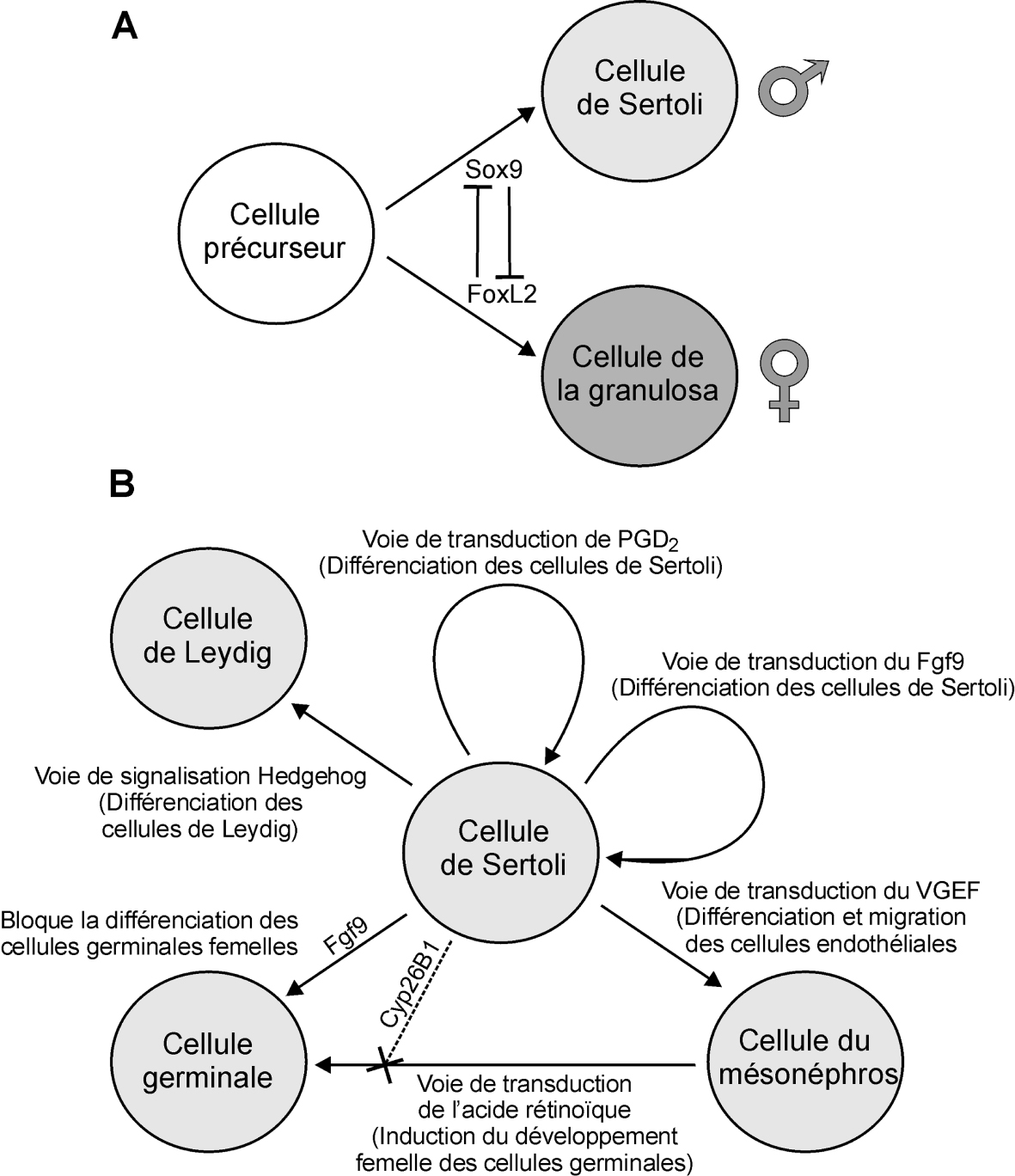
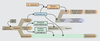
Une notion importante à garder en tête est la plasticité du système de détermination sexuelle, à tout moment de son développement. Le maintien dans un phénotype sexuel mâle ou femelle est basé sur un système de signalisation antagoniste (Sox9 pour le mâle et FoxL2 pour la femelle chez les mammifères) auquel sont associées de multiples boucles de régulation (figures 7.3A et B

).
Tout déséquilibre du système à différents points d’entrée va être amplifié et propagé par les boucles de régulation et engendrer des altérations du développement testiculaire ou ovarien pouvant aller de la subfertilité jusqu’à l’inversion sexuelle. En fonction du nombre et du moment où les cellules germinales vont être perdues, on pourra obtenir tout un spectre de physiopathologies plus ou moins sévères.
Suite à ces premières étapes, s’en suit une période d’intense prolifération des cellules germinales. Selon les espèces, cette période est sous le contrôle des œstrogènes chez les femelles (ruminants). Le fait que la stéroïdogenèse soit active ou non chez les femelles pendant la vie fœtale constitue une différence importante entre espèces. Les espèces avec un système hormonal actif seront plus sensibles aux effets de perturbateurs endocriniens que celles, comme les rongeurs, chez lesquelles le système est inactif pendant la vie fœtale. À l’inverse, chez les mâles, la stéroïdogenèse est activée précocement quelles que soient les espèces.
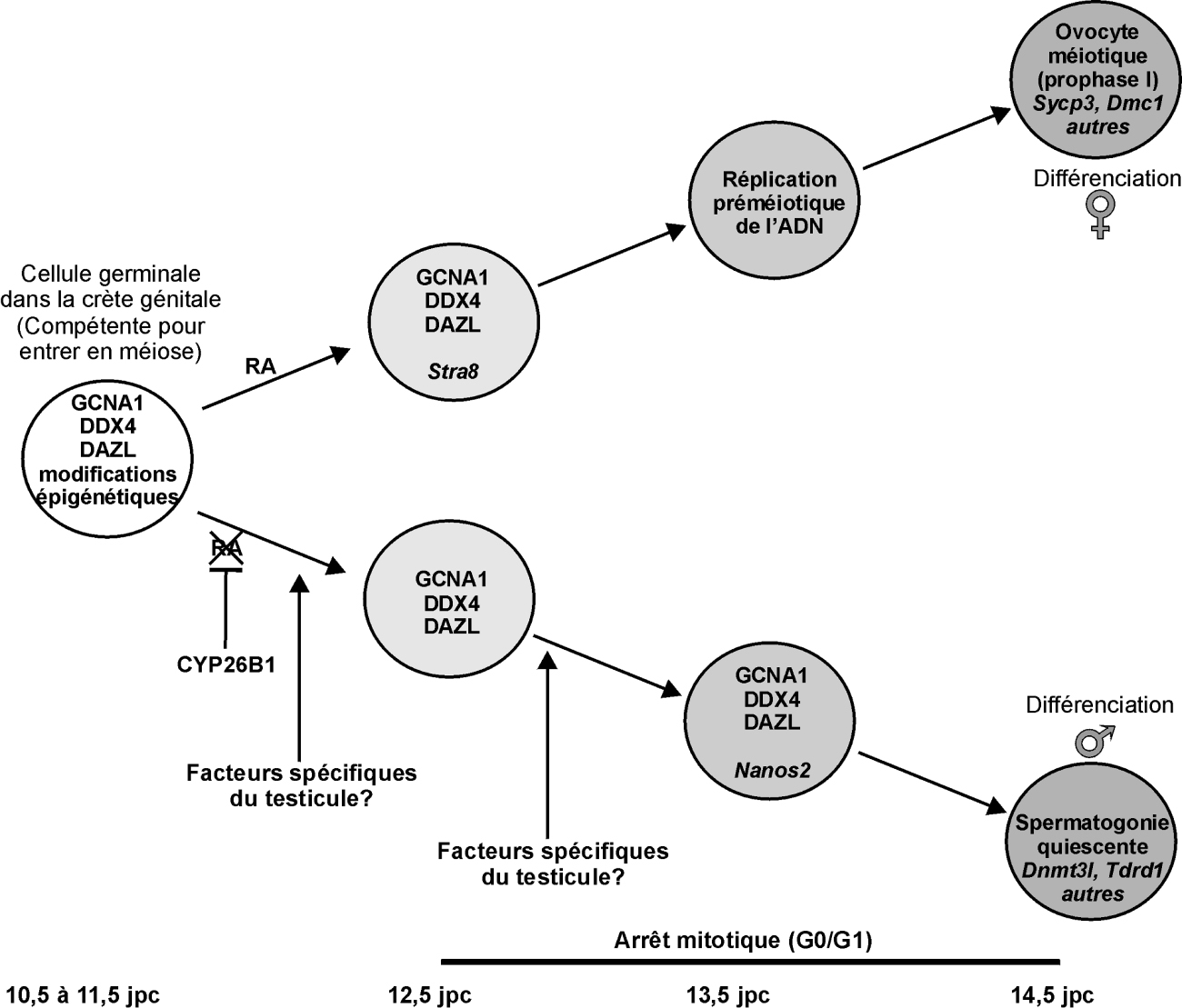
Un événement majeur va ensuite avoir lieu au niveau des cellules germinales. Tandis que les PGC mâles vont cesser de se multiplier et entrer en quiescence, les PGC femelles vont entrer en prophase I de méiose. L’entrée en méiose est contrôlée en partie par la voie de signalisation de l’acide rétinoïque, laquelle est bloquée chez le mâle. La cascade moléculaire impliquée dans l’arrêt mitotique des spermatogonies n’est pas complètement connue mais plusieurs facteurs clés ont été découverts récemment (Bowles et Koopman, 2010

; figure 7.4

). Chez la femelle, le rôle de l’acide rétinoïque dans l’initiation et le déroulement de la méiose semble également différent en fonction des espèces (Le Bouffant et coll., 2010

). Le stade de développement auquel la méiose va survenir varie selon les espèces, il conviendra d’en tenir compte pour évaluer l’impact des perturbateurs endocriniens sur la gamétogenèse en fonction des fenêtres d’exposition.
Différenciation testiculaire
La différenciation testiculaire est caractérisée par la formation de cordons séminifères, c’est-à-dire de cordons épithéliaux composés de cellules germinales (les spermatogonies, qui subissent une période de multiplication puis un arrêt mitotique dû à l’environnement testiculaire) et de cellules somatiques (les cellules de Sertoli). La différenciation des cellules de Sertoli est le premier évènement de l’organogenèse testiculaire. En même temps se différencie la tunique albuginée, assise de tissu conjonctif se développant sous l’épithélium cœlomique. Entre ces cordons, au sein du mésenchyme, les cellules de Leydig se différencient, à partir de la huitième semaine chez l’homme.
Le testicule fœtal, très précocement, sécrète deux types d’hormones : l’hormone anti-müllérienne (AMH) sécrétée par les cellules de Sertoli et la testostérone produite par les cellules de Leydig. Ces hormones exercent deux sortes d’action pendant la différenciation de l’appareil génital, d’une part, l’AMH provoque la disparition des canaux de Müller, d’autre part, la testostérone ou la dihydrotestostérone (DHT) sont responsables de la différenciation des voies génitales mâles, la masculinisation du sinus urogénital et des organes génitaux externes (figure 7.5

).
Les cellules de Leydig produisent également le facteur 3 insulino-semblable (INSL3). INSL3 est produit aussi bien dans les cellules de Leydig fœtales que dans ces mêmes cellules adultes. Il a été démontré que le principal facteur responsable du développement (épaississement et allongement) du gubernaculum, le ligament qui fixe le testicule au scrotum, au début de la différenciation sexuelle mâle, était INSL3. De plus, les souris mâles chez lesquelles le gène codant pour INSL3 a été invalidé, présentent toutes un phénotype cryptorchide évident, sans aucune autre anomalie génitale (Feng et coll., 2009

).
Testicule durant l’enfance
À la naissance, les testicules contiennent des cellules de Leydig néonatales et des cordons séminifères (sans lumière centrale) dans lesquels vont être retrouvées les cellules de Sertoli immatures et les cellules germinales néonatales dont on pense qu’il existe trois types : les gonocytes, les cellules intermédiaires et les pré-spermatogonies (Mieusset, 2010

).
La réactivation après la naissance du système hypothalamo-hypophyso-testiculaire appelé mini puberté entraîne une augmentation des sécrétions de gonadotrophines qui atteint un maximum vers 2-3 mois. La sécrétion de testostérone est le résultat de la stimulation et de la multiplication des cellules de Leydig, sécrétion qui va ensuite diminuer après le 3e mois. L’AMH augmente au premier mois pour atteindre un maximum vers 6 mois, puis décroît durant l’enfance. L’inhibine va également augmenter pour atteindre un pic avec des valeurs supérieures à celles retrouvées chez l’adulte, pour décroître après 15 mois et avoir des valeurs basses jusqu’à la puberté.
Après la naissance, les cellules germinales se transforment en spermatogonies Ad (voir plus loin), dont le nombre pourrait être un des facteurs conditionnant la spermatogenèse à l’âge adulte.
Des cellules germinales allant jusqu’au stade spermatocytes I ont pu être retrouvées chez le petit enfant témoignant d’une évolution occasionnelle des spermatogonies et montrant que le testicule de l’enfant n’était pas obligatoirement au repos (Chemes, 2001

).
Les cellules de Sertoli immatures, n’exprimant pas le récepteur aux androgènes et exprimant l’AMH, vont se multiplier. À la puberté (environ 9-14 ans), les cellules de Sertoli deviennent matures et expriment le récepteur des androgènes et la sécrétion d’AMH diminue.
Dans le contexte d’exposition à des substances pouvant avoir un effet délétère sur la fonction de reproduction masculine, l’ensemble des processus physiologiques se déroulant durant l’enfance, et notamment en période postnatale, ne doit pas être ignoré, dans la mesure où ces étapes sont probablement importantes pour une spermatogenèse optimale chez l’adulte.
Développement de l’ovaire
Le développement de l’ovaire comporte deux étapes clés : la méiose des ovogonies et la formation des follicules, le follicule étant l’unité fonctionnelle de l’ovaire. Il existe un décalage dans le temps entre la différenciation mâle et femelle. Chez tous les mammifères, la différenciation ovarienne est plus tardive que la différenciation testiculaire (voir tableau 7.I

). Il faudra en tenir compte dans le choix des fenêtres d’exposition.
Formation des follicules
On distingue deux grandes phases de formation des follicules, celle indépendante des hormones gonadotropes et celle qui survient après la puberté sous le contrôle hormonal. En dehors de l’ovocyte, le follicule est composé de cellules somatiques nourricières, les cellules de granulosa ou cellules folliculaires. Puis dans un deuxième temps, se différencient les cellules de la thèque qui fournissent aux cellules de granulosa productrices d’œstrogènes par l’enzyme aromatase, le précurseur androstènedione.
Les différents stades de la folliculogenèse sont la formation des follicules primordiaux (pool ou réserve ovarienne), le recrutement des follicules à partir du pool des primordiaux pour former les follicules primaires, secondaires, tertiaires et enfin les follicules ovulatoires et le corps jaune.
Formation des follicules primordiaux
Les ovocytes après avoir entamé leur prophase 1 de méiose vont interrompre celle-ci au stade diplotène et rester bloqués jusqu’à la reprise de méiose au moment de l’ovulation soit plus de 15 à 50 ans plus tard chez la femme. Chez la souris, la méiose est arrêtée à 14,5 jpc. Avant de former les follicules, les ovocytes bloqués sont regroupés en nids ovigères aussi appelés cystes. Les follicules primordiaux se forment de la rupture de ces nids et de l’association d’un ovocyte avec quelques (3-4) cellules pre-granulosa. Cette association représente le premier stade de la folliculogenèse ; il a lieu pendant la dernière moitié de la gestation chez l’homme et quelques jours après la naissance chez la souris (Baker, 1963

; Hirshfield, 1991

).
Chez les mammifères, la population de follicules primordiaux créée dans l’ovaire fœtal ou néonatal constitue un pool fini d’ovocytes appelé la réserve, disponible pendant toute la durée de vie reproductive des femelles. Cela constitue une différence majeure entre mâles et femelles. Car chez les mâles, la méiose n’aura lieu qu’après la puberté, sans interruption et le renouvellement des spermatogonies aura lieu durant toute la vie adulte.
Une exposition in utero pourra donc avoir des effets à très long terme sur la fertilité femelle, une altération de la réserve est irréversible alors que chez le mâle la spermatogenèse est continue.
Maintenance des follicules primordiaux et recrutement initial
Le recrutement des follicules est généralement subdivisé en deux catégories : tout d’abord l’activation initiale des follicules primordiaux, qui se produit toute la vie jusqu’à la ménopause chez la femme, et ensuite, après la puberté, le recrutement cyclique d’un nombre limité de petits follicules à partir des follicules en croissance, à partir desquels une sous-fraction ou un seul sera sélectionné pour la dominance et l’ovulation (McGee et Hsueh, 2000

). Bien que le recrutement initial des primordiaux vers le pool en croissance reste un processus peu compris, l’étude de souris mutantes (
knock out) a permis l’identification de plusieurs facteurs clés régulateurs de cette étape précoce de la folliculogenèse parmi lesquels des facteurs de transcription (Nobox, FoxL2...) et des facteurs de croissance (BMP15, GDF9) (Edson et coll., 2009

).
Tableau 7.I Chronologie de la différenciation des gonades
|
Principales étapes chez les mâles (M) et les femelles (F)
|
Stade de développement chez la souris (et le rat) en jours post coïtum (jpc)
|
Stade de développement chez l’homme en semaines post conception (sem)
|
|
Migration des cellules génitales dans la crête génitale
|
10 à 11 jpc (13 jpc)
|
4 à 5 sem
|
|
Différenciation des cordons séminifères (M)
|
12 jpc (14 jpc)
|
7 sem
|
|
Différenciation des cellules de Leydig (M)
|
12,5-13 jpc (15 jpc)
|
8 sem
|
|
Début de la prophase méiotique (F)
|
13,5 à 14 jpc (16,5-17 jpc)
|
9-11 sem
|
|
Début de la folliculogénèse (F)
|
À la naissance (3 jours après la naissance)
|
15-16 sem
|
Cependant, il est important de noter que bien que les gonades adultes présentent des structures remarquablement similaires d’un point de vue morphologique chez différentes espèces de vertébrés, les mécanismes moléculaires et cellulaires utilisés pour créer ces organes similaires ne sont pas conservés au cours de l’évolution. Il faudra donc en tenir compte avant d’extrapoler d’une espèce à l’autre.
Formation du tractus génital interne et externe
Voies génitales internes
Au moment où débute la différenciation gonadique mâle, le tractus est encore sexuellement indifférencié. Le mésonéphros s’est mis en place, pendant la quatrième semaine du développement fœtal humain. Dans le mésonéphros, des néphrons débouchent dans le canal de Wolff, qui, à la cinquième semaine, continue son extension sous la vessie jusqu’au sinus-urogénital, et forme un diverticule à la hauteur de l’ébauche du métanéphros (futur rein). Quant au canal de Müller, il est issu d’une invagination de l’épithélium cœlomique de la région antérieure du mésonéphros, ayant pris naissance à proximité de la région antérieure du canal de Wolff au cours de la sixième semaine, pendant la période de formation des crêtes génitales. Il se développe ensuite vers l’avant et vers l’arrière jusqu’au sinus urogénital en cheminant le long du canal de Wolff.
Chez le fœtus mâle, la différenciation des voies génitales, en réponse à l’action de la testostérone produite par les cellules de Leydig dans les testicules fœtaux, débute dès la 8e semaine de gestation dans l’espèce humaine.
Deux phénomènes vont marquer la différenciation des voies génitales masculines :
• la régression des canaux paramésonéphrotiques (de Müller) ;
• le développement et la différenciation des canaux mésonéphrotiques (de Wolff).
Sous l’action de l’AMH, les canaux de Müller régressent totalement, ne laissant qu’un reliquat facultatif au niveau de l’épididyme (l’hydatide sessile) et un petit diverticule de l’urètre prostatique (l’utricule prostatique).
Dans leur partie moyenne, les canaux de Wolff, sous l’action des androgènes, constituent les canaux épididymaires, où s’abouchent les canaux efférents. Dans leur portion inférieure, ils deviennent les canaux éjaculateurs qui débouchent dans l’urètre prostatique. En résumé, le canal mésonéphrotique (canal de Wolff) va donner naissance à l’épididyme, au canal déférent, à la vésicule séminale et au canal éjaculateur.
Différenciation des glandes sexuelles accessoires
Les vésicules séminales vont se différencier au cours de la 12e semaine, à partir d’une évagination du canal déférent. Ces glandes paires produisent l’essentiel des sécrétions nourricières pour le sperme. La partie du canal de Wolff comprise entre les vésicules séminales et l’urètre prostatique s’appelle le canal éjaculateur. Entre les deux canaux éjaculateurs s’abouche l’utricule prostatique impair (vestige des canaux de Müller).
La prostate se développe à partir d’excroissances entoblastiques de la face postérieure de l’urètre prostatique dans le courant de la 12e semaine. La glande devient active à partir de la 15e semaine. Elle englobe à ce stade les canaux éjaculateurs et l’utricule prostatique ainsi que l’urètre prostatique.
Dans le courant de la 12e semaine et parallèlement au développement de la prostate, les glandes bulbo-urétrales (de Cowper) se développent à partir de bourgeonnements entoblastiques pairs de l’urètre pénien qui fait suite à l’urètre prostatique. Ce sont finalement les sécrétions des vésicules séminales, de la prostate et des glandes bulbo-urétrales et urétrales qui entrent dans la composition du liquide séminal.
Les organes génitaux externes se forment de la 9e à la 14e semaine de gestation chez l’homme, à partir du tubercule génital. Les orifices génital et urinaire sont communs.
Enfin, la migration des testicules en dehors de l’abdomen, dans le scrotum, se fait durant le septième et le huitième mois de la grossesse. La position des testicules est déterminée par deux ligaments génitaux : le ligament suspenseur crânial et le gubernaculum (ou ligament génital caudal). Chez les mâles, c’est la croissance des gubernaculums qui permet la descente des testicules en position scrotale. L’absence de cette descente testiculaire, ou cryptorchidie, entraîne une stérilité.
Chez le fœtus femelle, c’est durant la 7e semaine de gestation que les voies génitales se différencient. En l’absence d’AMH, les canaux mésonéphrotiques (de Wolff) régressent et les conduits paramésonéphrotiques ou canaux de Müller donnent naissance aux futures trompes utérines, à l’utérus et à la partie supérieure du vagin.
Les canaux de Wolff régressent à l’exception de quelques vestiges embryonnaires : l’époophore, le paroophore au niveau du mésovarium et de petits kystes allongés appelés canaux de Gartner au niveau du vagin.
Les canaux de Müller forment, dans leurs segments supérieurs, les trompes de Fallope. Dans leurs segments inférieurs, ils fusionnent pour constituer le canal utéro-vaginal (présentant un renflement postérieur, le tubercule de Müller) alors que les segments moyens évoluent en deux cornes utérines. À partir du quatrième mois, les deux cornes utérines se soudent en un utérus unique, le tubercule de Müller devient le col de l’utérus et le vagin se cavite. La partie distale des conduits, génital (partie basse du vagin) et urinaire, dépend de l’évolution du sinus urogénital, à partir du quatrième mois. Les organes génitaux externes se forment au cours du troisième mois à partir du tubercule génital. Les orifices urinaire et génital sont totalement distincts l’un de l’autre.
Organes génitaux externes
Il est important de remarquer que l’aspect morphologique des organes génitaux externes est similaire dans les deux sexes jusqu’à la 9e semaine.
Chez le mâle, sous l’effet des hormones androgènes, la différenciation et le développement des organes génitaux, deviennent manifestes à partir du 3
e mois chez le fœtus humain masculin (tableau 7.II

).
Le tubercule génital s’allonge pour former le pénis et entraîne avec lui les replis urogénitaux. La partie postérieure des bourrelets labio-scrotaux se transforme en bourrelets scrotaux. L’urètre pénien s’entoure d’une masse de tissu mésenchymateux érectile, le corps spongieux, qui se prolonge dans l’extrémité du pénis, formant le gland. Au-dessus du corps spongieux, les deux corps caverneux complètent le tissu érectile du pénis. Les deux bourrelets scrotaux fusionnent à leur tour sur la ligne médiane et forment le scrotum. La ligne de soudure du scrotum et du pénis est appelée le raphé médian.
Les mécanismes du développement des organes génitaux externes chez la femelle restent encore largement incompris, mais les œstrogènes sécrétés par le placenta et les ovaires fœtaux semblent y contribuer.
Le tubercule génital ne s’allonge que très peu, puis régresse dès la 14e semaine et devient le clitoris. Les plis urogénitaux ne fusionnent pas à ce niveau et le sinus urogénital reste largement ouvert avec l’urètre à sa partie antérieure et le vagin à sa partie postérieure (portion vestibulaire du sinus). Les plis urogénitaux non fusionnés donneront naissance aux petites lèvres (labia minora), alors que les plis labioscrotaux vont former les grandes lèvres (labia majora), qui fusionnent à l’arrière pour former la commissure labiale postérieure, alors qu’antérieurement elles forment le mont pubis.
Tableau 7.II Chronologie de la différenciation du tractus génital
|
Principales étapes
Fœtus mâles (M) et femelles (F)
|
Âge du fœtus murin
en jours post coïtum (jpc)
|
Âge du fœtus humain
en semaine post conception (sem)
|
|
Régression des canaux de Müller
|
14 jpc
|
8 sem
|
|
Masculinisation des organes génitaux externes, distance anogénitale augmentée (M)
|
16 jpc
|
9 à 10 sem
|
|
Vésicules séminales (M)
|
16 jpc
|
10 sem
|
|
Bourgeons prostatiques (M)
|
17 jpc
|
10 sem
|
|
Régression des canaux de Wolff (F)
|
15 jpc
|
10 sem
|
|
Fin de la migration testiculaire (M)
|
18 jpc
| |
|
intra-abdominale
| |
12 sem
|
|
intra-scrotale
| |
28 sem
|
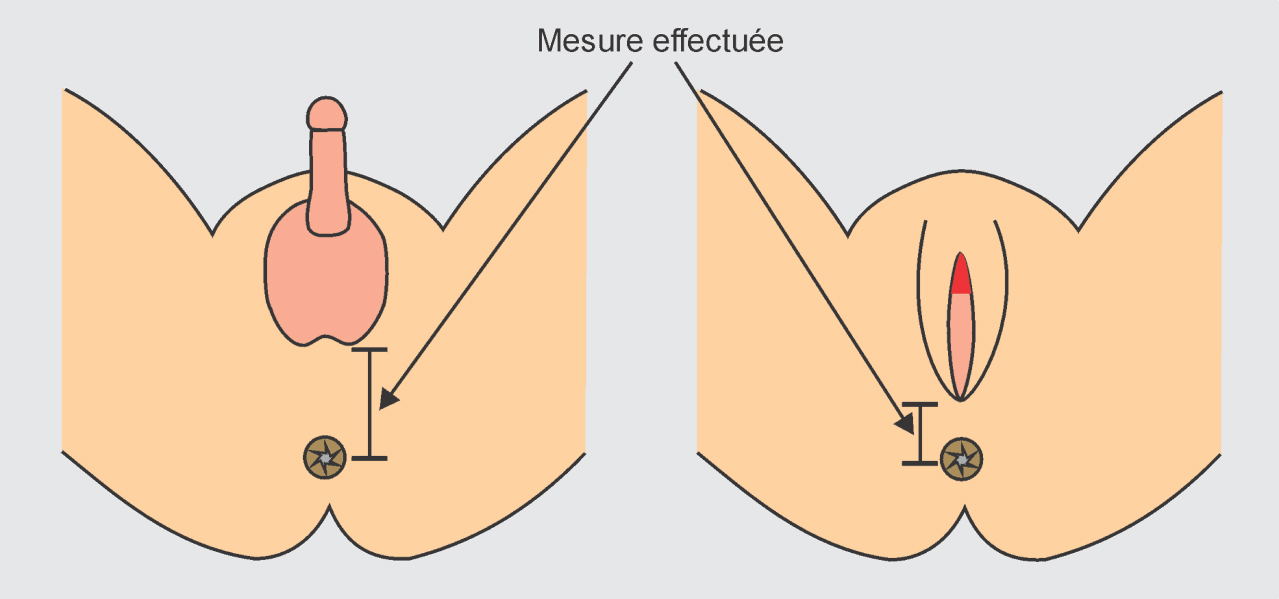
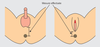
La différenciation des organes génitaux externes aboutit à une différence de longueur de la distance anogénitale entre les sexes. Celle-ci est courte chez la femelle et plus longue chez le mâle (figure 7.6

).
La distance anogénitale est une mesure utilisée pour traduire le taux d’hormones auquel l’individu a été exposé in utero ou dans la prime enfance. D’abord développée et utilisée par les biologistes sur des modèles animaux, elle est également utilisée chez l’homme dans le cadre d’études sur les perturbateurs endocriniens. Cette distance augmente chez le garçon lorsque, in utero, le testicule embryonnaire commence à produire de la testostérone. Du développement fœtal à la puberté, cette distance est contrôlée par les hormones. Il a été montré qu’une distance anogénitale plus petite était un signe de féminisation des rongeurs mâles, un indicateur qui traduit en fait une moindre exposition fœtale des cellules à la testostérone et qui s’accompagne souvent d’anomalies du développement des organes génitaux mâles (micropénis en particulier). Chez l’homme, la distance anogénitale semble également corrélable avec un risque augmenté d’anomalies qui évoquent une féminisation (que l’on suppose due à l’exposition à des perturbateurs endocriniens lors de la vie fœtale, au moment de la formation des testicules).
Développement mammaire
Période embryonnaire
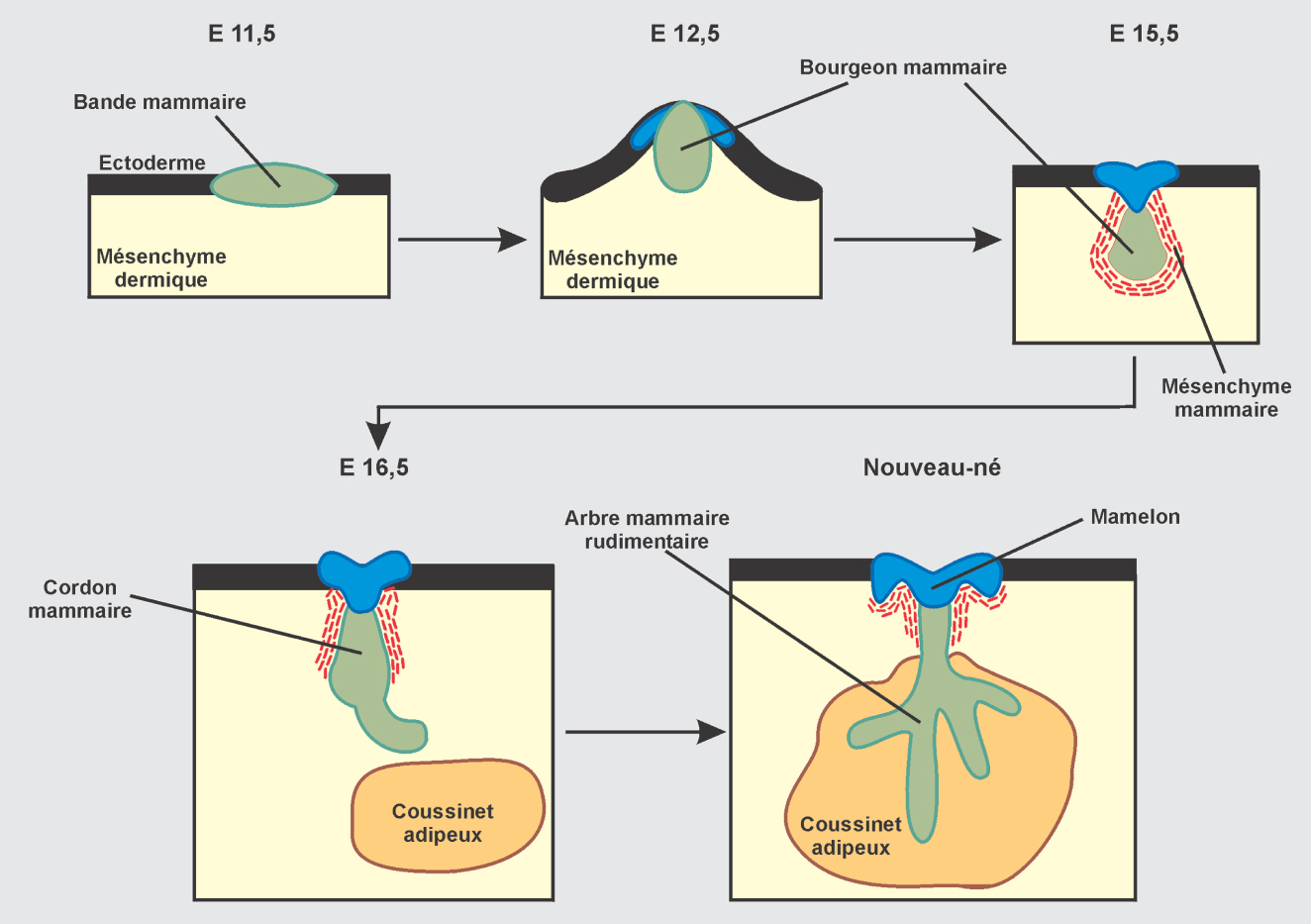
Au cours de la 5
e semaine de gestation, l’ectoblaste s’épaissit de chaque côté du tronc entre les racines des membres supérieur et inférieur pour former les bandes mammaires. Ceci se produit par migration et concentration cellulaires et non par multiplication des cellules (Balinsky, 1950

chez le lapin). Les bandes mammaires s’épaississent grâce à la participation du mésenchyme sous-jacent, on parle alors de crêtes mammaires. Rapidement, les crêtes régressent, laissant 5 à 7 points mammaires de chaque côté. La plupart des points mammaires régressent également. À la 8
e semaine chez l’homme, un seul point mammaire persiste de chaque côté, en région thoracique.
Au niveau de ce point mammaire, un nodule ectoblastique plein s’enfonce dans une condensation du mésenchyme sous-jacent pour former le bourgeon mammaire primaire dont l’évolution s’arrête temporairement.
Période fœtale
La croissance reprend vers le 5e mois. Le bourgeon primaire se déprime en surface (cupule mammaire) et émet en profondeur 15 à 20 bourgeons secondaires pleins. Les extrémités vont se diviser. Puis, à mi-longueur de ces cordons pleins, une lumière apparaît par destruction des cellules internes. Au cours des 8e et 9e mois, les ramifications s’étendent et les cellules externes se différencient en cellules sécrétrices et en cellules myoépithéliales. La croissance et la différenciation des ébauches épithéliales nécessitent la présence de tissu dermique qui joue un rôle inducteur.
Période prénatale
À l’approche du terme, les mamelons qui sont de grosses papilles cutanées, se soulèvent par épaississement dermique. Des muscles lisses radiaires et annulaires se différencient dans les mamelons. Après desquamation superficielle de l’épiderme, les canaux lobaires s’ouvrent.
Sous l’influence des hormones maternelles et placentaires, les glandes mammaires peuvent, dans les deux sexes, présenter une activité sécrétoire qui accompagne la crise génitale du nouveau-né. Cette sécrétion est connue sous le nom de « lait de sorcière ».
Chez le fœtus humain à terme, les mamelles sont identiques dans les deux sexes. Dans certaines espèces, comme les souris, il existe un dimorphisme sexuel des glandes mammaires dès avant la naissance.
Les différentes étapes sont résumées à la figure 7.7

.
Période postnatale
Du fait de l’absence de stimulation hormonale, la glande revient au repos et y reste jusqu’à la période prépubertaire. Au cours de la première année, le tissu conjonctif se développe. Il apparaît du tissu adipeux et des manchons conjonctifs périglandulaires se différencient. Durant toute l’enfance, la glande va rester quiescente, et sa croissance sera très lente.
Période pubertaire
Chez le garçon, la puberté ne modifie pas la glande, en dehors de phénomènes d’hypertrophie transitoires. Durant tout le reste de la vie, la glande conservera un aspect proche de celui de la période prépubertaire.
Dans le sexe féminin, au contraire, une croissance active se produit sous l’influence des hormones sexuelles ovariennes. L’œstradiol entraîne une prolifération canaliculaire et le développement du tissu adipeux. Les canaux et les culs de sacs pénètrent le conjonctif voisin qui achève de s’organiser autour des structures épithéliales.
Si une grossesse survient, une nouvelle phase de croissance amène la glande à son stade fonctionnel qui persiste le temps de l’allaitement. À la ménopause, la stimulation hormonale s’arrête et la glande évolue vers une atrophie de type prépubertaire.
Bibliographie
[1] BAKER TG. A quantitative and cytological study of germ cells in human ovaries.
Proc R Soc Lond B Biol Sci. 1963;
158:417
-433

[2] BALINSKY BI. On the prenatal growth of the mammary gland rudiment in the mouse.
J Anat. 1950;
84:227
-235

[3] BOWLES J, KOOPMAN P. Sex determination in mammalian germ cells: extrinsic versus intrinsic factors.
Reproduction. 2010;
139:943
-958

[4] CHABOISSIER MC, KOBAYASHI A, VIDAL VI, LÜTZKENDORF S, VAN DE KANT HJ, . Functional analysis of Sox8 and Sox9 during sex determination in the mouse.
Development. 2004;
131:1891
-1901

[5] CHEMES HE. Infancy is not a quiescent period of testicular development.
Int J Androl. 2001;
24:2
-7

[6] COWIN P, WYSOLMERSKI J. Molecular mechanisms guiding embryonic mammary gland development.
Cold Spring Harb Perspect Biol. 2010;
2:a003251

[7] DEFALCO T, CAPEL B. Gonad morphogenesis in vertebrates: divergent means to a convergent end.
Annu Rev Cell Dev Biol. 2009;
25:457
-482

[8] EDSON MA, NAGARAJA AK, MATZUK MM. The mammalian ovary from genesis to revelation.
Endocr Rev. 2009;
30:624
-712

[9] FENG S, FERLIN A, TRUONG A, BATHGATE R, WADE JD, et coll. INSL3/RXFP2 signaling in testicular descent.
Ann N Y Acad Sci. 2009;
1160:197
-204

[10] GUIGON CJ, COUDOUEL N, MAZAUD-GUITTOT S, FOREST MG, MAGRE S. Follicular cells acquire sertoli cell characteristics after oocyte loss.
Endocrinology. 2005;
146:2992
-3004

[11] GUIGON CJ, MAGRE S. Contribution of germ cells to the differentiation and maturation of the ovary: insights from models of germ cell depletion.
Biol Reprod. 2006;
74:450458Erratum in :
Biol Reprod 2006,
75 : 660.

[12] HIRSHFIELD AN. Development of follicles in the mammalian ovary.
Int Rev Cytol. 1991;
124:43
-101

[13] KASHIMADA K, KOOPMAN P. SRY: the master switch in mammalian sex determination.
Development. 2010;
137:3921
-3930

[14] LE BOUFFANT R, GUERQUIN MJ, DUQUENNE C, FRYDMAN N, COFFIGNY H, et coll. Meiosis initiation in the human ovary requires intrinsic retinoic acid synthesis.
Hum Reprod. 2010;
25:2579
-2590

[15] MAZAUD GUITTOT S, GUIGON CJ, COUDOUEL N, MAGRE S. Consequences of fetal irradiation on follicle histogenesis and early follicle development in rat ovaries.
Biol Reprod. 2006;
75:749
-759

[16] MCGEE EA, HSUEH AJ. Initial and cyclic recruitment of ovarian follicles.
Endocr Rev. 2000;
21:200
-214

[17] MIEUSSET R. Anomalies postnatales du développement de la spermatogenèse associées aux troubles de la migration testiculaire.
Andrologie. 2010;
20:179
-189

[18] PANNETIER M, PAILHOUX E. FoxL2, the gatekeeper of ovarian identity.
Med Sci. (Paris):2010;
26:470473

[19] PARMA P, RADI O, VIDAL V, CHABOISSIER MC, DELLAMBRA E, et coll. R-spondin1 is essential in sex determination, skin differentiation and malignancy.
Nat Genet. 2006;
38:1304
-1309

[20] SALAZAR-MARTINEZ E, ROMANO-RIQUER P, YANEZ-MARQUEZ E, LONGNECKER MP, HERNANDEZ-AVILA M. Anogenital distance in human male and female newborns: a descriptive, cross-sectional study.
Environ Health. 2004;
3:8

→ Aller vers SYNTHESE
 ). Chez la femelle, l’absence d’Y est nécessaire à la différenciation d’un ovaire. Cependant, la cascade génétique est moins bien connue chez la femelle. Cette étape précoce de différenciation des cellules somatiques de la gonade est cruciale pour le devenir du testicule ou de l’ovaire (figure 7.1
). Chez la femelle, l’absence d’Y est nécessaire à la différenciation d’un ovaire. Cependant, la cascade génétique est moins bien connue chez la femelle. Cette étape précoce de différenciation des cellules somatiques de la gonade est cruciale pour le devenir du testicule ou de l’ovaire (figure 7.1 ).
).
 )
) ; Parma et coll., 2006
; Parma et coll., 2006 ; Pannetier et coll., 2010
; Pannetier et coll., 2010 ). Toute substance chimique capable de perturber ces étapes précoces aura des effets néfastes sur la fonction de reproduction.
). Toute substance chimique capable de perturber ces étapes précoces aura des effets néfastes sur la fonction de reproduction. ).
). ; Mazaud Guittot et coll., 2006
; Mazaud Guittot et coll., 2006 ). Dans l’espèce humaine, les individus femelles XO (un seul chromosome X) qui ont perdu leur PGC avant l’âge adulte (syndrome de Turner) ont des bandelettes fibreuses à la place des ovaires. Il en est de même pour les jeunes femmes XX ayant perdu leurs cellules germinales précocement (chimiothérapie). Les cellules germinales femelles auraient également comme rôle d’empêcher la différenciation d’un testicule dans la gonade femelle. Le stade auquel les cellules germinales sont perdues peut avoir un impact sur la sévérité du dysfonctionnement qui peut aller jusqu’à l’inversion sexuelle, comme cela est montré chez la souris (Guigon et Magre, 2006
). Dans l’espèce humaine, les individus femelles XO (un seul chromosome X) qui ont perdu leur PGC avant l’âge adulte (syndrome de Turner) ont des bandelettes fibreuses à la place des ovaires. Il en est de même pour les jeunes femmes XX ayant perdu leurs cellules germinales précocement (chimiothérapie). Les cellules germinales femelles auraient également comme rôle d’empêcher la différenciation d’un testicule dans la gonade femelle. Le stade auquel les cellules germinales sont perdues peut avoir un impact sur la sévérité du dysfonctionnement qui peut aller jusqu’à l’inversion sexuelle, comme cela est montré chez la souris (Guigon et Magre, 2006 ).
).
 )
) ).
).
 ; figure 7.4
; figure 7.4 ). Chez la femelle, le rôle de l’acide rétinoïque dans l’initiation et le déroulement de la méiose semble également différent en fonction des espèces (Le Bouffant et coll., 2010
). Chez la femelle, le rôle de l’acide rétinoïque dans l’initiation et le déroulement de la méiose semble également différent en fonction des espèces (Le Bouffant et coll., 2010 ). Le stade de développement auquel la méiose va survenir varie selon les espèces, il conviendra d’en tenir compte pour évaluer l’impact des perturbateurs endocriniens sur la gamétogenèse en fonction des fenêtres d’exposition.
). Le stade de développement auquel la méiose va survenir varie selon les espèces, il conviendra d’en tenir compte pour évaluer l’impact des perturbateurs endocriniens sur la gamétogenèse en fonction des fenêtres d’exposition.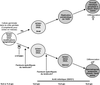
 )
) ).
).
 ).
). ).
). ).
). ). Il faudra en tenir compte dans le choix des fenêtres d’exposition.
). Il faudra en tenir compte dans le choix des fenêtres d’exposition. ; Hirshfield, 1991
; Hirshfield, 1991 ).
). ). Bien que le recrutement initial des primordiaux vers le pool en croissance reste un processus peu compris, l’étude de souris mutantes (knock out) a permis l’identification de plusieurs facteurs clés régulateurs de cette étape précoce de la folliculogenèse parmi lesquels des facteurs de transcription (Nobox, FoxL2...) et des facteurs de croissance (BMP15, GDF9) (Edson et coll., 2009
). Bien que le recrutement initial des primordiaux vers le pool en croissance reste un processus peu compris, l’étude de souris mutantes (knock out) a permis l’identification de plusieurs facteurs clés régulateurs de cette étape précoce de la folliculogenèse parmi lesquels des facteurs de transcription (Nobox, FoxL2...) et des facteurs de croissance (BMP15, GDF9) (Edson et coll., 2009 ).
). ).
). ).
).
 )
) chez le lapin). Les bandes mammaires s’épaississent grâce à la participation du mésenchyme sous-jacent, on parle alors de crêtes mammaires. Rapidement, les crêtes régressent, laissant 5 à 7 points mammaires de chaque côté. La plupart des points mammaires régressent également. À la 8e semaine chez l’homme, un seul point mammaire persiste de chaque côté, en région thoracique.
chez le lapin). Les bandes mammaires s’épaississent grâce à la participation du mésenchyme sous-jacent, on parle alors de crêtes mammaires. Rapidement, les crêtes régressent, laissant 5 à 7 points mammaires de chaque côté. La plupart des points mammaires régressent également. À la 8e semaine chez l’homme, un seul point mammaire persiste de chaque côté, en région thoracique.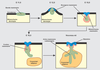
 )
)